超高效液相色谱-四极杆飞行时间质谱法快速定性、定量分析人全血中米酵菌酸
2023-03-21周丽屏郭嘉明郭尧平
周丽屏,郭嘉明,郭尧平,陈 纠,王 致
(广州市第十二人民医院 职业环境与健康重点实验室,广州 510620)
受椰毒假单胞菌污染的椰子或玉米面制品在一定条件下可产生米酵菌酸,食用后可导致人或动物中毒甚至死亡[1]。米酵菌酸无色、无味,受其污染的食物具有正常的外观、气味和口感[2],因此米酵菌酸中毒事件时有发生,相关报道案例仅发生在印度尼西亚、非洲和中国3个国家[3-5]。1953年到1994年,我国16个省共发生椰毒假单胞菌酵米面亚种食物中毒事件545起,中毒人数3 352人,死亡1 401人,平均病死率41.80%[6]。1996年到2005年,仅广西省就报告11起酵米面中毒事件,中毒人数77人,死亡人数50人,病死率高达64.94%[7]。
米酵菌酸中毒后,患者通常会出现头痛、眩晕、意识丧失、抽搐、腹痛、恶心、呕吐、腹泻性心血管病、胸痛、心悸[4]、血尿、血便[8]、黄疸、肝肿大等多脏器损害症状[9],大多数中毒事件与患者食用过玉米面[10]、发泡黑木耳[11]、变质银耳[12-14]、新鲜河粉等湿性制品[15]相关。新鲜河粉、粿条等湿米制品是广东省传统食品,米酵菌酸中毒事件发生风险较高。结合我院过往的接诊病例情况,大多数患者就诊时并不能明确具体致病原因,医生需根据患者临床症状并结合实验室的检测结果才能进行最终确诊,因此中毒患者生物检材中毒物的快速定性、定量至关重要。
血液、尿液中米酵菌酸多采用液相色谱法[16-18]、液相色谱-质谱法[19]和液相色谱-串联质谱法[20-21]测定,但定性、定量分析均依赖于标准品,而米酵菌酸标准品在使用过程中易转化为异米酵菌酸,不利于米酵菌酸的准确检测。鉴于此,试验采用超高效液相色谱-四极杆飞行时间质谱法,在全离子采集一级质谱(MS1-Allions)模式下即可实现米酵菌酸的快速定性和准确定量。除此之外,还增设了10,40 V 碰撞电压,使得在获得米酵菌酸一级母离子的同时得到更丰富的二级碎片离子信息。MS1-Allions采集模式不仅考虑了一级母离子的精确质量数,还考虑了二级碎片离子的质量数、共流出保留时间以及同位素得分率,使无标定性结果的准确率大幅提高;结合提取离子流图(EIC)提取的母离子或特征碎片离子的峰面积,还可进行准确定量。
1 试验部分
1.1 仪器与试剂
1290UPLC-6545QTOF型超高效液相色谱-四极杆飞行时间质谱仪;TG 20型台式离心机;SORVALL pico型高速离心机;Multi Reax型振荡器;Milli-Q Reference型超纯水机;1 mL可调微量移液器、100μL 可调微量移液器、20μL 可调微量移液器。
米酵菌酸标准储备溶液:取0.000 10 g米酵菌酸铵盐标准品于小烧杯中,用甲醇溶解后,转移至10 mL容量瓶中,用甲醇定容,配制成9.0 mg·L-1米酵菌酸(以米酵菌酸计)标准储备溶液,于-20 ℃密封冷冻保存。
米酵菌酸标准溶液系列:取适量米酵菌酸标准储备溶液,用甲醇逐级稀释,配制成0.45,0.90,1.80,2.70,3.60,4.50 mg·L-1的米酵菌酸标准溶液系列。
基质匹配米酵菌酸标准溶液系列:取0.9 mL空白全血于6根1.5 mL 硅化微型离心管(EP 管)中,加入0.1 mL 米酵菌酸标准溶液系列,制得45,90,180,270,360,450μg·L-1的基质匹配米酵菌酸标准溶液系列。
米酵菌酸铵盐标准品纯度不小于98%;甲醇、乙腈、甲酸均为液相色谱-质谱纯;氨水(质量分数28%)纯度不小于99.99%;10 mol·L-1甲酸铵溶液(市售);试验用水为超纯水。
1.2 仪器工作条件
1.2.1 色谱条件
Infinity Lab Poroshell 120 EC-C18色谱柱(150 mm×3.0 mm,2.7μm);柱温40 ℃;流量0.40 mL·min-1;流动相A 为含10 mmol·L-1甲酸铵的0.1%(体积分数,下同)甲酸溶液,B为乙腈;进样量10.0μL。梯度洗脱程序:0~1.5 min时,B为5%;1.5~15.0 min 时,B 由5%升 至55%;15.0~25.0 min 时,B 由55% 升至95%,保持5.0 min;30.0~30.1 min时,B 由95%跳转至5%,保持4.99 min。
1.2.2 质谱条件
双喷射流电喷雾离子(AJS ESI)源,负离子模式;在扩展动态范围(2 GHz)和离子切分器高分辨模式下进行调谐;干燥气温度350 ℃,干燥气流量8 L·min-1;鞘气温度350 ℃,鞘气流量12 L·min-1;雾化气压力275.8 k Pa;毛细管 喷雾电 压3 500 V,喷嘴电压500 V,毛细管出口电压140 V,截取锥电压65 V,射频电压750 V;MS1-Allions采集模式,碰撞能量分别设置为0,10,40 V;扫描范围质荷比(m/z)50~1 100;定量离子m/z441.265 1;图谱采集速率3张·s-1。
1.3 试验方法
用碘伏给患者取血区皮肤消毒后,用肝素钠抗凝管采集疑似中毒患者静脉血3.0 mL,置于冷藏盒中避光保存。振荡混匀后,取200 μL 全血于1.5 mL硅化EP管中,加入预先在-20 ℃冷冻的甲醇800μL,振荡5 min,以12 000 r·min-1转速离心5 min,上清液按照优化的仪器工作条件测定。随同进行空白全血试验。
2 结果与讨论
2.1 前处理条件的选择
米酵菌酸的前处理方法主要有固相萃取法[20-21]、液液萃取法[16]和蛋白沉淀法[19]。液液萃取法虽然准确度较高,但是耗时较长,且容易引入污染物;考虑到中毒患者对结果时效性要求很高,因此试验选择采用蛋白沉淀法进行前处理。以450μg·L-1基质匹配米酵菌酸标准溶液为待测对象,比较了蛋白沉淀剂分别为乙腈、甲醇、体积比1∶1乙腈-甲醇混合溶液时的提取效果。结果显示:以乙腈为蛋白沉淀剂时,米酵菌酸的回收率仅为5.70%;以体积比1∶1乙腈-甲醇混合溶液为蛋白沉淀剂时,米酵菌酸的回收率为73.5%;以甲醇为蛋白沉淀剂时,米酵菌酸的回收率可达90.0%。推测:以乙腈为蛋白沉淀剂时,全血中的蛋白会沉淀成团,这些成团的蛋白无法被振荡分散;以甲醇为蛋白沉淀剂时,全血中的蛋白会沉淀成疏松小颗粒,可被振荡分散。因此,试验选择的蛋白沉淀剂为甲醇。
2.2 色谱条件的选择
以90μg·L-1米酵菌酸标准溶液为待测对象,比较了固定相分别为Infinity Lab Poroshell 120 EC-C18色谱柱(150 mm×3.0 mm,2.7μm)和Zorbax Hilic Plus色谱柱(100 mm×3.0 mm,1.8μm),流动相A 分别为水、0.1%,0.2%(均为体积分数,下同)氨水溶液和0.1%,0.2%(均为体积分数,下同)甲酸溶液时的分离效果。结果显示:当使用Zorbax Hilic Plus色谱柱作固定相,以甲酸溶液作流动相A时,米酵菌酸响应值较高,但是色谱峰拖尾严重,且酸度越大拖尾越严重;以水作流动相A 时,米酵菌酸几乎无响应;以氨水溶液作流动相A 时,米酵菌酸响应值随酸度降低而增加,且氨水溶液体积分数为0.2%时的色谱峰峰形尖锐、对称,但是米酵菌酸保留时间重现性差,且Zorbax Hilic Plus色谱柱对碱性稍高的流动相不耐受,会产生柱效降低、柱压升高甚至柱子损坏等问题。当使用Infinity Lab Poroshell 120 EC-C18色谱柱作固定相,以氨水溶液和水作流动相A 时,米酵菌酸的响应值随着酸度的降低而逐渐升高,但是响应值均较低;以甲酸溶液作流动相A 时,米酵菌酸响应值增加,甲酸溶液体积分数为0.1%时的响应值较高,色谱峰峰形尖锐、对称,且无明显拖尾,甲酸溶液体积分数为0.2%时响应值出现明显下降,推测流动相A 酸度过大会导致米酵菌酸的离子化受到抑制。进一步试验发现,在甲酸溶液中加入一定量的甲酸铵,可提高米酵菌酸的响应值,这是由于甲酸与甲酸铵形成了缓冲体系,有利于米酵菌酸的离子化。当甲酸溶液体积分数为0.1%,甲酸铵浓度为10 mmol·L-1时,响应值较高,甲酸溶液体积分数和甲酸铵浓度继续增加,米酵菌酸响应值未见明显升高。综合考虑,试验选择的固定相为Infinity Lab Poroshell 120 EC-C18色谱柱,流动相A 为含10 mmol·L-1甲酸铵的0.1%甲酸溶液。
2.3 质谱条件的选择
与AJS ESI正离子模式相比,以AJS ESI负离子模式检测时的基质干扰更小、响应值更高,这是由于米酵菌酸结构中含有三个羧基,易丢失质子,在负离子模式下灵敏度更高。因此,试验选择在AJS ESI负离子模式下检测。
试验继续优化干燥气温度、干燥气流量、毛细管喷雾电压、喷嘴电压和毛细管出口电压等关键参数。由于米酵菌酸是三元羧酸,干燥气温度过高容易引起源内脱羧,得不到较强的[M-H]-峰,应适当通过降低干燥气温度和提高干燥气流量来进行热补偿,以提高米酵菌酸的离子化效率。在AJS ESI负离子模式下,若毛细管喷雾电压过高,容易产生尖端放电,使样品裂解、响应值降低。对于弱极性不易电离的米酵菌酸,当喷嘴电压高于1 500 V 时,米酵菌酸几乎无响应。毛细管出口电压对母离子的传输效率影响较大,过大容易引起源内裂解,过小则传输效率较低、检测灵敏度下降。综合考虑上述因素,试验选择的干燥气温度为350 ℃、干燥气流量为8 L·min-1、毛细管喷雾电压为3 500 V、喷嘴电压为500 V、毛细管出口电压为140 V。
在优化的仪器工作条件下,米酵菌酸标准溶液的色谱图见图1。
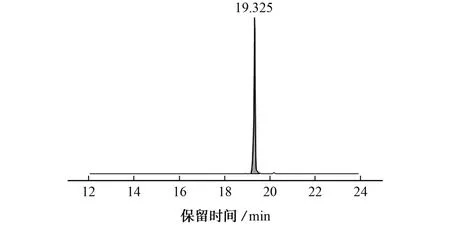
图1 米酵菌酸标准溶液的色谱图Fig.1 Chromatogram of the bongkrekic acid standard solution
2.4 质谱定性分析
MS1-Allions模式下采集的准分子离子[MH]-同位素丰度由高到底依次为m/z485.254 0,486.257 5,487.260 0,488.263 1,m/z与理论 值误差分别 为-0.000 48,-0.000 38,-0.000 68,-0.000 31,各同位素丰度与理论值相对误差分别为0,-12%,20%,-16%;共流出丰度由高到低的二级碎片离子依次为m/z441.265 1,397.274 8,153.055 7,321.258 8,109.065 9,173.133 6,365.248 1;共流出 保留时 间极差小于0.017 min。对二级碎片离子进行归属分析,结果见图2。
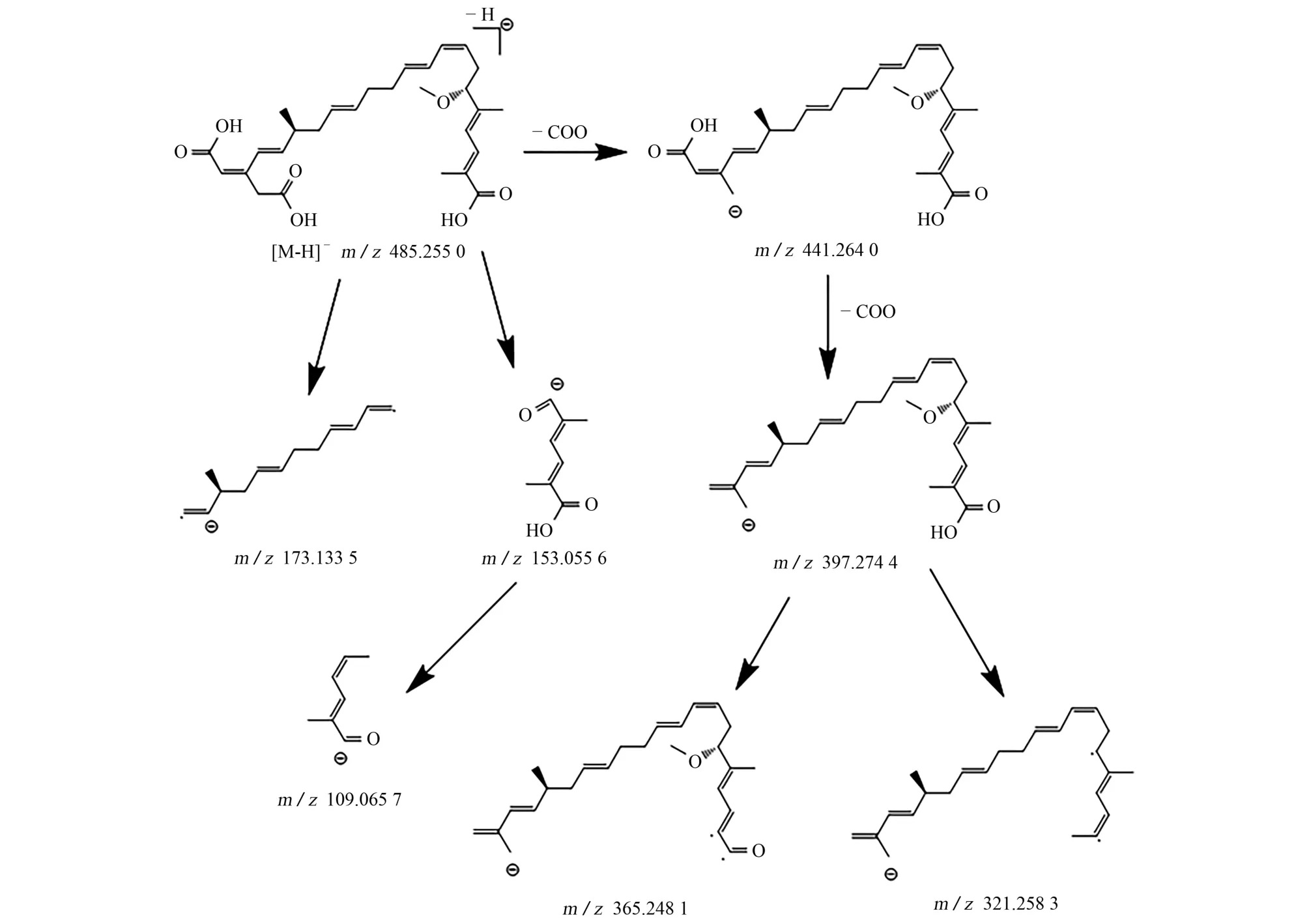
图2 米酵菌酸二级碎片离子的归属分析Fig.2 Attribution analysis on secondary fragment ions of bongkrekic acid
2.5 基质效应
按照试验方法处理空白全血样品,离心后,分取3份450μL 上清液于3 个样品小瓶中,分别加入225,450,900μg·L-1米酵菌酸标准溶液50μL,配制成22.5,45,90μg·L-1基质匹配米酵菌酸标准溶液,同时用甲醇配制22.5,45,90μg·L-1米酵菌酸标准溶液,按照仪器工作条件测定。以基质匹配后、前米酵菌酸峰面积的比值计算基质效应值,所得结果分别为88.28%,94.67%,94.46%,说明血液基质对米酵菌酸的测定具有一定抑制作用。因此,试验选择以基质匹配法制作工作曲线。
2.6 工作曲线、检出限和测定下限
按照试验方法测定基质匹配米酵菌酸标准溶液系列,以米酵菌酸的质量浓度为横坐标,其对应的峰面积为纵坐标绘制工作曲线。结果显示,米酵菌酸工作曲线的线性范围为45~450μg·L-1,线性回归方程为y=1 585x-4 023,相关系数为0.998 2。
以3倍信噪比(S/N)计算得检出限(3S/N),结果为3.2μg·L-1;以10 倍信噪比计算测定下限(10S/N),结果为10.5μg·L-1。
2.7 精密度和回收试验
取3根25 mL比色管,各加入约9 mL 空白全血样品,再分别加入50,200,500μL 米酵菌酸标准储备溶液,用空白全血样品稀释至10 mL,振荡混匀,制得质量浓度分别为45,180,450μg·L-1的低、中、高浓度水平的加标空白全血样品。每个浓度水平制备6个样品,按照试验方法测定,计算回收率和测定值的相对标准偏差(RSD)。结果显示,米酵菌酸的回收率为82.6%~90.1%,测定值的RSD 为4.5%~5.6%。
2.8 稳定性试验
以450μg·L-1米酵菌酸标准溶液为待测对象,新配制和常温密封放置48 h的该溶液中的异米酵菌酸响应值分别为米酵菌酸响应值的3.2%和121%,这是由于米酵菌酸在光照等条件下可转化成无毒的异米酵菌酸[20]。因此,在保存含米酵菌酸相关样品过程中,须特别注意环境避光,并应尽快测定,以防止米酵菌酸转化为异米酵菌酸,影响米酵菌酸的准确定量。
2.9 样品分析
按照试验方法分析一起食用鲜河粉后出现不适症状的疑似米酵菌酸中毒患者的全血样品。结果显示,该患者全血样品中米酵菌酸的检出量为2 225μg·L-1。
在米酵菌酸实际检测工作中,中毒患者全血中毒物含量相对较高,且需快速定性诊断,而本工作提出的超高效液相色谱-四极杆飞行时间质谱法简单、高效、定性可靠、定量准确,适用于急性中毒患者全血中米酵菌酸的快速定性、定量分析,具有一定应用推广价值。
