苗药五藤膏外敷对膝骨关节炎兔模型的治疗作用及机制
2023-03-17韩珊周静马武开肖丽娜姚血明唐芳申海艳陈琳王颜君
韩珊,周静,马武开,肖丽娜,姚血明,唐芳,申海艳,陈琳,王颜君
1 贵州中医药大学第二附属医院风湿免疫科,贵阳 550001;2 贵州省骨科医院疼痛科;3 贵州中医药大学研究生院
膝骨关节炎(KOA)是一种慢性退行性骨关节疾病,患病率与年龄呈正相关。据不完全统计,40岁以上人群患病率10%~17%,60 岁以上患病率为50%以上[1]。该病以关节软骨变性、破坏及骨质增生为主要病理特征,主要临床表现为进行性膝关节疼痛、肿胀、活动受限及畸形[2]。其临床治疗主要以迅速有效缓解疼痛为主,包括药物治疗、运动治疗、手术治疗等,其中药物治疗不良反应多,易反复发作;运动治疗适应证较少,患者依从性差;手术治疗易发生感染、神经损伤、关节活动障碍等并发症[3]。随着祖国医学的不断发展,苗医药治疗KOA有极大优势,其中尤以外治法为精。苗医学主张“壅塞为病,通达为康”“身不通则痛”,认为冷风毒壅塞筋脉是形成KOA 的主要原因,治疗应以“通筋散血”为主[4]。苗药五藤膏有祛风通络、活血止痛等功效,前期临床研究证实该药能有效缓解KOA患者关节疼痛、肿胀、僵硬等临床症状[5-6]。相关研究认为,KOA 的病理改变主要与软骨降解、骨赘形成及软骨下骨改变相关,涉及Wnt、Notch 等多条信号转导途径。其中Wnt 信号作为调节软骨细胞代谢,维持成骨细胞和破骨细胞平衡的重要途径,其关键酶GSK-3β 可直接磷酸化枢纽蛋白β-catenin 来激活Wnt/β-catenin 信号转导途径,继而促进软骨细胞、滑膜细胞、成骨细胞及骨髓基质细胞分泌基质金属蛋白酶-3(MMP-3)、骨保护素(OPG),使软骨细胞外基质(ECM)发生降解和骨形成,引起关节软骨和软骨下骨进行性破环,KOA 形成;而Notch 信号作为调控软骨细胞分化、发育的重要途径,通过生成胞内区与细胞核中DNA 结合蛋白结合后激活下游靶基因(Notch1 等)相关蛋白发挥作用[7-9]。研究表明,Notch1 蛋白是导致KOA 的常见信号通路效应蛋白[10]。2020 年6 月—11 月,本研究在前期研究基础上,观察五藤膏外敷干预对KOA 兔模型的治疗作用及机制。
1 材料与方法
1.1 动物、试剂及仪器 选取4~5月龄普通级健康家兔96 只,雌雄各半,体质量(2.0 ± 0.5)kg,由贵州中医药大学动物实验中心提供,动物合格证号:SCXK(黔)2018-00012。饲养于贵州中医药大学动物实验中心动物房,每笼1 只,房内保持恒温,明暗光线交替(12 h/12 h),实验前均适应性喂养1 周。在实验过程中遵照实验动物伦理要求。
苗药五藤膏由贵州中医药大学第二附属医院药剂科提供(黔药制字Z20120072)。氟比洛芬巴布膏(日本三笠制药株式会社,规格:40 mg/贴);TRIzol(美国Ambion 公司)、HiScript Reverse Transcriptase (RNase H)、5×HiScript Buffer(南京诺唯赞生物科技股份有限公司)、Ribonuclease Inhibitor(北京全式金生物技术股份有限公司)、DL2000 DNA Marker[天根生化科技(北京)有限公司]。
实时荧光定量PCR 仪(美国ABI 公司)、微量分光光度计(杭州奥盛仪器有限公司)、电热恒温水浴锅(北京市长风仪器仪表有限公司)、pH 计(德国Metter-Toledo GmbH 公司)、水平电泳仪(北京君意东方电泳设备有限公司)。
1.2 动物分组及模型制备 采用随机数字表法将96 只家兔分为空白对照组、模型组、巴布膏组及五藤膏低、中、高剂量组,每组16 只。除空白对照组外,其余组分别于第1、4、7天给予4%木瓜蛋白酶生理盐水溶液0.3 mL注入兔右膝关节腔内,制备KOA模型[11]。第7 天注射完毕后,不再进行任何干预,继续正常饲养4周。
1.3 药物干预与标本获取 家兔药物使用剂量均按标准换算成人体等效剂量[12]。造模第6 周,空白对照组、模型组每日给予无菌纱布包扎固定右膝关节4 h。巴布膏组给予氟比洛芬巴布膏(4 cm×3 cm)贴敷于兔右膝关节前方,苗药五藤膏低、中、高剂量组分别给予1、2、4 g五藤膏(4 cm×3 cm)贴敷于兔右膝关节前方,贴敷前用动物专用剃毛器剃除兔膝关节周围白毛,均用绷带包扎固定4 h,每日给药1 次,干预4 周。分别于给药1、2、3、4 周每组各取4 只家兔,采用空气栓塞法处死,暴露其右侧膝关节,取右侧股骨内髁顶点钙化层以上软骨。
1.4 观察指标与方法
1.4.1 膝关节软骨组织病理学变化观察 暴露右膝关节软骨后,肉眼观察关节软骨表面,然后取股骨内髁顶点钙化层以上软骨制作病理标本,经中性甲醛固定、硝酸脱钙、常规石蜡包埋、切片及HE 染色后,观察软骨组织形态变化。采用Mankin's 评分[13]评价膝关节软骨组织病理学改变程度,包括软骨组织结构:①光滑正常计0 分;②表面不规则裂隙,排列紊乱,但层次可计1 分;③排列明显不规则,层次紊乱计2分;④严重紊乱,裂隙深达辐射层计3分;⑤裂隙达钙化层计4分;⑥软骨层脱落计5分。细胞数量:①正常计0分;②数量弥漫性增多计1分;③出现簇集样细胞团计2分;④数量明显减少计3分。潮线完整性:①完整计0 分;②多层次计1 分;③模糊计2分;④有血管穿过计3分。
1.4.2 膝关节软骨组织中Wnt/β-catenin 信号通路下游靶基因GSK-3β、MMP-3、OPG及Notch信号通路下游靶基因Notch1 mRNA 表达检测 采用RT-PCR法。用TRIzol 法提取样本总RNA:按照试剂盒说明书要求,取-80 ℃冰箱中冻存软骨组织100 mg,剪碎并加入TRIzol试剂进行研磨、裂解及离心;加入氯仿并以12 000 r/min离心15 min,离心半径为13.5 cm;将上层RNA 转至另一含异丙醇的EP 管中静置、离心,管底可见白色RNA 沉淀;弃上清液,加入无RNase 的75% 乙 醇1 mL,以1 000 r/min,离 心5 min;重复以上步骤1 次,将干燥RNA 沉淀溶于20 μL DEPC 水中,计算RNA 浓度,并将所得cDNA稀释4 倍进行RT-PCR。反转录反应体系:cDNA 4 μL、Forward Primer 0.4 μL、Reverse Primer 0.4 μL、SYBR Green Master Mix 10 μL、50×ROX Reference Dye 2 0.4 μL、H2O 4.8 μL。反应条件:50 ℃ 2 min,95 ℃ 10 min;95 ℃ 30 s,60 ℃ 30 s,40个循环。绘制溶解曲线,以2-ΔΔCt法计算目的基因相对表达量。以β-actin 为内参,GSK-3β、MMP-3、OPG、Notch1 引物由武汉巴菲尔生物技术服务有限公司设计与合成,见表1。

表1 基因引物序列
1.5 统计学方法 采用SPSS23.0 统计软件。符合正态分布的计量资料以±s表示,多组比较采用单因素方差分析,进一步两两比较采用LSD-t检验;不同时间点比较采用重复测量方差分析。P<0.05 为差异有统计学意义。
2 结果
2.1 各组关节软骨组织病理变化比较 空白对照组关节软骨表面光滑平整,结构清晰,软骨细胞数目多且分布均匀,潮线识别度清晰,未发生变性、萎缩。模型组关节软骨表面粗糙不平整,结构模糊,软骨细胞数目少且分布紊乱,潮线识别度模糊,重度变性、萎缩。各治疗组软骨组织破坏程度、软骨细胞分布排列及潮线识别度等均低于模型组、高于空白对照组;五藤膏高剂量组关节软骨表面较光滑平整,结构较清晰,软骨细胞数目较多且分布较均匀,潮线识别度较好,发生轻度变性、萎缩;而苗药五藤膏低、中剂量组及巴布膏组伴不同程度的关节肿胀及滑膜充血,层次结构较模糊,软骨细胞数量较少且分布轻度紊乱,个别潮线识别度模糊,发生中度变性、萎缩。空白对照组、模型组、五藤膏低剂量组、五藤膏中剂量组、五藤膏高剂量组、巴布膏组膝关节软骨组织Mankin's 评分分别为(0.91 ± 0.74)、(13.20 ± 1.15)、(7.70 ± 0.60)、(4.70 ± 0.62)、(3.33 ± 0.68)、(4.60 ± 0.78)分。与空白对照组比较,模型组膝关节软骨组织Mankin's 评分高(P<0.05);与模型组比较,各治疗组Mankin's 评分低(P均<0.05),且五藤膏高剂量组Mankin's 评分最低(P均<0.05)。
叶顶汽封运行中即使与覆环碰磨,也不会造成转子热弯,振动理论认为,一般不会引起碰磨振动。但严重的碰磨会在覆环上留下非常显著的划伤,同样也是不能接受的。刷式汽封及蜂窝汽封与转子碰磨时对转子的损伤较轻,尤其是蜂窝汽封基本上不会磨伤转子。而且两种汽封都具备比较耐磨的特点。因此,更适用于直径大线速度比隔板汽封高的叶顶汽封。
2.2 各组不同时点膝关节软骨组织中GSK-3β mRNA表达比较 见表2。
表2 各组不同时点膝关节软骨组织中GSK-3β mRNA表达比较( ± s)
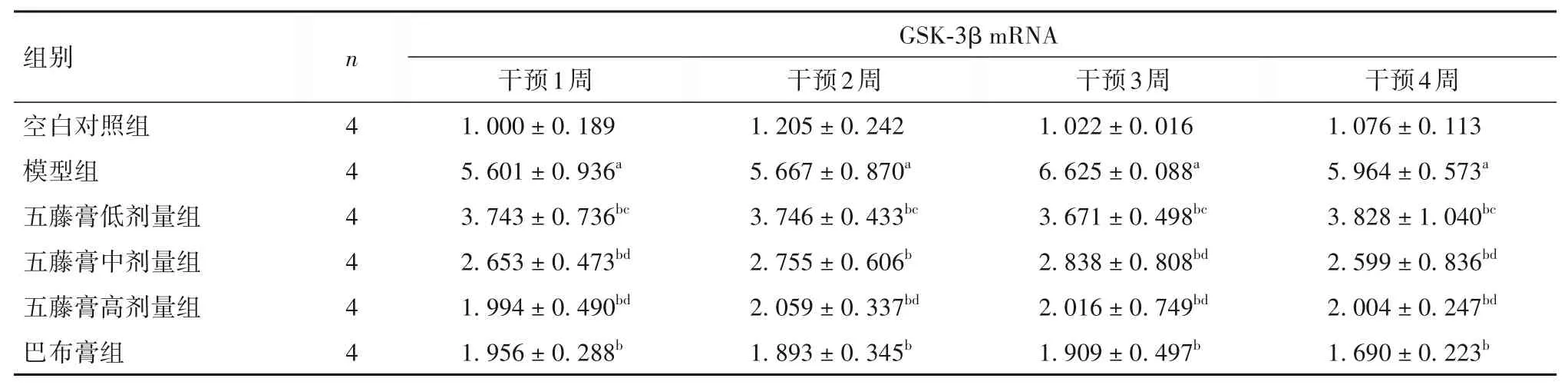
表2 各组不同时点膝关节软骨组织中GSK-3β mRNA表达比较( ± s)
注:与空白对照组同期比较,aP<0.05;与模型组同期比较,bP<0.05;与巴布膏组同期比较,cP<0.05;苗药五藤膏组组内各时点比较,dP<0.05。
组别空白对照组模型组五藤膏低剂量组五藤膏中剂量组五藤膏高剂量组巴布膏组n 4 4 4 4 4 4 GSK-3β mRNA干预1周1.000 ± 0.189 5.601 ± 0.936a 3.743 ± 0.736bc 2.653 ± 0.473bd 1.994 ± 0.490bd 1.956 ± 0.288b干预2周1.205 ± 0.242 5.667 ± 0.870a 3.746 ± 0.433bc 2.755 ± 0.606b 2.059 ± 0.337bd 1.893 ± 0.345b干预3周1.022 ± 0.016 6.625 ± 0.088a 3.671 ± 0.498bc 2.838 ± 0.808bd 2.016 ± 0.749bd 1.909 ± 0.497b干预4周1.076 ± 0.113 5.964 ± 0.573a 3.828 ± 1.040bc 2.599 ± 0.836bd 2.004 ± 0.247bd 1.690 ± 0.223b
2.3 各组不同时点膝关节软骨组织中MMP-3 mRNA 表达比较 见表3。
表3 各组不同时点膝关节软骨组织中MMP-3 mRNA表达比较(±s)

表3 各组不同时点膝关节软骨组织中MMP-3 mRNA表达比较(±s)
注:与空白对照组同期比较,aP<0.05;与模型组同期比较,bP<0.05;与巴布膏组同期比较,cP<0.05;苗药五藤膏组组内各时点比较,dP<0.05。
组别空白对照组模型组五藤膏低剂量组五藤膏中剂量组五藤膏高剂量组巴布膏组n 4 4 4 4 4 4 MMP-3 mRNA干预1周1.000 ± 0.151 5.275 ± 1.233a 5.136 ± 0.510c 4.406 ± 0.395bc 3.483 ± 1.017bd 3.320 ± 0.501b干预2周1.167 ± 0.016 5.889 ± 0.619a 4.533 ± 0.535bc 3.552 ± 0.276bd 2.763 ± 0.286bd 2.906 ± 0.413b干预3周0.970 ± 0.181 6.509 ± 0.490a 3.673 ± 0.467b 2.963 ± 0.579bd 2.120 ± 0.243bd 2.144 ± 0.309b干预4周1.045 ± 0.106 5.891 ± 0.617a 4.007 ± 0.440b 3.351 ± 0.465bd 2.461 ± 0.398bd 2.644 ± 0.299b
2.4 各组不同时点膝关节软骨组织中OPG mRNA表达比较 见表4。
表4 各组不同时点膝关节软骨组织中OPG mRNA表达比较(±s)

表4 各组不同时点膝关节软骨组织中OPG mRNA表达比较(±s)
注:与空白对照组同期比较,aP<0.05;与模型组同期比较,bP<0.05;与巴布膏组同期比较,cP<0.05;苗药五藤膏组组内各时点比较,dP<0.05。
组别空白对照组模型组五藤膏低剂量组五藤膏中剂量组五藤膏高剂量组巴布膏组n 4 4 4 4 4 4 OPG mRNA干预1周1.000 ± 0.163 0.384 ± 0.016a 0.437 ± 0.061bc 0.580 ± 0.243bd 0.765 ± 0.223bd 0.751 ± 0.188b干预2周1.024 ± 0.139 0.353 ± 0.047a 0.412 ± 0.068bc 0.593 ± 0.164bd 0.754 ± 0.106bd 0.793 ± 0.147b干预3周1.178 ± 0.015 0.249 ± 0.151a 0.475 ± 0.110bc 0.589 ± 0.130bd 0.725 ± 0.249bd 0.777 ± 0.123b干预4周1.067 ± 0.096 0.329 ± 0.071a 0.490 ± 0.115bc 0.586 ± 0.086bd 0.799 ± 0.169bd 0.788 ± 0.165b
2.5 各组不同时点膝关节软骨组织中Notch1 mRNA表达比较 见表5。
表5 各组不同时点膝关节软骨组织中Notch1 mRNA表达比较(±s)

表5 各组不同时点膝关节软骨组织中Notch1 mRNA表达比较(±s)
注:与空白对照组同期比较,aP<0.05;与模型组同期比较,bP<0.05;与巴布膏组同期比较,cP<0.05;苗药五藤膏组组内各时点比较,dP<0.05。
组别空白对照组模型组五藤膏低剂量组五藤膏中剂量组五藤膏高剂量组巴布膏组n 4 4 4 4 4 4 Notch1 mRNA干预1周1.000 ± 0.364 5.285 ± 0.744a 4.584 ± 0.582bc 4.364 ± 0.631bc 3.909 ± 0.403b 3.601 ± 0.542b干预2周1.239 ± 0.125 6.100 ± 0.071a 4.379 ± 0.231bc 4.034 ± 0.361b 3.435 ± 0.369b 3.252 ± 0.412b干预3周1.334 ± 0.030 5.063 ± 0.966a 3.846 ± 0.314b 3.531 ± 0.306b 2.762 ± 0.183bd 2.681 ± 0.506b干预4周1.191 ± 0.172 5.483 ± 0.546a 3.167 ± 0.566b 2.926 ± 0.471bd 2.268 ± 0.367b 2.227 ± 0.345b
3 讨论
KOA 是导致老年人行动障碍的重要疾病之一,隶属中医“痹症”之“骨痹、膝痹”范畴,在苗医学中称“冷骨风”,以关节软骨变性、退化及骨质增生为主要特征[14]。关节软骨作为骨关节炎病变的主要部位,由1%的软骨细胞和99%的ECM 组成,其中占比较大的ECM 赋予了关节软骨张力、弹性及分散、吸收关节处负荷的能力。研究表明,一旦关节软骨遭受损伤时,软骨下骨也会因此而发生相应的力学改变,继而使软骨细胞表型发生转移,骨转换失衡,骨重塑异常,最终干扰关节内环境稳态,减弱软骨支撑作用和保护机制,加速骨关节退变,导致骨关节炎发生[15]。KOA 作为临床最为常见的骨关节炎,近年来越来越多研究发现关节软骨细胞、ECM、成骨细胞及破骨细胞导致的软骨细胞破坏、软骨基质过度降解及骨重塑异常与其发病密切相关。此过程涉及多条信号通路,其中以Wnt和Notch信号通路研究较为广泛。Wnt、Notch 信号通路在KOA 患者软骨细胞、成骨细胞、破骨细胞等骨性细胞分化、增殖及凋亡,维持软骨细胞表型及基质代谢平衡等方面发挥重要作用[13,16]。
Notch信号通路是一条影响细胞命运、进化上高度保守的跨膜信号转导通路,普遍存在于脊椎和无脊椎动物体中,由4 种受体(Notch1、Notch2、Notch3、Notch4)、5 种配体(DLL1、DLL3、DLL4、Jagged1、Jagged2)及转录因子CSL 组成[20]。两个相邻细胞的Notch 受体与配体相互作用激活Notch 信号通路,激活后的Notch 信号通路可参与调控软骨细胞的形成、增殖、分化及凋亡过程。研究表明,Notch信号通路在骨关节炎中具有保护和破坏双重调节作用,即:抑制Notch 信号会导致关节软骨细胞的增殖、肥大,促进Notch 信号则能增加关节软骨基质的合成从而抑制关节软骨的退变[21]。Notch1 作为Notch 信号通路中研究最为广泛的受体,其在KOA 中的作用机制目前尚未阐明,但有研究认为异常激活的Notch1 蛋白可持续刺激巨噬细胞产生炎性因子,从而导致骨赘增加和骨代谢平衡能力下降[22-23],由此我们推测Notch1 可能在KOA 关节软骨病理破坏过程中发挥重要作用。
苗药五藤膏是治疗KOA 的外治经验方,方中黑骨藤祛风通络止痛为君药;青风藤、香血藤祛风除湿活络为臣药;大血藤、络石藤祛风通络、败毒活血、凉血消肿为佐药;加少许冰片透邪、起透皮作用为使药。诸药合用,共奏活血化瘀、消肿止痛、祛风通络之效[24]。本研究发现,GSK-3β、MMP-3、Notch1 mRNA表达趋势一致,均于模型组中最高,空白对照组中最低;而OPG mRNA表达则于空白对照组中最高,模型组中最低。说明GSK-3β、MMP-3、OPG及Notch1 mRNA表达可能与KOA 的发生发展密切相关。与模型组比较,苗药五藤膏及巴布膏组不同时间段GSK-3β、MMP-3、Notch1 mRNA 表达均降低,OPG mRNA 表达则升高,且不同剂量的苗药五藤膏外敷干预与GSK-3β、MMP-3、Notch1 mRNA 表达呈负相关,而与OPG mRNA 表达则呈正相关,说明苗药五藤膏可能通过促进兔关节软骨组织中OPG mRNA 表达,抑制GSK-3β、MMP-3、Notch1 mRNA 表达,来延缓疾病进展及软骨、软骨下骨病变程度,从而起到治疗KOA的作用。
本研究初步证明苗药五藤膏可通过调控Wnt/β-catenin、Notch信号通路下游靶基因治疗KOA。但在研究过程中,因实验条件受限,样本量较少,未对Notch 信号通路其他基因如Notch2 受体、Notch3 受体、DLL3 配体等及Wnt/β-catenin 信号通路其他基因runt 相关转录因子2、Ⅱ型胶原、轴蛋白等进一步研究,这将是未来研究的方向。
