α-微管蛋白乙酰化调控NLRP3炎症小体活化的研究进展①
2023-03-17李陈广吴晓君肖礼祖华中科技大学协和深圳医院深圳518052
李陈广 吴晓君 肖礼祖 (华中科技大学协和深圳医院,深圳 518052)
炎症小体是由多种蛋白质组成的大型胞内复合物,包括NLRP1、NLRP3、NLRC4 和AIM2 等,而NLRP3 炎症小体是当前研究最多的炎症小体,由凋亡相关斑点样蛋白(apoptosis associated speck like protein containing a CARD,ASC)、pro-caspase-1 和NLRP3 等蛋白质组装而成,巨噬细胞、中性粒细胞和树突状细胞等多种细胞经各种激动剂如尼日利亚菌素(nigericin)、胞外腺嘌呤核苷三磷酸(adenosine triphosphate,ATP)、尿酸钠晶体(monosodium urate,MSU)和二氧化硅(SiO₂)等激活后诱导细胞焦亡发生,释放成熟IL-1β和IL-18,引起强烈的固有免疫应答,这是机体抵抗病原微生物感染的重要防御机制[1-2]。但NLRP3 炎症小体的过度活化又与人类许多炎症性疾病和自身免疫性疾病相关,如2 型糖尿病(type 2 diabetes,T2D)、痛风和阿尔茨海默病(Alzheimer's disease,AD)等[3-5]。因此,如何调控 NLRP3 炎症小体的活化成为当下研究NLRP3 炎症小体的重点。
NLRP3 炎症小体可被多种激动剂激活,但由于各种激动剂的化学结构差异甚大,因此不大可能直接作用于NLRP3,而是调控细胞内信号活化NLRP3炎症小体,并伴随离子流动、活性氧(reactive oxygen species,ROS)产生、线粒体功能失调和溶酶体破裂等一系列现象产生[6]。迄今为止,尚无一个公认的确切机制说明NLRP3 炎症小体是如何被活化的。研究表明,NLRP3 炎症小体活化时,感受蛋白NLRP3 通过其自身结构域的相互作用,促进自身的寡聚化,随后寡聚化的NLRP3与接头蛋白ASC 通过两者同源蛋白相互作用而结合形成ASC speck,随后ASC 与pro-caspase-1 相互作用,从而形成大型胞内复合物NLRP3 炎症小体,进而诱导pro-caspase-1 自我切割活化,引发IL-1β 和IL-18 的活化及细胞焦亡发生[3-5]。在该过程中,线粒体可作为NLRP3炎症小体组装平台,通过线粒体上的膜蛋白,如线粒体抗病毒蛋白(mitochondrial antiviral signaling protein,MAVS)、线粒体外膜蛋白mitofusin 2 以及外化的心磷脂等募集NLRP3,促进NLRP3炎症小体活化。而在哺乳动物细胞中微管网络作为细胞内信号的主要调节物参与线粒体的调控和分布,有利于促进NLRP3 炎症小体活化,在破坏微管后,线粒体产生的ROS 并不会促进IL-1β 分泌[7-8]。然而,微管是如何适时调控NLRP3 到达线粒体并与ASC 进行相互作用,进而活化NLRP3 炎症小体的呢?这是需要深入探讨的方向。
1 α-微管蛋白乙酰化
1.1 α-微管蛋白乙酰化修饰的机制研究 微管包括γ-微管蛋白、α-微管蛋白和β-微管蛋白,它们是细胞质骨架的重要组成成分。其中,γ-微管蛋白是主要定位于微管组织中心(microtubule organizing center, MTOC)的微管蛋白,其对微管的形成具有重要作用,而α-微管蛋白和β-微管蛋白组成的异二聚体则是微管组装基本单元,每13 个单元为1 圈,形成螺旋中空管状结构(图1)。由于微管处于生长速度较快解离速度较慢的(+)端和生长速度较慢解离速度较快的(-)端的不断动态变化中,因此允许微管不断地在增长和收缩间切换[9]。微管还是两种运载分子——驱动蛋白(kinesin)和动力蛋白(dynein)的行走轨道,因此微管在细胞内具有多种生理功能,如参与胞内物质运输、细胞器定位、细胞分裂和运动等[9]。微管蛋白的翻译后修饰赋予了其功能上的多样性。最早于1985 年在衣藻的鞭毛中发现微管蛋白的乙酰化修饰,其主要发生于α-微管蛋白上K40 的ε-氨基,由于大多数微管的翻译后修饰发生在微管外壁,而α-微管蛋白的K40 的乙酰化修饰是微管腔内唯一的翻译后修饰,因此受到广泛关注[10-11]。K40 的乙酰化水平主要由两类酶调控,一类是去乙酰化酶,包括烟酰胺腺嘌呤二核苷酸 (nicotinamide adenine dinucleotide,NAD+)非依赖的组蛋白脱乙酰基酶6(histone deacetylase 6,HDAC6)和NAD+依赖的沉默信息调节因子2(sirtuin type 2,SIRT2),SIRT2主要分布于细胞质,少量分布于细胞核,但核 内的SIRT2 并 没有 去乙 酰化 活性[12-14]。SIRT2 去乙酰化反应是通过水解NAD+,生成烟酰胺(nicotinamide,NAM)和乙酰-ADP-核糖。通过抑制剂FK866 可减少烟酰胺磷酸核糖基转移酶(NAM phosphoribosyltransferase,NamPRT),降低胞内NAD+合成,从而促进α-微管蛋白乙酰化[15]。另一类是乙酰化酶,如α-微管蛋白乙酰转移酶-1(α-tubulin acetyltransferase-1,αTAT1)。αTAT1 可通过微管末端或微管网格的内部间隙进入微管内腔,然后相对缓慢地扩散到微管内部,寻找其催化位点。当缺失αTAT1 时,体内多种组织中几乎检测不到α-微管蛋白K40 的乙酰化[16-17]。有趣的是,缺失αTAT1 可以增强微管的稳定性并降低微管动力,虽然聚集的乙酰化α-微管蛋白可以稳定微管,但αTAT1本身可能不利于微管的稳定[16-17]。
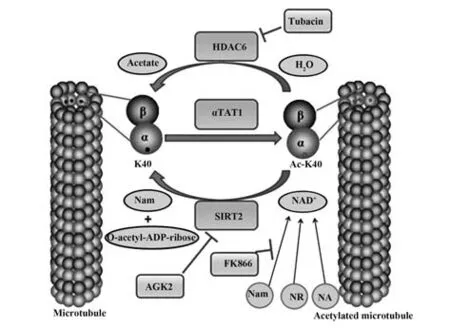
图1 α-微管蛋白的乙酰化修饰[12-13,17]Fig.1 Acetylation modification of α-tubulin[12-13,17]
1.2 α-微管蛋白乙酰化的生物学功能 微管作为细胞内囊泡运输的骨架和轨道,其α-微管蛋白的乙酰化有利于细胞内囊泡沿微管轨道运输。虽然 α-微管蛋白乙酰化不会改变微管的组装和形态结构,但可以影响微管的稳定性并抑制微管的成核作用,阻碍微管蛋白原纤维间相互作用并加速收缩速率,从而增加微管的弹性并维持长寿命微管的机械稳定性[18]。有趣的是,乙酰化的α-微管蛋白更容易形成束状微管,增强了微管驱动蛋白和动力蛋白的运输功能[19]。不过到目前为止微管的长寿命与稳定性是乙酰化的结果还是原因仍不清楚。过去大多数观点认为微管的乙酰化是微管稳定的原因,因为使用化学试剂稳定微管后,可明显提高其乙酰化水平;另外,有证据显示乙酰化大都发生在更为稳定的微管上,因此认为乙酰化水平较高的微管较稳定[20]。但同时也有实验表明,人工提高微管的乙酰化水平似乎并不足以增加微管的稳定性,2014 年SZYK 等[21]的研究结果表明,由于αTAT1 催化α-微管蛋白乙酰化的速率相对缓慢,且需要进入微管腔内发挥作用,使得乙酰化更多地发生在稳定且寿命较长的微管上,这为乙酰化与微管稳定性的关系提供了最新的解释。
1.3 α-微管蛋白乙酰化与疾病发生 研究表明, α-微管蛋白的乙酰化水平与人类疾病密切相关。在乳腺癌和胰腺癌细胞中,α-微管蛋白乙酰化明显升高,但在肠炎中却明显降低;感染艾滋病病毒、疱疹病毒和流感病毒等同样可以影响α-微管蛋白的乙酰化[22]。研究表明,通过药物抑制HDAC6 活性,提高乙酰化的水平的过程中,会加剧神经退行性疾病的程度[23]。因此,α-微管蛋白的乙酰化可以作为治疗各种疾病的新靶点。
2 α-微管蛋白乙酰化与NLRP3 炎症小体活化
2.1 α-微管蛋白乙酰化参与NLRP3 炎症小体活化 在NLRP3 激动剂刺激下,仅发现核周边有大量聚集的乙酰化α-微管蛋白。敲低αTAT1后,明显降低NLRP3激动剂诱导的乙酰化α-微管蛋白水平,且影响线粒体的运输并抑制NLRP3 炎症小体活化。因此,α-微管蛋白乙酰化对NLRP3 炎症小体活化至关重要。而通过敲低SIRT2 或使用SIRT2 特异性抑制剂AGK2 处理后,可导致在核周边形成乙酰化 α-微管蛋白并使线粒体在核周边聚集;而另一个sirtuin 家族成员SIRT1 并不影响α-微管蛋白的乙酰化水平及线粒体运输。但在敲低或抑制另一个去乙酰化酶HDAC6 后,虽然α-微管蛋白乙酰化水平提高,却不影响线粒体运输至核周边及随后的NLRP3活化[8]。进一步研究发现,不同试剂诱导的乙酰化α-微管蛋白结构可能不同。研究显示,使用HDAC6抑制剂tubacin 可明显增加整个细胞的α-微管蛋白乙酰化程度[24];然而使用抑制剂AGK2 直接抑制SIRI2 活性或使用NAD+的合成酶NamPRT 抑制剂FK866 间接使SIRT2 失活,最终均导致仅在核周边形成高度乙酰化的α-微管蛋白[24-25]。这些结果表明,虽然SIRT2 与HDAC6 的去乙酰化位点相同,但两者可能识别不同结构的微管蛋白。
MISAWA 等[8]发现使用秋水仙素、诺考达唑和鬼臼素等微管解聚剂破坏微管可明显抑制nigericin诱导的NLRP3 炎症小体活化和IL-1β 分泌,提示微管参与NLRP3 炎症小体活化的调控;而使用细胞松弛素D 则破坏细胞骨架另一种成分——微丝后,除了抑制依赖于吞噬作用的激动剂如MSU 和SiO2诱导的IL-1β 分泌外,其余NLRP3 炎症小体激动剂的作用均不受影响。与此截然不同的是,秋水仙素可明显抑制NLRP3 不同激动剂所诱导的IL-1β 分泌,且并不影响细胞对SiO2的吞噬,进一步说明微管调控NLRP3 炎症小体的活化并不依赖于细胞的吞噬功能,且抑制微管的形成不会影响NLRC4 和AIM2炎症小体活化,更加说明α-微管蛋白乙酰化特异性调控NLRP3炎症小体活化。
2.2 α-微管蛋白乙酰化介导线粒体运输有利于NLRP3 炎症小体的组装 线粒体功能异常或紊乱能够介导NLRP3 炎症小体活化。一方面是NLRP3激动剂导致线粒体功能紊乱,释放mtDNA 和mtROS作为危险信号介导NLRP3 炎症小体活化[26-27];另一方面是线粒体的心磷脂从内膜外移至外膜,可直接与NLRP3 的LRRs 结构域结合,并活化NLRP3 炎症小体。因此线粒体自身也可作为NLRP3 聚集的平台,促进NLRP3炎症小体活化。
研究表明,在NLRP3 活化过程中,线粒体上外源转入的ASC 移动到核周边区域,并与内质网上同样是外源转入的NLRP3 共定位[28]。在静息状态下,内源性NLRP3 主要分布于内质网,激动剂诱导NLRP3活化时,线粒体接近细胞核周边的内质网,导致线粒体上的ASC 与内质网上的NLRP3相互靠近,进而活化NLRP3 炎症小体。而微管可调控细胞内多种物质运输,包括对细胞器的运输,如线粒体等;秋水仙素处理能够明显抑制线粒体向核周边的运输及随后ASC 与NLRP3 的相互作用。说明微管调控的线粒体运输和重新分布可为NLRP3 炎症小体活化信号转导找到一个最佳的活化位点。
在哺乳动物细胞中,微管负责线粒体的长距离运输。线粒体的运输分为两类,一类为驱动蛋白介导的从细胞核向外周的顺行性运输;另一类为动力蛋白介导的由外周向细胞核的逆行性运输[29]。由于在NLRP3 炎症小体活化时,线粒体是由外周向细胞核逆行性运输,因此使用动力蛋白抑制剂ciliobrevin-D预处理后可明显抑制由不同NLRP3激动剂诱导的线粒体向核周边的运输以及随后ASC 与 NLRP3的相互作用,最终抑制NLRP3炎症小体活化和IL-1β 分泌[30]。提示线粒体依赖动力蛋白沿微管的运输有利于NLRP3炎症小体活化。
NLRP3 炎症小体的激动剂能够降低线粒体膜电位,诱导线粒体损伤,降低胞内NAD+浓度,导致SIRT2失去活性,进而引起乙酰化α-微管蛋白聚集,且微管动力蛋白可结合在乙酰化的α-微管蛋白上[31]。表明α-微管蛋白乙酰化可调控线粒体依赖于微管动力蛋白运输的过程,使线粒体上的ASC 沿着乙酰化的微管逆行性运输至细胞核周边并与内质网上的NLRP3合并在一起,从而促进NLRP3炎症小体活化。
2.3 线粒体相关内质网膜(mitochondria-associated endoplasmic reticulum membranes,MAMs)介导NLRP3炎症小体活化 MAMs是线粒体外膜和内质网膜某些区域高度重叠的部位,通过线粒体外膜蛋白Mitofusin 2彼此相互“连接”,但又不发生膜融合,保持稳定的10~30 nm 膜间距,在物质转运和信号转导过程中起重要作用[32]。研究表明,MAMs 可作为炎症小体组装平台,通过上述α-微管蛋白乙酰化介导线粒体上的ASC 运输至细胞核周边与NLRP3 共定位于MAMs[8,33]。SUBRAMANIAN 等[34]发现 线 粒体 抗 病毒蛋白MAVS 在NLRP3 炎症小体活化过程中分布于MAMs,而MAVS 可作为连接蛋白与NLRP3 的N端相互作用,促进NLRP3 定位于线粒体并诱导其活化[34-35]。有趣的是,MAVS 可形成脘病毒样的聚集体,而这样的聚集体又有利于NLRP3 寡聚化的形成[36]。因此,MAVS 不仅介导抗病毒的Ⅰ型IFN 反应,同时也可作为线粒体对NLRP3 炎症小体调控的桥梁。另外,在流感病毒和脑心肌炎病毒(encephalomyocarditis virus,EMCV)感染过程中,线粒体外膜上的Mitofusin 2可作为NLRP3在线粒体上的停靠位点,同样对NLRP3的活化至关重要[37]。
HDAC6 抑制剂诱导微管高度乙酰化可增强内质网滑动的频率,提示α-微管蛋白乙酰化不仅可以调控胞内线粒体分布,还能够调控内质网的滑动。由于α-微管蛋白乙酰化导致内质网的滑动与线粒体运输是偶联的,进一步说明α-微管蛋白乙酰化介导内质网上的NLRP3 和线粒体上的ASC 可以在MAMs 处相互靠近和结合,使得NLRP3 炎症小体在空间上得到合适的活化条件[38]。
值得注意的是,ZHOU 等[28]在未刺激的THP-1细胞中发现ASC 主要定位于细胞质,没有或很少与线粒体共定位。ZHANG 等[39]研究发现,在不同的NLRP3 激动剂处理下,线粒体主要聚集在高尔基体周围,然后1,2-二酰甘油(diacylglycerol,DAG)迅速积聚在高尔基体,随后募集蛋白激酶D(protein kinase D,PKD)来磷酸化NLRP3 的Ser293 位点,最终使NLRP3 从MAMs 中释放出来,才能进一步完成组装而得以活化。因此,MAMs 在NLRP3 炎症小体活化过程中的分子作用机制仍需深入探讨。
3 药物调控α-微管蛋白乙酰化影响NLRP3炎症小体活化
3.1 抑制α-微管蛋白乙酰化调控NLRP3炎症小体活化 秋水仙素是微管解聚剂,以不可逆的方式结合微管。MARTINON 等[40]首先发现秋水仙素可抑制MSU 诱导的THP-1细胞中NLRP3炎症小体活化,这可能是秋水仙素治疗痛风的主要机制。MISAWA等[8]发现秋水仙素抑制NLRP3 的活化是通过抑制α-微管蛋白乙酰化,从而抑制线粒体的运输并影响ASC 与NLRP3 的结合。另外,秋水仙素可抑制P2X7R 形成的孔洞,进而抑制ROS 的产生和IL-1β释放[41];还可抑制pyrin 的表达以抑制NLRP3 炎症小体组装[42]。
相较于秋水仙素通过破坏微管结构来抑制α-微管蛋白的乙酰化水平,白藜芦醇可抑制α-微管蛋白的乙酰化,但并不影响微管结构。由于秋水仙素的细胞毒性和副作用较大,因此不适用于如糖尿病、动脉粥样硬化等需要长期治疗的疾病。相反白藜芦醇毒性很低,体内实验发现,白藜芦醇能够抑制体内NLRP3炎症小体活化,改善MSU诱导的小鼠腹膜炎,可作为治疗NLRP3 相关疾病的候选药物。有研究报道,白藜芦醇可调控SIRT2 的酶活性,因此,白藜芦醇可能通过增强SIRT2活性,从而降低α-微管蛋白的乙酰化水平,进而抑制NLRP3 炎症小体活化[43]。但由于没有具体实验方法检测αTAT1 的酶活性,很难探究白藜芦醇是否对αTAT1 的酶活性有直接影响,因此白藜芦醇抑制α-微管蛋白乙酰化的具体机制仍有待探索。
NAMPT 是合成NAD+补救途径上关键限速酶,而水飞蓟宾可提高NAMPT 的表达水平,因此可逆转棕榈酸盐诱导的肝细胞内NAD+浓度的下降,促进SIRT2 的活性和表达,并降低αTAT1 表达,但对HDAC6无影响[44];最终抑制α-微管蛋白的乙酰化和NLRP3炎症小体的组装[45]。
3.2 促进α-微管蛋白乙酰化调控NLRP3炎症小体活化 吴茱萸碱可促进微管蛋白聚合,是一种微管稳定剂[46]。LI 等[47]研究表明吴茱萸碱可促进α-微管蛋白乙酰化,形成一个乙酰化的束状微管并与MTOC 共定位,促进ASC 等NLRP3 炎症小体组分与内质网上的NLRP3 接近,以增强炎症小体的组装和活化。由于吴茱萸碱不影响细胞内NAD+水平,因此,吴茱萸碱可能通过对SIRT2 活性的直接抑制作用来促进α-微管蛋白乙酰化[48]。另外,敲低αTAT1后可明显逆转吴茱萸碱促进α-微管蛋白乙酰化水平及NLRP3 炎症小体活化,提示吴茱萸碱也可能直接影响αTAT1活性。
紫杉醇能够促进微管蛋白聚合活性,可结合于β-微管蛋白,抑制微管的解聚;埃博霉素 B的生物活性研究显示其作用机制与紫杉醇相似,且在微管上的结合位点很大程度上是重叠的。研究发现紫杉醇和埃博霉素B这两个微管稳定剂与吴茱萸碱一样诱导α-微管蛋白的乙酰化,促进NLRP3炎症小体的活化和IL-1β 释放,以提高细菌性感染小鼠的存活率[12,49]。
4 总结与展望
炎症小体活化需要多种组成元件形成复合体,因此,NLRP3炎症小体需要像MTOC一样的平台,能更加有效地进行组装和活化,装载在微管(+)末端轨道上的NLRP3 将沿着微管快速运输,以便其正确递送到微管(-)末端MTOC 上。在NLRP3 激动剂刺激下,NLRP3 在微管的运输过程中首先遇到线粒体,也许是为了获得更多能量,然后进一步运输至MTOC 进行有效的装配和活化。值得注意的是, NLRP3 一旦到达MTOC 并组装成大的复合体时,就不再定位于线粒体,而只是围绕着MTOC。因此,NLRP3运输至线粒体有可能是一种过渡状态。
除α-微管蛋白外,细胞骨架的其他组成成分也可能参与NLRP3 炎症小体的活化,如微丝参与线粒体的短距离运输。因此微丝是否也参与了炎症小体活化过程?上文提到微丝药物细胞松弛素只影响与细胞吞噬相关的激动剂诱导的NLRP3 炎症小体活化,且葫芦素E虽然快速破坏微丝骨架,但不影响NLRP3炎症小体活化,提示NLRP3炎症小体的活化可能与微丝骨架关联不大[8]。但也有文献报道 F-肌动蛋白可通过Flightless-Ⅰ和LRRFIP2 与活 化的NLRP3 炎症小体相互作用,而Flightless-Ⅰ和 LRRFIP2 可抑制caspase-1 活化和IL-1β 分泌,细胞内Ca2+浓度升高可激活Flightless-Ⅰ切割F-肌动蛋白,促进IL-1β 分泌[50]。而β-微管蛋白的K252 位点在乙酰基转移酶San 的作用下也可发生乙酰化修饰来调控微管的多聚化,该特点是否会对线粒体的运输和NLRP3 炎症小体活化有影响仍需进一步研究[51]。
另外,虽然微管稳定剂可诱导α-微管蛋白乙酰化,但是否只要促进α-微管蛋白乙酰化,就一定能促进NLRP3 炎症小体活化?研究发现姜黄素虽然可与微管结合,进一步促进nigericin 诱导的胞内NAD+浓度降低,降低SIRT2 活性来促进nigericin 诱导的α-微管蛋白乙酰化,但会抑制线粒体运输至细胞核周边,从而抑制NLRP3 炎症小体的组装与活化[52]。提示线粒体运输至细胞核周边还存在其他未知途径。另一方面,使用Tubacin 抑制HDAC6 的去乙酰化酶活性,虽然可以导致α-微管蛋白的乙酰化明显上升,但对NLRP3 炎症小体的活化无影响,表明α-微管蛋白的乙酰化对NLRP3 炎症小体的活化可能是充分不必要条件。
α-微管蛋白乙酰化有利于调控NLRP3 炎症小体组分的空间分布和组装,这种微管乙酰化介导炎症小体活化的机制(图2),可能成为寻找解决人类炎症性疾病治疗方向的新线索。通过联合使用微管抑制剂和NLRP3 炎症小体抑制剂可针对更为广泛的潜在靶点来治疗相关的炎症性疾病。
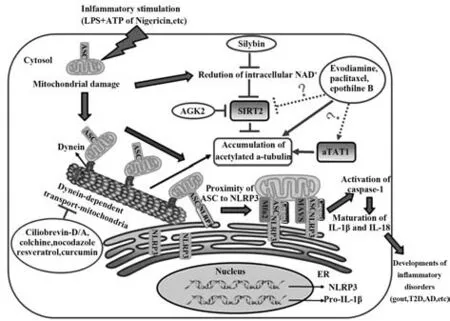
图2 α-微管蛋白乙酰化与NLRP3炎症小体活化[8,47,49,53-54]Fig.2 α-tubulin acetylation and NLRP3 inflammasome activation[8,47,49,53-54]
