外泌体调控树突状细胞免疫功能的研究进展①
2023-03-17李琳琳陈京涛吉林大学第一医院长春130061
李琳琳 朱 珊 陈京涛 (吉林大学第一医院,长春 130061)
外泌体是直径40~160 nm 脂质双层膜结构的圆形囊泡状小体,由内含囊泡的多泡体与细胞膜融合后释放至胞外。几乎所有细胞均可分泌外泌体[1]。外泌体携带蛋白质、核酸、脂类等各类物质,可在供体细胞和受体细胞间“穿梭”,实现细胞间物质传递和信息交流,参与受体细胞生物学功能调控。
树突状细胞(dendritic cells,DC)是连接固有免疫和适应性免疫的桥梁[2]。作为诱导固有免疫的关键因素,DC摄取加工抗原并通过主要组织相容性复合物(major histocompatibility complex,MHC)将其提呈给初始T细胞,启动特异性免疫应答[3]。同时,DC也具有免疫调节功能,通过分泌细胞因子参与T 细胞和B细胞发育、分化和活化。外泌体可参与DC免疫功能调控,工程化外泌体具有一定临床应用前景,因此,系统探究外泌体调控DC 免疫功能的作用及机制,充分了解工程化外泌体改造与应用对免疫治疗策略开发具有重要意义。
1 外泌体在DC功能调控中的“双面性”
外泌体在大小、携带物、功能和来源方面呈高度异质性,可能是外泌体可激活DC 又可引发功能障碍的原因[4]。WANG等[5]发现人肺癌细胞A594来源外泌体可上调DC 表面MHCⅡ和共刺激分子表达,诱导其分泌IL-12,促进T 细胞增殖与活化;采用与外泌体共孵育的DC 治疗荷瘤小鼠,其肿瘤组织T细胞数量增加,IFN-γ水平升高,IL-10和TGF-β水平降低,肿瘤增殖减缓,小鼠生存期延长。表明肿瘤来源外泌体在DC 介导抗肿瘤免疫应答启动中发挥重要作用。越来越多的研究表明其他肿瘤细胞,如小鼠乳腺癌细胞E0771、人结肠癌干细胞HT-29-CSC 和人宫颈癌细胞HeLa 来源外泌体也具有类似功能[6-8]。此外,也有研究发现M1 型巨噬细胞来源外泌体可诱导未成熟DC 分泌IL-12、IL-6、IFN-γ 和TNF-α,引发局部炎症,利于Th1 细胞分化[9]。肠道微生物来源外泌体可诱导DC 分泌促炎细胞因子,激活T 细胞应答,是启动宿主先天免疫系统的重要信号传递工具[10]。
随着研究深入,研究者逐渐发现外泌体也可通过多种方式引发DC 功能障碍,如抑制DC 成熟、削弱其抗原提呈能力、改变其细胞因子分泌模式以及将其诱导为调节性或耐受性DC(regulatory/tolerogenic DC,DCreg/TolDC)。YU 等[11]证实EGFR 突变小鼠肺癌细胞LLC 来源外泌体可将有活性的突变EGFR 转移至DC 表面,下调DC 表面MHCⅡ和共刺激分子表达,促进IL-10 分泌,抑制T 细胞活化与增殖。也有研究显示骨髓间充质干细胞(mesenchymal stem cell,MSC)来源外泌体可上调DC 内miRNA-146a 表达,抑制其成熟,提高同种异体肾移植存活率[12]。此外,其他细胞如上皮性卵巢癌细胞、尤文氏肉瘤细胞、乳腺癌细胞等来源外泌体也可诱导DC功能障碍[13-15]。DC 在免疫调节中具有免疫激活和免疫耐受双重作用,其中TolDC 通过诱导T 细胞凋亡或无反应状态及Treg 分化引起免疫耐受。近年TolDC 在器官移植与自身免疫性疾病等领域备受关注。HE 等[16]发现过表达IDO 骨髓MSC 来源外泌体可抑制DC 成熟,促进其分泌IL-10,上调Treg 数量。将以上外泌体注射到同种异体心脏移植大鼠体内,可减少移植免疫排斥反应,改善移植心脏功能。同样,未经基因改造的MSC、Treg细胞等来源外泌体被DC 摄取后,也可诱导DC 呈现TolDC 表型及功能特征,引起免疫耐受,为自身免疫性疾病治疗和诱导移植免疫耐受提供了新思路和新策略[17-18]。
2 外泌体调控DC免疫功能的分子机制
2.1 外泌体提供配体结合DC 表面受体 研究发现,外泌体携带的多种蛋白均可作为DC中Toll样受体(Toll-like receptors,TLRs)配体激活下游信号通路参与DC 功能调控,其中外泌体中高水平的热休克蛋白(heat shock protein,HSP)一度成为研究热点。如黑色素瘤细胞B16-F10 来源外泌体HSP72 和HSP105 可与DC 上的TLR2 和TLR4 结合,促进DC分泌大量IL-6,激活肿瘤细胞内STAT3 通路进而上调基质金属蛋白酶9表达,最终促进肿瘤肺转移[19]。此外,桥本甲状腺炎(HT)患者血清来源外泌体携带的HSP60 可 与DC 中TLR2/3 结 合,上 调DC 表 面CD40 和CD83 表 达及IL-6 分 泌,利于Th17 细胞 分化,证实循环外泌体参与HT 炎症反应,为自身免疫性甲状腺炎治疗提供了新思路[20]。
除TLRs 外,外泌体蛋白与DC 其他受体结合的研究也逐渐深入。如前列腺癌细胞DU145 来源外泌体携带的前列腺素E2(prostaglandin E2,PGE2)可与DC 表面PGE2 受体结合,抑制TNF-α 和IL-12 分泌,负调控CD8+T细胞活化;PGE2与DC表面受体结合可显著诱导DC 表面CD73 表达[21]。CD73 是一种腺苷代谢相关新型免疫检查点分子,通过抑制抗肿瘤免疫促进肿瘤进展和转移[22]。同样,有研究发现胶质瘤患者脑脊液来源外泌体含有半乳糖蛋白9,与DC 表面T 细胞免疫球蛋白黏蛋白-3 结合后抑制DC 对抗原的识别、处理和提呈,削弱CTL 介导的抗肿瘤免疫应答[23]。此外,正常细胞来源外泌体相关蛋白也可与DC 表面受体结合参与DC 功能调控。BROWN 等[24]报道,淋巴管内皮细胞(lymphatic endothelial cells,LEC)来源外泌体携带大量CX3CL1,该趋化因子与DC 表面CX3CL1 受体结合,促进DC定向迁移,证实在炎症和癌症中淋巴管周围LEC 分泌外泌体是基底外侧促迁移层(basolateral promigratory layer)的重要参与者。参与DC 功能调控的相关受体不仅定位于细胞表面,对外泌体携带蛋白如何到达不同细胞区域结合受体还需进一步阐释。
2.2 外泌体非编码RNA 调控DC 相关功能蛋白表达及活性 目前关于外泌体非编码RNA 调控DC 功能的研究多涉及外泌体miRNA,可能与其丰度高且调控机制相对单一有关。绝大多数miRNA 发挥功能都是通过与靶基因mRNA 3'UTR 结合抑制mRNA翻译,DC 中受外泌体miRNA 调控的靶基因包括共刺激分子、趋化因子、TLRs 和其他重要调控蛋白。如胰腺癌细胞来源外泌体miR-212 可抑制DC 中 调节因子X 相关蛋白(regulatory factor X-associated protein,RFXAP)表达,作为MHCⅡ的转录因子,RFXAP 低表达引起MHCⅡ转录抑制,最终加速胰腺癌进展与转移[25]。与间接作用于转录因子不同,结直肠癌患者来源外泌体miR-424 可同时靶向T 细胞和DC 中CD28 和CD80 mRNA,抑制其表达,破坏T细胞共刺激信号传导,导致T细胞无法完全激活继而诱导免疫耐受[26]。除肿瘤来源外泌体miRNA外,研究发现MSC 来源外泌体miR-21 可靶向DC 中CCR7 mRNA,抑制CCR7表达从而抑制DC迁移,MSC在多种急慢性炎症及自身免疫性疾病中的调控作用为后续研究提供了更多启示[27]。也有报道,过敏性鼻炎小鼠模型中,滤泡辅助性T 细胞来源外泌体miR-142 靶向抑制DC 中的CDK5,抑制DC 成熟,进一步加剧炎症反应,为过敏性鼻炎发病机制研究和治疗指明了新方向[28]。
随着lncRNA 研究的深入,研究者开始关注外泌体lncRNA参与的生物学事件[29]。关于外泌体lnc-RNA 参与DC 调控的系统性研究不多,其中肺腺癌转移相关转录子1(metastasis-associated lung adenocarcinoma transcript 1,MALAT1)是该方向热点。据报道MALAT1 高表达利于DC 向耐受表型转变。心脏移植和自身免疫性疾病中,高表达的MALAT1 通过miRNA-155/DC-SIGH/IL-10 轴诱导TolDC 和免疫耐受[30]。此过程中MALAT1 通过竞争结合抑制miR-155功能,即作为miRNA海绵调控DC相关功能基因表达,继而影响DC 功能。研究发现,沉默MALAT1 的肺癌细胞来源外泌体可上调DC 吞噬功能、表面CD80 和CD86 表达及IL-12 和IFN-γ 分泌。机制上,肺癌细胞来源外泌体MALAT1 通过AKT/mTOR 途径抑制DC 吞噬、炎症因子分泌、共刺激分子表达并促进细胞自噬,但外泌体MALAT1 在以上事件中直接调控的分子机制尚不明确,需进一步探索[31]。
2.3 外泌体参与DC 内信号转导过程调控 近年研究表明外泌体携带的相关介质能够通过直接或间接调控相关信号通路关键蛋白表达并影响其磷酸化状态参与DC胞内信号转导。如肝癌细胞Huh7来源外泌体将干扰素诱导的跨膜蛋白2(interferon induced transmembrane protein 2,IFITM2)转移至DC内,抑制ERK磷酸化,进而抑制内源性IFN-α合成并阻断外源性IFN-α 通路激活,最终削弱乙型肝炎抗病毒治疗效果[32]。LIU 等[31]发现沉默MALAT1 的肺癌细胞来源外泌体被DC 获取后,DC 中AKT 和mTOR 蛋白磷酸化水平下调,促进DC 成熟并增强其功能。也有研究发现气道上皮细胞来源外泌体携带的CNTN1 可通过Notch 信号通路调控DC 内NICD表达,促进DC 募集、增殖与激活,引发过敏性气道炎症[33]。此外,外泌体提供多种配体与DC 表面TLRs结合激活下游NF-κB通路[20]。
除上述较为经典的信号通路外,近年研究表明cGAS-STING 信号通路也参与外泌体对DC 功能的调控。KITAI 等[34]发现拓扑替康(topotecan,TPT)处理的乳腺癌细胞E0771 分泌含有大量DNA 的外泌体,可激活DC 内STING 信号通路及其下游信号IRF3 和NF-κB,促进IFN-β 和IL-6 分泌。随后有研究提出人原代淋巴母细胞瘤来源外泌体携带基因组和线粒体DNA,上述核酸特异性激活DC内cGAS/STING 信号通路,上调干扰素刺激基因(interferonstimulated genes,ISGs)表达;另一方面,当DC 与T细胞发生抗原依赖性接触时,含有基因组和线粒体DNA 的T 细胞外泌体被DC 获取,其中外泌体DNA可激活cGAS/STING-IRF3 信号通路,随之启动抗病毒免疫应答,表明外泌体DNA 在DC 固有免疫功能调控中也发挥重要作用[35]。
免疫代谢是近年备受关注的新领域,研究发现外泌体携带的代谢产物或中间物可能参与DC 代谢和功能调控。2020 年国内学者报道小鼠多种肿瘤细胞来源外泌体脂肪酸可通过过氧化物酶体增殖物激活受体α(peroxisome proliferator-activated receptor α,PPARα)信号通路增强DC 内脂质含量,并将DC能量代谢从糖酵解转变为氧化磷酸化,最终抑制效应CD8+T 细胞活化和增殖[36]。表明PPARα 信号通路可能是DC 免疫代谢的重要调控节点,并揭示了外泌体介导的DC代谢调控在免疫调节中的作用。
3 工程化外泌体助力DC免疫治疗
3.1 工程化外泌体用于DC 免疫功能调控 基于外泌体的分子运输能力、长期循环能力和出色的生物相容性,外泌体工程化加速了其作为药物递送利器的应用步伐。早期主要通过基因工程改造供体细胞实现外泌体中目的分子装载[37]。如在小鼠白血病细胞L1210 中过表达CD80 和CD86,获得的外泌体可诱导DC成熟,促进其分泌IL-12和TNF-α[38]。或通过电穿孔技术在小鼠结肠癌细胞CT26 中过表达miR-155,获得的外泌体可上调DC表面MHCⅡ和共刺激分子表达及IL-12 和IFN-γ 分泌,诱导DC 成熟,促进效应T细胞活化与增殖[39]。
除基因工程外,研究人员逐渐开发出多种无细胞方式实现目的分子装载,包括共孵育、电穿孔、超声处理和挤压等。PARK 等[40]通过电穿孔和共孵育方法将酪氨酸酶相关蛋白2(tyrosinase related protein-2,TRP2)和单磷酰脂质A(monophosphoryl lipid A,MPLA)导入血清来源外泌体,该工程化外泌体被DC 获取后,抑制其分泌IL-6 和TNF-α。LEE 等[41]将TLR7/8 激动剂R848 通过超声法导入外泌体,这种药物胶囊化外泌体(R848-encapsulated EXOs)可促进DC 分泌IL-12 和TNF-α。基于多柔比星(doxorubicin,DOX)纳米颗粒具有优异的抗肿瘤功效,有研究团队采用挤压法将荷载DOX 的PLA-PEG 纳米粒装载于内皮细胞来源外泌体,全身给药治疗胶质瘤荷瘤小鼠,利于DOX 通过血脑屏障在肿瘤组织有效积聚,延长荷瘤小鼠生存期;分析治疗方法对免疫微环境的影响结果显示以上治疗方法可促进DC 成熟,显著增加肿瘤组织中CTL 浸润[42]。表明药物纳米递送和外泌体结合可进一步提高工程化外泌体生物相容性,在肿瘤治疗中具有潜在应用价值。
研究人员也利用基因工程手段对外泌体表面结构进行修饰,提高外泌体靶向性。较为常见的是构建包含引导多肽或蛋白基因序列与外泌体膜蛋白基因序列的融合基因质粒,转染供体细胞后获得的外泌体在其表面展示特异引导性多肽或蛋白,该修饰使外泌体具有较好的组织细胞特异性[43]。上述修饰后的外泌体可高效靶向肿瘤细胞、T 细胞、神经元细胞等,进一步引发受体细胞内一系列生物学事件[44-46]。但其是否直接靶向于DC 并参与DC 免疫功能调控目前少有文献阐述,期待接下来的研究能丰富相关内容。
外泌体表面修饰策略还包括无细胞的化学修饰或连接锚定肽等[47]。MOK 团队采用1,2-二硬脂酰-sn-甘油-3-磷酸乙醇胺和甘露糖对外泌体进行化学修饰,可与DC 表面甘露糖受体CD206 结合,促进DC分泌IL-6和TNF-α[48]。此外,2018年尹海芳团队研发了一种外泌体锚定肽CP05,该肽一端偶联外泌体表面CD63 蛋白,一端偶联靶向肽或递送的功能性分子,首先证实CP05可用于从人血清中分离外泌体,便于外泌体收集和纯化,可实现外泌体靶向递送[49]。2020 年 该 课 题 组 应 用CP05 将 预 警 素HMGN1 连接至外泌体,修饰后的外泌体命名为TEX-N1ND,可诱导DC 活化,上 调 表 面MHC Ⅰ、MHCⅡ、CD83 和CD86 表达;小鼠肝癌原位模型中,采用与TEX-N1ND共孵育的DC治疗小鼠,可延长荷瘤小鼠生存期,产生长效抑瘤作用[50]。证明了锚定肽修饰外泌体在肿瘤免疫治疗方面具有巨大潜力。
3.2 基于DC 功能调控工程化外泌体的应用 基于工程化外泌体的高生物相容性、组织细胞靶向性、低免疫原性和易于修饰等特征,其在肿瘤诊断、免疫治疗和药物递送等领域具有极大实用价值[51-53]。MORISHITA 团队[54]开发了一种基于外泌体的肿瘤抗原-佐剂共传递系统,即基因工程化细胞来源外泌体(SAV-exo)与佐剂CpG ODN 结合构成的CpG-SAV-exo,被DC摄取后促进DC分泌TNF-α、IL-6和IL-12。小鼠肿瘤模型中,较单独使用外泌体或CpG ODN,CpG-SAV-exo 表现出更强的体内抑瘤能力。近期汪付兵团队开发了一种载有TLR3 激动剂Poly-ICLC(Hiltonol)和人中性粒细胞弹性蛋白酶(Elastase,ELANE)的外泌体(命名为HELA-exo),可诱导DC 活化,上调MHCⅠ表达,促进CD8+T 细胞活化与增殖[55];小鼠三阴性乳腺癌模型和患者来源肿瘤类器官中,HELA-exo均可有效抑制肿瘤进展。可见不同形式工程化外泌体为DC 肿瘤疫苗研发提供了新思路和新策略。近年关于利用PD-L1高表达的生物载体治疗自身性免疫疾病的研究越来越多。XU等[56]通过慢病毒在MSC中过表达PD-L1,以上细胞分泌外泌体(MSC-sEVs-PD-L1)可与DC表面PD-1结合,抑制DC 共刺激分子表达。小鼠溃疡性结肠炎或银屑病模型中,MSC-sEVs-PD-L1 可抑制DC 活化及分泌促炎细胞因子,改善小鼠炎症反应。
部分工程化外泌体药物开发基于肿瘤微环境中的DC 功能调控。如活化的DC 分泌IL-12 可有效激活淋巴细胞,促进抗肿瘤免疫应答,但IL-12 半衰期短,且具有剂量相关性毒性,限制了其临床应用。2020 年9 月15 日Codiak BioSciences 公司宣 布开 始外泌体药物ExoIL-12 Ⅰ期临床试验。ExoIL-12旨在外泌体表面展示IL-12,在肿瘤病灶靶向释放IL-12,增强IL-12 剂量控制,限制其在非肿瘤部位暴露并产生相关毒性。此外,2021 年11 月16 日,该公司公布了工程化外泌体药物exoSTING 治疗实体瘤1/2期临床试验中获得的初步数据。ExoSTING 旨在为肿瘤微环境中的APC(包括DC)提供STING 激动剂靶向递送,以局部激活固有免疫应答,并通过将肿瘤抗原提呈给T细胞产生适应性免疫应答。以上两个工程化外泌体药物临床试验启动对外泌体肿瘤治疗领域具有里程碑式意义。
4 总结
外泌体作为细胞间信息交换媒介在人体免疫调节中发挥重要作用。就目前研究来看,由于外泌体的异质性,其参与DC 功能调节的方式及机制不尽相同(图1),同时基于外泌体分子运输能力、长期循环能力和出色的生物相容性,不同类型工程化外泌体在肿瘤治疗、药物递送和组织修复再生等领域具有很大潜力。深入研究外泌体参与DC 功能调控及相关免疫应答的方式及机制,对DC 相关免疫学理论扩展和免疫治疗临床应用均具有重要意义。
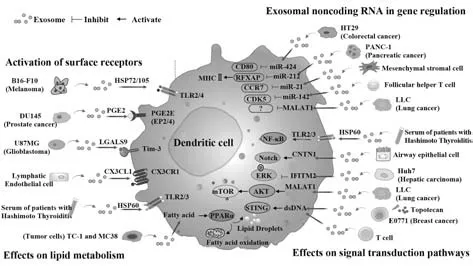
图1 外泌体调控DC免疫功能的分子机制Fig.1 Molecular mechanism of dendritic cell function modulated by exosomes
