两种新型冠状病毒免疫学检测方法的应用评价①
2023-03-17郑仲华黄鑫鑫邹丽容李振翠郭前方刘美真梁丽君李柏生
郑仲华 黄鑫鑫 张 欢 邹丽容 胡 瑶 李振翠 郭前方 刘美真 梁丽君 李柏生
(广东省疾病预防控制中心,广东新发突发传染病防治工作站,广州 511430)
2019年12月以来,湖北省武汉市部分医院陆续发现了多例不明原因的肺炎病例,并在随后的1 个多月内蔓延至全国[1]。引起此次疫情的病原体随后被命名为新型冠状病毒,属于套式病毒目冠状病毒科冠状病毒属,是一种具有不规则形状的线性单股正链RNA病毒,直径60~220 nm。根据系统发育树,冠状病毒可分为α、β、γ 和δ 4 种,SARS-CoV-2 是可分为A、B、C和D等4种亚群的β属冠状病毒[2]。
目前应对新型冠状病毒疫情的最有效方法是“早发现、早隔离、早诊断、早治疗”[3]。2020 年3 月 3 日,国家卫生健康委发布了《新型冠状病毒肺炎诊疗方案(试行第七版)》,第一次将新冠抗体检测纳入临床辅助诊断标准,同时国家药监局也应急审批了广州万孚(胶体金试纸条)、英诺特(唐山)、博奥塞斯(重庆)和厦门万泰(化学发光法)等多家企业的新冠抗体检测试剂盒注册申请[4]。本研究选取胶体金法和化学发光法分别检测新冠抗体,通过与病毒中和试验检测中和抗体滴度进行比较,从灵敏度、特异度和Kappa值等方面进行评价,并比较新冠抗体检测方法的优缺点,为国内新冠肺炎疫情常态化防控(尤其是大规模人群免疫后血清抗体监测),选取合适的抗体检测方法提供参考。
1 资料与方法
1.1 资料
1.1.1 一般资料 根据《新型冠状病毒肺炎诊疗方案(试行第八版)》标准将2021年2月7日至2021年2月25日由广东省内各地市上送至广东省疾病预防控制中心的92 例样本分为确诊病例组(67 例)和健康对照组(25例)。
1.1.2 SARS-CoV-2 病毒株 来源于2020 年1 月 1 例有武汉旅行史的疑似新型冠状病毒肺炎患者由广东省疾病预防控制中心病原微生物检验所分的离肺泡灌洗液,实验室编号为20SF014[5]。
1.1.3 试剂和仪器 新型冠状病毒IgM/IgG 抗体检测试剂盒(胶体金法,医疗器械注册证编号/产品技术要求编号:国械注准20203400177,生产许可证号:冀食药监械生产许20150033号)购自英诺特(唐山)生物技术有限公司;化学发光免疫分析仪 Axceed 260 购自博奥赛斯(天津)生物科技有限公司;胎牛血清和MEM 培养基购自美国Gibco 公司;倒置显微镜购自日本Nikon 株式会社;二级生物安全柜购自美国赛默飞世尔科技公司;Moxi Z 便携式自动细胞计数仪购自美国Orflo 公司;含5%CO2的37 ℃细胞培养箱购自德国BINDER 公司;Eppendorf 5804R高速冷冻离心机购自德国Eppendorf公司。
1.2 方法
1.2.1 样本收集与处理 采集所有研究对象静脉血5 ml,置于含分离胶的黄头真空采血管内,室温下静置20 min,3 000 r/min、4 ℃离心10 min 后,将血清分装至3 个EP 管,200 µl/管,56 ℃金属浴30 min 灭活,分别利用化学发光免疫分析仪、SARS-CoV-2 IgG/IgM 抗体检测试剂盒(胶体金法)和微量病毒中和抗体试验检测SARS-CoV-2 临床确诊患者血清中的抗体水平。
1.2.2 胶体金法测定 按照新型冠状病毒IgM/IgG抗体检测试剂盒说明书,采用免疫捕获法原理检测新型冠状病毒IgM 抗体和IgG 抗体。打开检测卡的铝箔袋包装,取出检测卡平铺,然后分别取10 µl 待测血清(或血浆)加至IgM 抗体和IgG 抗体检测试剂的圆形样本孔,再分别加80 µl(或两滴)样本稀释液,室温放置15 min观察结果。IgM抗体和IgG抗体检测试剂判读窗口T 线和C 线位置出现清晰的紫红色条带,判读为新型冠状病毒IgM 抗体和IgG 抗体阳性;若仅在C线位置出现清晰的紫红色条带,判读为新型冠状病毒抗体阴性;若判读窗口C 线无紫红条带为试验无效,需重新检测。
1.2.3 化学发光法测定 按照化学发光免疫分析仪 Axceed 260 说明书,先稀释样本,取15 µl 样本血清和735 µl样本稀释液,使用旋涡混匀器混匀5 s后备用,IgM和IgG项目共用稀释后的样品。稀释后的样本上机检测,首次出结果时间为47 min。结果解读:S/CO=样本发光值/cut-off 值(S 代表标本的OD值,CO即临界值,是判断检测结果的标准)。S/CO<1为阴性;S/CO≥1为阳性。建议尽快调查该患者的接触史、发热史、治疗史,3~5 d 后再抽血复测IgM 和IgG抗体;S/CO介于0.7~1.0为灰区结果,建议3~5 d后再抽血复测。
1.3 统计学分析 采用SPSS24.0软件进行统计学分析,P<0.05 为差异有统计学意义。通过灵敏度、特异度、阴阳预测值、Kappa 值等筛检评价指标对胶体金法和化学发光法两种抗体检测方法进行评价。
2 结果
2.1 病毒中和试验结果 92 份样本的微量病毒中和试验∶新冠抗体滴度≥1∶4 者占比为72.83%(67/92),其中抗体最高滴度为1∶1 024,占比为3.26%(3/92),见表1。
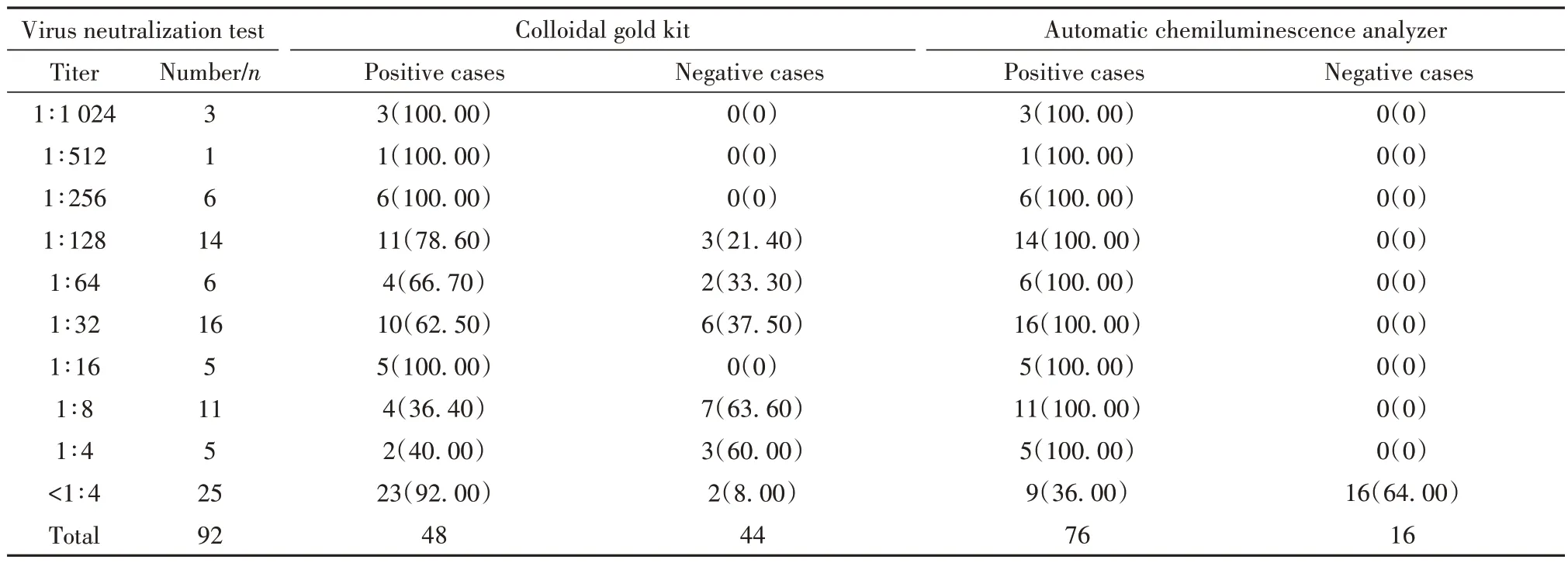
表1 胶体金法和化学发光法检测血清的结果(构成比)分布[例(%)]Tab.1 Distribution of results (constituent ratio) of serum detected by colloidal gold method and chemiluminescence method [n(%)]
2.2 胶体金法检测结果 92 份样本中,新冠抗体阳性结果占比为52.17%(50/92),其中弱阳性结果占比为12.50%(6/48),见表2。
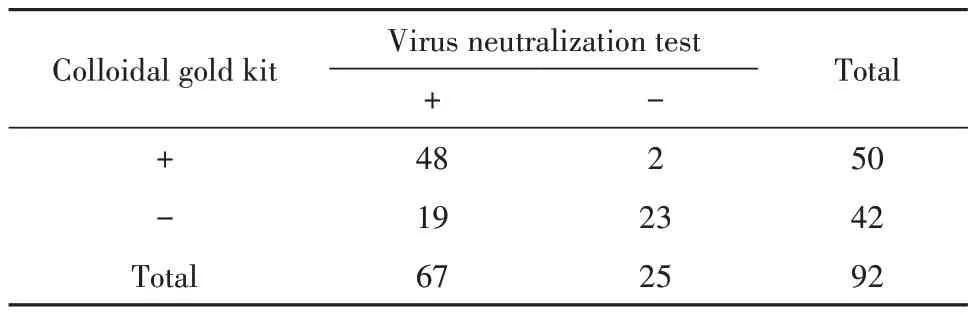
表2 胶体金法结果Tab.2 Results of colloidal gold method
2.3 化学发光法检测结果 92 份样本中,新冠抗体阳性结果占比为82.61%(76/92),其中IgM 阳性者占总阳性结果的44.74%(34/76),IgG 阳性者占总阳性结果的92.11%(70/76);阴性占17.39%(16/92),见表3。

表3 化学发光法结果Tab.3 Results of chemiluminescence method
2.4 胶体金和化学发光法检测结果比较 当以微量病毒中和抗体试验的结果作为本研究的实验室诊断金标准,胶体金法灵敏度小于化学发光法,但特异度大于化学发光法;两种检测方法的Kappa 值分别为0.525和0.721;胶体金法检测新冠抗体的阴性预测值不如化学发光法,但阳性预测值较高,见表4。

表4 胶体金和化学发光法的检测结果比较Tab.4 Comparison of detection results between colloidal gold kit and automatic chemiluminescence analyzer
3 讨论
SARS-CoV-2 引起的新型冠状病毒肺炎疫情已经在世界范围内流行。截至2021年4月13日24时,国内累计治愈出院病例85 513 例,累计死亡病例 4 636 例,累计报告确诊病例90 447 例[6]。同时,世界卫生组织(WHO)统计,全球范围累计确诊病例136 996 364例,累计死亡病例2 951 832例[7]。
目前SARS-CoV-2 病原学检测方法主要包括病毒核酸检测和血清抗体检测,核酸检测作为新冠病毒确诊的金标准,主要采用RT-PCR 方法检测鼻咽拭子、痰液等呼吸道样本中的病毒RNA,但此方法的检测结果易受病程、标本采集和存储、检测过程等因素影响,且对实验室条件也有较高要求,应当至少按照二级生物安全、三级防护条件从事相关核酸检测工作[8-10]。因此,新冠抗体检测手段可以很好地作为辅助性诊断方法,且能够同时检测特异性IgM 和IgG 抗体:检测IgM 抗体有助于早期诊断新型冠状病毒感染;检测IgG 抗体有助于检测出是否是既往感染或免疫后产生的抗体。疫苗是人类抵抗传染病最为有效的手段,截至2020年11月12日,有164 种新冠疫苗正在开发,国内已有多款新冠疫苗被批准用于紧急使用,随着疫苗大规模在人群中接种,导致抗体检测方法均无法有效区分是既往感染还是免疫产生的抗体[8]。因此,国家新冠肺炎疫情防控方案规定抗体检测需结合流行病学史、临床表现和基础疾病等情况进行综合判断[9]。
本研究表明,若以微量病毒中和抗体试验结果为抗体检测金标准时,化学发光法的灵敏度、Kappa值均高于胶体金法,提示化学发光法在检测同一组样本时较胶体金法更好[11]。与童伟等[4]对两种免疫学检测方法的应用评价结果不同。初步怀疑是因为胶体金法检测对弱阳性结果靠肉眼判断结果不稳定,易受实验者个人因素影响,导致灵敏度波动;由于新型冠状病毒导致的疫情较为严重,根据试剂盒说明书,在试剂盒开发时更大程度地提高诊断灵敏度,避免因漏检造成严重后果。通过试剂盒截断值(即临界值,是判断检测结果的标准)的设定提高灵敏度,不同区域的截断值有一定程度差异,可能会出现因截断值差异导致的假阳性;同时患者血清样本中可能存在内源性干扰物质导致假阳性。
微量病毒中和抗体试验应在三级生物安全条件下进行,虽然结果准确可信,但也存在试验过程人为判断细胞病变以及耗时耗力的缺点[10]。本研究结果表明,相较于中和试验,胶体金法与化学发光法在抗体检测方面各有其优缺点。胶体金法的灵敏度和Kappa值一般,但其检测过程方便快捷,尤其是对实验室条件无严格要求,且用时较短,非常适合于基层相关检测部门进行快速的大规模人群检测。化学发光法的灵敏度和Kappa 值较高,结果相对稳定可靠且用时较短;但自动化设备价格较昂贵,操作也相对复杂,因此,在新冠抗体复检或少量监测样本时,具有较高使用价值。
因本研究收集到的样本数量有限,对SARSCoV-2 两种免疫学检测方法的应用评价还不够全面,需要进一步收集更多样本数据进行研究以完善相关评价机制。参考试剂盒说明书,胶体金法和化学发光法均只能定性检测,无法检测保护性抗体含量。鉴于我国正在进行大规模人群注射新冠疫苗,如若无法找到可替代的定量抗体检测方法,将无法有效判定抗体的保护效果,因此,中和抗体试验仍将被长期用于保护性抗体监测。部分疫苗(如羊布鲁氏菌病疫苗)免疫一段时间后,利用试管凝集试验(SAT)和虎红平板凝集试验(RBT)基本无法检测到凝集抗体,但ELISA法的抗体阳性率依然可观[11]。因此,本研究为新冠疫苗免疫后抗体水平的监测提供了一种新的思考方向,是否可于免疫后利用多种监测手段对新冠抗体水平进行监测,尤其是利用高灵敏度的检测方法,而后再利用中和试验进行保护性抗体监测。当然,本课题组希望利用大数据样本抗体监测找到更好、更快、更方便的抗体检测方法,用于替代复杂的病毒中和抗体试验。
