circAGFG1在皮肤鳞状细胞癌组织中的表达及其对SCC13细胞增殖、迁移的影响
2023-03-17宋丹丹宋明旭江南大学附属医院皮肤科无锡214122
宋丹丹 宋明旭 孙 鸿 (江南大学附属医院皮肤科,无锡 214122)
皮肤鳞状细胞癌是我国常见的恶性肿瘤,目前其发病机制尚未阐明,随着医疗技术的进步,分子靶向治疗成为皮肤鳞状细胞癌的重点研究[1-2]。环状RNA(circular RNA,circRNA)不具有5'端帽子结构与3'端多聚腺苷酸尾巴结构,具有稳定性与组织特异性,circRNA 可充当微小RNA(miRNA)的海绵分子而调节其靶基因表达,研究表明circRNA 在皮肤鳞状细胞癌发生及发展过程中发挥重要调控作用[3-4]。circAGFG1 在三阴性乳腺癌中表达上调,可通过充当miR-195-5p 的海绵分子而抑制三阴性乳腺癌细胞增殖及转移下调其表达[5]。Starbase 预测显示circAGFG1与miR-653-5p存在结合位点。研究表明miR-653-5p 在黑色素瘤中呈低表达,上调其表达可抑制黑色素瘤增殖及转移[6]。但circAGFG1/miR-653-5p 分子轴在皮肤鳞状细胞癌发生及发展过程中的作用机制尚未明确。因此,本研究主要探讨circAGFG1是否可通过靶向调控miR-653-5p表达而调节皮肤鳞状细胞癌细胞增殖及迁移。
1 资料与方法
1.1 资料
1.1.1 临床资料 收集2018 年3 月至2020 年5 月江南大学附属医院收治的46 例皮肤鳞状细胞癌患者的癌组织及其相应癌旁组织标本,置于-80 ℃超低温冰箱内保存。其中男26 例,女20 例,年龄44~63 岁,平均年龄(52.35±3.26)岁,所有患者均经手术组织病理证实为皮肤鳞状细胞癌。本研究经江南大学附属医院伦理委员会批准,所有患者知情且签署同意书。
1.1.2 细胞与试剂 人皮肤鳞状细胞癌细胞SCC13 购自美国ATCC;LipofectamineTM3000 Transfection Reagent 购自美国Invitrogen;DMEM 培养基、胎牛血清、Trizol 试剂购自上海碧云天生物;反转录试剂与SYBR 荧光定量试剂购自北京天根生化;si-NC、si-circAGFG1、miR-NC、miR-653-5p mimics、antimiR-NC、anti-miR-653-5p 购自广州锐博生物;野生型载体WT-circAGFG1、突变型载体MUT-circAGFG1 与双荧光素酶活性检测试剂盒购自美国Promega。
1.2 方法
1.2.1 实验分组 将SCC13 细胞接种于6 孔板 (1×105个/孔),待细胞生长融合度约为70%时进行转染,细胞分为si-NC 组(转染50 nmol/L circAGFG小干扰RNA 的阴性对照)、si-circAGFG1 组(转染 50 nmol/L circAGFG 小干扰RNA)、miR-NC 组(转染50 nmol/L miR-653-5p 寡核苷酸模拟物的阴性对照mimic NC 序列)、miR-653-5p 组(转染50 nmol/L miR-653-5p 寡核苷酸模拟物)、si-circAGFG1+antimiR-NC 组(共转染50 nmol/L si-circAGFG1 与miR-653-5p特异性寡核苷酸抑制剂的阴性对照)、si-circ-AGFG1+anti-miR-653-5p组(共转染50 nmol/L si-circ-AGFG1与miR-653-5p特异性寡核苷酸抑制剂)。
1.2.2 qRT-PCR 检测circAGFG1、miR-653-5p 的表达水平 皮肤鳞状细胞癌组织、癌旁组织与各组SCC13 细胞加入1 ml Trizol 试剂提取总RNA,反转录合成cDNA,qRT-PCR 扩增反应体系:SYBR Green Master Mix 10 µl、正反向引物0.8 µl、cDNA 1 µl,ddH2O 补足体系至20 µl;反应条件:95 ℃预变性 5 min 循环1 次,95 ℃变性30 s,60 ℃退火30 s,72 ℃延伸30 s,共循环40 次。circAGFG1 以GAPDH 为内参,miR-653-5p 以U6 为内参,采用2-ΔΔCt法计算circ-AGFG1、miR-653-5p相对表达量。
1.2.3 CCK-8 实验检测细胞增殖 收集各组SCC13 细胞接种于96 孔板(3×103个/孔),每孔加入10 µl CCK-8 溶液,于培养箱内培养2 h,采用酶标仪检测450 nm波长处的光密度值(OD值)。
1.2.4 平板克隆形成实验 取各组SCC13 细胞 (1 000个/孔),于37 ℃、CO2体积分数为5%的培养箱培养14 d,弃培养基,预冷PBS 洗涤,加入500 µl 甲醇固定细胞20 min,400 µl 1%结晶紫染色液染色15 min,对≥30 个细胞的集落进行观察,于显微镜下观察细胞克隆形成数。
1.2.5 划痕实验 收集各组SCC13 细胞接种于 6孔板(1×104个/孔),待细胞生长融合度达到80%时,用200 µl移液枪的枪头在细胞单层划线,于培养箱内培养24 h 后于显微镜下观察迁移距离,应用Image J软件检测各组细胞迁移距离并计算细胞划痕愈合率,愈合率(%)=(0 h 划痕宽度-24 h 划痕宽度)/0 h 划痕宽度×100%。
1.2.6 Transwell 实验检测细胞迁移 收集各组SCC13 细胞加入0.25%胰蛋白酶消化,加入不含血清的DMEM 培养液制备单细胞悬液(5×104个/ml),取200 µl 细胞悬液接种于上室,下室加入600 µl 含有10%胎牛血清的培养液,培养箱内培养24 h,多聚甲醛固定20 min,0.1%结晶紫染液染色10 min,显微镜下随机选取5个视野观察迁移细胞数。
1.2.7 双荧光素酶报告实验检测circAGFG1 与miR-653-5p 的靶向关系 Starbase 预测显示circAGFG1 与miR-653-5p 存在结合位点,构建荧光素酶报告基因载体:野生型载体WT-circAGFG1、突变型载体MUT-circAGFG1,分别将荧光素酶报告基因载体与miR-NC 或miR-653-5p mimics 共转染至SCC13 细胞,于培养箱内培养24 h,采用双荧光素酶活性检测试剂盒检测细胞荧光素酶活性。
1.3 统计学分析 采用统计学软件SPSS21.0进行分析,计量资料以±s表示,两组间比较采用独立样本t检验,多组间比较采用单因素方差分析;Pearson法进行相关性分析,以P<0.05 为差异具有统计学意义。
2 结果
2.1 皮肤鳞状细胞癌组织中circAGFG1 和miR-653-5p 的表达 与癌旁组织比较,皮肤鳞状细胞癌组织中circAGFG1 的表达量升高(P<0.05),miR-653-5p 的表达量降低(P<0.05),见图1A、1B。采用Pearson 法分析皮肤鳞状细胞癌组织中circAGFG1与miR-653-5p 表达量的相关性,结果显示,circAGFG1与miR-653-5p呈负相关(r=-0.571 7,P<0.001),见图1C。
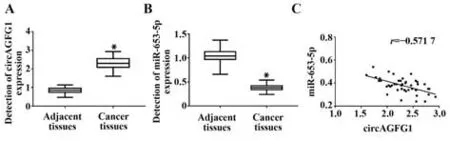
图1 circAGFG1 和miR-653-5p 在皮肤鳞状细胞癌组织中表达的检测及相关性分析Fig.1 Detection and correlation analysis of circAGFG1 and miR-653-5p expressions in skin squamous cell carcinoma
2.2 下调circAGFG1 对SCC13 细胞增殖、迁移的影响 与si-NC 组比较,si-circAGFG1 组miR-653-5p 的表达量升高(P<0.05),细胞增殖抑制率升高(P<0.05),划痕愈合率降低(P<0.05),细胞克隆形成数和迁移细胞数减少(P<0.05),见表1。
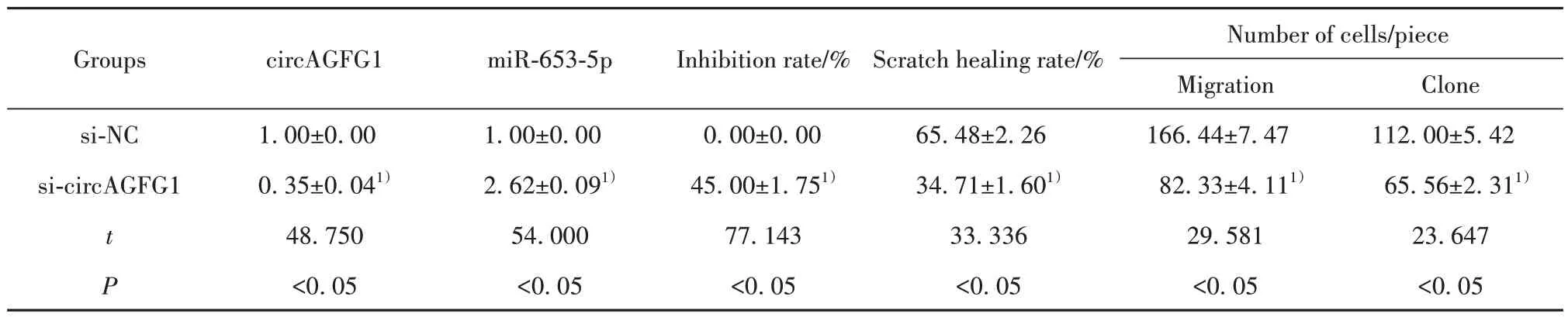
表1 下调circAGFG1抑制SCC13细胞增殖、迁移(xˉ±s,n=9)Tab.1 Down-regulation of circAGFG1 inhibits proliferation and migration of SCC13 cells (xˉ±s,n=9)
2.3 circAGFG1 靶 向miR-653-5p circAGFG1 与miR-653-5p 存在结合位点,见图2。共转染野生型载体WT-circAGFG1 的细胞实验中,与miR-NC 组比较,miR-653-5p 组细胞荧光素酶活性降低(P<0.05),见表2。表明circAGFG1 与miR-653-5p 存在靶向调控作用。

图2 circAGFG1与miR-653-5p存在结合位点Fig.2 There are binding sites for circAGFG1 and miR-653-5p
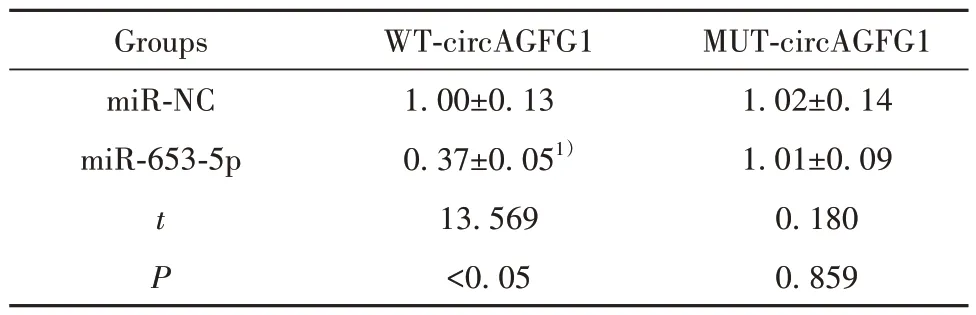
表2 双荧光素酶报告实验(xˉ±s,n=9)Tab.2 Double luciferase report experiment (xˉ±s,n=9)
2.4 miR-653-5p对SCC13细胞增殖、迁移的影响 与miR-NC 组比较,miR-653-5p 组细胞增殖抑制率升高(P<0.05),划痕愈合率降低(P<0.05),细胞克隆形成数和迁移细胞数减少(P<0.05),见表3。
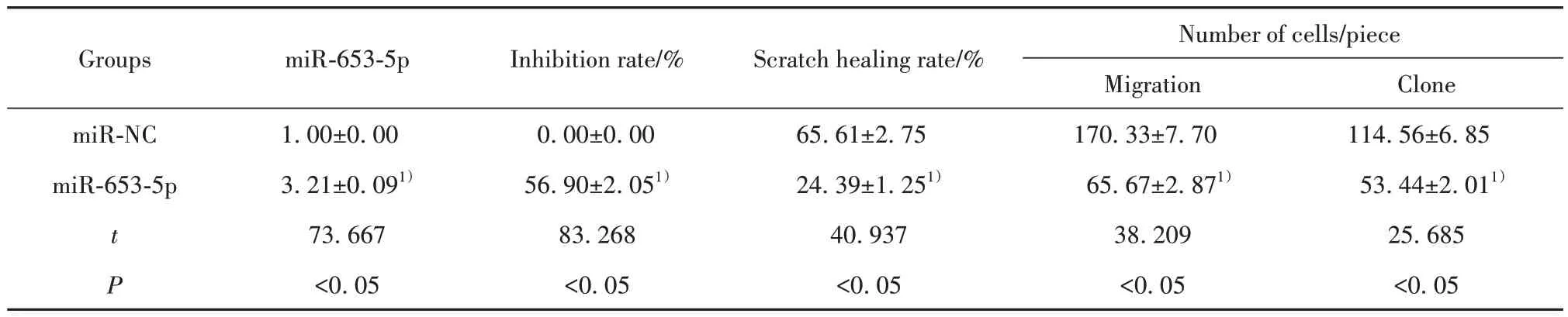
表3 miR-653-5p抑制SCC13细胞增殖、迁移(xˉ±s,n=9)Tab.3 miR-653-5p inhibits proliferation and migration of SCC13 cells (xˉ±s,n=9)
2.5 抑制miR-653-5p 对下调circAGFG1 处理的SCC13 细胞增殖、迁移的影响 与si-circAGFG1+ anti-miR-NC 组比较,si-circAGFG1+anti-miR-653-5p组细胞增殖抑制率降低(P<0.05),划痕愈合率升高(P<0.05),细胞克隆形成数和迁移细胞数增多(P<0.05),见表4。
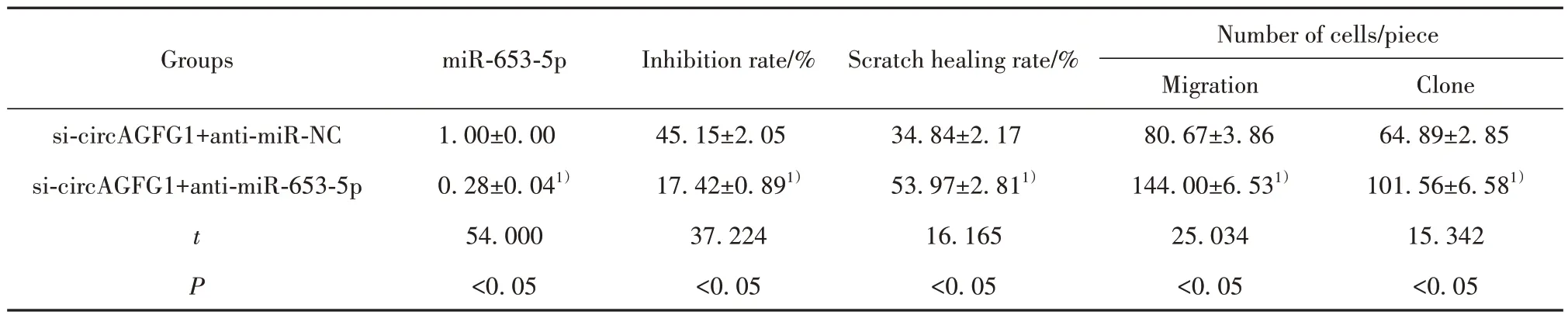
表4 抑制miR-653-5p可逆转下调circAGFG1对SCC13细胞增殖、迁移的抑制作用(xˉ±s,n=9)Tab.4 Inhibition of miR-653-5p can reverse inhibitory effect of down-regulation of circAGFG1 on proliferation and migration of SCC13 cells (xˉ±s,n=9)
3 讨论
circRNA 可通过充当miRNA 的海绵分子而间接调控靶基因表达,研究表明circRNA 在皮肤鳞状细胞癌中表达异常,并可调节细胞生物学行为[7-9]。circRNA 可通过调节miRNA/mRNA 分子轴从而影响皮肤鳞状细胞癌细胞增殖、凋亡等生物学过程,还可能作为皮肤鳞状细胞癌靶向治疗的潜在靶点[10-11]。
circAGFG1 可通过调节YY1/CTNNB1 分子轴促进结直肠癌细胞增殖及转移[12]。circAGFG1 可充当miR-28-5p的海绵分子调节HIF-1α 的表达而促进非小细胞肺癌进展[13]。circAGFG1 可通过下调p53 表达而促进宫颈癌细胞增殖及转移[14]。但circAGFG1在皮肤鳞状细胞癌中表达及其可能作用机制尚未明确。本研究结果显示,皮肤鳞状细胞癌组织中circAGFG1 的表达量升高,下调circAGFG1 表达后皮肤鳞状细胞癌细胞增殖抑制率升高,划痕愈合率降低,细胞克隆形成数和迁移细胞数减少,提示下调circAGFG1 表达可抑制皮肤鳞状细胞癌细胞增殖、克隆形成及迁移。
miR-653-5p 在胃癌中表达下调,上调其表达可抑制胃癌细胞转移[15]。miR-653-5p 表达上调可抑制宫颈癌细胞增殖[16]。miR-653-5p 通过靶向调控MAPK6 而抑制乳腺癌细胞生长及迁移[17]。miR-653-5p 表达上调可抑制非小细胞肺癌细胞生长和侵袭[18]。本研究结果显示,皮肤鳞状细胞癌组织中miR-653-5p 的表达量降低,circAGFG1 与miR-653-5p 呈负相关,circAGFG1 可充当miR-653-5p 的海绵分子,并可负向调控miR-653-5p的表达,miR-653-5p过表达可抑制皮肤鳞状细胞癌细胞增殖、克隆形成及迁移,而抑制miR-653-5p表达可拮抗下调circAGFG1 表达对皮肤鳞状细胞癌增殖、克隆形成及迁移的抑制作用。提示circAGFG1可通过靶向调控miR-653-5p 表达而促进皮肤鳞状细胞癌细胞增殖、克隆形成及迁移。
综上所述,皮肤鳞状细胞癌组织中circAGFG1表达水平升高,miR-653-5p 的表达水平降低,circ-AGFG1 可靶向结合miR-653-5p,下调circAGFG1 表达可通过促进miR-653-5p 表达而抑制皮肤鳞状细胞癌细胞增殖、克隆形成及迁移,circAGFG1 可能作为皮肤鳞状细胞癌治疗的潜在靶点。但关于其具体作用机制尚需进一步探究。
