KRT17在结肠癌细胞和组织中的表达及生物学功能①
2023-03-17胡运洲王小军张亚奇崔红斌天水市第二人民医院天水741000
胡运洲 王小军 张亚奇 崔红斌 陈 昊 李 刚 (天水市第二人民医院,天水 741000)
目前约有40%的结肠癌患者在以手术结合化疗、放疗的治疗策略中无法获得更加显著的生存效益,免疫治疗作为肿瘤治疗的新兴策略之一,部分单克隆抗体在结肠癌的治疗中已展现出显著的生存效益。国外首次通过基因微阵列/RNA 测序验证了角蛋白17(keratin 17,KRT17)可作为结肠癌稳健的预后生物标志物,在现有的高危因素基础上提供额外的预后分层[1]。KRT17是上皮细胞中典型的中间纤维蛋白,其阳性表达的非小细胞肺癌、胃癌、食管鳞癌细胞相较于其他类型的细胞,在增殖、侵袭、预后及肿瘤细胞其他生物学行为上均表现出高度恶性[2-4]。在结肠癌转移、侵袭过程中,KRT17 参与上 皮-间质转化(epithelial-mesenchymal transition,EMT)过程,协助释放促癌因子,参与癌症的发生和发展机制[1]。由此看来,掌握KRT17 在涉及结肠癌发生、发展的生物学行为中所介导的潜在机制对结肠癌的临床诊治具有重要指导价值。然而,针对KRT17 对结肠癌生物学行为影响的相关报道仍然较少,以致其难以转化为用于诊断和治疗的潜在可靠生物标志物。本研究通过评估不同表达水平的KRT17 对结肠癌细胞增殖、侵袭、迁移等生物学行为的影响,分析其可能参与结肠癌发生、发展潜在的分子机制,以期为KRT17 作为结肠癌的分子标志物提供体外实验证据。
1 材料与方法
1.1 材料
1.1.1 组织标本、细胞株 在病理标本库收集2013 年1 月至2015 年12 月于天水市第二人民医院行手术确诊的结肠癌患者癌组织标本及配对癌旁组织(距离癌组织>5 cm)33例。其中男19例,女14例;年龄42~79岁,中位年龄65岁,≥65岁者22例,<65岁者11 例;发病部位左21 例,右12 例;乳头状腺癌 7 例,管状腺癌18 例,其他腺癌8 例;高分化8 例,中分化16例,低分化9例;Dukes分期A/B 期22例,C/D期11 例;无淋巴结转移19 例,有淋巴结转移14 例;获取患者五年生存预后数据,术后五年出现复发/转移/死亡为预后不良,反之为预后良好,预后不良者24例,预后良好者9例。
人结肠癌SW480 细胞和人结肠癌SW620 细胞购自上海一研生物科技有限公司(货号:EY-X0739、EY-X1067);本研究获得天水市第二人民医院医学伦理会批准,实验符合癌细胞处理和使用相关规定。
1.1.2 主要试剂与仪器 RPMI1640 培养基(上海信裕生物科技有限公司,货号:AAPR123);Lipofectamine2000 转染试剂盒(上海恪敏生物科技有限公司);小鼠抗人单克隆抗体anti-KRT17(艾美捷科技有限公司,货号:MAB1985);RIPA蛋白裂解液(武汉博士德生物工程有限公司);BCA 试剂盒(赛默飞世尔科技有限公司,货号:23221-23230);ECL 发光试剂盒(联迈生物)。CO2培养箱(上海新诺仪器设备有限公司,型号:WJ-3-160T);Multiskan FC 酶标仪(美国赛默飞世尔公司);CytoFLEX 流式细胞仪(美国Beckman公司)。
1.2 方法
1.2.1 细胞培养、传代与转染 细胞置于含10%胎牛血清的RPMI1640培养基中,于37 ℃、含5%CO2的培养箱中培养;显微镜观察细胞生长情况,当细胞汇合度达到80%及以上时加入0.25%的胰酶消化细胞制成单细胞悬液;吸取单细胞悬液至离心管,800 r/min离心5 min;弃上清液,加入含10%胎牛血清的RPMI1640 培养基重悬,细胞移至培养瓶中培养;待细胞生长状态良好时换为无血清培养基同步化24 h,按照Lipofectamine2000 转染说明书转染siRNA 寡核苷酸,敲除细胞内KRT17,将人结肠癌SW480 细胞分为对照组(转染阴性对照组原液KRT17-control)、KRT17 组(转染小鼠抗人单克隆抗体anti-KRT17),8株/组,转染72 h后观察转染效果。
1.2.2 免疫荧光共聚焦实验 对照组、KRT17 组细胞孵育24 h 后,PBS 冲洗,多聚甲醛固定10 min,HOE33342 染色剂染色,共聚焦显微镜下观察绿色荧光细胞百分比(代表KRT17),徕卡LAS X 软件分析图像。获得的溶液采用1×Tris Buffer 缓冲液洗涤,经0.25%胰蛋白酶消化,制备细胞悬液,结合1×Tris Buffer缓冲液重悬细胞,流式细胞术分析KRT17与癌细胞的相互作用。
1.2.3 免疫组织化学法观察KRT17 表达 10%甲醛溶液固定癌组织和癌旁组织,脱水,石蜡包埋,切成4 µm 连续切片,依次脱蜡、修复、梯度乙醇水化、PBS漂洗、内源性过氧化物酶活性消除,两种组织滴加小鼠抗人KRT17 多克隆抗体(1∶100) 4 ℃孵育过夜,PBS 漂洗,再滴加即用型生物素化二抗37 ℃孵育30 min,PBS 漂洗,滴加辣根酶标记的链霉卵白素工作液,37 ℃孵育20 min,PBS 漂洗,经DAB 显色、苏木素复染、脱水,透明后封片,观察KRT17表达。
1.2.4 Western blot 检测KRT17 蛋白表达 PBS 溶液冲洗癌细胞和癌旁细胞,RIPA 裂解后取上清,BCA 试剂盒测定蛋白质浓度;依次上样、电泳、转膜、封闭、漂洗,加KRT17(1∶500)、GAPDH 一抗 (1∶2 000),4 ℃冰箱过夜;漂洗后加二抗,25 ℃摇床1 h;漂洗后以ECL 发光试剂盒曝光、显影。同法检测对照组和KRT17组中KRT17的蛋白表达水平。
1.2.5 细胞CCK-8 增殖实验 接种各组对数生长期细胞制成单细胞悬液,加入含10%胎牛血清的RPMI1640 培养基调整浓度为1×104个/ml,接种于 96 孔板,每孔含2 ml细胞悬液;37 ℃、5%CO2条件下培养24 h 至细胞汇合度达到90%及以上,加10 µl CCK-8 溶液培养180 min,低速振荡10 min 后利用Multiskan FC 酶标仪测定其在570 nm 处的光密度(optical density,OD)值,重复实验3次取平均值。
1.2.6 Transwell 细胞迁移、侵袭实验 细胞划痕实验:取转染后细胞使各组细胞密度约为90%,用200 µl 无菌枪头对孔板培养细胞进行划痕处理,PBS缓冲液洗涤3次,加入无血清培养基,于5%CO2、37 ℃的培养箱中培养24 h,观察细胞迁移轨迹。
Transwell:调整细胞浓度为5×105个/ml,向上室加入细胞悬液200 µl,下室加入700 µl 培养基(含20%FBS),48 h后PBS清洗Transwell小室,置于甲醛中固定15 min,0.2%结晶紫染色20 min,随机选取 5 个视野拍照并进行计数统计;将Transwell 小室上表面铺适量厚度的基质胶,按上述步骤操作,显微镜下观察小室下表面附着的侵袭细胞。
1.2.7 细胞凋亡实验 取转染后细胞加入含10%胎牛血清的RPMI1640 培养基调整浓度为2×105~ 5×105个/ml,2 000 r/min 离心5 min,弃上清液;加入500 µl PBS 溶液重悬细胞,分别加入5 µl Annexin V-FITC 溶液和PI 溶液,室温避光孵育5 min;流式细胞仪观察细胞凋亡情况,计算细胞凋亡率,重复实验3次取平均值。
1.3 统计学方法 使用SPSS21.0软件进行统计分析,非正态分布的资料采用中位数(四分位数范围)[M(P25~P75)]表示;计量资料以±s表示,两组间比较采用独立样本t检验;计数资料用频率或构成比表示,两组间比较采用卡方确切概率法检验;Med-Cale 统计软件绘制受试者特征工作曲线(receiver characteristic working curve,ROC)曲线,并采用Z检验分析预测价值,P<0.05为差异有统计学意义。
2 结果
2.1 KRT17 与结肠癌细胞的关系 KRT17 与SW480 细胞、SW620 细胞共表达时绿色荧光信号显著增强,见图1。KRT17与SW480细胞、SW620细胞被荧光标记的KRT17 包裹率分别为(77.80±3.79)%、(64.68±3.66)%,提示KRT17 被SW480 细胞、SW620 细胞内化;KRT17 与SW480 细胞内化程度均较为显著,因此在后续实验中选择结肠癌SW480细胞进行实验。
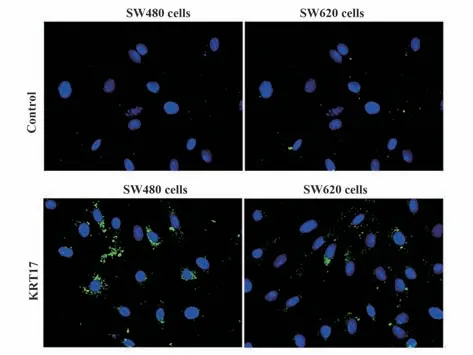
图1 免疫荧光共聚焦实验图Fig.1 Diagram of immunofluorescence confocal experiment
2.2 结肠癌和癌旁组织中KRT17 的表达 KRT17主要定位于细胞质,呈棕黄色颗粒;在结肠癌组织中,棕黄色颗粒较多且密集;癌旁组织中棕黄色颗粒较少且不清晰(图2)。与癌旁组织相比,结肠癌组织蛋白条带信号增强(图3);结肠癌组织中KRT17 蛋白 表 达量(3.22±1.03)高 于癌 旁 组织(2.06±0.87)(t=4.942,P<0.001)。
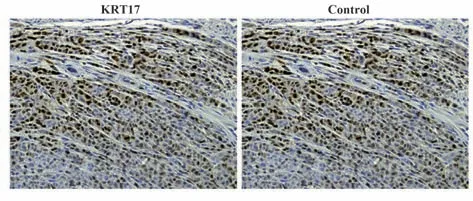
图2 免疫组化染色(SP,×200)Fig.2 Immunohistochemical staining (SP,×200)
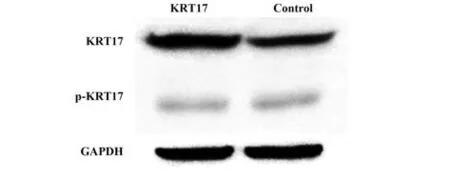
图3 结肠癌组和癌旁组中KRT17表达Fig.3 Expression of KRT17 in colon cancer group and adjacent group
2.3 KRT17 表达与结肠癌患者特征的关系 确定癌组织和癌旁组织中KRT17表达中位数为3.06,结肠癌组织中KRT17高表达率(>3.06)为66.67%(22/33),高于癌旁组织中的39.39%(13/33)(χ2=4.927,P=0.026)。性别、部位、组织学类型、分化程度不同的结肠癌患者癌组织中KRT17 表达水平差异无统计学意义(P>0.05);年龄、Dukes分期、淋巴结转移、预后不同的结肠癌患者癌组织中KRT17 表达水平差异有统计学意义(P<0.05),见表1。
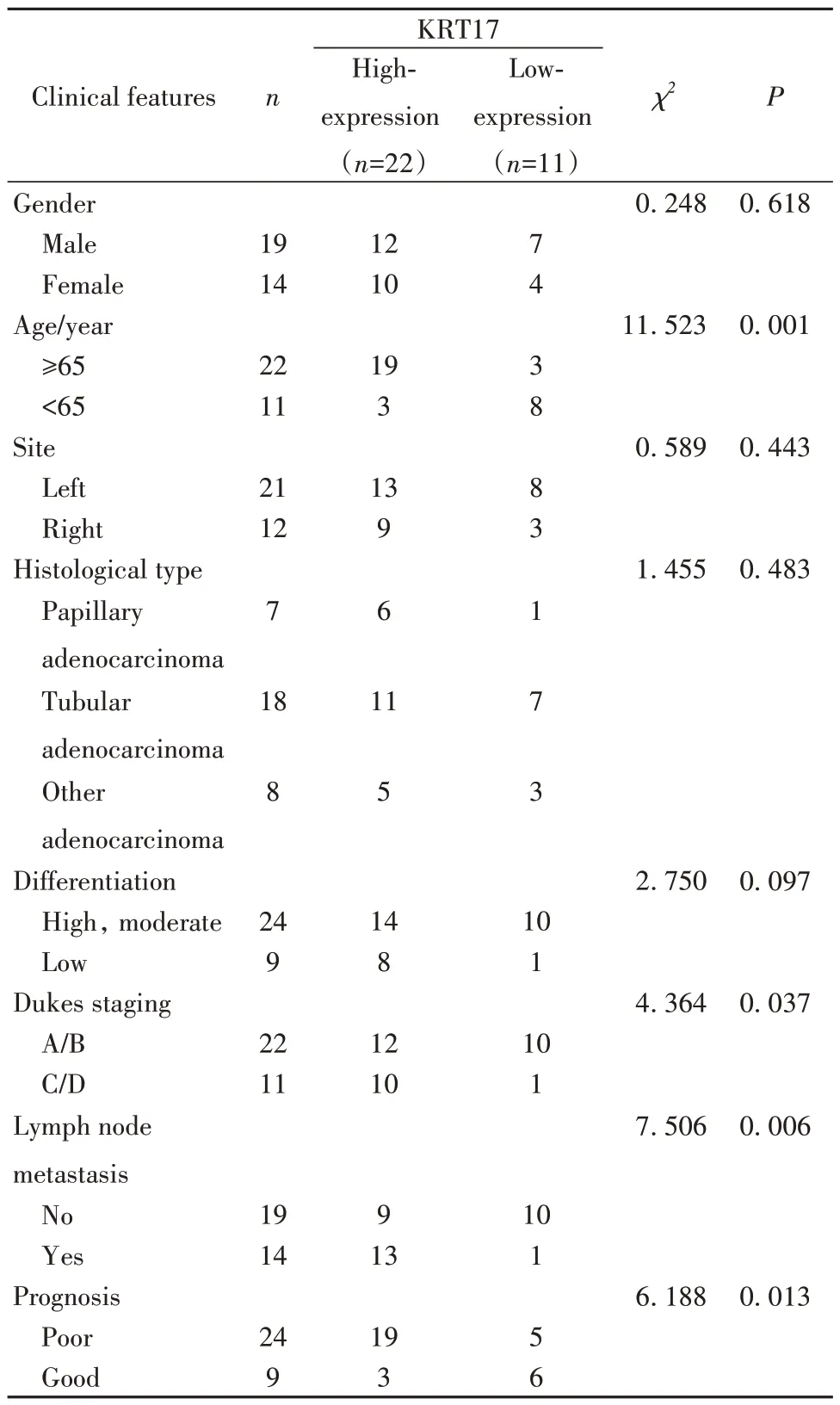
表1 不同临床特征结肠癌患者KRT17表达比较[例(%)]Tab.1 Comparison of KRT17 expression in colon cancer patients with different clinical features [n(%)]
2.4 KRT17 高表达率预测结肠癌进展的模型建立与确定 选择因素方程中具有统计学意义的变量指标KRT17 高表达率及其回归系数建立预测模型的多元回归方程,建立多因素Logistic回归模型:logitP=-4.118+1.241×KRT17高表达率,在预测模型中,KRT17 低表达定义为0、高表达定义为1,KRT17 高表达率临床模型诊断结肠癌进展和预后发生的标准误为0.066,AUC(95%CI)为0.847(0.802~0.911),敏感度为71.15%、特异度为82.22%,见图4。
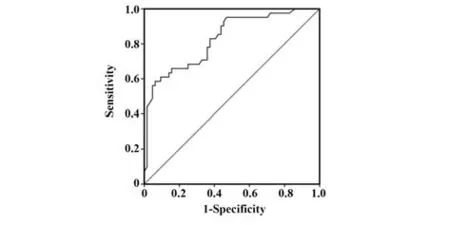
图4 临床模型诊断的ROC曲线Fig.4 ROC curve of clinical model diagnosis
2.5 对照组和KRT17组SW480细胞增殖率 与对照组相比,KRT17 组SW480 细胞在48 h、72 h、96 h的OD 值增大(P<0.05),见表2。转染KRT17 后,SW480细胞增殖得到促进;48 h、72 h、96 h时,KRT17组SW480 细胞计数高于对照组,且细胞计数随时间延长增加速度更显著,见图5。
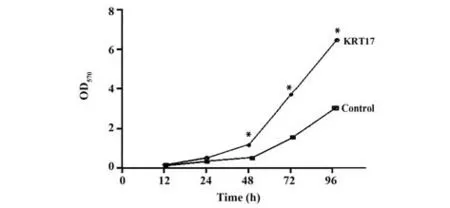
图5 两组细胞增殖率比较Fig.5 Comparison of cell proliferation rate of two groups
表2 两组SW480细胞转染不同时间的OD值(±s,n=8)Tab.2 OD values of SW480 cells transfected in two groups at different times (±s,n=8)
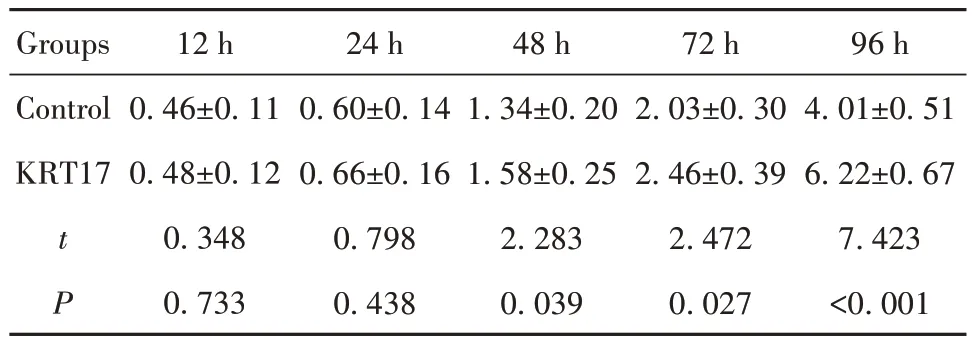
表2 两组SW480细胞转染不同时间的OD值(±s,n=8)Tab.2 OD values of SW480 cells transfected in two groups at different times (±s,n=8)
2.6 对照组和KRT17组SW480细胞迁移能力 培养24 h 后,KRT17 组SW480 细胞划痕面积大于对照组,见图6。
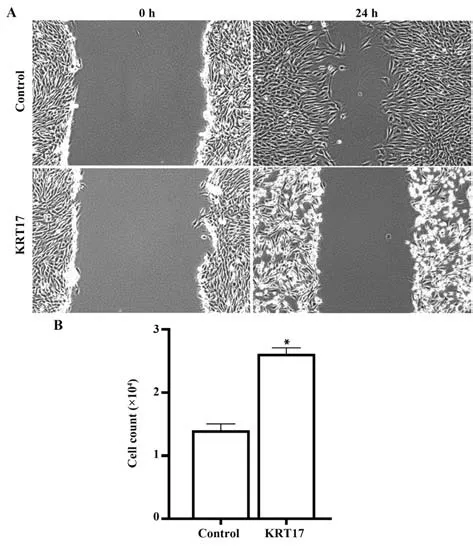
图6 两组SW480细胞迁移能力Fig.6 Migration ability of SW480 cell in tow groups
2.7 对照组和KRT17 组SW480 细胞侵袭能力 KRT17 组SW480 细胞向器官表面靠拢,基底层可见较多伪足,形成大范围癌巢;对照组SW480 细胞较少,不见伪足或仅有少量伪足,未形成癌巢,见图7A。转染KRT17 后,SW480 细胞侵袭能力得到促进,KRT17组穿过小室膜的细胞数[(226.35±52.36)个]多 于 对 照 组[(170.62±48.47)个](t=2.209,P=0.043),见图7B。
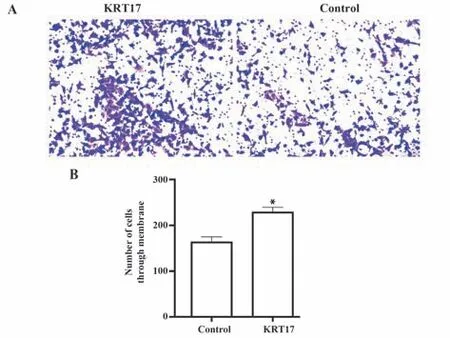
图7 两组SW480细胞侵袭能力(×100)Fig.7 Invasion ability of SW480 cells in two groups (×100)
2.8 对照组和KRT17组SW480细胞凋亡率 流式细胞术结果表明,KRT17 组SW480 细胞凋亡率低于对照组,见图8。
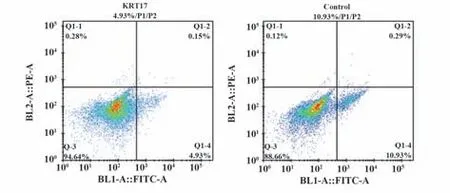
图8 SW480凋亡实验Fig.8 SW480 apoptosis experiment
3 讨论
CHEN 等[5]认为结肠癌的发生、侵袭及转移与抑癌基因失活、癌基因突变、血管形成、DNA 去甲基化、癌基因激活等密切相关,且抑癌基因失活对结肠癌发生、发展的影响尤为显著。近年临床开始关注结肠癌的免疫治疗,目前DNA 错配修复(DNA mismatch repair,MMR)是推荐在结肠癌A/B 期患者中临床使用的唯一有效标志物,其中dMMR 患者在不进行辅助治疗的情况下有良好的预后[6]。而实际上,一些预后生物标志物研究对T3/pMMR 肿瘤Ⅱ期患者的分层较敏感。KRT17 表达在T3/pMMR 亚组中具有显著的预后价值[7-8],考虑KRT17免疫组织化治疗单独或与常规因素联合有可能完善影响术后决策的预后。
KRT 为正常血管生长过程中的必需因子,自发现以来已被证实可参与多种肿瘤细胞的增殖、侵袭和转移过程:刘金生等[9]研究显示KRT19 在肝细胞癌组织中高表达,且高表达KRT17 组侵袭能力更强;HAO 等[3]、CHIVU 等[10]指出高表达KRT17 可促进膀胱癌细胞增殖、迁移、侵袭过程;YAN 等[11]的体外实验结果显示,KRT17 在骨肉瘤细胞中高表达,可调节肿瘤细胞与肿瘤微环境的相互作用;KRT17在结肠癌中高表达,下调KRT17 表达可抑制癌细胞血管浸润和淋巴结转移,且提示该病预后较好[1]。本研究结肠癌组织中KRT17 呈高表达,与上述研究数据分析一致。同时,年龄≥65 岁、Dukes 分期C/D期、有淋巴结转移、预后不良的结肠癌患者KRT17高表达率低,考虑KRT17 的表达与结肠癌进展、预后有一定关系。通过KRT17 高表达率建立临床预测模型,在区分度评估中,AUC 为0.847,提示准确度高。本文预测准确度高于类似研究结果:秦琼等[12]通过癌结节对Ⅲ期结肠癌患者预后及TNM 分期进行整体评估,结果癌结节数目纳入淋巴结数目整体评估决定TNM 分期,更能准确地反映患者预后,但准确率仅达到80%;K-ras基因突变、硫酸酯酶1均可预测预后,但不具有特异性,并未在临床中得以应用[13-14]。KRT17 的表达以组织特异性和环境依赖方式受到严格调控,有助于维持细胞完整性[15]。KRT17 在各种腺体的基底和肌上皮细胞中表达,与血管生成素具有相似结构域及高度同源性,可协同血管内皮生长因子(vascular endothelial growth factor,VEGF)共同调节内皮细胞增殖及血管生成[16]。KRT17 在健康皮肤中不表达,应激状态下可迅速在皮肤上皮细胞中诱导,导致细胞生长和炎症反应[17]。本文采用CCK-8 法检测不同时间对结肠癌SW480 细胞增殖的影响,生长曲线图显示,过表达KRT17 可有效促进癌细胞生长增殖,提示KRT17 在参与结肠癌病理性进展中发挥促癌作用。根据转染时间图发现,过表达KRT17 对结肠癌细胞作用机制呈时间依赖性,时间越长,促进效应越明显。刘金生等[9]的平板克隆实验结果显示,敲除KRT17 可明显降低单细胞克隆形成率,达到有效抑制肝细胞癌细胞增殖作用。Transwell 侵袭实验结果表明,转染组穿过小室膜的细胞数更少,细胞迁移率更低,表明KRT17 可有效促进结肠癌细胞的侵袭、转移,证实KRT17 是一种可在体内外调节肿瘤细胞侵袭和转移的调控因子。ZHAO等[18]发现KRT17能扩大其他众多癌基因转录,其主要通过靶向调节特异性信号蛋白通路促进结肠癌侵袭能力。有研究显示,敲除KRT17 可通过加强血管内皮细胞周围的支持细胞联系以维持血管完整和稳定[19]。YAN 等[11]敲除小鼠KRT17 基因后其内皮细胞形态恢复正常,血管稳定性改善,且其与周围细胞及基质的联系变好。有研究认为KRT17 可能通过Wnt/β-catenin/PI3K/Akt 信号通路促进结直肠癌HCT116 细胞系的迁移、增殖、侵袭等生物学行为的发生[20],但仍有待进一步研究。
综上所述,KRT17 在结直肠癌组织和细胞中高表达,KRT17 高表达的结肠癌细胞具有更强的增殖、迁移和侵袭能力,建立KRT17 表达的临床模型可预测结肠癌患者的进展和预后。但本研究未对其他细胞株进行研究,可能存在局限性和误差,有待后期研究继续探讨。
