MIF 通过调节急性幽门螺杆菌感染介导的炎症反应、自噬和凋亡促进胃癌细胞增殖及细胞周期进展①
2023-03-17王培红李俊杰汤旭山新疆医科大学附属肿瘤医院消化内科乌鲁木齐830000
李 娜 王培红 李俊杰 汤旭山 (新疆医科大学附属肿瘤医院消化内科,乌鲁木齐 830000)
胃癌是全球第四大常见恶性肿瘤,其导致的癌症相关病死率全世界范围内位列第三[1]。其中幽门螺杆菌(helicobacter pylori, Hp)感染是胃癌发展中公认的确定因素之一,影响全球约44 亿人,是最为常见的感染之一[2-4]。Hp 主要感染胃黏膜上皮细胞,一旦感染将导致局部胃黏膜组织慢性炎症反应,并诱导慢性胃炎发生,可进展为多步骤的胃癌级联反应[3]。研究证实,这种慢性炎症环境与Hp 感染引起宿主细胞内大量活性氧(reactive oxygen species,ROS)、线粒体损伤、氧化性DNA 损伤密切相关[5]。自噬是在饥饿、缺氧或其他特定的细胞应激条件下,由一系列自噬相关基因严格调控的缺陷蛋白和细胞器降解和循环的一个重要细胞内稳态过程,而无论在正常细胞或肿瘤细胞中,自噬不仅能维持细胞存活,也能促进细胞死亡[6-7]。相关机制研究表明,细胞自噬具有选择性,也同时具有非选择性,其中非选择性自噬常发生于饥饿或压力下,涉及大量细胞成分破坏,而选择性自噬,尤其是通过磷酸酶和紧张素同源诱导的假定激酶1(phosphatase and tensin homolog-induced putative kinase 1,PINK1)介导的线粒体自噬清除受损的线粒体对Hp诱导的细胞损伤至关重要[7-9]。同时,Hp 感染也能通过调控细胞线粒体自噬以利于自身感染的持续[9]。巨噬细胞迁移抑制因子(macrophage migration inhibitory factor, MIF)是一种多功能的促炎因子,既往研究表明其不仅能够在炎症反应和免疫疾病中起关键作用,还能联系炎症与肿瘤发生,在多种肿瘤中发挥促癌作用[10-11]。而在Hp 感染中,有研究发现Hp能够直接刺激机体产生大量MIF,且后者在胃黏膜细胞的异常增殖中具有重要地位,并推测Hp 感染可能部分通过MIF 介导的途径参与胃癌发生[12]。近年来国内外均有报道,MIF 在胃癌组织中的表达较正常胃黏膜组织异常增加,进一步证实MIF 参与调控胃癌发生与进展[13-14]。同时,YOON等[15]团队最新研究显示,Hp感染诱导的胃黏膜细胞异常增生与胃癌不同表征可能部分归因于MIF和自噬。MIF 在Hp 感染诱导的胃癌细胞自噬中的作用及相关机制尚不清楚,故本研究通过体外培养Hp感染的胃癌细胞进行探究,以期进一步阐明Hp 在胃癌发生中的相关机制。
1 材料与方法
1.1 材料 Hp 的J99 标准菌株(北京流行病控制研究所);胃癌细胞系AGS 细胞(武汉普诺赛生命科技有限公司);RPMI1640、胰蛋白酶(美国Hyclone公司);胎牛血清FBS(美国Gibco 公司);兔抗LC3B、p62 多克隆抗体(美国Santa Cruz);大鼠抗MIF、Parkin、PINK1 单克隆抗体(美国Abcam 公司);MTT 试剂(美国Sigma 公司);DCFH-DA 法ROS 检测试剂盒、Annexin V-FITC/PI 试剂盒、BCA 蛋白定量试剂盒、HRP 标记的山羊抗兔或兔抗大鼠二抗(江苏碧云天生物科技有限公司);RIPA、蛋白酶抑制剂(武汉博士德生物技术有限公司);线粒体mitotracker deep red633 染色试剂(美国Cell Signaling Technology);TRizol 试剂、反转录试剂盒、LipofectamineTMRNAiMAX 试剂盒(美国Thermo 公司);SYBR Green Master 试剂盒(康为世纪生物科技股份);JC-1 法线粒体膜电位检测试剂盒、FACSCalibur 流式细胞仪(美国BD 公司);FITC 标记的山羊抗兔二抗(美国Biolegend公司)。
1.2 方法
1.2.1 胃癌细胞的培养与转染 使用含10%FBS、1%双抗的RPMI1640 培养基培养AGS 细胞,并置于37 ℃、5%CO2恒温培养箱。取对数生长期AGS 细胞,胰酶常规消化后,调整细胞密度至2×105个/孔,接种至6 孔板中培养24 h,将培养基更换为Opti-MEM 溶液。参考转染试剂盒RNAiMAX 说明书方法,将si-MIF与si-NC转染入AGS细胞中,4 h后吸弃转染体系,将培养基更换为含10%FBS 的RPMI-1640常规培养基置于培养箱中培养。
1.2.2 胃癌细胞Hp 感染与分组 取200 µl 的Hp均匀涂抹在含10%胰蛋白酶大豆琼脂与5%羊血和5%Dent抗生素补充剂的培养基包被的培养板上,置于含85%N2、10%CO2与5%O2的37 ℃培养罐中培养3~5 d。收集Hp 菌落,使用含10%FBS 的胰蛋白酶大豆肉汤制成悬液,使用光密度法计算悬液中的细菌数量。参考文献[16]方法,按Hp 细菌数与细胞数为100∶1的比例将Hp与AGS进行共培养,并按处理方式不同将细胞分为4 组:转染si-NC 的si-NC 组细胞、转染si-MIF 的si-MIF 组细胞、Hp 与转染si-NC共培养12 h 的Hp+si-NC 组细胞和Hp 与转染si-MIF共培养12 h的Hp+si-MIF组细胞。
1.2.3 MTT 检测胃癌细胞的活力 取对数生长期AGS 细胞,常规消化后,按2×104个/孔接种至96 孔板,按1.2.2方法进行分组处理后,置于培养箱中分别培养12 h、24 h、36 h、48 h 后加入0.5 mg/ml 的MTT 溶液(20 µl/孔),继续培养4 h 后,吸弃上清,每孔加入150 µl DMSO,室温下充分振荡后,酶标仪490 nm 处检测吸光度值(OD490)。每组每个时间点设置5个复孔,实验单独重复3次。
1.2.4 RT-PCR 取转染si-NC 或si-MIF 24 h 后的AGS细胞,TRIzol法提取细胞中的总RNA,评估浓度与纯度后,参考逆转录试剂盒说明书方法对RNA 进行逆转录。按照SYBR Green Master 试剂盒说明书方法进行RT-PCR,MIF-F:5′-CGGACAGGGTCTACATCAACT-3′,MIF-R:5′-ACCGTTTATTTCTCCCCACCA-3′;GAPDH-F:5′-AGGTGAAGGTCGGAGTCAAC-3′,GAPDH-R:5′-GGGGTCATTGATGGCAACAATA-3′。以GAPDH 为内参,采用2-ΔΔCt方法分析胃癌细胞中MIF表达。上述实验单独重复3次。
1.2.5 各组胃癌细胞中ROS 水平检测 取生长状态良好的各组AGS 细胞,常规消化后取约1×105个细胞加入10 nmol/L 的DCFH-DA 试剂1 ml,室温下避光孵育20 min 后流式细胞仪检测。实验单独重复3次。
1.2.6 Annexin V-FITC/PI法检测胃癌细胞凋亡 收集各组AGS 细胞,调整细胞浓度至1×106个/ml, 取100 µl细胞悬液按800 r/min 离心5 min,200 µl结合缓冲液重悬细胞后置于流式管中,分别加入10 µl的Annexin V-FITC 与5 µl 的PI 溶液,室温下避光孵育15 min,加入300 µl结合缓冲液,流式细胞仪检测各组细胞凋亡率。实验单独重复3次。
1.2.7 JC-1 染色检测细胞线粒体膜电位 收集各组AGS 细胞,常规消化后,按JC-1 试剂盒操作说明方法取约5×105个细胞加入0.5 ml 的JC-1 染色液(10 ng/ml),37 ℃下避光孵育20 min,4 ℃预冷的染色缓冲液充分洗涤细胞后,共聚焦显微镜在单激发(488 nm)和双激发(530 nm、590 nm)光下观察拍照并分析。JC-1 单体呈绿色荧光表示线粒体膜电位的耗散,而JC-1 聚合体呈红色荧光表示膜电位完整。
1.2.8 Western blot 实验 收集待测AGS 细胞,使用RIPA 与蛋白酶抑制剂制备细胞裂解液,BCA 法检测蛋白浓度,加热变性后,取约30 µg 等量蛋白样品进行SDS-聚丙烯酰胺凝胶电泳,并转移至PVDF膜。5%脱脂奶粉室温封闭1 h 后,加入一抗:MIF (1∶800)、LC3B(1∶500)、p62(1∶500)、PINK1(1∶1 000)、Parkin(1∶1 000) 4 ℃孵育过夜,PBST 洗膜后,加入二抗(1∶3 000)室温下孵育2 h,PBST 再次洗膜后,使用ECL化学发光液检测目的蛋白表达,以GAPDH为内参,Image J 软件分析蛋白条带灰度值。实验单独重复3次。
1.2.9 免疫荧光检测LC3B 与线粒体的共定位表达 取各组AGS 细胞,常规制备细胞爬片后,加入500 nmol/L 的线粒体mito tracker 室温染色30 min,PBS再次洗涤细胞,预冷的4%多聚甲醛固定细胞爬片10 min,0.2%Triton X-100 室温下进行透化细胞 5 min 后,5%山羊血清于室温下抗体封闭1 h,加入LC3B抗体(1∶300),4 ℃孵育过夜,然后加入FITC 标记的山羊抗兔二抗(1∶1 000)置室温避光孵育1 h,加入抗荧光猝灭剂封片,荧光显微镜下观察并拍照分析。
1.3 统计学分析 使用SPSS19.0 与GraphPad Prism 5.0 软件统计分析及绘图,所有实验数据使用±s表示,两组间比较采用独立样本t检验,多组间比较采用单因素方差分析(one-way ANOVA),进一步两两比较使用LSD-t检验。P<0.05表示差异具有统计学意义。
2 结果
2.1 Hp 感染对胃癌细胞中MIF 表达的影响 Western blot 结果显示,与0 h 相比,随Hp 刺激时间延长,胃癌细胞中MIF 蛋白表达逐渐升高(P<0.05),其中12 h 表达增加最为明显,提示Hp 感染以时间依赖性促进胃癌细胞中MIF 表达,选择12 h为后续实验Hp刺激时间(图1)。
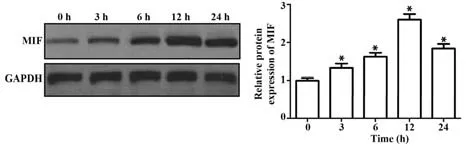
图1 Hp感染促进胃癌细胞MIF表达Fig.1 Hp infection promotes MIF expression in gastric cancer cells
2.2 Hp 感染对沉默MIF 的胃癌细胞增殖的影响 RT-PCR 与Western blot 检测沉默MIF 的转染效率,结果表明,与si-NC 组相比,si-MIF 组MIF mRNA 与蛋白表达均显著降低(P<0.05),说明si-MIF 转染成功降低了胃癌细胞中MIF 表达(图2A、B)。MTT 检测结果显示,与si-NC 组相比,si-MIF 组增殖能力明显降低(P<0.05),Hp+si-NC 组与Hp+si-MIF 组增殖能力显著升高(P<0.05);与Hp+si-NC 组相比,Hp+si-MIF组增殖能力明显降低(P<0.05,图2C)。
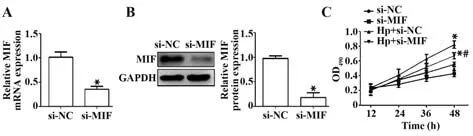
图2 沉默MIF后抑制Hp对胃癌细胞增殖的促进作用Fig.2 Inhibitory effect of HP on proliferation of gastric cancer cells after silencing MIF
2.3 Hp 感染对沉默MIF 的胃癌细胞凋亡的影响 Annexin V-FITC/PI 染色结果显示,与si-NC 组相比,Hp+si-NC 组与Hp+si-MIF 组凋亡率明显升高(P<0.05),si-MIF 组无明显改变(P>0.05);与Hp+si-NC组相比,Hp+si-MIF组凋亡率明显升高(P<0.05,图3)。
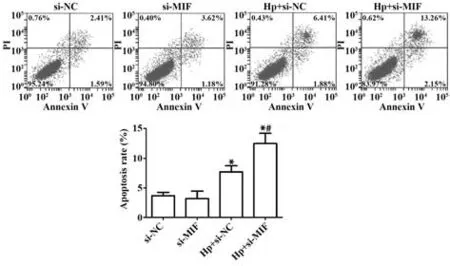
图3 Annexin V-FITC/PI检测各组胃癌细胞凋亡率Fig.3 Annexin V-FITC/PI was used to detect apoptosis rate of gastric cancer cells in each group
2.4 Hp 感染对各组胃癌细胞ROS 水平的影响 DCFH-DA 染色后流式细胞术检测结果显示,与si-NC组相比,Hp+si-NC组与Hp+si-MIF组ROS均显著增加(P<0.05),si-MIF 组无明显变化(P>0.05);而与Hp+si-NC 组相比,Hp+si-MIF 组ROS 增加趋势更为明显(P<0.05,图4)。
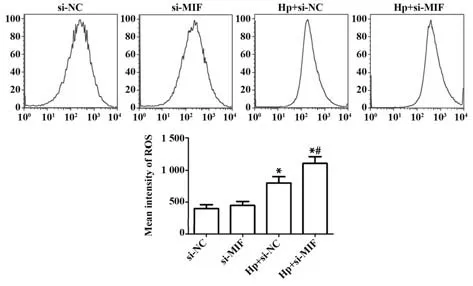
图4 各组胃癌细胞ROS水平的流式检测Fig.4 Flow cytometry of ROS levels in gastric cancer cells in each group
2.5 Hp 感染对各组胃癌细胞线粒体膜电位的影响 JC-1染色后荧光显微镜观察结果显示,si-NC细胞线粒体膜电位较高,呈大量JC-1 聚合体,产生红色荧光,而Hp 感染后胃癌细胞线粒体膜电位严重去极化,呈JC-1 单体,产生绿色荧光。与si-NC 组相比,Hp+si-NC 与Hp+si-MIF 组线粒体膜电位显著降低(P<0.05),si-MIF 组无明显变化(P>0.05);而与Hp+si-NC 组相比,Hp+si-MIF 组膜电位水平降低更为明显(P<0.05,图5)。
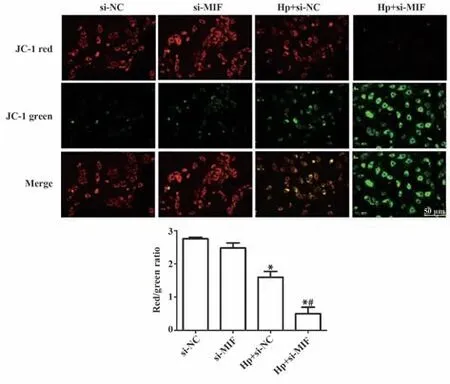
图5 各组胃癌细胞线粒体膜电位的JC-1检测Fig.5 Mitochondrial membrane potential of gastric cancer cells in each group were detected by JC-1
2.6 Hp感染对各组胃癌细胞中线粒体自噬水平的影响 Western blot 检测结果显示,与si-NC 组相比,Hp+si-NC与Hp+si-MIF组LC3Ⅱ/LC3Ⅰ、PINK1、Parkin 蛋白表达均显著升高(P<0.05),p62 蛋白表达明显降低(P<0.05),si-MIF 组上述指标无明显变化 (P>0.05);与Hp+si-NC 组相比,Hp+si-MIF 组的LC3Ⅱ/LC3Ⅰ、PINK1、Parkin表达明显降低(P<0.05),p62表达显著升高(P<0.05,图6A)。免疫荧光共定位检测结果显示,LC3B 在Hp 感染的胃癌细胞线粒体中大量聚集,分析结果显示,与si-NC 组相比,Hp+ si-NC 组与Hp+si-MIF 组LC3B 共定位的线粒体数明显增加(P<0.05),si-MIF 无明显改变(P>0.05),与Hp+si-NC 相比,Hp+si-MIF 组LC3B 共定位的线粒体数明显减少(P<0.05,图6B)。
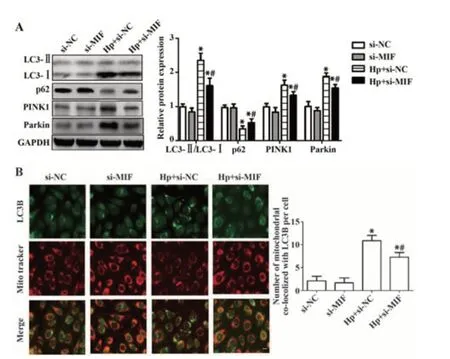
图6 各组胃癌细胞线粒体自噬水平Fig.6 Mitochondrial autophagy level of gastric cancer cells in each group
3 讨论
Hp是一种革兰氏阴性菌,世界卫生组织将其定义为一类致癌物,而根除Hp 可将胃癌发病率降低 3 倍[2]。既往对其致癌机制研究表明,Hp 可能通过自身成分,如细胞毒素基因A 相关的活性蛋白 (active protein associated with cytotoxin gene A,CagA)和空泡化细胞毒素A(vacuolating cytotoxin V,VacA)直接或间接导致胃癌发生,但其在胃癌细胞自噬中的作用尚不清楚。自噬在胃癌中的双重作用(包括抑癌与促癌)也让Hp 感染与胃癌自噬相关研究仍处于探索中[7]。急性Hp 感染可诱导细胞自噬,保护胃黏膜免受Hp 入侵及感染扩大,而随着Hp 持续感染,细胞自噬功能出现损伤或缺陷,诱导细胞毒性物质积累,如ROS等,引起DNA突变增加,基因组不稳定性,加速胃黏膜细胞癌症形成风险[17]。而在Hp阳性的胃癌组织中,自噬标志蛋白LC3B 显著高于Hp阴性组,Atg5显著降低,LC3B与Atg5均能直接预测MIF 水平,提示MIF 和自噬的相互作用可能参与Hp 相关胃癌发生发展[15]。线粒体自噬作为一种选择性自噬,能有效降解受损的线粒体,减少大量ROS 释放及线粒体途径介导的凋亡发生,从而利于细胞存活[18]。本研究结果表明,Hp感染能促进胃癌细胞MIF 表达,并通过促进细胞中线粒体PINK1/Parkin 介导的自噬促进肿瘤细胞增殖,降低Hp 诱导的细胞凋亡。
既往研究发现,在胃癌中Hp 可能通过多种途径促进细胞增殖,如在胃癌组织中Hp 感染或Hp 的DNA 水平与Toll 样受体9 上调相关,进一步体外研究发现,敲除TLR9 能显著抑制胃癌细胞MKN45 与AGS 增殖[19]。而XU 等[20]研究中发现,Hp 感染能显著抑制miR-195 的表达,在胃癌细胞SGC-7901 中过表达miR-1915 能够靶向抑制晚期糖基化终产物特异性受体的蛋白水平从而减弱细胞增殖能力。在胃黏膜细胞中,XIA 等[12]发现MIF 在Hp 介导的胃黏膜细胞增殖中起重要作用,MIF 抗体能有效阻滞Hp的上述促进现象。而鉴于Hp CagA 等毒素的存在,大量研究表明Hp 能显著促进细胞凋亡[21]。本实验中,课题组同样发现Hp 感染能显著促进AGS 细胞增殖与凋亡,下调MIF的表达能明显降低Hp对细胞的增殖与凋亡的促进作用。此外,马骥等[22]在胃癌细胞系SGC-7901 中利用siRNA 沉默MIF 的研究表明,下调MIF 表达能显著抑制SGC-7901细胞增殖并促进其凋亡,在本研究中课题组仅观察到下调MIF能降低AGS 增殖能力,并未发现其对细胞凋亡的影响,可能与胃癌细胞系种类不同有关。
线粒体是维持细胞内稳态的重要细胞器,不仅通过能量产生,还能通过控制信号级联调节细胞死亡、分化和衰老[9]。同时,在线粒体产生能量的过程中,还会产生以ROS 为主的副产物,但在正常情况下线粒体内的ROS 是由内源性抗氧化物酶系统进行有效控制,而在外源刺激存在时,胞质中出现的ROS 能进一步触发线粒体膜通透性的转变,进而诱导线粒体进一步释放ROS,造成蛋白质、脂质和DNA 的氧化损伤,最终导致细胞死亡[18]。而在线粒体功能受损时,膜电位出现下降,PINK1在线粒体外膜大量积累,而Parkin 是一种E3 泛素连接酶,其能被线粒体外膜中的PINK1 所募集,进而催化线粒体膜表面的相关蛋白发生泛素化,而泛素化的线粒体能够被自噬相关蛋白p62 所识别,促进其与溶酶体膜表面的LC3B 等同源蛋白进行结合,诱导线粒体发生自噬,从而选择性地清除受损的线粒体,抑制损伤扩大和凋亡发生[23]。本研究结果显示,Hp感染能增加胃癌细胞中的ROS,降低线粒体膜电位水平,而沉默胃癌细胞中MIF表达能显著加剧Hp的这种作用,Western blot 实验结果表明,沉默MIF 可能通过抑制PINK1/Parkin介导的线粒体自噬水平发挥上述作用,免疫荧光染色进一步证实Hp 能够促进LC3B 在线粒体中的定位,而沉默MIF 显著降低LC3B 在线粒体中的荧光强度,提示Hp 感染可能通过MIF 介导的线粒体自噬水平促进其持续感染。MIF的上述作用与其在二手烟诱导的心肌收缩功能障碍的小鼠模型中的作用一致,均能通过促进线粒体自噬功能在疾病中发挥重要作用[24]。
综上所述,本实验表明Hp 感染能促进胃癌细胞MIF 表达,并通过促进细胞中线粒体PINK1/Parkin介导的线粒体自噬水平保护线粒体功能,从而促进肿瘤细胞增殖,降低Hp 诱导的细胞凋亡,沉默胃癌细胞中MIF 表达能显著削弱Hp 的上述作用。本研究进一步揭示了Hp 在胃癌中的作用机制,而靶向MIF 的深入探究有望成为Hp 相关胃癌的治疗靶点。
