大黄素通过抑制NF-κB信号通路改善骨关节炎的软骨降解分析①
2023-03-17兰伟斌阙武堂谢建鸿涂学招胡秀华邱汉民福建医科大学附属龙岩第一医院骨科龙岩364000
兰伟斌 阙武堂 谢建鸿 涂学招 胡秀华 邱汉民 (福建医科大学附属龙岩第一医院骨科,龙岩 364000)
骨关节炎(osteoarthritis,OA)是一种关节退行性病变,特征为关节软骨破坏、软骨下骨硬化和骨赘形成,主要临床表现为疼痛和功能障碍,可导致患者生活质量下降[1]。软骨稳态反映了软骨素合成代谢和分解代谢平衡。但OA发病机制尚不清楚。OA进展涉及多种因素,其中关节软骨降解主要与分解软骨的蛋白过量产生有关,包括基质金属蛋白酶(matrix metalloproteinases,MMPs)、血小板结合蛋白基序的解聚蛋白样金属蛋白酶(a disintegrin and metalloproteinase with thrombospondin motifs,ADAMTS)和其他分解代谢酶[2]。MMP-1、MMP-3 和MMP-13在OA 软骨退化中起重要作用,而ADAMTS-4 是最有效的聚集蛋白聚糖酶,与OA 发病机制相关[3-4]。MMP-13 切割collagen Ⅱ,而ADAMTS-4 降解蛋白多糖[5]。非甾体类抗炎药是OA主要治疗方法之一,虽然该类药物可缓解患者临床症状,但无法保护软骨免受进一步损伤。因此迫切需要探索新的抑制关节软骨退化的药物。大黄素(1,3,8-三羟基-6-甲基蒽醌)是一种从掌叶大黄根茎中分离的天然蒽醌,具有抗菌、抗癌和抗炎活性[6-8]。此外,大黄素在多种细胞中具有抑制MMPs(包括MMP-2和MMP-9)的作用[9]。本研究检测了大黄素对IL-1β 刺激的大鼠软骨细胞MMP-13 和ADAMTS-4 表达的影响,以及对细胞内NF-κB 信号传导的影响,以期揭示大黄素对OA软骨降解的治疗价值。
1 材料与方法
1.1 材料 体质量200~220 g 的雄性Sprague-Dawley 大鼠(南京君科生物工程有限公司);0.1%胶原酶、10%胎牛血清、DMEM 培养基(Gibco BRL);大黄素(Sigma-Aldrich);MTT(碧云天生物技术研究所);Hoechst33324(Solarbio);重组大鼠IL-1β(Pepro-Tech);Trizol 试剂(Invitrogen);Primescript-RT 试剂盒(Ta-KaRa);0.1%番红O(Sigma);所有一抗(Cell Signaling Technology);辣根过氧化物酶标记的山羊抗兔IgG(Abcam);酶标仪(Bio-Rad);ABI PRISM 7700 型荧光定量PCR仪(Applied Biosystems)。
1.2 方法
1.2.1 细胞获取 从雄性SD大鼠膝盖和股骨头处收集关节软骨,PBS冲洗3次并切成小块,0.1%胶原酶孵育3 h释放软骨细胞,含10%胎牛血清的DMEM培养基37 ℃、5%CO2培养,融合的软骨细胞按1∶3传代,第2代细胞用于后续实验。
1.2.2 MTT 检测细胞活力 大黄素溶于DMSO,用前过滤灭菌。软骨细胞接种于96孔板(1×104个/孔), 与10~100 µmol/L 大黄素共培养24 h、48 h,在指定时间20 µl/孔加入MTT(5 mg/ml),37 ℃培养4 h,除去培养基,150 µl/孔加入DMSO,酶标仪测量570 nm处吸光度。将无大黄素的孔作为正常对照组,无细胞的孔作为空白组。细胞存活率(%)=(大黄素处理孔平均OD 值-空白孔平均OD 值)/(正常对照孔平均OD值-空白孔平均OD值)×100%。
1.2.3 Hoechst 染色检测大黄素对软骨细胞的毒性 不同剂量大黄素处理细胞48 h,Hoechst33324(10 µg/ml)染色30 min,BX51 荧光显微镜下观察。活细胞核DNA 染成蓝色,而凋亡或坏死细胞可通过凝聚或片段化蓝染核识别。
1.2.4 体外细胞处理 将培养板中的融合单层软骨细胞用完全培养基洗涤3 次,无血清培养基孵育过夜。分别将血清饥饿的软骨细胞分为3 类:①单独用重组大鼠IL-1β(10 ng/ml)预处理24 h;②采用20 µmol/L 大黄素预处理2 h,IL-1β(10 ng/ml)孵育24 h;③未经处理。不同时间点收获软骨细胞用于RT-PCR和Western blot分析。
1.2.5 RT-PCR 按照Trizol 试剂说明从大鼠软骨细胞中提取总RNA,采用Primescript-RT 试剂盒逆转录为cDNA,ABI PRISM 7700 型荧光定量PCR 仪进行RT-PCR,所有实验重复3 次,以GAPDH 为内参。引物序列为collagen ⅡF:5'-GGTAAGTGGGGCAAGACTGTTA-3',R:5'-TGTTGTTTCTGGGTTCAGGTTT-3';aggrecan F:5'-GTCAGATACCCCATCCACACTC-3',R:5'-CATAAAAGACCTCACCCTCCAT-3';MMP-13 F:5'-AGCCACTTTATGCTTCCTGATG-3',R:5'-GATGTTTAGGGTTGGGGTCTTC-3';ADAMTS-4 F:5'-ACAGGCAGGGAGAGACAAAGAT-3',R:5'-C- CAAGGTCAGAGGCAAAGTT-3';NF-κB p65 F:5'- TGCATTCTGACCTTGCCTAT-3',R:5'-TCCAGTCTCCGAGTGAAGC-3';IKK-β F:5'-CCGTGACTGTTGACTACT-3',R:5'-GTCCACTTCGCTCTTCTG-3';IκB-α F:5'-CAAGTACCCGGATACAGCAG-3',R:5'-ACACAGTCATCGTAGGGCAA-3';β-catenin F:5'-GTTGCTCCACTCCAGGAATGAAGG-3',R:5'-GCACCAATGTCCAGTCCGAGATC-3';GAPDH F:5'-AGTTCAACGGCACAGTCAAGGC-3',R:5'-GACATACTCAGCACCAGCATCACC-3'。ΔΔCt法分析相对表达。
1.2.6 细胞番红O 染色 为了评估软骨特异性基质蛋白糖胺聚糖(glycosaminoglycans,GAG),将软骨细胞接种至6孔板(2×104个/孔),分别给予20 µmol/L 大黄素和10 ng/ml IL-1β处理,每48 h用新鲜含大黄素和IL-1β 的培养基替换培养基,培养7 d 后吸出培养基,PBS 洗涤3 次,4%多聚甲醛固定30 min,PBS洗涤2 次,0.1%番红O 储备液室温孵育30 min,除去染料,PBS洗涤,拍摄染色结果。
1.2.7 Western blot PBS 洗涤大鼠软骨细胞后裂解20 min,BCA 法测量蛋白浓度,95 ℃变性5 min,SDS-PAGE 分离总裂解物蛋白(30 µg/泳道)转至PVDF膜,5%脱脂牛奶室温封闭1 h,TBST洗涤,加入稀释的一抗aggrecan(1∶1 000)、collagen Ⅱ(1∶1 000)、MMP-13(1∶3 000)、ADAMTS-4(1∶2 000)、NF-κB p65 (1∶2 000)、IKK-β(1∶1 000)、IκB-α(1∶1 000)、 β-catenin(1∶2 000)和β-actin(1∶1 000) 4 ℃孵育过夜,TBST 洗涤,加入辣根过氧化物酶标记的山羊抗兔IgG(1∶2 000)二抗室温孵育1 h,ECL,检测蛋白条带。
1.3 统计学分析 采用SPSS18.0 软件分析数据,数据表示为±s。采用t检验比较两组间差异,单因素方差分析(ANOVA)和LSD 检验比较多组间差异。P<0.05表示差异有统计学意义。
2 结果
2.1 大黄素对软骨细胞活力的影响 MTT 和Hoechst 染色结果表明,10~100 µmol/L 大黄素孵育24 h 和48 h 后,大黄素对软骨细胞无显著细胞毒性作用(P>0.05,图1)。
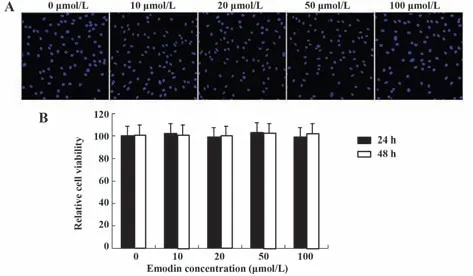
图1 大黄素对软骨细胞活力的影响Fig.1 Effects of emodin on chondrocyte viability
2.2 大黄素对IL-1β 诱导的大鼠软骨细胞aggrecan和COL2A1 表达的影响 RT-PCR 结果显示,IL-1β(10 ng/ml)诱导的大鼠软骨细胞中aggrecan 和COL2A1 mRNA 水平显著降低,而20 µmol/L 大黄素处理的软骨细胞两种基因表达显著高于仅用IL-1β处理的细胞(图2)。Western blot 评估aggrecan 和COL2A1蛋白表达,结果与RT-PCR一致。
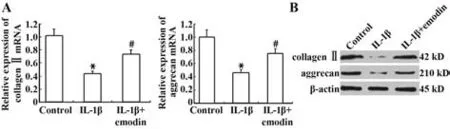
图2 大黄素对aggrecan和COL2A1表达的影响Fig.2 Effects of emodin on aggrecan and COL2A1 expressions
2.3 大黄素对IL-1β 诱导的大鼠软骨细胞合成蛋白多糖GAG 的影响 番红O 染色证实了软骨细胞合成蛋白多糖GAG 的过程,GAG 在IL-1β 诱导的软骨细胞中表达显著低于大黄素处理的软骨细胞(图3)。
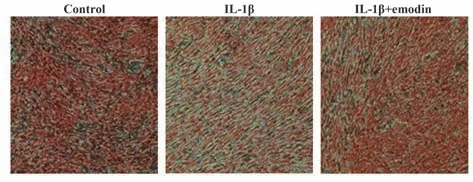
图3 番红O染色结果Fig.3 Safranin O staining results
2.4 大黄素对IL-1β 诱导的大鼠软骨细胞MMP-13和ADAMTS-4表达的影响 与未处理的大鼠软骨细胞相比,IL-1β(10 ng/ml)刺激的软骨细胞MMP-13 mRNA 表达显著升高,而20 µmol/L 大黄素预处理可显著抑制IL-1β 诱导的MMP-13 表达上调。Western blot 结果与RT-PCR 一致(图4)。与未用IL-1β 刺激的大鼠软骨细胞相比,IL-1β(10 ng/ml)处理后, ADAMTS-4 mRNA 和蛋白表达显著升高,大黄素预处理则可显著抑制ADAMTS-4表达。
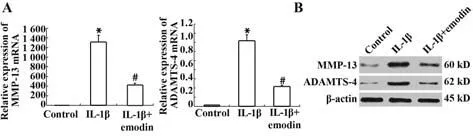
图4 大黄素对MMP-13和ADAMTS-4表达的影响Fig.4 Effects of emodin on MMP-13 and ADAMTS-4 expressions
2.5 大黄素对IL-1β 诱导的大鼠软骨细胞NF-κB信号通路的影响 IL-1β(10 ng/ml)预处理可显著提高IKK-β 和NF-κB p65 表达,并降低IκB-α 表达,但20 µmol/L大黄素处理则可抑制上述过程,说明IL-1β 预处理可激活NF-κB 信号通路,但大黄素可通过抑制IκB-α降解下调IKK-β和NF-κB p65水平。Western blot结果与RT-PCR一致(图5)。
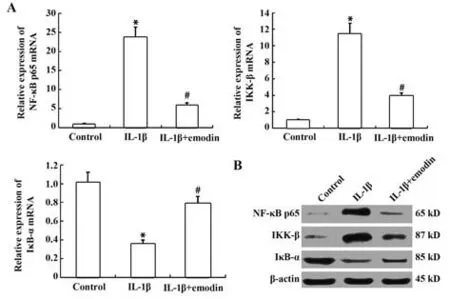
图5 大黄素对NF-κB p65、IKK-β和IκB-α表达的影响Fig.5 Effects of emodin on NF-κB p65, IKK-β and IκB-α expressions
3 讨论
OA 是一种由年龄增长、创伤、肥胖、关节畸形或先天性异常等因素引起的关节退行性病变,主要特征包括关节软骨破坏、软骨下骨硬化、骨赘形成等,可导致患者关节疼痛、僵硬、肿胀、活动受限等,严重影响患者生活质量[10-12]。根据病因可将OA 分为原发性OA 和继发性OA,原发性OA 发病机制尚不明确,可能与患者年龄、体重、劳动程度有关。而继发性OA 主要由炎症、神经缺陷、代谢异常、内分泌异常等因素引起[13-15]。软骨稳态反映了软骨素合成代谢和分解代谢平衡,在OA 进展中具有重要作用,关节软骨降解主要与分解软骨的蛋白过量产生有 关,包 括MMP-1、MMP-3 和MMP-13、ADAMTS等[16-18]。而这些蛋白由受多种信号调节,其中,NF-κB 是调节炎症基因表达的重要转录调节因子,在OA进展中起重要作用[19]。
目前OA 治疗主要采用非甾体类抗炎药和其他缓解疼痛的药物,但这些药物均无法阻止软骨退化。此外,长期使用非甾体类抗炎药可能导致严重胃肠道、肾脏和心血管方面不良反应[20]。因此,开发更有效和安全的药物用于OA 治疗非常需要。大黄素是一种从掌叶大黄根茎中分离的天然蒽醌,具有抗炎作用,且已广泛用于临床[21]。GAO 等[22]研究发现,大黄素降低了链脲佐菌素(STZ)诱导的糖尿病大鼠早期蛋白尿和纤维连接蛋白表达,在预防糖尿病早期肾功能不全方面具有一定应用价值。王少杰等[23]考察了大黄素在DL-乙硫氨酸和四环素诱导的小鼠急性脂肪肝中的作用,发现大黄素可有效改善小泡型肝脂肪变性及肝细胞肿大,增加脂肪酸氧分泌、减少肝脏脂肪酸摄取,对脂肪肝具有较好改善作用。大黄素通过抑制促炎细胞因子,如TNF-α、IL-6、IL-8 以及MMP-1 和MMP-13 等MMPs 抑制炎症反应[24-25]。任凯旋等[26]探讨了大黄素对脂多糖诱导小鼠RAW264.7 巨噬细胞炎症反应的影响,发现大黄素可通过PPARγ/NF-κB 信号通路抑制脂多糖诱导的巨噬细胞炎症反应,提示大黄素在炎症相关性疾病治疗中具有潜在应用价值。彭菲菲等[27]考察了大黄素对类风湿关节炎滑膜细胞增殖及转移的影响,发现不同浓度大黄素可显著抑制体外培养的类风湿关节炎滑膜细胞转移及增殖,说明大黄素治疗类风湿关节炎具有较高应用前景。但目前大黄素在OA 发病机制及临床治疗中的作用和价值尚不明确,因此本研究探讨了大黄素的潜在软骨保护作用。
关节软骨是一种结构精细、表面光滑、减少骨摩擦、缓冲振动等多功能胶原纤维构成的软骨,在关节活动中具有关键作用。运动过程中,关节软骨可承受力学负荷、缓冲运动压力、润滑作用、增加关节灵活性等,是一种专门的连接组织,其细胞外基质主要由大分子组成,包括软骨中最丰富的蛋白多糖aggrecan 和collagenⅡ[28]。葡聚糖酶介导的aggrecan 降解发生在软骨破坏初始阶段,使胶原蛋白纤维对胶原酶更加敏感[28]。IL-1β 在体外研究中广泛用于诱导OA,因此本研究采用IL-1β 对大鼠软骨细胞进行诱导[29]。IL-1β 可降低软骨细胞aggrecan 和collagenⅡmRNA 和蛋白水平,而大黄素预处理的细胞中,aggrecan 和collagenⅡ表达显著上调。此外,大黄素处理的软骨细胞蛋白多糖GAG沉积增加。
胶原蛋白降解主要通过胶原蛋白降解MMPs 进行,这些酶的表达增加与OA 进展密切相关[30]。MMPs 组中,MMP-13 对细胞外基质collagenⅡ蛋白具有强大水解作用,是参与OA 软骨退变的主要酶[31]。因此,抑制MMP-13 表达可能具有软骨保护作用。本研究显示,与未处理的大鼠软骨细胞相比,IL-1β 刺激的软骨细胞MMP-13 表达显著升高,而大黄素预处理则可显著抑制MMP-13 上调。聚集蛋白聚糖酶属于ADAMTS 家族,与关节疾病相关的聚集蛋白聚糖酶是ADAMTS-4[32]。敲除这些酶中的任何一种均会减弱炎症递质刺激的软骨细胞aggrecan 降解,减弱aggrecan 降解可提供更强的OA 保护作用[33]。本研究显示,IL-1β 诱导的大鼠软骨细胞ADAMTS-4 显著增加,大黄素预处理则可显著抑制ADAMTS-4表达。因此推测大黄素的软骨保护作用主要通过阻断MMP和ADAMTS表达和活化阻止OA进展。
NF-κB 是炎症基因表达的重要转录调节因子,在OA 进展中起重要作用[34]。通常NF-κB 与其抑制蛋白IκB-α 以无活性形式存在于细胞质,而抑制蛋白IκB-α降解受IKK-β调节。促炎细胞因子,如IL-1β刺激可导致IKK-β 活化,磷酸化IκBα 并将NF-κB 从细胞质转运至细胞核,激活炎症相关基因表达,包括COX-2、TNF-α、IL-6、MMPs和ADAMTS[35-40]。本研究观察到IL-1β 预处理可显著提高IKK-β 和NF-κB p65表达,并降低IκB-α 表达,但20 µmol/L 大黄素处理则可抑制上述过程,说明IL-1β 预处理可激活 NF-κB信号通路,但大黄素处理可通过抑制IκB-α降解下调IKK-β 和NF-κB p65 表达,并最终抑制NF-κB p65 活化。因此推测大黄素对MMP 和ADAMTS 表达的抑制作用部分归因于其对NF-κB途径的抑制。
综上,本研究表明,大黄素可提高IL-1β 诱导的大鼠软骨细胞aggrecan 和COL2A1 表达,并显著抑制IL-1β 诱导的MMP-13 和ADAMTS-4 上调,此外,大黄素处理可通过抑制IκB-α 降解下调IKK-β 和NF-κB p65 水平,提示大黄素对MMP 和ADAMTS 表达的抑制作用部分归因于其对NF-κB 途径的抑制,从而发挥软骨保护作用。
