热解兰炭(SCs)基活性炭高效吸附SCs废水中苯酚的动力学和热力学
2023-03-16杨婷婷卢翠英曹元甲张智文
杨婷婷,卢翠英,曹元甲,张智文,王 震,马 强
(陕西省低变质煤洁净利用实验室/榆林学院 化学与化工学院, 陕西 榆林 719000)
1 前 言
兰炭(SCs)是陕西省榆林地区的两大支柱产业之一,由于SCs生产过程所用的设备和工艺会不可避免产生大量废水,其主要污染物组成与焦炭废水有很多相似之处,但由于干馏温度不同,SCs废水中不仅含有大量的酚类化合物,还含有脂肪族化合物、杂环化合物和多环芳烃,其中酚类化合物是主要化合物,约占有机物总量的85%[1]。一些酚类化合物已被证实能加速肿瘤的形成、癌变和突变。不同国家和监管机构对含有苯酚的工业废水实行严格的排放标准[2-4],其中我国废水三级排放标准规定:废水中苯酚的含量不得超过1.00 mg/L。目前SCs废水的处理方法主要借鉴焦化废水处理方法,有混凝-絮凝、物理化学分解、氧化、光催化和吸附法[5]。但SCs废水的浓度比焦化废水高出10倍左右[6],成分更加复杂,在处理上更加困难,故低成本处理SCs废水是一个亟待解决的问题。另外,这些技术大多存在诸如有机物消除不完全、对试剂和能量的要求高、选择性低、投资和运行成本高及需要消除的二次废物的产生等缺点[7]。吸附法具有表面积大,成本低、效率高、易于操作,性能更好[8-9]等优点,被认为是去除废液中苯酚的一种有效方法。吸附剂中活性炭因其具有丰富的微孔结构和较高的吸附反应活性、制备原料来源广泛而倍受青睐,制备活性炭的主要原料有煤及其衍生物、生物质和有机高分子三大类[10],与生物质及有机分子相比,煤及其衍生物价廉且来源稳定,以煤及其衍生物为原料生产的活性碳具有易再生、抗磨损等优点[11]。
SCs是榆林优质煤通过550~700 ℃干馏的一种半焦,具有低硫、低磷、低灰、低铝、低爆、高比电阻、高化学活性、高固定碳比、高反应活性、适宜磨料等一般炭材料所不具有的特性。
本研究以SCs为前驱体,KOH为活化剂,制备了SCs基活性材料(SACs去灰分样品后命名为ASACs)。研究了炭化温度,碱用量,灰分对样品微结构和吸附性能的影响,借助ASACs吸附苯酚的动力学和热力学分析,了解SACs吸附苯酚的机理,探索SCs基SACs在废水处理中的应用。
2 实 验
2.1 原材料和试剂
SCs来自中国陕西神府煤田,氢氧化钾(KOH,AR,≥99%)),苯酚(AR,≥99%),盐酸(HCl,AR,36%~38%),均为外购。
2.2 实验设备
采用热重分析对SCs的热稳定性进行表征。使用扫描电镜(SEM)观察SACs的表面形貌。利用X射线衍射仪(XRD)表征了SCs基SACs的结晶度。实验采用傅里叶红外光谱仪(FTIR),通过KBr压制对样品在4 000~400 cm-1波数范围内的表面官能团进行定性以及采用Boehm滴定法进行定量分析。孔隙率分析仪和全自动比表面积(BET)测定样品的孔径分布、比表面积和微孔。紫外-可见分光光度计(UV-Vis,UV-2450)测定苯酚溶液的吸光度,并计算出苯酚的去除率。
2.3 SCs的去灰处理
球磨过100目筛分的SCs于3 M的HCl中磁力搅拌24 h,用去离子水清洗掉水溶性粘合杂质,加入60 g NaOH和蒸馏水共500 mL混合搅拌24 h,用蒸馏水冲洗至pH=7后,在105 ℃风干箱内烘干12 h。
将坩埚盛有1.00 g去灰样品后放于马弗炉,以速率10 ℃/min从室温升到1 000 ℃并保温2 h,待自然冷却至室温后称重。灰分的含量按式(1)计算。
(1)
式中:AC为样品中灰分所占的比例(%);m为加热前样品的质量(g),m1为加热后样品的质量(g)。
2.4 SACs的制备
SACs用KOH对粉末SCs进行化学活化制备得到,具体过程如下:将KOH与SCs按一定质量比(2∶1、3∶1和4∶1)充分混合,置于坩埚后将坩埚放入程序升温气氛管式炉(长1 000 mm,内径100 mm)中碳化,以5 ℃/min加热速率从室温加热至380 ℃,并保持30 min,再以10 ℃/min升温至620 ℃,保持90 min,最后以10 ℃/min升温至850 ℃,并保持120 min。活化结束后用1 M HCl去除样品中残余KOH及其相关产物,蒸馏水洗涤至中性后于105 ℃下干燥12 h。去灰分和不去灰分SCs制备的样品质量分别记作ASACx和SACx,x为KOH与SCs质量比(x=2、3和4)。制备过程见图1。

图1 KOH活化 SCs制备SACs的流程示意图
2.5 吸附实验
2.5.1标准曲线的绘制 称取0.025 0 g苯酚加入到1 L去离子水中,搅拌均匀得200 mg/L苯酚标准溶液。分别取0.625、1.25、2.5、7.25和12.5 mL溶液于25 mL比色管,去离子水定容得到溶液浓度分别为0、5、10、20、50和100 mg/L标准溶液。使用UV-Vis测定各溶液于265 nm处的吸光度并绘制标准曲线,如图2所示,用于苯酚的含量计算。
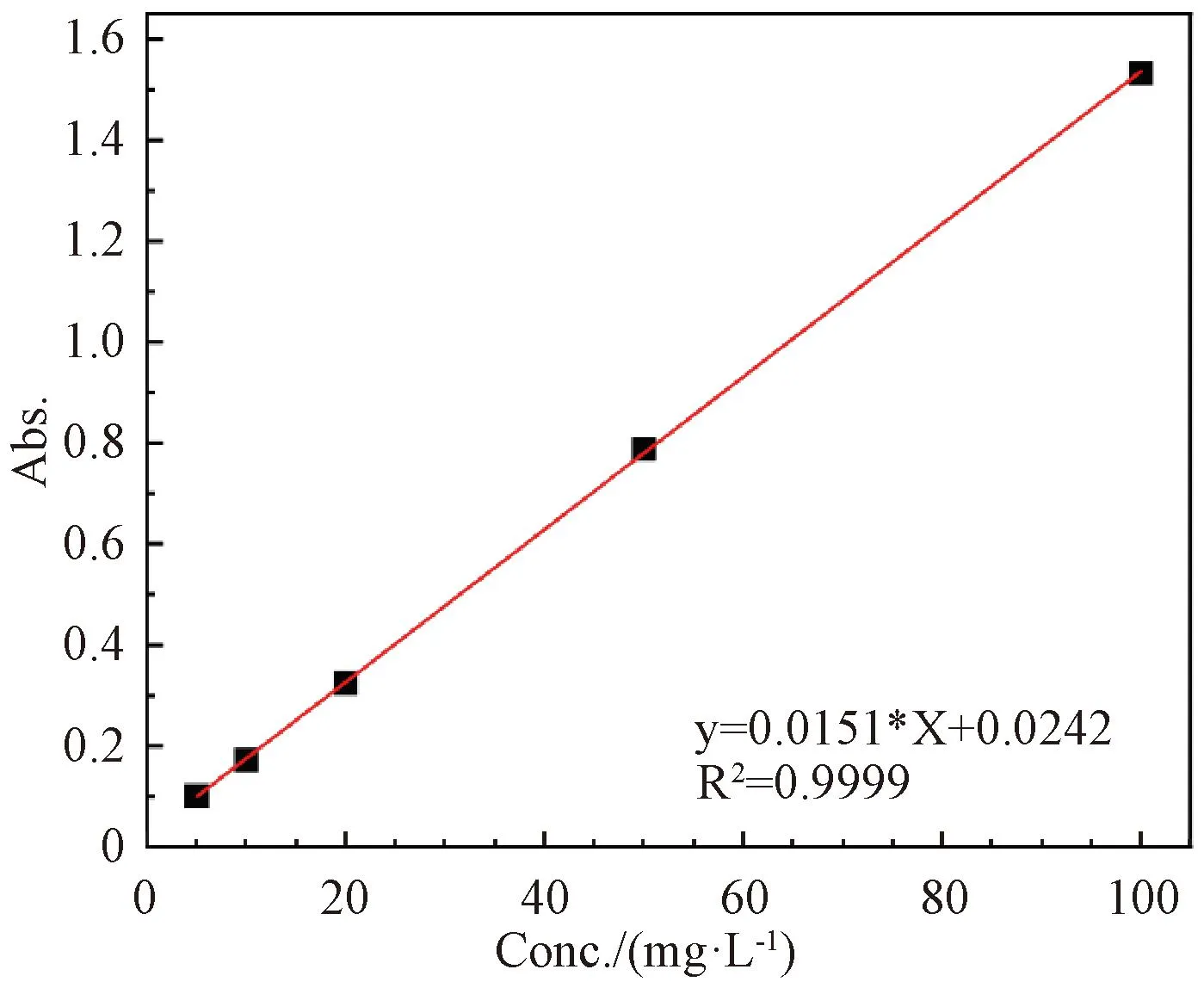
图2 标准曲线
2.5.2吸附性能测试 200 mg/L苯酚溶液用于SACs吸附研究。磁力搅拌下将0.025 0 g SACs加入到含有200 mg/L、50 mL苯酚的锥形瓶中,120 min吸附平衡后过滤。采用UV-Vis测定滤液的吸光度,并计算滤液中苯酚的含量。平衡吸附能力由式(2)计算。
(2)
式中:Qe(mg/g)表示在吸附平衡时的SACs吸附能力,Ce(g/mL)为吸附平衡时的苯酚浓度,C0(g/mL)为苯酚的初始浓度,V(mL)为苯酚溶液的体积,m(g)是SACs的质量。
吸附平衡时的吸附效率(AE%)按式(3)计算[12]。
(3)
2.5.3等温吸附模型 吸附等温线是指溶质分子在两相界面的吸附过程中在某一温度下达到平衡时的两相溶质分子浓度之间的关系曲线[13]。
为了获得材料的最大理论吸附量,吸附数据分别采用Langmuir[14](式(4))和Freundlich[15]模型(式(5))进行拟合。
(4)
(5)
式中:Qe和Ce的意义如上,Qmax(mg/g)为最大吸附量,KL(L/mg)为Langmuir常数,KF(mg/g)和n表示弗氏常数。
2.6 吸附动力学模型
2.6.1动力学模型 吸附动力学用于描述吸附剂吸收的速率。利用该模型拟合的数值探讨吸附机制。一阶动力学模型、二阶动力学模型和粒子内扩散模型是分析吸附动力学的主要经典模型,主要用于确定吸附过程中发生的物理化学反应的物质转移和速率变化过程。动力学常数K可用于计算吸附速度。一阶动力学模型(Lagergren)[16]、二阶动力学模型(Mckay)和粒子内扩散模型(Weber)[17]、线性处理及作图横纵坐标见表1。

表1 三种常用动力学模型
Qt的计算如下:
(6)
式中:Ct(g/mL)表示t时苯酚的浓度,Qt(mg/g)表示SACs在t时的吸附能力。
2.6.2热力学模型通过热力学参数(包括吉布斯自由能(G0)、焓(H0)、熵(S0))的变化,了解吸附程度和驱动力,可深入分析各种因素对吸附造成的影响。通过Arrhenius方程(式(7)和式(8)),对SACs吸收酚类废水过程的热力学计算[18]如下:
(7)
(8)
式中:KV(L/mg)为吸附平衡常数;R(8.314 J/mol/K)为通用气体常数;T(K)为绝对溶液温度;ΔH0(kJ/mol)为吸附标准焓变;ΔS0(kJ/mol)为吸附标准熵变。Kd为温度T时的反应速度常数;A为Arrhenius常数,称为指前因子;Ea(kJ/mol)为反应的活化能。根据式(7)和式(8)作lnKV/T与lnKd/T曲线图,计算出ΔS0、ΔH0和Ea。
3 结果与讨论
3.1 SACs的制备
SCs为煤低温干馏产物,由于煤中晶体水、挥发性气体和小分子油的馏出而留下孔隙,同时固定碳进行一定的结构重排而结晶度提高,但总体上孔隙不够发达(图3(c))。为获得具有丰富孔结构的ASACs,用高活性KOH活化SCs可以消除SCs表面的灰分和焦油,降低活化反应温度,加速非碳成分的脱除,提高热解反应速率,同时在KOH活化过程中发生R1~R6的化学反应[19-20],并在活化过程中释放出CO2、H2、CH4等小分子,从而在残留碳中产生大量的微孔[21-22]。因此KOH用量越多,SACs的孔结构越丰富。相比之下,ASACs微孔明显增多(图3(d)),比表面积由1 025.22 cm2/g增大到1 689.23 cm2/g,孔体积由0.44 cm3/g增大到0.75 cm3/g,这些孔洞为苯酚分子向SACs上的活性位点迁移提供了扩散通道,具有较大的比表面积,从而增强了苯酚的吸附。

图3 SAC4的SEM图像 (c)及局部放大后的SEM图像 (a)~(b)和ASAC4的SEM图图像(f)及局部放大的SEM图像 (d) ~ (e)

(9)

(10)

(11)

(12)

(13)
(14)
3.2 TG与DTG曲线分析
从图4可以看出,SCs的整个热解过程可以分为四个温度段:0~100 ℃,TG曲线略有下降,相应的DTG曲线出现第一个波谷,这是由于SCs在洗煤中吸附的水分引起的;450~680 ℃,TG和DTG曲线下降变缓,没有明显的波谷,该阶段是由于SCs中易挥发物质脱出;700~780 ℃,TG曲线再次出现急速下降,对应的DTG曲线出现第2次波谷,在745 ℃出现极小值。在这一阶段,SCs经过强烈的热解和缩聚反应,分散相物质中的中小分子从固定相中析出,芳香烃的烷基侧链断裂生成脂肪烃产物,导致—CH2—和—CH3结构减少[23];850~1 000 ℃,TG曲线下降缓慢且趋于稳定。此阶段SCs进入了一个高度碳化的过程,使碳的芳香结构之间的夹角逐渐消失。碳微晶结构获得进一步发展[24]。
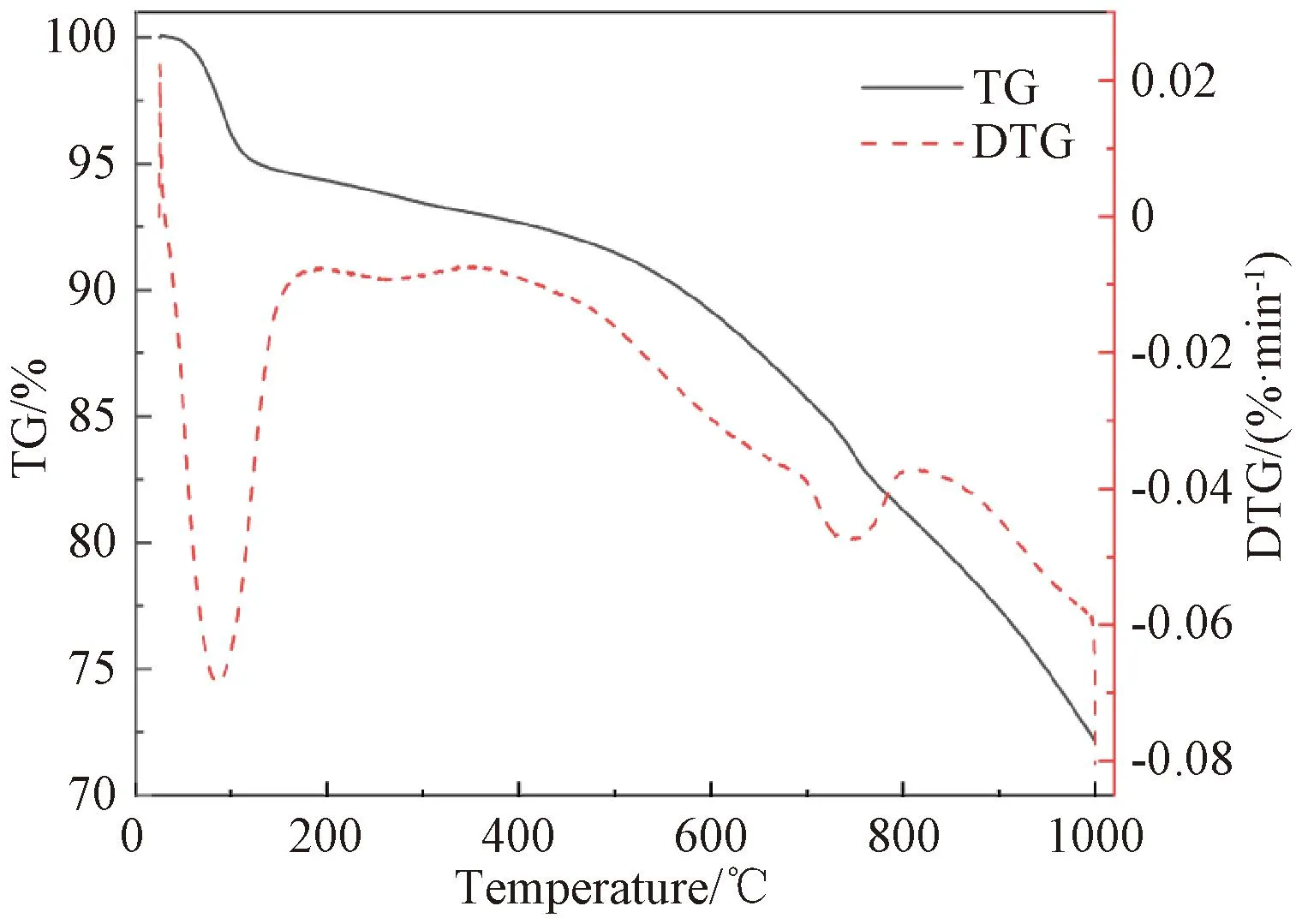
图4 SCs的热重曲线
3.3 BET分析
为获得更多的孔结构信息,采用N2检测样品在77 K下孔隙的吸脱附量。如图5(a)所示,在较低的相对压力下(P/P0<1),SACs的吸附量均随压力的增加而线性增加。P/P0>1时,吸附量几乎不随P/P0变化,吸附线与脱线基本重合,说明N2在样品表面的吸附量达饱和状态。基于IUPAC吸附等温类型判断所有样品的吸附过程属于第一吸附类型,即Langmuir吸附模型,主要由微孔组成,毛细管孔可以忽略不计,N2分子在SACs主要是单层吸附。图5(b)及表2进一步说明样品中大部分孔径小于2 nm。
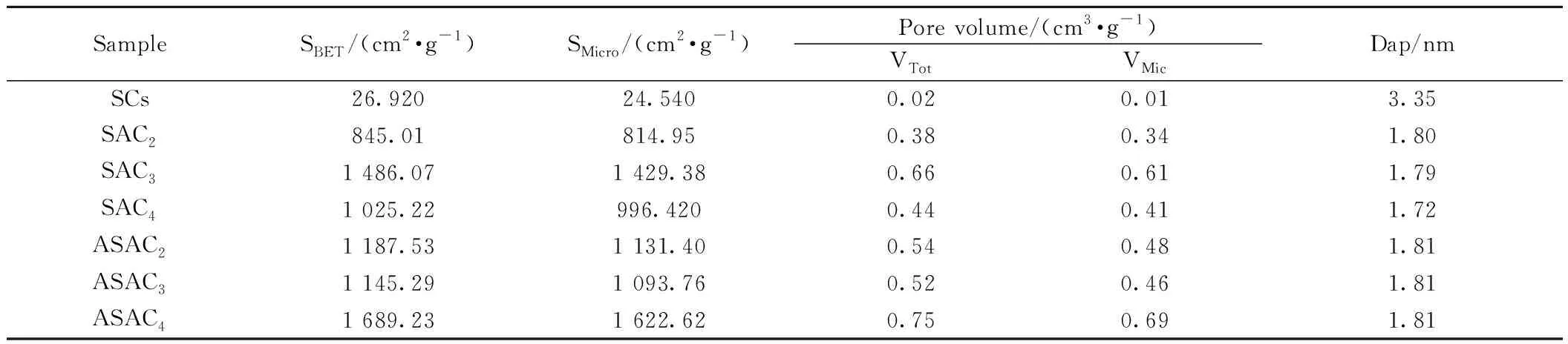
表2 SCs,SACs和ASACs的孔隙特性

图5 SACs和ASACs吸脱附(a)及孔径分布(b)图
由表2可见,KOH用量和灰分对样品的结构影响显著,随着KOH/SCs质量比的增大和灰分的减少,吸附量、比表面积和孔体积明显增大。样品ASAC4具有最大比表面积,1 689.23 mg/g孔体积为0.75 cm3/g,平均孔径1.81 nm。苯酚的分子大小为0.67 nm,小于2 nm孔道适合苯酚的吸附。
3.4 XRD分析
图6(a)显示26°处出现一个平坦的衍射峰,且各样品的峰强度没有明显变化。该峰是碳的典型衍射峰(002),代表碳材料石墨化程度,平坦的峰表明在KOH活化前后都存在部分石墨微晶。根据Scherrer公式Dhkl= kλ(βcosθ),计算得出石墨微晶颗粒的大小为300 nm。这是由于煤在热解和活化过程中芳香族化合物发生缩聚而石墨化,但由于低的热解和活化温度,所以石墨化度较低,导致衍射峰平坦。此外,这6条曲线在2θ=43°处均有小衍射峰,对应于碳的(004)衍射峰,也进一步说明SACs中存在石墨微晶[25]。此外,图中没有发现K峰,说明SACs洗涤的很干净。

图6 SACs 和ASACs的XRD(a)和FTIR光谱图(b)
3.5 FTIR分析
SACs表面存在的官能团是决定SACs吸附性能的另一个重要因素,决定其与苯酚间的相互作用力强弱。图6(b)中4 000~400 cm-1范围内表现出许多吸收峰。在3 440 cm-1处的吸收峰由O—H键[26]的拉伸振动产生。芳香族结构中的C=C拉伸振动位于1 630 cm-1处的吸收峰,在1 440 cm-1处的吸收峰是由酚类[27]的拉伸振动产生。1 045 cm-1处的吸收峰可能是取代芳香或灰[28]的C—H拉伸振动,表明KOH成功激活SCs。在600~650 cm-1范围内的一些弱的峰与O—H基团的C—O—H扭转振动有关[29]。显然,ASAC4中的芳香环、-OH的存在加强与吸附质苯酚间相互作用力,从而加强吸附性能。表3为Boehm滴定法测定的ASAC4和SAC4表面官能团的测试结果,发现与FTI分析一致,去灰分之后的活性炭酸含量明显减少。

表3 SAC4和ASAC4的表面官能团的含量
3.6 吸附平衡研究
3.6.1pH值对吸附性能的影响 溶液pH值对SACs对苯酚的吸附起着非常重要的作用,因为其会影响苯酚的存在形式和SACs的表面的电荷。图7表明,在pH=2~9范围内,SACs的吸附率随着pH值的增加先增加后减小,pH=7时对苯酚的吸附能力最大,可达220.13 mg/g。根据常温下苯酚的电离平衡常数Ka=1.0×10-10得出苯酚的电离度为6.57×10-12,由于苯酚在水中可以电离成C6H5O-和H+,pH<6.57时,SACs表面带正电荷,溶液中H+浓度较高,与苯酚竞争性地吸附在SACs上,导致对苯酚吸附能力减弱。在pH>6.57时,溶液中的苯酚主要以阴离子形式存在,苯酚表面电荷密度和吸附量减小,解离苯酚在pH>pKa下的溶解度增加,解离苯酚的溶解度增加,以及吸附解离形式与带负电的活性炭表面之间的斥力增大。根据实验结果,pH=7为最佳pH值。

图7 ASAC4和SAC4在不同pH值下对苯酚的吸附
3.6.2吸附等温线 由图8和表4可知:Langmuir模型所得的R2均大于0.99,均优于Freundlich等温式拟合的吸附曲线,这说明ASAC4的吸附更符合Langmuir模型。ASAC4由于具有更丰富的孔隙结构和更大的比表面积,对苯酚的饱和吸附量高达407.06 mg/g,而SAC4的饱和吸附量为304.67 mg/g。ASAC4的Langmuir和Freundlich模型中R2分别为0.999 3和0.992 2,均高于SACs的R2,表明ASAC4其单层吸附特性,产生这种结果的原因可能是SAC4的酸含量大于碱含量导致。1/n=0.239~0.260小于0.5,说明ASAC4和SAC4对苯酚具有较强的吸附能力。

表4 ASAC4和SAC4吸附苯酚的Langmuir和Freundlich模型参数

图8 ASAC4和SAC4吸附苯酚的等温线及Langmuir(a)和Freundlich(b)模型的非线性拟合
Freundlich常数KF表示吸附容量的大小,KF越大吸附容量越大。由表4中KF值可得,ASAC4比SAC4更易吸附废水中苯酚[30]。
3.6.3吸附动力学 吸附速率的快慢是评估吸附剂在实际废水处理中是否成功应用的重要参数之一。从图9(a)可见,吸附能随时间的延长呈非线性关系。整个吸附过程可分成两个阶段:在吸附的初始阶段,吸附苯酚的量随时间的延长快速提高,在浓度为200 mg/L苯酚吸附5 min后去除率大小为54%,当吸附10 min后,对苯酚的吸附趋于平衡,去除率达60%。

图9 ASAC4吸附苯酚的不同时间数据 (a),准一级动力模型(b),准二级动力模型(c)和粒子内扩散模型(d)
动力学研究可以反映出吸附材料去除吸附质的速率和机理,有助于提示吸附质在液相中的变化,准一阶动力学模型、准二阶动力学模型和粒子内扩散模型是研究吸附动力学的经典模型[32],主要用于确定吸附过程中吸附剂的转移机理和速率控制步骤。ASAC4的大多数孔小于1.8 nm,因而扩散过程可能影响吸附,为了进一步解释扩散机理,又引入粒子扩散模型,相关参数有助于对吸附速率的预测,进而为设计和建模吸附过程提供重要信息。图9(b)~(d)为ASACs吸附不同浓度苯酚准一、二级和粒子内扩散动力学模型模拟图,三种动力学模型参数和回归系数列于表5。从表5可见,不同浓度下ASAC4吸附行力与拟二级动力学模型计算值吻合较好,说明苯酚在ASAC4上的吸附属于拟二级动力学模型过程。与文献报道(表6)的吸附效果相比,坚果壳活性炭对苯酚的最大吸附量为280 mg/g,高于SCs活性炭,但其饱和吸附时间长于本实验中结果,这与它更高的表面积(1 689 m2/g)有关。
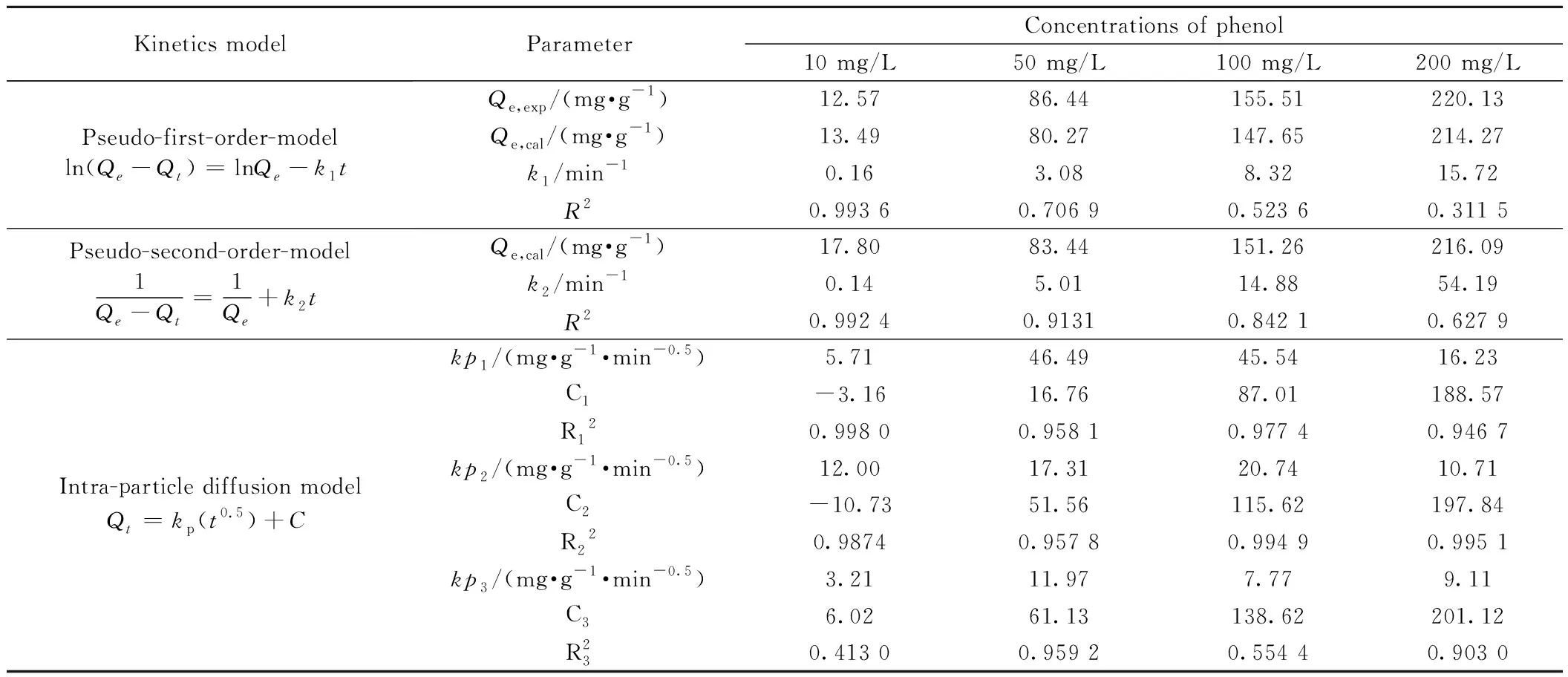
表5 ASAC4吸附苯酚的动力学参数
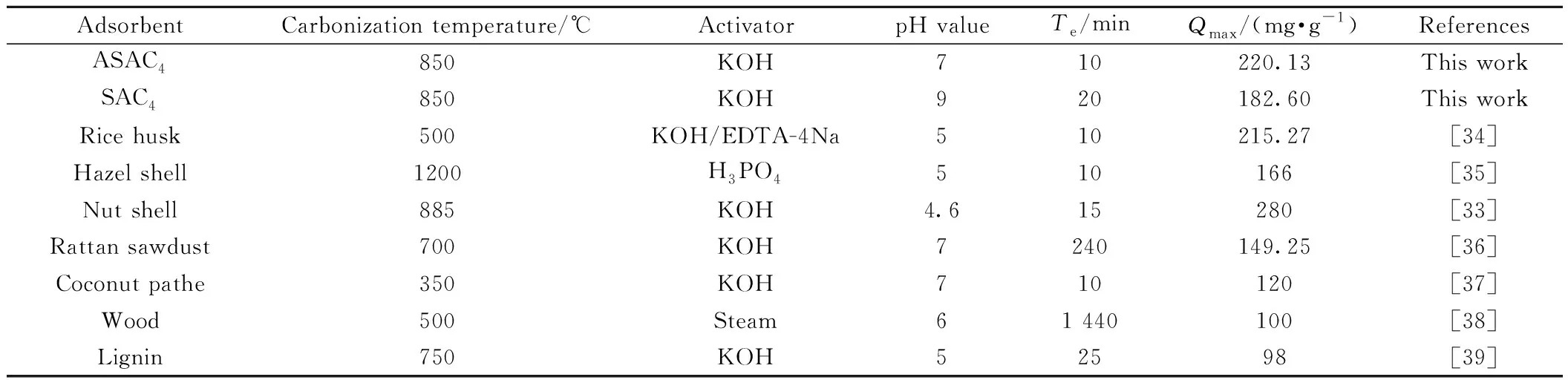
表6 吸附法去除废水中苯酚效果的对比
3.6.4吸附热力学 吸附热力学主要研究吸附过程中所能达到的程度,ASAC4吸附苯酚的焓变,吸附的直接反应力,根据苯酚在ASAC4上的吸附等温曲线[40](图8),参照公式4由lnCe对1/T作图(图10),可得到相应的热力学参数,见表7。热力学分析表明,在选定温度范围内和苯酚浓度下,从303 K升高到343 K时,ASAC4对苯酚的吸附从407.1 mg/g下降到192.0 mg/g,吸附反应的吉布斯自由能变和焓变均小于零,表明吸附过程是自发放热的,低温更有利于对苯酚的吸收(图10)。随着温度的升高,吸附能力降低可能是吸附剂和吸附物的活性位点[41]之间的吸附力减弱及吸附剂[42]周围分子间的相互作用力减弱。此外,温度持续降低,过程的自发性降低,因此在较高温度下吸附不利。Ea为-4.44 kJ/mol,说明此吸附过程为物理吸附。由于吸附质在吸附表面的吸附降低了其在吸附剂-吸附质界面的随机性从而导致ΔS0<0。
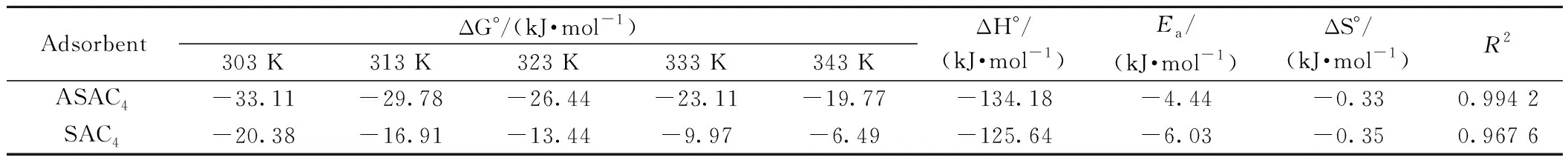
表7 不同温度下ASAC4和SAC4吸附苯酚的ΔG°、ΔH°和ΔS°值

图10 ASAC4和SAC4吸附苯酚的热力学图
4 结 论
本研究以SCs为前体,制备了高表面积、官能团丰富的SACs。随着KOH/SC质量比的增加,SACs的比表面积增大。随着热解温度的升高,比表面积先增大后减小。最佳活化条件为温度为850 ℃,KOH与SCs比例为4∶1的ASAC4孔隙丰富,当ASAC4用量为0.025 g,当初始浓度为200 mg/L,pH=7时,活性炭的平衡吸附量为220.13 mg/g,ASAC4吸附苯酚达到饱和平衡所需时间为10 min。ASAC4的苯酚脱吸附等温线可以更好地符合Langmuir模型,说明它们的吸附主要是单层吸附。而Freundlich模型能更好地描述SAC4对苯酚的等温吸附过程。苯酚在ASACs上的吸附符合准二阶动力学模型,热力学吸附结果表明,吉布斯自由能变化ΔG0均小于零,说明不同条件下SACs对苯酚的吸附是良好的自发行为。SCs的灰分不影响吸附机理,但明显影响对苯酚的吸附能力。
