维生素D 对PCOS 大鼠颗粒细胞凋亡的影响
2023-03-14孙婷马思琪郜艳翠刘远航李琳曲银娥
孙婷,马思琪,郜艳翠,刘远航,李琳,曲银娥
华北理工大学基础医学院 河北省慢性疾病基础医学重点实验室,河北唐山 063210
多囊卵巢综合征(polycystic ovary syndrome,PCOS)常见于育龄期女性,发病率为6%~8%[1],其特征是生殖、内分泌和代谢异常,但持续的激素失衡会导致月经周期不规律、排卵障碍等,可导致女性不孕。颗粒细胞(granulosa cells,GCs)是卵泡的主要组成部分,是分泌性激素的重要细胞,在女性卵巢内,通过GCs 凋亡机制调控优势卵泡发育及卵泡闭锁[2]。有研究报道,PCOS 患者卵巢GCs可能存在异常细胞凋亡调控而引起PCOS[3]。研究发现PCOS 患者体内维生素D(vitamin D,VD)不足与PCOS 发病有一定关系,给予适当VD 治疗可改善PCOS 患者血压情况、降低胰岛素抵抗以及总睾酮(testosterone,T)和雄烯二酮水平,同时,VD 在调节人类和大鼠的排卵障碍中起着重要作用[4-5]。PI3K/AKT/mTOR 信号通路参与了PCOS 疾病的发生,并对PCOS 卵泡异常发育起到了调控作用[6],但VD 是否通过PI3K/AKT/mTOR 影响颗粒细胞凋亡目前尚不明确。本研究通过构建PCOS 大鼠模型,给予VD 治疗,分离培养GCs,给予PI3K 抑制剂LY294002 处理,探讨VD 对颗粒细胞凋亡的影响及其作用机制,为治疗PCOS 提供新的方案。
1 材料与方法
1.1 材料
1.1.1 实验动物 3 周龄SD 雌性大鼠21 只,体质量55~70g,购自北京华阜康生物科技有限公司[实验动物可证号:SCXK(京)2019-0009],饲养于华北理工大学动物实验室中心:室内温度23.0℃,湿度45%。本研究经华北理工大学医学伦理委员会审批(伦理审批号:SQ2022098)。
1.1.2 药物与试剂 来曲唑(生产单位:浙江海正药业股份有限公司,批准文号:H20133109,规格:2.5mg),维生素D(生产单位:青岛双鲸药业股份有限公司,批准文号:H20113033,规格:每粒含维生素D 400 单位);羧甲基纤维素钠(Adams-beta);PI3K、Akt、mTOR、p-PI3K、p-AKT、p-mTOR、Bax蛋白、Bcl-2 抗体(沈阳万类生物科技有限公司,批号分别为M09282477、4020965、HJ1121、HJ1121、50613、M08091506、M07221637、M0912208);β-actin 抗体(武汉爱博泰克生物科技有限公司,批号:AC026);兔二抗(美国Sera care 公司,批号:10312942);LY294002(美国Cayman 公司)。
1.2 方法
1.2.1 动物分组及药物干预 21 只大鼠适应性饲养2~3d 后,采用随机数字表法分为对照组(n=6)和造模组(n=15)。建立PCOS 大鼠模型。造模组采用来曲唑[1mg/(kg·d),溶于0.5%羧甲纤维素钠溶液]灌胃联合高脂饲料喂养,对照组采用等量的0.5%羧甲基纤维素钠溶液灌胃,给予普通饲料喂养,连续喂养28d。喂养第21 天起,每天7 时30 分对两组大鼠进行阴道细胞学检查,观察大鼠动情周期变化。造模后眼内眦取血,测定T、黄体生成素(luteinizing hormone,LH)、促卵泡激素(follicle-stimulating hormone,FSH)。再将12 只造模成功的大鼠(3 只造模失败),采用随机数字表法分为PCOS 组(n=6)和PCOS+VD 组(n=6),PCOS+VD 组大鼠给予VD[200IU/(kg·d)]干预,对照组和PCOS 组同时间灌胃同等剂量玉米油,普通饲料喂养,连续21d。
1.2.2 GCs 的分离培养及鉴定 无菌取出卵巢,在预温的磷酸盐缓冲液中清洗3 次,体视显微镜下用1ml 的注射器针头划破卵巢表面被膜,刺破大卵泡,使细胞流出,使用70μm 细胞筛除去较大卵巢组织,然后用40μm 细胞筛再次过滤,离心5min,弃去上清液。用DMEM/F12 完全培养基(含1%双抗、15%胎牛血清)重悬细胞,在37℃、6%CO2和95%湿度条件下孵育。弃去培养液,用磷酸盐缓冲液洗涤2次,4%多聚甲醛固定后,加入胎牛血清封闭30min,弃去封闭液加入FSHR 抗体过夜,倒置荧光显微镜下观察绿色荧光鉴定GCs。卵泡刺激素受体是颗粒细胞的特异性标志物,表达于GCs 胞质,呈绿色荧光。结果显示,阳性率>90%,提示从大鼠卵巢分离培养的颗粒细胞可以满足后续实验要求,见图1。将颗粒细胞分为GCs 对照组(n=6)、GCs-PCOS 组(n=6)、GCs-(PCOS+VD)组(n=6)、GCs-(PCOS+VD+LY294002)组(n=6)(在抑制剂LY294002 作用前12h,将培养液中胎牛血清浓度减至2%,LY294002 浓度为20μmol/L,作用24h)。
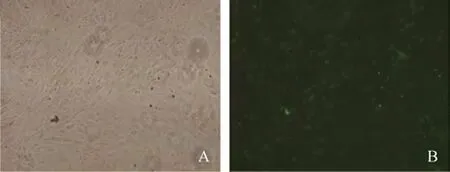
图1 颗粒细胞鉴定(×100)
1.3 观察指标
①阴道细胞学检查:将蘸有生理盐水的无菌棉签插入大鼠阴道,沿阴道壁顺时针方向旋转一圈,涂于干净载玻片上,根据瑞氏染色剂说明进行染色,在光学显微镜下观察,判断动情周期;②卵巢组织形态学变化:药物干预结束当晚20 时开始禁食水,次日早8 时眼内眦取血,脱臼处死大鼠。取大鼠双侧卵巢,左侧卵巢4%多聚甲醛固定,常规石蜡包埋,4μm 连续切片,用于苏木精-伊红染色;右侧卵巢分离GCs,体外培养,用于检测凋亡率、电镜观察及蛋白表达水平检测;③酶联免疫吸附法测定大鼠血清中25-(OH)D、T、FSH、LH 水平,按照试剂盒说明书操作;④颗粒细胞凋亡情况:收集处理结束后的各组GCs,用预冷的磷酸盐洗涤细胞沉淀,在1×结合缓冲液中以浓度为1×106/ml 将细胞悬浮;将100µl 细胞悬液(1×105个细胞)转移至EP 管中,添加5µl FITC 膜联蛋白和5µl 碘化丙啶(propidium iodide,PI),轻轻旋转细胞,并在室温(25℃)下黑暗中培养15min,然后再向每个EP管中添加400µl 1×结合缓冲液,在1 小时内通过流式细胞仪检测颗粒细胞凋亡率;⑤蛋白表达水平:LY294002 作用24h 后收集蛋白,采用蛋白印迹法进行检测。使用Nanodrop2000 测蛋白浓度,固定上样蛋白质量(50 μg)和体积(10µl),取适量蛋白加5×上样缓冲液,并用双蒸水配平沸水煮10min。取每组蛋白样品各10µl 经凝胶电泳分离,转膜;TBST 缓冲液洗涤5min 后放入6%的脱脂奶粉中,室温封闭2h。将聚偏二氟乙烯膜放入一抗PI3K、p-PI3K、AKT、p-AKT、m-TOR、p-mTOR、Bax、Bcl-2(稀释比例均为1:500),4℃过夜。加入二抗(1:5000),37℃放置70min。
1.4 统计学方法
采用Image Lab 软件扫描条带,导出结果用ImageJ 量化后进行数据统计分析。采用GraphPad Prism 8 统计学软件对数据进行处理分析。多组间比较采用单因素方差分析,两两比较采用Tukey 检验,计量资料采用均数±标准差()表示,P<0.05为差异有统计学意义。
2 结果
2.1 动情周期比较
对照组大鼠动情周期规律,4~5d 为一个动情周期。造模组大鼠动情周期紊乱,10 只大鼠动情间期延长,2 只大鼠动情前期延长,经VD 治疗后,动情周期恢复正常,见图2。
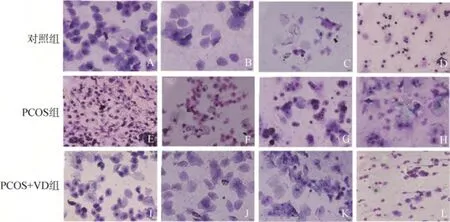
图2 大鼠动情周期变化(瑞氏染色,×400)
2.2 卵巢组织形态学变化
对照组大鼠卵巢内可见不同发育阶段的卵泡及黄体,颗粒细胞层数多、排列整齐,未见囊状卵泡;PCOS 组大鼠卵巢中卵泡数量减少,呈囊状改变,颗粒细胞层数少且排列不规则,黄体数量减少;PCOS+VD 组囊状卵泡明显减少,卵泡内颗粒细胞层数增多且排列整齐,黄体数目增多,见图3。
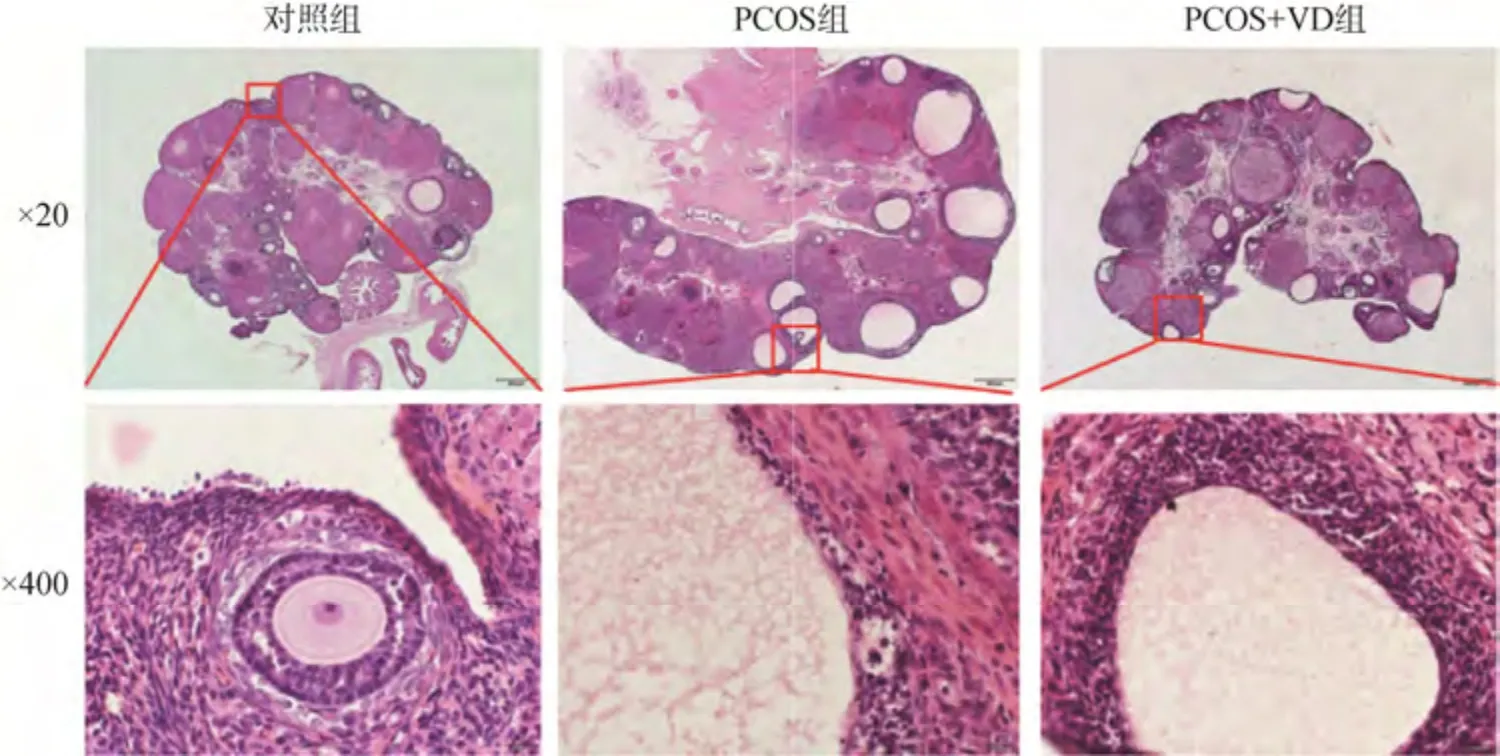
图3 各组大鼠卵巢组织形态学变化(HE)
2.3 血清25-(OH)D 及激素水平比较
与对照组比较,PCOS 组、PCOS+VD 组的血清25-(OH)D 水平均降低,但PCOS+VD 组高于PCOS 组,差异有统计学意义(P<0.05)。与对照组比较,PCOS 组、PCOS+VD 组的血清T、LH 均升高,FSH 均降低,LH/FSH 均增高,其中PCOS+VD组的25-(OH)D 和FSH 水平高于PCOS 组,差异均有统计学意义(P<0.05),见表1。
表1 各组大鼠血清25-(OH)D 及激素水平比较()
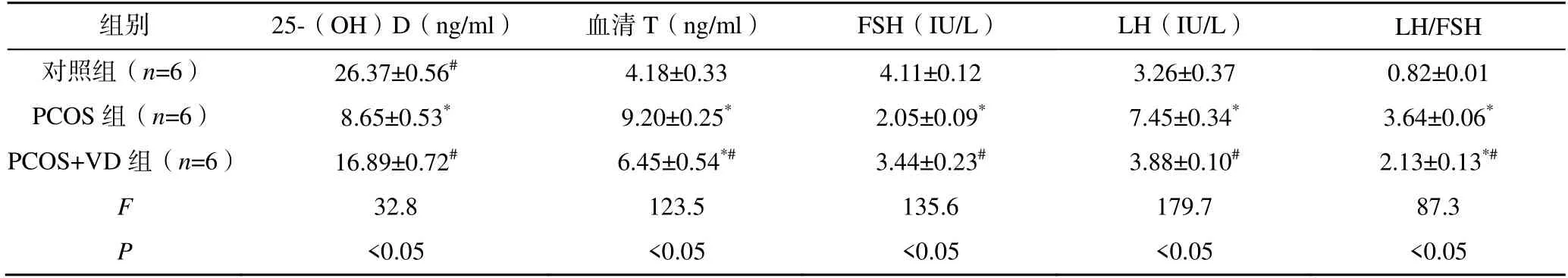
表1 各组大鼠血清25-(OH)D 及激素水平比较()
注:与对照组比较,*P<0.05;与PCOS 组比较,#P<0.05
2.4 GCs 凋亡率比较
与GCs-对照组[(5.63±1.86)%]比较,GCs-PCOS组[(27.23±0.96)%]、GCs-(PCOS+VD)组[(6.65±1.30)%]、GCs-(PCOS+VD+LY294002)组[(22.15±2.10)%]的细胞凋亡率均升高,差异有统计学意义(F=136.4,P<0.05),见图4。

图4 流式细胞仪检测各组颗粒细胞凋亡
透射电镜观察显示,GCs-PCOS 组大鼠颗粒细胞体积小,染色质凝聚呈块状,经VD 治疗后,细胞核染色质轻微边移,凋亡现象得到明显改善,GCs-(PCOS+VD+LY294002)组细胞染色质形态与GCs-PCOS 组相似,见图5。

图5 各组颗粒细胞凋亡电镜观察结果(×4000)
2.5 Bcl-2、Bax、p-PI3K、p-AKT、p-mTOR 蛋白表达水平比较
与GCs 对照组比较,GCs-PCOS 组Bcl-2 蛋白表达降低、Bax 蛋白表达增加、Bcl-2/Bax 降低,p-PI3K、p-AKT、p-mTOR 蛋白表达降低,差异均有统计学意义(P<0.05);与GCs-PCOS 组比较,GCs-(PCOS+VD)组Bcl-2 蛋白表达增加、Bax 蛋白表达降低、Bcl-2/Bax比率升高,p-PI3K、p-AKT、p-mTOR 蛋白表达升高,差异均有统计学意义(P<0.05);GCs-(PCOS+VD+LY294002)组与GCs-PCOS 组各项蛋白表达水平比较,差异无统计学意义(P>0.05)。与GCs-(PCOS+VD)组比较,GCs-(PCOS+VD+LY294002)组Bax蛋白表达增加,Bcl-2、Bcl-2/Bax、p-PI3K、p-AKT、p-mTOR 表达均降低,差异有统计学意义(P<0.05),见图6、7,表2。
表2 各组细胞Bcl-2、Bax、Bcl-2/Bax、p-PI3K、p-AKT、p-mTOR 蛋白水平比较()
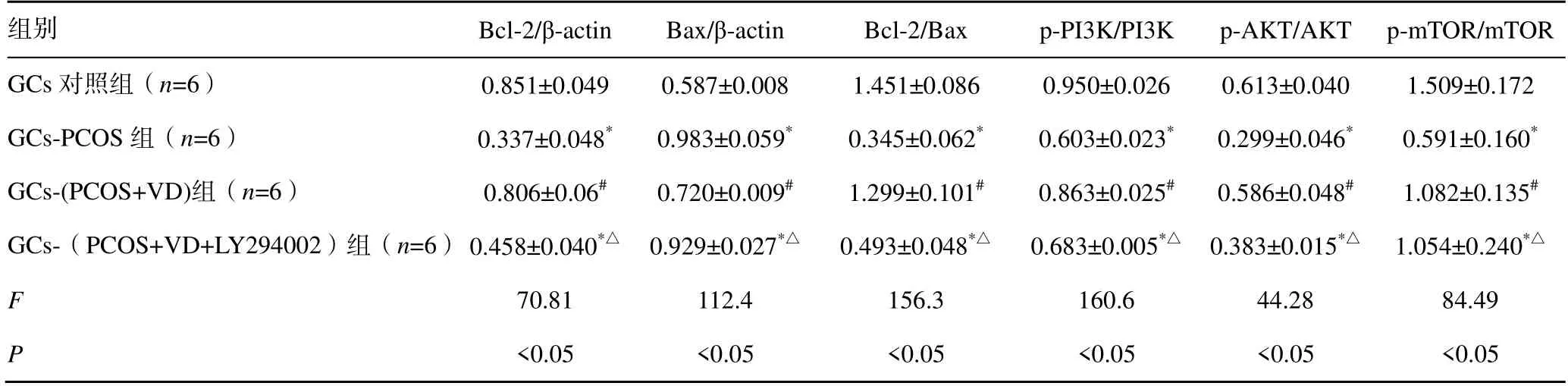
表2 各组细胞Bcl-2、Bax、Bcl-2/Bax、p-PI3K、p-AKT、p-mTOR 蛋白水平比较()
注:与GCs 对照组比较,*P<0.05;与GCs-PCOS 组比较,#P<0.05;与GCs-(PCOS+VD)组比较,△P<0.05
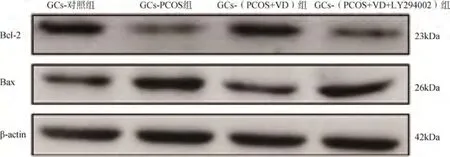
图6 各组卵巢颗粒细胞中Bcl-2、Bax 蛋白表达变化
3 讨论
维生素D 是一种类固醇激素,其受体广泛分布于各种细胞中,颗粒细胞、平滑肌细胞、单核细胞等。除参与钙磷代谢平衡与骨骼结构外,维生素D在高血压、肥胖症、代谢性和自身免疫性疾病等多种疾病预防方面具有潜在作用。研究显示,适当补充维生素D,可使PCOS 女性血清中25-(OH)D恢复至生理水平,有效降低空腹血糖,改善胰岛素敏感性、高脂血症和激素水平[7-8]。
在卵泡和卵母细胞的发育过程中,除了膜细胞为卵泡的发育提供必要的雄激素并介导卵母细胞和颗粒细胞之间的相互作用外,颗粒细胞在决定卵泡的命运和卵母细胞的成熟方面起着决定性的作用[9-10]。Dell’Aquila 等[11]报道,颗粒细胞凋亡率过高影响卵母细胞成熟。另有学者认为,PCOS 患者血清中T和LH水平及胰岛素的升高可使颗粒细胞异常凋亡,进而导致卵泡发育异常,增加不孕率[12-13]。本研究首先建立PCOS 大鼠模型,通过给予维生素D治疗,探究维生素D 对颗粒细胞凋亡的影响以及作用机制。流式细胞术结果显示,GCs-PCOS 组大鼠颗粒细胞凋亡率显著高于GCs-对照组,GCs-(PCOS+VD)组较GCs-PCOS 组凋亡率降低。透射电镜结果佐证了上述结果,GCs-PCOS 组染色质核凝聚呈块状,GCs-(PCOS+VD)组的凋亡现象明显改善。本研究结果显示,GCs-PCOS 组Bax 表达水平明显升高,Bcl-2 蛋白表达水平明显降低。经VD 治疗后,Bcl-2 蛋白表达升高,Bax 蛋白表达降低(即Bcl-2/Bax 比率处于相对稳定状态)。由此可推测,PCOS大鼠血清中激素水平异常导致高雄激素血症和氧化应激可诱导颗粒细胞凋亡,进而导致卵泡异常发育。同时,卵泡发育异常也可促进多囊卵巢的发生[14-16]。本研究结果与金萍[17]和Narvaez 等[18]研究结果具有一致性,给予VD 治疗可抑制细胞凋亡。

图7 各组颗粒细胞中p-PI3K、p-AKT、p-mTOR 蛋白表达
PI3K/AKT/mTOR 信号通路不仅参与细胞生长、增殖和存活过程,同时调控细胞的凋亡与自噬,当PI3K/AKT/mTOR 信号通路出现异常情况时,会导致PI3K 激活或恶性转化,进一步磷酸化下游因子AKT并激活mTOR,选择性激活细胞凋亡及自噬相关基因表达[19]。本研究结果显示,通过给予PI3K 抑制剂LY294002 干预后,与GCs-(PCOS+VD)组相比,细胞内p-PI3、p-AKT、p-mTOR 蛋白表达水平显著降低,细胞凋亡率升高。与GCs-PCOS 组的结果比较,差异无统计学意义。该结果提示,维生素D 抑制颗粒细胞凋亡可能与激活PI3K/AKT/mTOR 信号通路有关,与已有研究结果一致[20],在软骨细胞中PI3K/AKT/mTOR 信号通路调控其凋亡与自噬,Gong 等[16]和陈娇等[21]研究结果显示,PI3K/AKT 信号通路可被生长激素和miR-141 激活,抑制PCOS大鼠卵巢GCs 凋亡,促进其增殖。本研究结果显示,经VD 干预治疗后,GCs 凋亡率降低,凋亡因子Bcl-2/Bax 比率升高,p-PI3K、p-AKT、p-mTOR 蛋白表达上调,LY294002 作用后阻断了PI3K 通路的激活,p-PI3K、p-AKT、p-mTOR 蛋白表达下调,细胞凋亡率升高,结果进一步说明VD 对颗粒细胞凋亡的治疗作用可由于抑制剂LY294002 阻滞PI3K 通路的激活而无治疗效果,表明VD 抑制PCOS 大鼠颗粒细胞凋亡可能是通过激活PI3K/AKT/mTOR 通路来完成的。
综上所述,本文通过维生素D 体内治疗,并进行颗粒细胞体外培养及抑制剂LY294002 作用后发现,维生素D 可能通过激活PI3K/AKT/mTOR 信号通路抑制卵巢内颗粒细胞的凋亡。因此,维生素D可为今后治疗PCOS 提供新的治疗方案。然而,细胞凋亡途径复杂,是否通过外在途径、线粒体诱导细胞凋亡仍需进一步探究。
