超高压处理对牦牛肉贮藏性能的影响
2023-03-12陈腊梅唐善虎李思宁赵佳莹李巧艳
陈腊梅,唐善虎,李思宁,赵佳莹,李巧艳
(西南民族大学食品科学与技术学院,四川成都 610041)
牦牛肉具有高蛋白、低脂肪、肉色好和风味独特等特点[1],但是,牦牛肉在屠宰、加工、运输等环节仍存在肉色与质地劣变、异味产生等诸多问题。目前,各类加工与贮藏方法被用来改善牦牛肉品质和提高经济价值。其中,超高压技术是一项新兴的非热加工技术,广泛用于食品加工与保鲜等领域[2]。据报道,100~1000 MPa压力处理可达到不同程度的灭菌效果,能有效提高肉制品的品质、保留营养成分并延长保质期[3]。此外,超高压处理还能有效改善蛋白质的功能特性[4−5]。但是,过高压力处理下肉制品会产生结构改变、氧化变质等不利影响[6],使超高压技术在肉制品方面的应用受到限制。例如,当压力超过300 MPa时,肉色会出现“增白效应”[7],压力超过400 MPa时,肉色呈灰棕色[8]。有研究表明,约在200 MPa时肌动球蛋白变性,400 MPa时Mb变性[9],高于400 MPa时氧合肌红蛋白(Oxymyoglobin, OMb)氧化,高铁肌红蛋白(Methemoglobin, MMb)比例急剧上升[8]。同时,当压力大于300 MPa时,虽然有效抑制了微生物的繁殖,但是显著促进了脂质氧化[3,10−11],蛋白结构也发生不可逆的变化,使蛋白氧化产物增加[12]。Guyon等[12]认为高压可以诱导脂质和蛋白质等成分的修饰,并通过促进自由基的形成来加速氧化,导致品质变化和营养损失。
目前,关于猪肉[13]、牛肉[12]、鸡肉[14]等经超高压处理后贮藏过程中品质变化的研究有较多报道,但是,尚未见有关牦牛肉经超高压处理后贮藏过程中的品质、理化特性以及微生物变化的研究。由于肉制品的体系复杂,不同品种的肉制品体系呈现出的变化不同,而目前品质变化的相关机制仍不明确。因此,本研究以不同压力处理牦牛肉,通过测定贮藏过程中牦牛肉的理化特性、蛋白和脂质氧化以及微生物的变化,探讨牦牛肉经超高压处理后贮藏0、4、8、12、16 d的理化品质变化规律,为超高压在牦牛肉保鲜以及牦牛肉制品中的应用提供参考价值。
1 材料与方法
1.1 材料与仪器
牦牛肉 购于四川省阿坝州红原县永源肉业,牦牛在红原县集中屠宰,取背长肌,经冷却排酸处理后,−4 ℃运回实验室储藏于4 ℃的环境中;Na2HPO4·12H2O、NaH2PO4·2H2O、MgCl2、EGTA、2,4-二硝基苯肼(DNPH)、氯仿、溴酚蓝、三氯乙酸、硼酸分析纯,成都科隆化学品有限公司;盐酸胍、SDS、尿素 分析纯,德国BioFroxx公司;2-硫代巴比妥酸(TBA)、5,5-二硫基-2,2-二硝基苯甲酸(DTNB) 分析纯,上海源叶生物有限公司;平板计数琼脂 杭州微生物试剂有限公司;尼龙真空袋(12×22 cm)、立式铝箔袋(35×50 cm) 成都鹏世达公司。
HPP 3-5L超高压灭菌设备 包头科发高压科技有限责任公司;TA-XT Plus质构仪 英国Stable Micro Systems公司;CR-700d/600d色差仪 日本Konica Minolta公司;Centrifuge 5804R高速冷冻离心机 德国Eppendorf公司;T-25高速匀浆机 德国IKA公司;UV1810S紫外分光光度计、PHS-3C酸度计 上海佑科仪器仪表有限公司;DHP-9052 电热恒温培养箱 上海齐欣科学仪器有限公司。
1.2 实验方法
1.2.1 样品前处理 参考Wang等[11]的方法并略作修改,对牦牛肉进行超高压处理。取牦牛肉背肌去脂肪、筋膜,分割成2.5×2.5×3.0 cm左右大小的肉块,采用尼龙真空袋真空包装,每袋50 g,测定时每组取3袋样品进行平行测定。对照组不进行处理,处理组样品置于超高压设备中,压力分别设定为200、400、600 MPa,常温下保压480 s,传压介质为水(温度保持在20±1 ℃)。处理完毕后用吸水纸吸干包装表面水分,置于立式铝箔袋中避光贮存于4 ℃冰箱中,分别测定0、4、8、12、16 d的肉品品质。
1.2.2 感官评价 感官评分标准参考李文东等[15]的方法并略作修改。感官评分小组由10名食品专业的研究生组成,每次评定前经过培训,熟悉评价内容和打分标准(见表1);评价时感官人员单独进行,相互不接触交流。

表1 感官评分标准Table 1 Sensory scoring criteria
1.2.3 pH的测定 参考Huang等[16]的方法略作修改,取3 g样品加入30 mL去离子水(pH7.0)中,10000 r/min均质30 s后测定,每个样品3次重复测定。
1.2.4 TVB-N含量的测定 参考李锦锦等[17]的方法,准确称取5 g肉样与22.5 mL 2.2%三氯乙酸匀浆(12000 r/min, 60 s)后离心(4 ℃, 8000×g, 10 min),取上清液5 mL置于扩散皿外室中,3 mL硼酸吸收液于扩散皿内室中,用带缺口毛玻璃将扩散皿密封,于外室中再加入5 mL碳酸钾溶液(10 g/L),密封,37 ℃孵育2 h。使用0.01 mol/L盐酸滴定内室中的硼酸液体,直到其恢复至原始颜色。通过消耗的盐酸量计算样品中TVB-N含量(mg/100 g)。
1.2.5 菌落总数的测定 参考GB 4789.2-2016《食品安全国家标准食品微生物学检验菌落总数测定》。
1.2.6 色差的测定 参考Tomasevic等[18]的方法并稍作修改。色差仪采用D65光源,8 mm孔径,近似角度10°,经零校正、白板校正后使用。样品去除包装,无隙置于白色载物板上,随机选取6个测定位置进行测定,记录样品的L*,a*,b*值。
1.2.7 Mb含量及状态的测定 参考Krzywicki[19]的方法并稍作修改,取10 g肉样,加入5倍体积(v/w)的0.04 mol/L的磷酸钠缓冲液(pH6.8),室温下10800 r/min匀浆10 s,冰浴1 h后离心(4 ℃, 1000×g,30 min),过滤上清液,在525、545、565、572 nm处测定吸光度。
式中,DMb、OMb、MMb分别表示脱氧肌红蛋白含量、氧合肌红蛋白含量、高铁肌红蛋白含量,R1、R2和R3分别代表吸光度比值:A572/A525;A565/A525;A545/A525。
1.2.8 肌原纤维蛋白(Myofibrillar Protein, MP)的提取 参考Wang等[20]方法,将4倍体积(v/w)的10 mmol/L磷酸盐缓冲溶液(含0.1 mol/L NaCl、2 mmol/L MgCl2、1 mmol/L EGTA,pH7.0)添加到10 g肉中,冰浴条件下10000 r/min匀浆1 min,离心(4 ℃, 2000×g, 15 min),弃去上清液,重复该过程两次。在与上述相同条件下用4倍体积(v/w)的0.1 mol/L NaCl洗涤沉淀并离心2次,第三次均质液通过4层纱布过滤去除结缔组织,滤液用0.1 mol/L HCl调pH至6.0,离心后弃上清液,所得沉淀即为MP。双缩脲法测定蛋白浓度,MP保存在4 ℃冰箱内的密闭瓶中,18 h内使用。
1.2.9 MP羰基含量的测定 参考王琳琳等[21]的方法。取0.5 mL 蛋白溶液(5 mg/mL)中加入0.5 mL含0.02 mol/L DNPH的2 mol/L HCl 溶液,空白组加入0.5 mL 2 mol/L HCl溶液,混匀后在25 ℃下反应40 min。此后,加入2.0 mL 20%三氯乙酸并离心(4 ℃, 10000 r/min, 5 min),除去上清液,沉淀用1.0 mL乙醇-乙酸乙酯溶液(V:V, 1:1)洗涤3次。加入3.0 mL 6.0 mol/L盐酸胍溶液,在37 ℃条件下水浴保温30 min溶解沉淀,以空白组为对照。在370 nm波长处测定吸光度,以摩尔吸光系数22000mol/(L·cm)计算总羰基含量(nmol/mg)。
1.2.10 MP巯基含量的测定 参考王琳琳等[21]的方法,取0.5 mL蛋白溶液(2 mg/mL)依次加入2 mL尿素-SDS溶液(含8.0 mol/L尿素,30 g/L SDS,0.1 mol/L磷酸钠缓冲液,pH8.0)和0.5 mL 10 mmol/L DTNB溶液(溶解于0.1 mol/L磷酸钠缓冲液,pH 8.0),空白组不含DTNB,室温下反应15 min后,412 nm处测定吸光度,以摩尔吸光系数11400 mol/(L·cm)计算巯基含量(nmol/mg)。
1.2.11 MP表面疏水性的测定 参考王琳琳等[21]的方法,向1.0 mL蛋白溶液(5.0 mg/mL)中加入200 μL 1.0 mg/mL溴酚蓝溶液,混匀离心(6000 r/min,15 min),取上清液进行10倍稀释,以无蛋白的磷酸盐溶液为空白对照,在595 nm波长处测定吸光度,以溴酚蓝结合量来表示表面疏水性指数(μg)。
1.2.12 硫代巴比酸值(TBARS)的测定 参考Huang等[16]的方法,取0.3 g肉样,加入3 mL 1% TBA溶液和17 mL TCA-HCl溶液均质,90 ℃水浴40 min,冷却后加入5 mL氯仿,离心(4 ℃, 3000 r/min, 5 min),取上清液在532 nm下测定吸光值,结果表示为每千克肉样中丙二醛(MDA)的毫克数。摩尔消光系数为152000 mol/(L·cm)。
1.3 数据处理
所有指标重复测定3次,结果以平均值±标准差表示;原始数据统计采用Excel 2019,采用SPSS 24.0进行平均值、标准差、ANOVA方差分析;处理组平均数之间采用Duncan多重比较进行显著性分析,显著水平为P˂0.05;采用Pearson相关性分析对指标相关性分析;所有图由Origin 2019b 绘制。
2 结果与分析
2.1 超高压处理对牦牛肉感官品质的影响
感官评价是最简便直接的评价肉制品的方法。由图1可知,经超高压处理的牦牛肉,在不同贮藏时间感官品质有所变化。经超高压处理后牦牛肉的感官评分随着压力增大而减小;色泽随着压力增大由深红变为粉红(200~400 MPa),当压力较高时(600 MPa),牦牛肉色泽变为棕褐色,与前人的研究结果吻合[7−8]。400 MPa组牦牛肉在贮藏8 d后感官品质相较其他组更佳,这说明适当的加压处理能改善肉品品质,但具体原因需要进一步确定。与对照组相比,当压力为200和400 MPa时,牦牛肉虽保留了良好的色泽和组织状态,但12 d后微生物的过度生长,脂质过氧化分解并产生异常气味[22]降低了可接受度。当压力为600 MPa时,牦牛肉在第0 d时就出现明显劣变,如组织结构松散,这可能是高压使蛋白碎片化导致[23]。
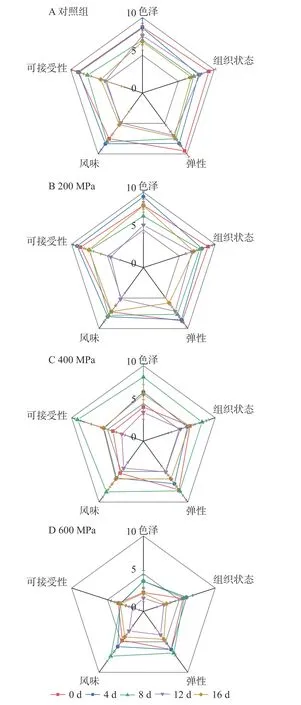
图1 超高压处理对贮藏过程中牦牛肉感官品质的影响Fig.1 Effects of HHP on the sensory quality of yak meat during storage
2.2 超高压处理对牦牛肉pH的影响
pH是影响色泽、持水力、嫩度和微生物生长等的主要因素[24]。由图2可知,与对照组相比,随着压力的增大,牦牛肉pH显著上升(P˂0.05)。这是由于超高压处理使蛋白结构发生变化,酸性基团被包埋,同时自由氨基酸进入细胞使含氮物质增加,氨基酸在压力作用下电解,导致pH升高[25]。
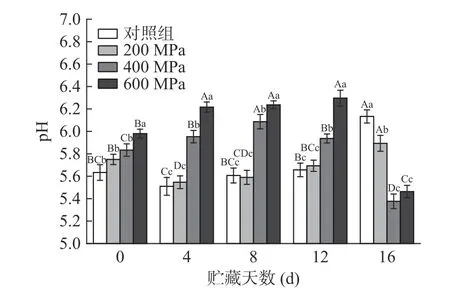
图2 超高压处理对贮藏过程中牦牛肉pH的影响Fig.2 Effects of HHP on pH of yak meat during storage
在贮藏前期,对照组和200 MPa组牦牛肉的pH略有下降,这可能是排酸不彻底,乳酸积累所致。随着贮藏时间的延长,对照组和200 MPa组pH显著增大(P˂0.05)。这是因为微生物在肉表面积聚、活动加快,产生氨、胺等碱性物质,同时在酶的作用下蛋白质分解,pH升高[24]。400 MPa组与600 MPa组牦牛肉的pH随时间增加先上升后下降。贮藏前期pH上升可能是由于蛋白质变性与脂质氧化加剧[26],而16 d时400 MPa组和600 MPa组的pH剧烈下降可能是由于细菌在受到损伤后逐渐恢复活性,生长繁殖分泌了有机酸、酮等腐败物质[27−28]。
2.3 超高压处理对牦牛肉新鲜度的影响
TVB-N和菌落总数常用于评判肉制品新鲜程度[29]。由图3A和图3B可知,超高压处理降低了牦牛肉的TVB-N含量和菌落总数,与Chen等[30]和Soladoye等[31]的描述相吻合。随着贮藏时间的延长,牦牛肉的菌落总数和TVB-N含量均显著增大(P<0.05)。这是由于微生物生长导致蛋白降解产生胺类物质,菌落总数增加,TVB-N含量升高[29]。贮藏16 d时,对照组TVB-N含量达15.68 mg/100 g,超过15.0 mg/100 g,而各处理组牦牛肉TVB-N含量均低于15 mg/100 g。同时,对照组和200 MPa组12 d时菌落总数远高于6 lg(CFU/g),分别达7.57、7.16 lg(CFU/g),而400 MPa组12 d时菌落总数达5.92 lg(CFU/g),600 MPa组16 d时菌落总数达5.83 lg(CFU/g),说明较高压力下杀菌效果更佳。综上,超高压处理能有效提高牦牛肉新鲜度、延长其保质期。
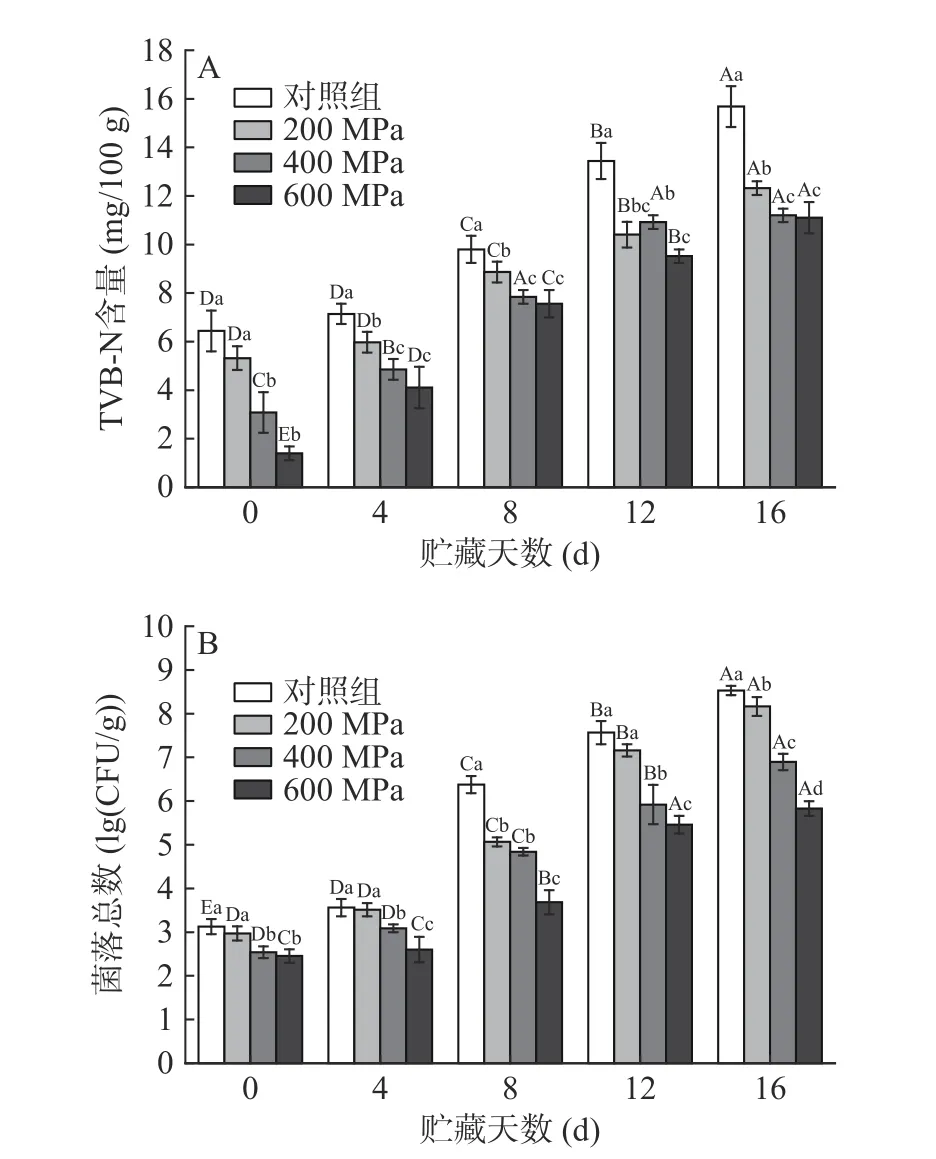
图3 超高压处理对贮藏过程中牦牛肉新鲜度的影响Fig.3 Effects of HHP on freshness of yak meat during storage
2.4 超高压处理对牦牛肉色泽的影响
色泽直接影响了消费者的购买意愿。由图4可知,随着压力增大,牦牛肉L*、b*值增大,当压力过高(600 MPa)时,a*值减小;贮藏过程中各组L*、b*值变化逐渐趋于稳定,a*值逐渐减小。0 d时,较高压力下(400 MPa和600 MPa),牦牛肉L*、b*值显著增大(P˂0.05),并在整个贮藏期内都维持在较高的水平(见图4A、图4C),这与Bak等[32]的研究结果相似。这可能是超高压处理使纤维结构疏松和表面性质变化,导致肉表面光学反射率改变[7]。贮藏0 d时,随着压力升高,牦牛肉a*值升高后显著降低(P˂0.05)(见图4B)。该结果与Kruk等[33]的报道相似。这或许与MMb含量变化有关,中等压力(200~400 MPa)下减少MMb的酶系统可能被激活,而较高压力(600 MPa)下酶系统和MMb的形成受到干扰[34]。贮藏8 d时,200 MPa组牦牛肉a*值显著下降(P˂0.05)。研究表明MMb的积累是a*值下降的主要原因[35];同时脂质氧化与肌红蛋白氧化之间相互促进,使肉表面a*值降低、色泽褐变[36]。
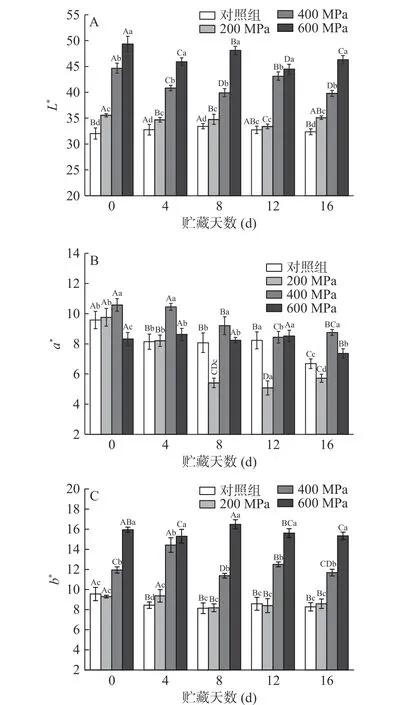
图4 超高压处理对贮藏过程中牦牛肉色泽的影响Fig.4 Effects of HHP on the color of yak meat during storage
2.5 超高压处理对牦牛肉Mb氧化的影响
色泽的变化与肌肉中水分的状态、Mb的氧化状态等有关,压力对Mb影响显著[7]。由图5可知,与对照组相比,处理组DMb含量减少,OMb、MMb含量增多,说明超高压促进Mb氧化。贮藏过程对照组DMb含量减少、OMb含量先减少后增多、MMb含量增多后减少。200 MPa组和对照组的变化趋势相似,贮藏4 d时MMb含量明显增多,而后显著降低(P˂0.05)。这或许是因为:线粒体耗氧及真空条件形成了厌氧环境,同时线粒体与OMb的相互作用使氧气转移,促进了DMb的形成、MMb的减少[37];MMb可能进一步氧化形成铁酰肌红蛋白而质子化,与蛋白质形成血红素-蛋白交联物质[35]。经超高压处理后,400 MPa组OMb含量增多,600 MPa组MMb含量增多,且两者在贮藏期内均维持在较高水平。这可能与还原酶系统的激活和破坏、蛋白与脂质氧化对Mb的氧化诱导、蛋白变性等因素有关[7]。综上,超高压显著促进了Mb的氧化,400 MPa组肉色稳定性良好。
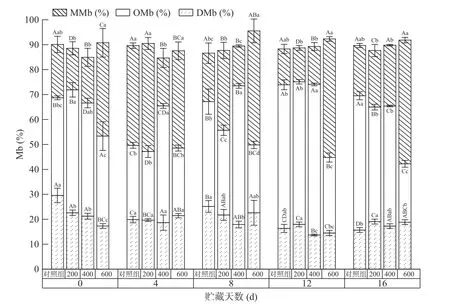
图5 超高压处理对贮藏过程中牦牛肉Mb氧化状态的影响Fig.5 Effects of HHP on the Mb oxidation state of yak meat during storage
2.6 超高压处理对牦牛肉MP氧化的影响
2.6.1 羰基含量变化 羰基是评估蛋白氧化的相关标志物,蛋白氧化程度越高,羰基含量越高[38]。由图6A可知,0 d时,与对照组相比,处理组羰基含量显著增多(P˂0.05),即超高压处理促进了蛋白质氧化。在处理组内,羰基含量随着压力升高而降低(P<0.05),可能是更高的压力使蛋白系统缩至更小的摩尔体积,形成较大的不溶性蛋白聚集体,影响了蛋白结构[7]。贮藏4 d时各组羰基含量相比0 d时显著增加(P<0.05),可能与Mb和脂质的氧化诱导有关[7,37,39]。对照组羰基含量增量比处理组小,可能是由于抗氧化蛋白的存在[40];处理组羰基含量增量随着压力增大而减小,可能与蛋白结构的变性程度有关[7]。8~12 d内各组羰基含量随时间延长而下降,可能原因有:贮藏过程中蛋白质被降解[41];或蛋白羰基进一步氧化,形成Strecker醛等[39]。在贮藏16 d时,各组羰基含量显著增大(P˂0.05),可能是随时间延长蛋白羰基化严重导致羰基含量再次增加。整个贮藏期内羰基含量的变化与Zhang等[42]辐照处理新鲜猪肉时的结果相似,说明超高压处理对羰基化合物的形成与降解影响显著。
2.6.2 总巯基含量变化 在MP表面及内部含有大量巯基,容易氧化形成二硫键,使巯基含量下降,因此巯基含量的变化也反映了蛋白氧化情况[39]。由图6B可知,相比对照组,处理组总巯基含量减少,即超高压促进了蛋白氧化。0 d时,200 MPa压力下活性巯基被加速氧化使总巯基含量显著减少(P<0.05);400 MPa组总巯基含量与对照组无显著差异(P>0.05),而600MPa组总巯基含量显著减少(P˂0.05),可能是蛋白内部的巯基在适当压力下暴露,而过高压力下巯基基团在蛋白重折叠过程中被包裹[43]。Nicolas等[44]也报道了约400 MPa的压力下兔的MP活性巯基含量有所增加。随着贮藏时间的延长,总巯基含量显著减少(P<0.05),这可能是由于蛋白质氧化使结构展开,巯基基团暴露被氧化[45]。
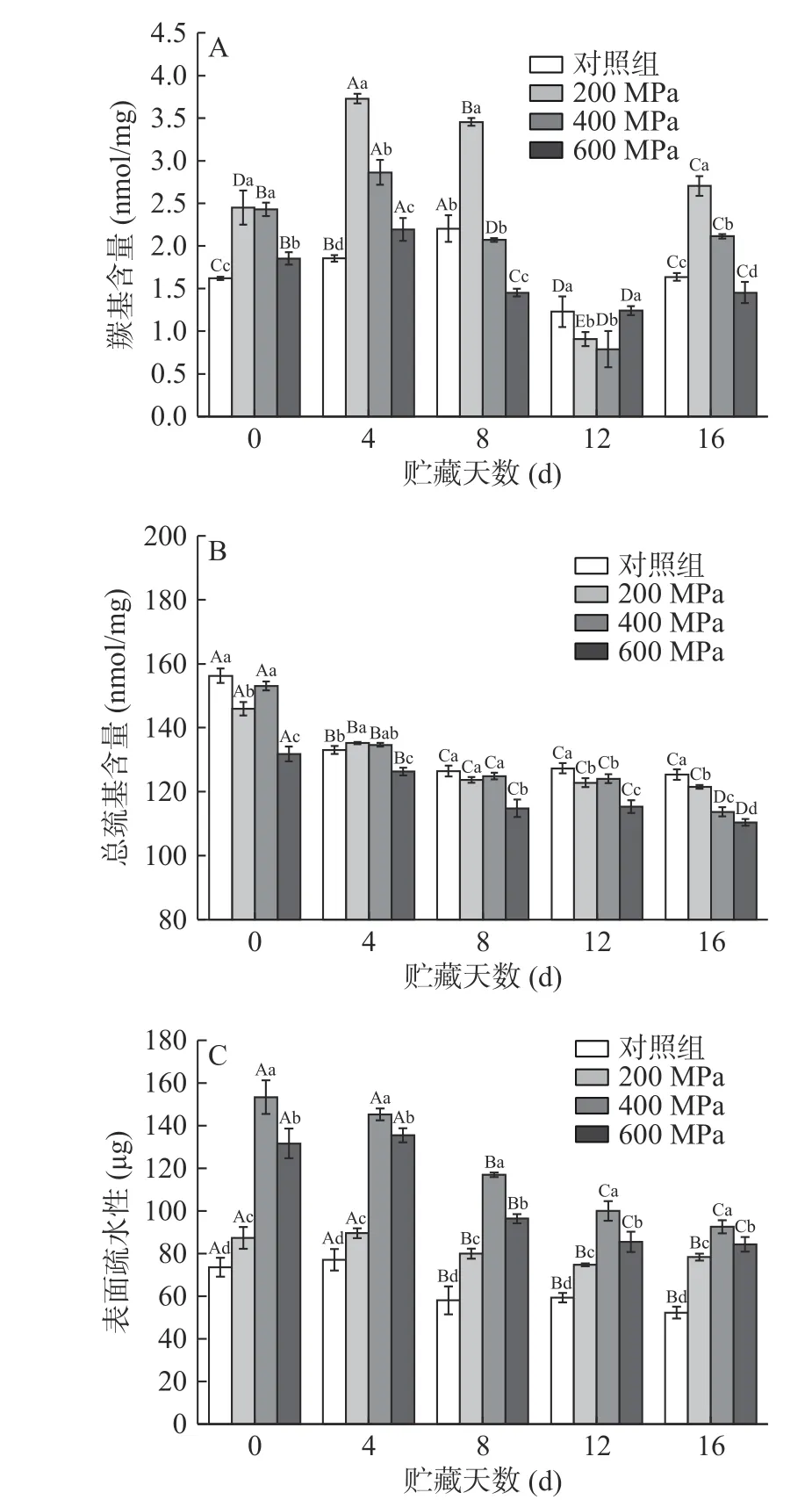
图6 超高压处理对贮藏过程中牦牛肉蛋白氧化的影响Fig.6 Effects of HHP on protein oxidation of yak meat during storage
2.6.3 表面疏水性变化 表面疏水性的变化反映了蛋白质三级结构的变化[46]。由图6C可知,相比对照组,处理组表面疏水性升高,可能是由于超高压处理使非极性氨基酸暴露[45]。在处理组内,随着压力的升高,表面疏水性升高后降低。研究表明,当压力超过400 MPa时,表面疏水性开始下降[46]。200~400 MPa内,表面疏水性随着压力升高而升高,与Zhang等[4]的结果吻合。600 MPa组表面疏水性显著降低(P<0.05)。这可能是高压力下疏水区域的暴露促进了疏水相互作用,使未折叠的蛋白重新结合或聚集[47]。贮藏过程中,表面疏水性显著下降(P˂0.05),可能是蛋白结构过度变性所致[45]。
2.6.4 超高压处理对牦牛肉MP氧化的影响 MP是肌肉蛋白中的主要成分,多项研究表明当压力超过一定阈值后,MP的物理化学特性会受到影响[46,48]。由2.6.1~2.6.3结果可知,当压力≥400 MPa时,超高压会显著促进牦牛肉MP的氧化,主要表现为羰基含量的增多、巯基含量的减少与表面疏水性的升高。
2.7 超高压处理对牦牛肉TBARS值的影响
TBARS值广泛用于衡量肉制品的脂质氧化程度[10]。由图7可知,与对照组相比,处理组牦牛肉TBABS值显著增大(P<0.05)。400 MPa组TBARS值最大,说明400 MPa极大地促进了脂质氧化的发生,这与多项研究结果相符[10]。600 MPa组TBARS值较400 MPa组小。Orlien等[49]发现TBARS的形成与压力高度相关,600、700 MPa压力下反而抑制了氧化的发生。在贮藏过程中,贮藏4 d时TBARS值显著减小后维持在较低水平(P<0.05),这与以往研究结果有些不同,脂质氧化是一个动态过程,氧化产物不断产生和降解,醛类可与蛋白质的亲核基团反应形成Schiff碱或Michael加成化合物等[35]。Şayin Sert等[50]将牛肉糜经加压后贮藏过程中TBARS值的降低归因于真空包装后的低氧、肉中抗氧化肽释放产生作用和丙二醛高度氧化降解成醇和酸。关于其具体原因需要进一步研究确认。
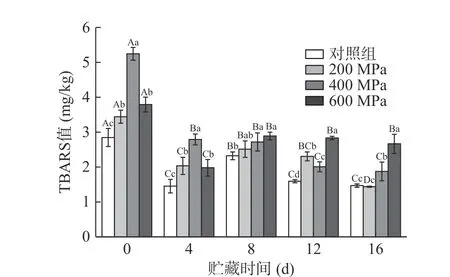
图7 超高压处理对贮藏过程中牦牛肉TBARS值的影响Fig.7 Effects of HHP on TBARS values of yak meat during storage
2.8 各指标间相关性分析
Pearson相关性分析结果见图8。由图8A可知,0 d时,随着压力的增大,牦牛肉的L*值与b*值强正相关(r=0.93,P<0.05),且均与pH、MMb含量、表面疏水性、TBARS值正相关,与DMb含量、巯基含量、菌落总数、TVB-N含量负相关;而a*值与OMb含量、羰基含量、巯基含量正相关,与MMb含量负相关(P<0.05)。说明色泽与蛋白质和脂质氧化、微生物情况相关。其中OMb与羰基含量正相关(r=0.80,P<0.05),MMb与巯基含量负相关(r=−0.72,P<0.05),表面疏水性与TBARS值强正相关(r=0.90,P<0.05),菌落总数、TVB-N含量均与DMb、表面疏水性、TBARS值相关(P<0.05)。说明压力可能导致蛋白质结构变化和微生物数量的减少,引起脂质和蛋白质氧化,使pH升高、色泽改变。
由图8B可知,贮藏16 d后牦牛肉a*值与肌红蛋白氧化状态无显著相关性(P>0.05),而OMb含量与L*值、b*值的负相关性加强(r=−0.91、−0.89,P<0.05),与TBARS值出现负相关性(r=−0.84,P<0.05)。羰基与其他指标间相关性不再显著(P>0.05)。TBARS值不再与表面疏水性相关(P>0.05),而与巯基出现负相关性(r=−0.82,P<0.05),同时与菌落总数的负相关性增强(r由−0.64增长为−0.91)。说明经贮藏后色泽的变化可能主要是脂质氧化引起的。0与16 d牦牛肉各指标的相关性异同说明:牦牛肉品质变化仍与蛋白质和脂质氧化、微生物情况相关,超高压处理可能影响了其变化机制。
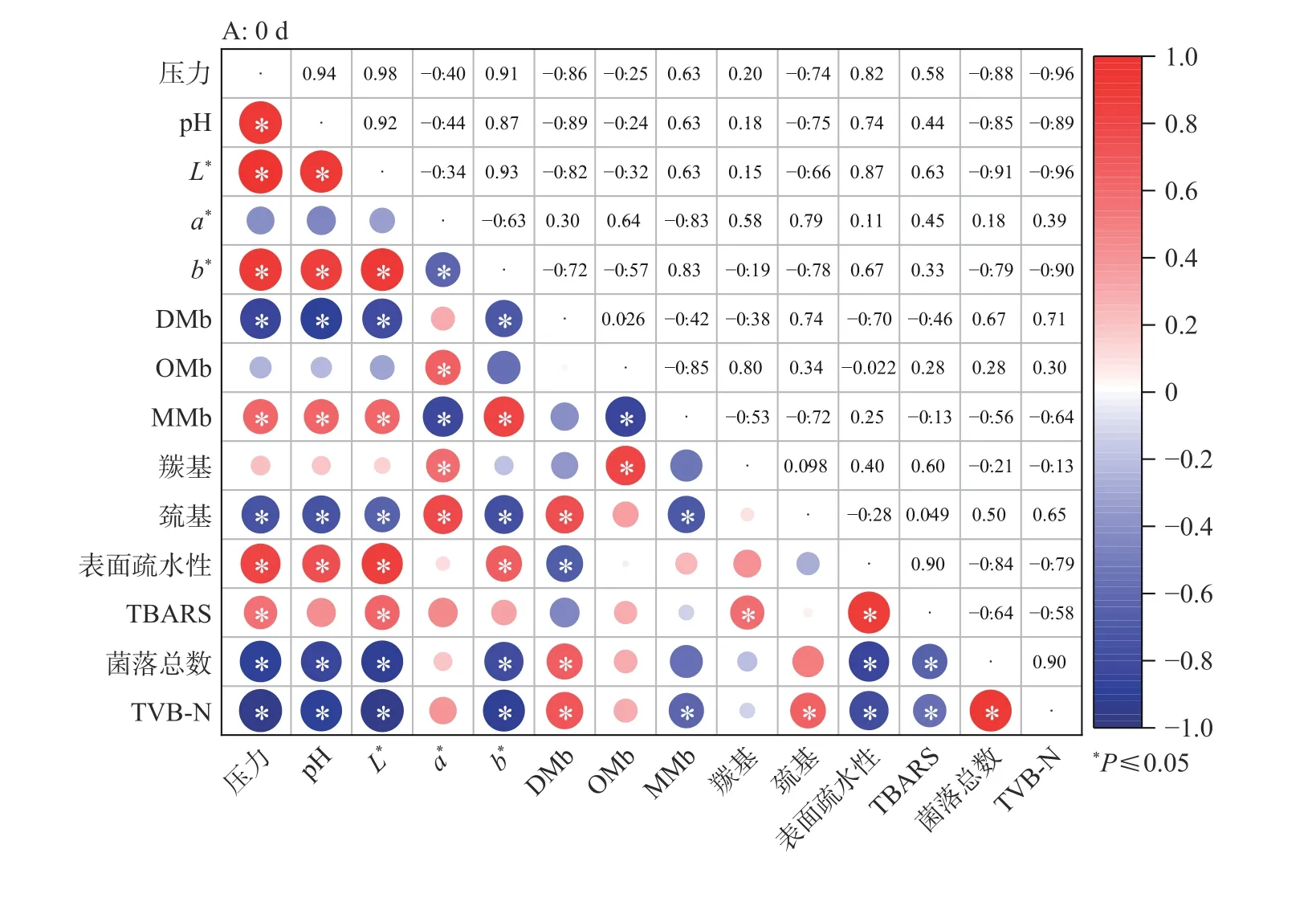
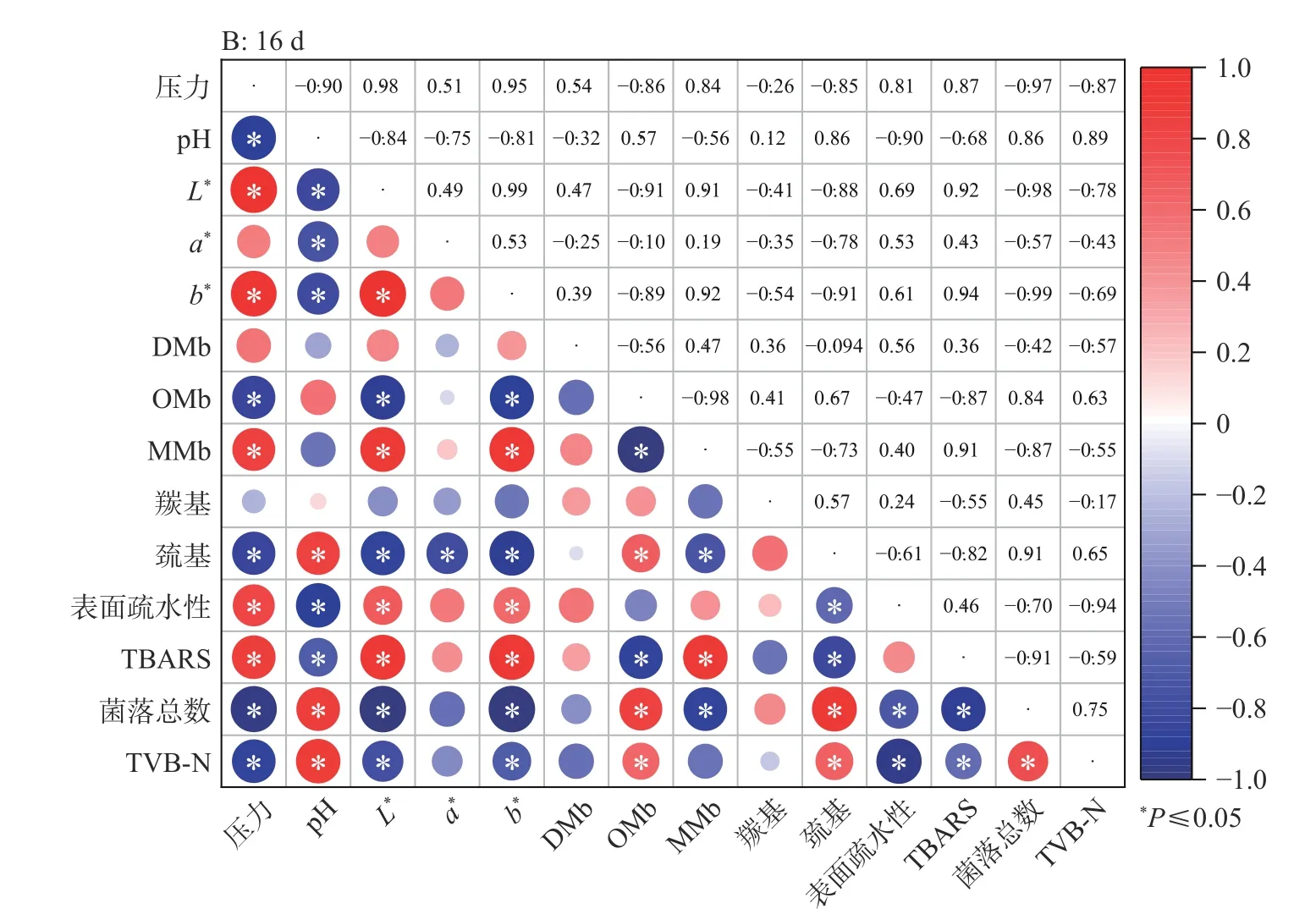
图8 各指标间Pearson相关性分析Fig.8 Pearson correlation analysis among indicators
3 结论
超高压处理显著延长了牦牛肉的保质期,主要表现为TVB-N含量和菌落总数的降低,但超高压处理也降低了感官品质,导致肉色劣变。进一步分析发现,超高压处理导致加速了脂质和蛋白质氧化,主要表现为OMb和MMb含量的增多、MP羰基含量、表面疏水性的上升和总巯基含量的减少、TBARS值的增大。其中,适当的氧化有利于牦牛肉的品质,牦牛肉贮藏4~8 d后超高压处理组保持更好的品质,且400 MPa下牦牛肉的肉色稳定性更佳。Pearson相关性结果表示经超高压处理后牦牛肉品质变化与压力显著相关,且色泽的变化与蛋白氧化、脂质氧化、微生物之间存在关联。
由于高寒低氧的生存环境,牦牛肉肌红蛋白含量高、肉色好。研究表明肉及肉制品色泽与压力、蛋白质和脂质氧化有关,关于微生物的作用却少有提及。因此,关于超高压处理后牦牛肉中在贮藏过程中的肌红蛋白自氧化、蛋白质氧化、脂质氧化、微生物与肉色的关系需要深入研究,以期为牦牛肉的保鲜与加工提供可靠参考意见。
