地参发酵酒的工艺优化及品质分析
2023-03-12江春阳邓乔晟
王 丹,江春阳,邓乔晟,杨 勤 ,周 浓,
(1.重庆三峡学院生物与食品工程学院,三峡库区道地药材绿色种植与深加工重庆市工程实验室,重庆 404120;2.重庆三峡医药高等专科学校,重庆 404120)
地参(Lycopus lucidus)又名虫草参,银条菜,地蚕子,是唇形科地笋属多年生草本植物,其形状、营养与人参相似[1]。在《中华本草》资料中记载了地参可作为蔬菜食用,其晒干之后还可以入药,功能与冬虫夏草相当[2]。药理研究表明[3],地参中含有大量的多酚类和多糖类,具有降血糖、抗氧化、抗肿瘤等疗效作用。地参可作为蔬菜食用,其保健功能丰富,享有“蔬菜珍品”、“山中之王”等美誉[4]。
目前国内外对地参药理研究主要集中在地参多糖、多酚等成分的提取研究[5−7],现有的对地参的工艺研究包括地参酸奶[8]、地参酸辣发酵羊蹄[9]、地参枸杞汁[10]等休闲食品,没有关于用鲜地参进行发酵酒的研究报道。针对目前市场上的地参加工成品,加工方法略微粗放,工业化程度较低,其产品质量稳定难以控制[11]。地参作为药食兼用的植物,营养成分丰富,保健功能明显,有着很大的开发利用价值,且地参含有大量的糖类物质,可作为酿造保健型发酵酒的良好原材料。因此,有必要对地参开展深加工技术,开发利用地参中的其它活性成分,提升地参产品附加值。
本研究以新鲜地参为原料,通过单因素和响应面试验来确定地参发酵酒的发酵工艺条件,并对其体外抗氧化活性和酚酸类物质进行分析,旨在酿造出一款口感佳、营养丰富、具有地参典型风味的地参发酵酒,为地参的深加工提供理论依据。
1 材料与方法
1.1 材料与仪器
鲜地参 重庆市万州区恒合乡石桶寨村种植地;酿酒酵母(Saccharomyces cerevisiae)DY9 自筛选地参发酵酒专用酵母菌;酵母浸出粉葡萄糖培养基(YPD液体培养基) 青岛高科技工业园海博生物技术有限公司;DPPH(2,2-联苯基-1-苦基肼基)、ABTS西亚化学科技(山东)有限公司;没食子酸、芦丁北京索莱宝科技有限公司;丹参素、对羟基苯甲酸、咖啡酸 成都曼思特生物科技有限公司;原儿茶酸上海源叶生物科技有限公司;白砂糖 重庆野山珍商贸有限公司;甲醇(色谱纯) 德国默克公司;氢氧化钠、过硫酸钾、苯酚、硫酸等试剂 成都市科隆化工试剂厂,均为分析纯。
ACQUITY UPLC H-Class 超高效液相色谱仪美国Waters公司;L18-Y915S型高速破壁调理机九阳股份有限公司;PHS-3C型精密酸度计 杭州齐威仪器有限公司;酒精计 衡水创纪仪器表有限公司;FA1004型电子天平 上海舜宇恒平科学仪器有限公司;YRE-2000A型旋转蒸发仪 巩义市予华仪器有限公司;V-1200型紫外可见分光光度计 上海美谱达仪器有限公司;HSY-26型水浴锅、HDPN-Ⅱ-256型电热恒温培养箱 上海跃进医疗器械有限公司。
1.2 实验方法
1.2.1 地参发酵酒的工艺流程和操作要点 地参发酵酒的工艺流程如图1所示,操作要点如下:
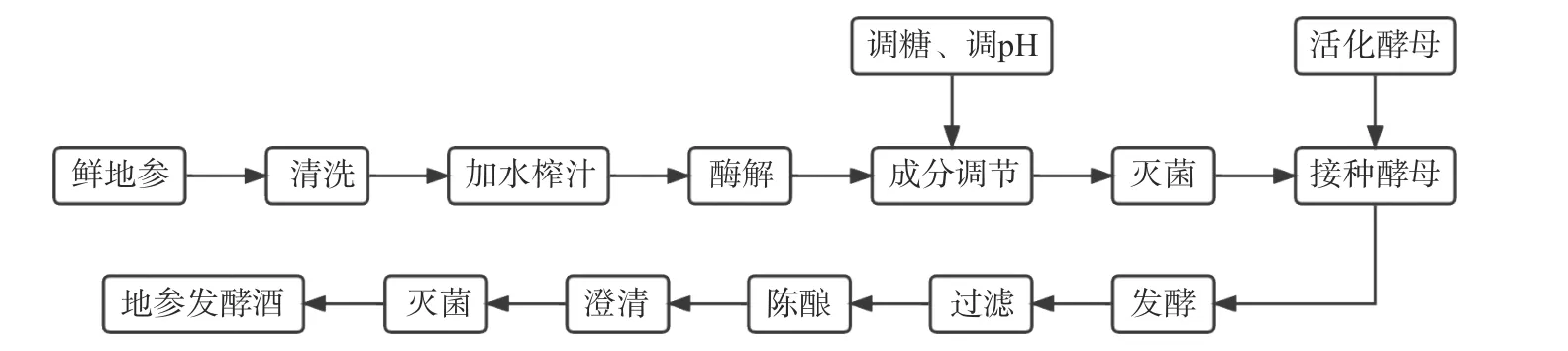
图1 工艺流程图Fig.1 Process flow chart
地参汁制备:挑选新鲜无病害的地参清洗,备用。新鲜地参按一定的料液比(1:2)榨汁,按地参汁总质量的0.1%添加果胶酶,40 ℃酶解2 h;添加焦亚硫酸钾(80 mg/L),用白砂糖调节糖度,用柠檬酸将pH调至酵母菌最适生长值4~4.5;
酵母活化:取自筛的酿酒酵母DY9,划线于YPD固体培养基上,28 ℃培养48 h,挑取单个菌落接种于YPD液体培养基中,于28 ℃的摇床振荡培养20 h,将1 mL菌液接入100 mL YPD液体培养基中,连续扩增。
发酵:将调整好成分的地参汁放入发酵瓶(500 mL)中,在水浴70 ℃下杀菌30 min,冷却至室温,接入活化好的酵母,使用硅胶塞单向阀盖好发酵瓶,按试验设计的发酵时间、温度进行发酵,发酵结束后,用4层纱布过滤去除发酵残渣,得到的酒液放置14~18 ℃下低温陈酿2个月。
灭菌:采用巴氏灭菌法,将澄清处理后的地参发酵酒置70 ℃热水中20 min。
1.2.2 单因素实验设计
1.2.2.1 酵母接种量 设不同酵母接种量为2.0%、3.0%、4.0%、5.0%、6.0%,发酵温度24 ℃,初始糖度22%,发酵时间9 d,发酵结束后测定发酵酒的酒精度和残糖含量,研究不同酵母接种量对发酵酒品质(酒精度和残糖量)的影响。
1.2.2.2 发酵温度 设不同发酵温度为19、22、25、28、31 ℃,酵母接种量5%,初始糖度22%,发酵时间9 d,发酵结束后测定发酵酒的酒精度和残糖含量,研究不同发酵温度对发酵酒的品质影响。
1.2.2.3 初始糖度 设不同初始糖度为18%、20%、22%、24%、26%,酵母接种量5%,发酵温度24 ℃,发酵时间9 d,发酵结束后测定发酵酒的酒精度和残糖含量,研究不同初始糖度对发酵酒的品质影响。
1.2.2.4 发酵时间 设不同发酵时间为3、5、7、9、11 d,发酵温度24 ℃,初始糖度22%,酵母接种量5%,发酵结束后测定发酵酒的酒精度和残糖含量,研究不同发酵时间对发酵酒的品质影响。
1.2.3 响应面试验设计 在单因素实验的基础上,选择发酵温度(A)、酵母接种量(B)和初始糖度(C)三个影响因素,以感官评分、酒精度为响应值,采用Box-Behnken中心组合设计原理设计响应面试验[12−14],试验因素及水平编码见表1。

表1 响应面试验因素水平表Table 1 Factors and levels for response surface experiment
1.2.4 理化指标测定 按照GB/T 15038-2006《葡萄酒、果酒通用分析方法》中酒精计法进行酒精度的测定[15];总酸(以柠檬酸计):按照GB/T 12456-2021《食品中总酸的测定》中的pH计电位滴定法测定[16];残糖量的测定:采用3,5-二硝基水杨酸(DNS)比色法[17];总酚含量的测定:采用Folin-Ciocaltue法[18],以没食子酸为对照品,标准曲线为y=1.5482x+0.4538,R2=0.9995;黄酮含量测定采用NaNO2-Al(NO3)3方法[19],以芦丁为标准品,标准曲线为y=10.541x−0.027,R2=0.9998;多糖含量的测定采用硫酸-苯酚比色法[20],以葡萄糖为标准品,标准曲线为y=0.121x−0.0005,R2=0.9989。
1.2.5 感官评价 随机选择10名食品专业人员,从地参发酵酒的外观、滋味、香气、典型性4个指标进行评定,满分100分,感官评分结果取平均值。感官品评表见表2。

表2 地参发酵酒感官评分标准Table 2 Standard of sensory evaluation for Lycopus lucidus fermented wine
1.2.6 地参发酵酒抗氧化能力的测定 将酒样稀释10倍后,吸取1.0 mL样品于刻度试管中进行实验。DPPH自由基清除能力的测定:参考苏龙等[21]的测定方法稍作修改;ABTS+自由基清除能力的测定:参考Miriam等[22]的方法稍作修改;对羟自由基清除能力的测定:参考万景瑞等[23]的方法稍作修改;以上方法均以0.1 mg/mL的VC为阳性对照,计算公式为:
式中:A1为样品溶液吸光度;A2为本底吸光度;A0为空白溶液吸光度。
1.2.7 地参发酵酒酚酸类物质的测定 对照品溶液的制备:分别精密称取没食子酸、对羟基苯甲酸、咖啡酸、丹参素、原儿茶酸对照品适量,置于10 mL棕色容量瓶中,加80%甲醇溶解并定容至刻度线,得到浓度分别为0.709、1.2、1.426、0.204、0.448 mg/mL的对照品贮备液,于4 ℃冰箱保存,备用。
样品溶液的制备:参考朱霞建等[24]的方法并稍作修改。取地参发酵酒20 mL,用1 mol/L NaOH 调节pH为7左右,加入20 mL乙酸乙酯反复萃取3次,合并上清液,40 ℃ 旋转蒸发浓缩至干,用甲醇复溶并定容至2 mL,过0.22 μm有机滤膜上机测定。
色谱条件:参考唐柯等[25]的方法并稍作修改。以ACQUITY UPLC BEH C18(2.1 mm×150 mm,1.7 μm)为色谱柱;以0.1%磷酸为流动相A,甲醇为流动相B,梯度洗脱(0~4 min,10%~20% B;4~9 min,20%~40% B;9~10 min,40%~10% B;10~12 min,10% B);流速0.3 mL/min;柱温35 ℃;检测波长280 nm;进样体积1 μL。
1.3 数据处理
全部试验重复3次,数据处理及分析采用Excel 2010。响应面试验设计及结果分析采用Design-Expert 8.0.6.1软件,用Origin 2021绘图软件绘制试验结果图。
2 结果与分析
2.1 单因素实验结果
2.1.1 酵母接种量对地参发酵酒的影响 不同酵母接种量对地参发酵酒精度及残糖量的影响结果见图2。由图2可知,随着酵母接种量的增加,酒精度出现先升高后降低的现象,当酵母接种量为5%时,酒精度出现了最大值,残糖含量最低。当酵母量超过5%时,酒精度降低的同时残糖量也略微增高,可能是因为酵母接种量过多,酵母生长代谢旺盛,会消耗发酵液中大量营养物质,影响了微生物的发酵导致酒精产量低[26]。当酵母接种量少时,发酵的速度慢,容易产生杂菌,从而影响发酵酒的口感[27]。经发酵酒精度及残糖含量综合考虑,选择酵母接种量为4%、5%、6%进行响应面试验。
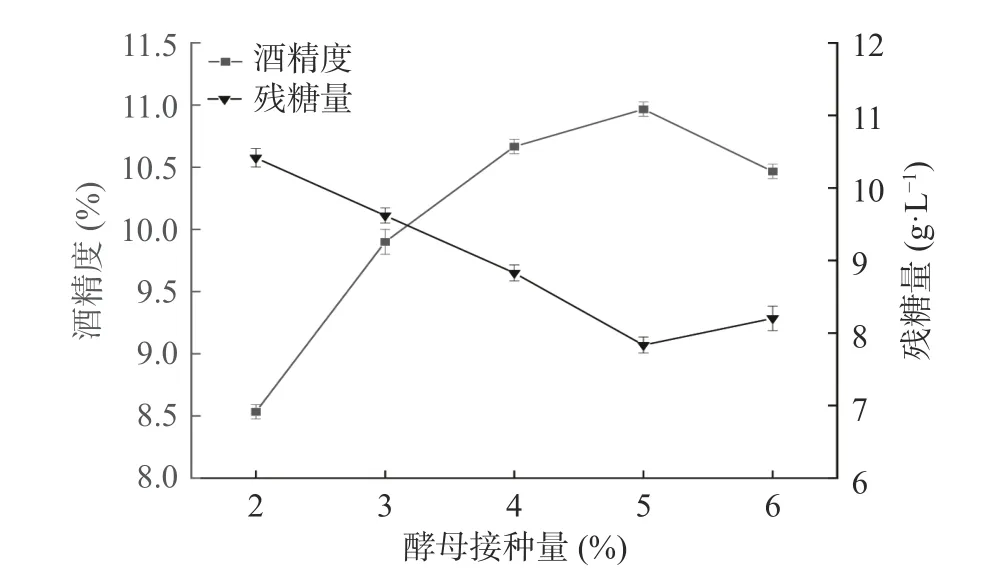
图2 酵母接种量对地参发酵酒酒精度和残糖量的影响Fig.2 Effects of yeast inoculation on the alcohol content and residual sugar of L. lucidus fermented wine
2.1.2 发酵温度对地参发酵酒的影响 不同发酵温度对地参发酵酒精度及残糖量的影响结果见图3。由图3可知,在19~25 ℃温度范围内时,随着温度的增加酒精度也升高。温度为25 ℃时酒精度达到了最大值,残糖含量最低。当温度在超过25 ℃时,发酵生成的酒精度呈下降趋势,残糖含量逐渐增多,发酵温度过高,酵母菌繁殖速度加快,容易使菌体提前衰老,不利于糖转化为酒精,温度高发酵物中风味物质易挥发,影响发酵酒的口感。经发酵酒精度及残糖含量综合考虑,选择发酵温度为22、25、28 ℃进行响应面试验。
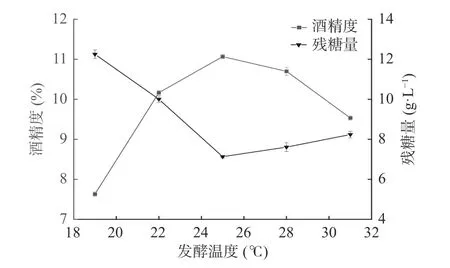
图3 发酵温度对地参发酵酒酒精度和残糖量的影响Fig.3 Effects of fermented temperature on the alcohol content and residual sugar of L. lucidus fermented wine
2.1.3 初始糖度对地参发酵酒的影响 不同初始糖度对地参发酵酒精度及残糖量的影响结果见图4。在发酵的过程中酵母菌利用糖进行生长繁殖,并将糖转化为酒精。由图4可知,随着初始糖度的增加,酒精度呈现出先升高后降低的情况,残糖含量在逐渐的增加。初始糖度太低,生成的酒精度低,酒的口感寡淡。初始糖度含量过多会增加发酵液的渗透压,酵母菌代谢活动会受到抑制,多余的糖未能转化为酒精导致酒精度降低,发酵酒中的剩余糖量过多,从而影响了发酵酒的口感[28]。当初始糖度为22%时,发酵酒的酒精度、残糖含量适中。因此,经发酵酒精度及残糖含量综合考虑,选择初始糖度为20%、22%、24%进行响应面试验。
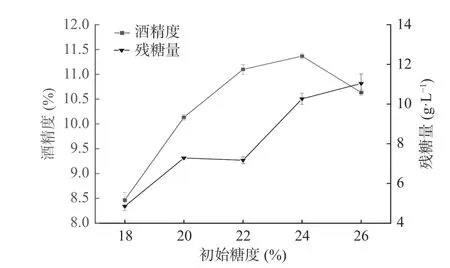
图4 初始糖度对地参发酵酒酒精度和残糖量的影响Fig.4 Effects of initial sugar content on alcohol content and residual sugar of L. lucidus fermented wine
2.1.4 发酵时间对地参发酵酒的影响 发酵时间过短或过长都会对酒的品质造成影响。由图5可知,当发酵时间为3 d时,酒精度最低,残糖量最高;在发酵时间3~9 d的范围内时,酒精度随着时间的延长而增加,这个阶段残糖量下降迅速。发酵时间为9 d时,酒精度的增长最快,酒精度达到了最大值,在9~11 d时酒精度基本不再生长,残糖量下降缓慢。发酵后期,发酵液中剩余的营养成分较少,酵母的生长受到了抑制,部分酵母衰老[29]。经发酵酒精度及残糖量综合考虑,加上时间的成本选择时间9 d为最佳发酵时间。
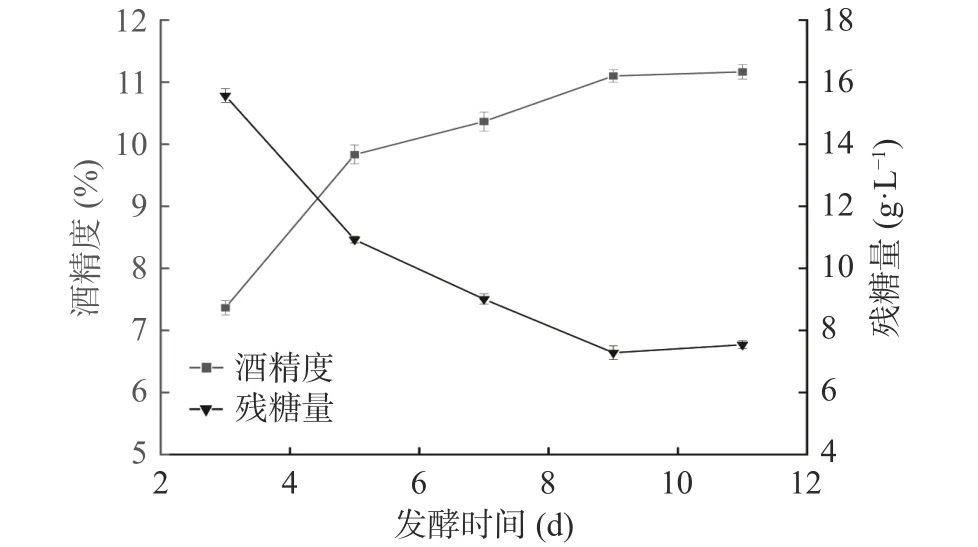
图5 发酵时间对地参发酵酒酒精度和残糖量的影响Fig.5 Effects of fermented time on the alcohol content and residual sugar of L. lucidus fermented wine
2.2 响应面试验
2.2.1 响应面试验结果 根据单因素实验结果,以发酵温度(A)、酵母接种量(B)和初始糖度(C)为自变量,分别以酒精度(Y1)和感官评分(Y2)为因变量进行Box-Benhken响应面优化设计试验,试验结果见表3。
利用Design Expert 8.0.6.1软件对表3数据进行二次回归方程拟合,分别得到酒精度(Y1)和感官评分(Y2)对发酵温度(A)、酵母接种量(B)和初始糖度(C)的二次多项回归方程:
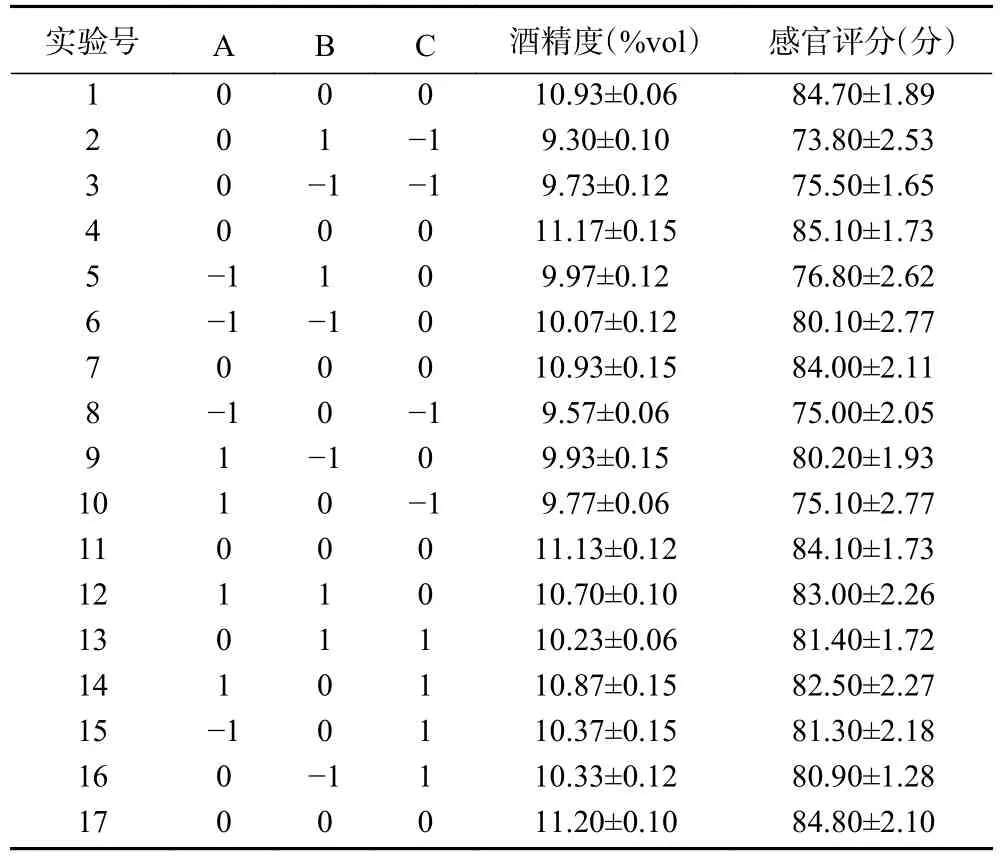
表3 地参发酵酒工艺优化响应面试验设计及结果Table 3 Experimental design and results of optimized response surface of Lycopus lucidus fermentation wine process
方差分析结果显示,所得回归模型极显著(P<0.01),失拟项不显著(P>0.05),证明所得模型能充分拟合试验数据,能够较好的预测试验值,详见表4。由P值结果得出3种因素对地参发酵酒酒精度影响的强弱顺序依次为:初始糖度>发酵温度>酵母接种量。一次项C对酒精度的影响极显著(P<0.01),A、B对酒精度影响不显著;交互项AB、AC、BC对酒精度影响均不显著;二次项A2对酒精度影响显著(P<0.05),B2、C2对酒精度影响极显著(P<0.01);3种因素对地参发酵酒感官评分影响的强弱顺序依次为:初始糖度>发酵温度>酵母接种量。一次项C对感官评分的影响极显著(P<0.01),A对感官评分的影响显著(P<0.05),B对酒精度影响不显著;交互项AB对感官评分的影响极显著(P<0.01),AC、BC对感官评分影响均不显著;二次项A2、B2、C2对感官评分影响极显著(P<0.01)。
2.2.2 响应面结果分析 响应面是响应值受各影响因子影响程度的三维曲面图,能很好地反映不同影响因子间的相互作用强弱,且响应面图曲面坡度越陡峭、等高线越密集成椭圆形表示两因素交互影响越大[30]。
利用Design Expert 8.0.6.1软件对影响地参发酵酒酒精度和感官评分的3个因素进行交互分析,交互作用的大小由响应面的的陡峭程度来体现。由图6可知,图6A的陡峭度和等高线的密集程度都高于图6B和图6C,证明了AB的相互作用对酒精度的影响要高于AC和BC交互作用的影响,这与表4中AB的P值小于AC和BC的P值相吻合。由图6D~图6F可知,A与B的响应面坡度最陡峭,其等高线呈椭圆,说明AB的交互作用对感官评分的影响较显著,而AC和BC的陡峭程度都不如AB,其高等线密集程度也弱于AB,这与表4中AB的P值小于AC和BC的结论相吻合。
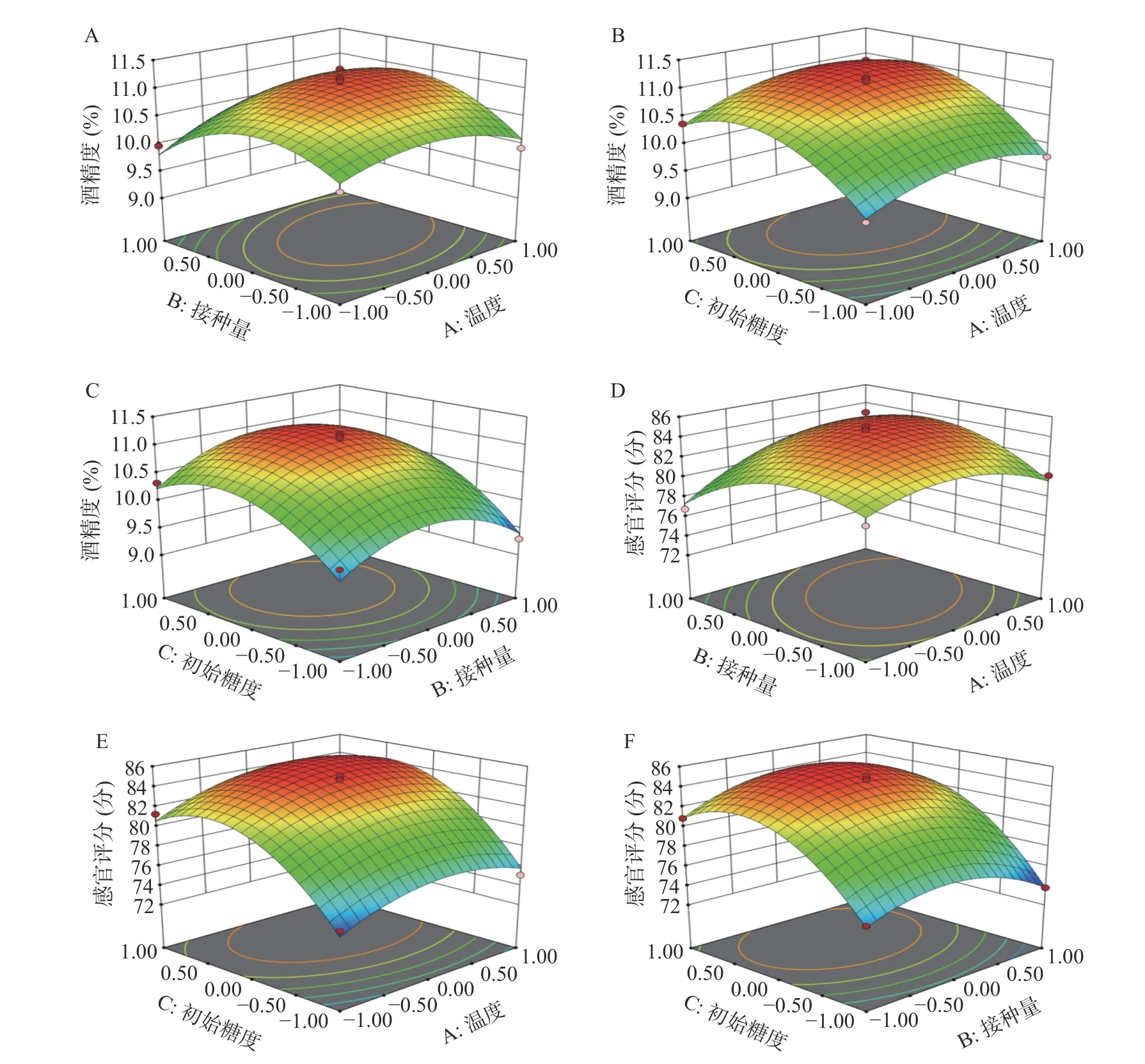
图6 各因素交互作用对酒精度和感官评分影响的响应面图Fig.6 Response surface view of the effect of factor interaction on alcohol content and sensory score
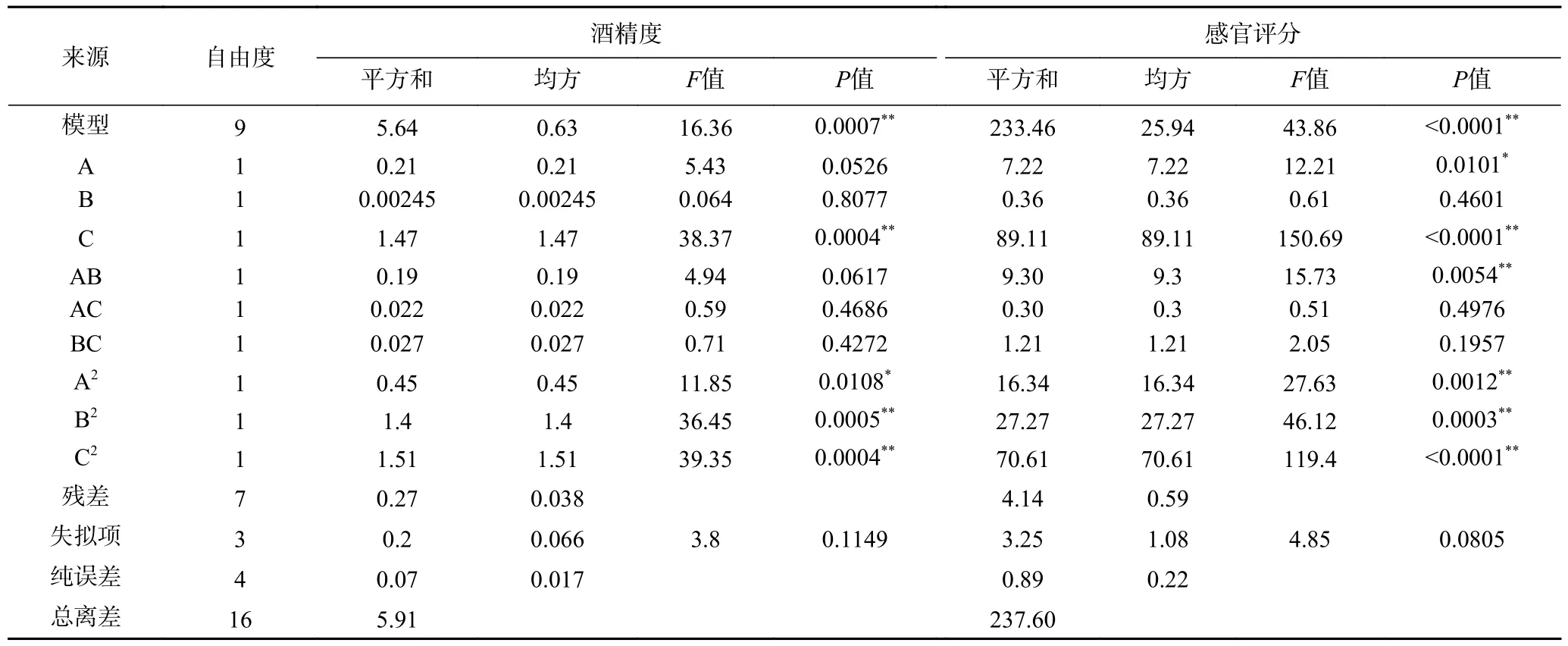
表4 响应面试验方差分析Table 4 Variance analysis of response surface methodology
2.2.3 最佳发酵工艺与验证 通过单因素实验得出最佳发酵时间为9 d,利用Design-Expert 8.0.6.1软件对响应面试验进行结果分析,确定地参发酵酒的最佳发酵工艺条件为发酵温度25.99 ℃,接种量为5.1%,初始糖度为22.78%,此条件下由公式算出的理论酒精度为11.18%vol,理论感官评分为85.38分。根据实际情况,验证试验的条件为发酵温度26 ℃,接种量为5.1%,初始糖度为22.8%,在此条件下,进行3次重复试验,得到地参发酵酒的酒精度为11.23%vol,感官评分为85.50分,测定结果与预测值偏差不大。因此,响应面优化地参发酵酒工艺参数是可靠的。
2.3 地参发酵酒品质评价
2.3.1 地参发酵酒理化指标分析 由响应面优化出的工艺参数发酵,所得到的地参发酵酒体色泽呈橘黄色,澄清透明,酒体醇厚丰满,具有独特的地参酒风味。理化指标,地参发酵酒多糖含量为6.54±0.08 g/L、总酚为384.31±0.12 mg/L、总酸和总黄酮为别为20.67±0.15 g/L和204.59±0.21 mg/L。
2.3.2 体外抗氧化活化 研究发现,地参发酵酒中含有丰富总黄酮、总酚物质,这两种物质有很好的抗氧化能力,能有效地清除体内自由基延缓衰老[31−32]。由图7可知,地参发酵酒对DPPH、·OH、ABTS+都有较强的清除作用,与VC的清除能力相比较,其DPPH自由基清除能力低于VC,·OH、ABTS+自由基清除能力高于VC。
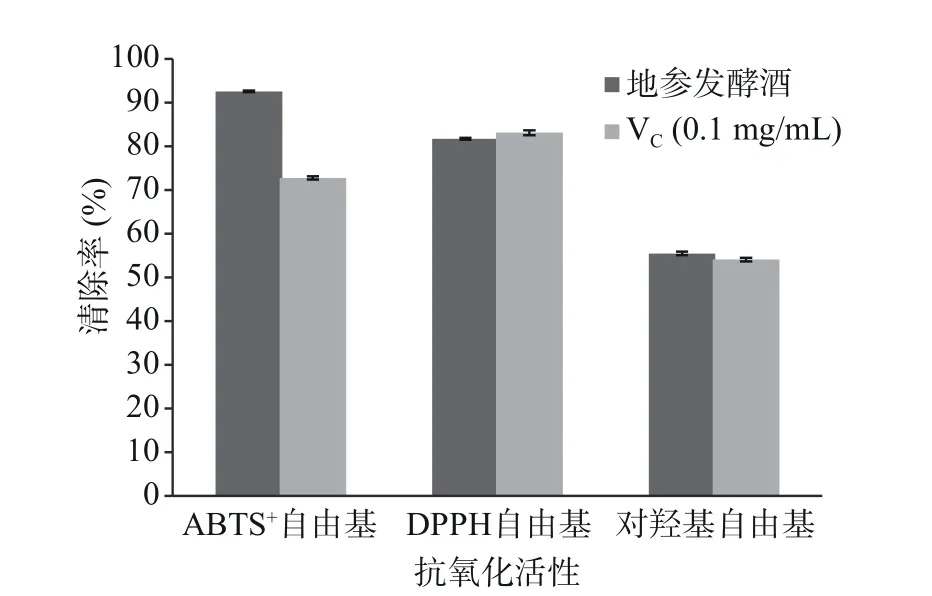
图7 地参发酵酒抗氧化活性Fig.7 Antioxidant activity of Lycopus lucidus fermented wine
2.3.3 酚酸类物质含量分析 在响应面试验得到的条件下,测定了地参发酵酒中酚酸物质含量,含量检测结果见表5,液相色谱图见图8。酚酸类物质具有良好的营养功能和抗氧化等药理活性,发酵酒中就含有大量的酚酸类物质[33]。由表5可知,从地参发酵酒中检测到了5种酚酸物质,其中没食子酸的含量最高(11.20 mg/L),占酚酸总量的33.2%,赵宁等[34]研究发现除“徐香”清汁发酵酒外其他5种猕猴桃酒中没食子酸含量最高,其次是咖啡酸,对羟基苯甲酸的含量最低(3.40 mg/L),本研究结果与其类似。没食子酸作为地参发酵酒中的主要酚酸类物质,具有抗炎、抗氧化、抗突变及抗肿瘤等多种生物活性[35]。本研究所得地参发酵酒中酚酸类物质种类较为丰富,具有一定的保健作用。
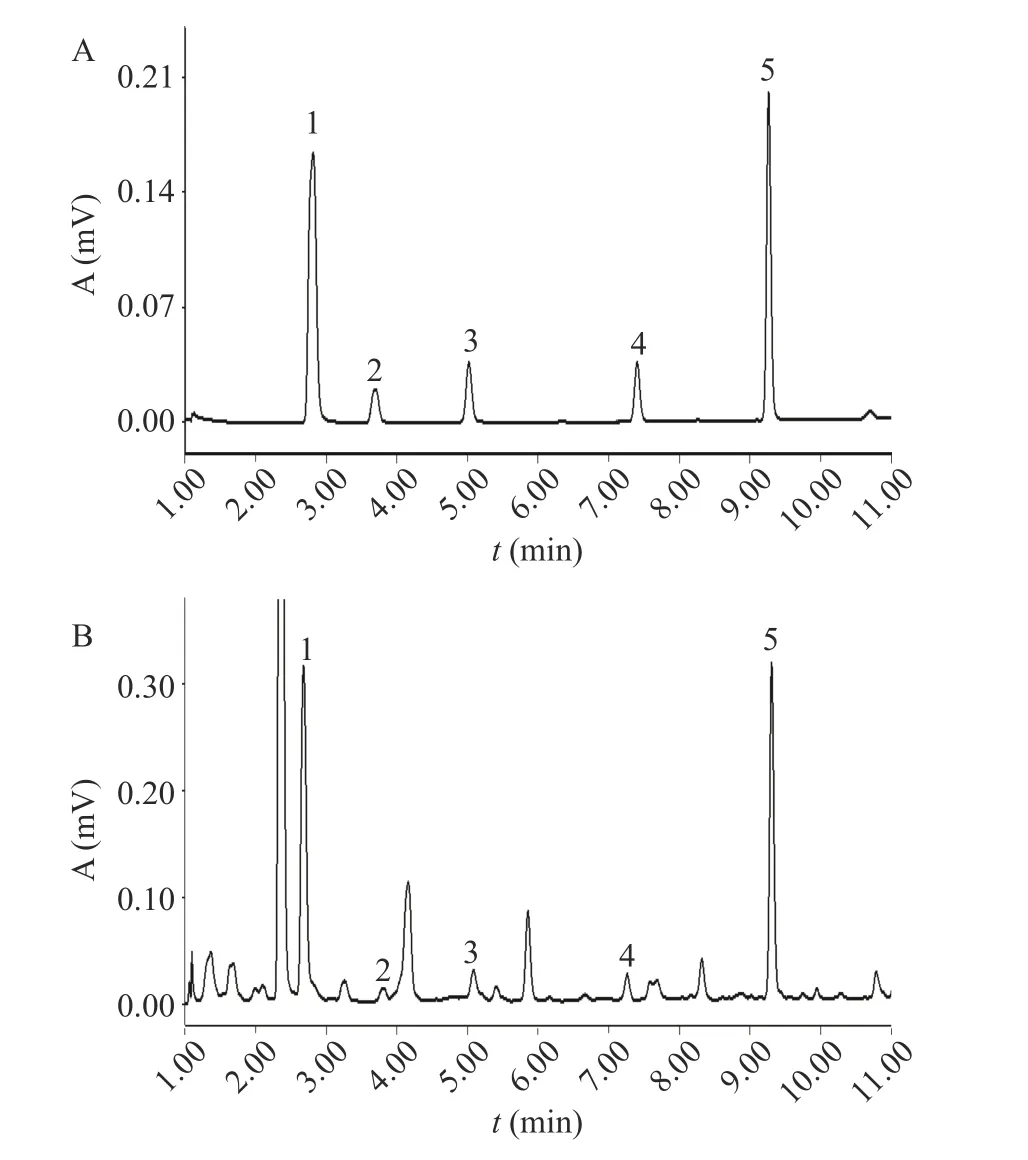
图8 混合对照品(A)及样品(B)的UPLC图谱Fig.8 UPLC spectra of mixed reference substance (A) and sample (B)
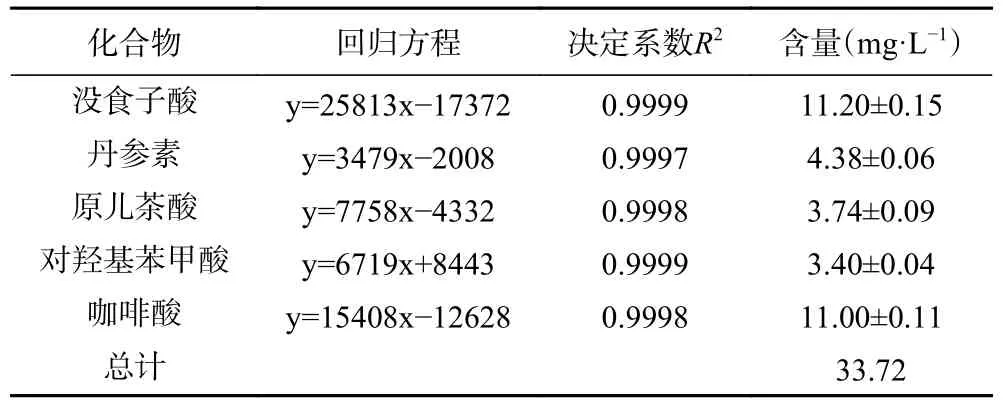
表5 地参发酵酒5种酚酸类物质含量Table 5 Contents of five phenolic acids in Lycopus lucidus fermented wine
3 讨论与结论
地参发酵酒的最佳工艺条件为发酵温度26 ℃,接种量5.1%,初始糖度22.8%,发酵时间9 d,在此条件下得到的地参发酵酒感官评分为85.50分,酒精度为11.23%vol,酿造得到的酒体醇厚丰满或酒体爽口,颜色为橘黄色,澄清透明,具独特的地参酒风味,酒香纯正优雅。地参发酵酒含有丰富的活性物质,多糖、总酚、总酸和总黄酮含量分别为6.54 g/L、384.31 mg/L、20.67 g/L和204.59 mg/L。单体酚酸类物质没食子酸为11.20 mg/L、丹参素为4.38 mg/L、原儿茶酸为3.74 mg/L、对羟基苯甲酸为3.40 mg/L,咖啡酸为11.00 mg/L。地参本身就具有丰富的营养价值和开发价值,本研究所得地参发酵酒酒色泽呈橘黄色,澄清透明,酒体醇厚丰满,不仅具有独特的地参酒风味,同时较好的保留了地参发酵酒多酚等活性成分,并且还具有一定的抗氧化活性。因此,开发地参酒可为今后地参的深加工提供新的思路,同时也增加了地参加工产业的经济效益。
