多组学分析众麦1号和糯麦116两种制曲小麦的特征
2023-03-09张原頔陈小雪史利霞韩北忠
张原頔,陈小雪,吴 鹏,史利霞,韩北忠
(1.中国农业大学 食品科学与营养工程学院 食品质量与安全北京实验室,北京 100083;2.中国农业大学 营养与健康系,北京 100083;3.河南顺鑫大众种业有限公司,河南 郑州 450003)
小麦是白酒固态酿造糖化发酵剂—高温和中温大曲的主要原料,富含淀粉、蛋白质和多种维生素,为发酵微生物产酶和代谢提供营养基质和发酵微环境[1]。微生物可以利用小麦中的淀粉和蛋白质等组分产生风味物质[2],因此,不同理化特性尤其是营养组分含量不同的小麦影响大曲的品质。以小麦为原料的制曲过程对小麦籽粒的营养组分含量均有一定的要求,如需要较高的淀粉含量,蛋白质含量在12%左右,含有适量的无机盐、纤维素等[3]。不同的淀粉含量对制曲过程中的水分、酸度、淀粉、糖化力、液化力、发酵力和主要微生物类群均可以产生一定的影响[4]。
小麦源微生物是影响小麦制曲的另一重要因素,DU H等[5]研究发现,制曲原料是大曲菌群的重要来源之一,不同原料显著影响微生物的代谢物谱;LIU C C等[6]研究发现,原料中的糖谱能调节发酵过程中产风味菌群的演替进而影响风味代谢物的产生;ZHANG Y D等[7]研究发现,小麦源微生物参与高温大曲培菌初期菌群的组装并影响初期代谢物的形成。因此,关注制曲原料源微生物有助于理解原料的选择对大曲品质的影响作用。
本研究通过理化检测、高通量测序、顶空固相微萃取-气相色谱-质谱联用(headspace solid phase microextractiongas chromatography-mass spectrometry,HS-SPME-GC-MS)和气相色谱-离子迁移谱联用(gaschromatography-ionmobility spectroscopy,GC-IMS)技术比较了两种制曲小麦(ZW1和N116)的理化性质、微生物组成和风味轮廓的差异,为优选制曲原料提供理论支撑。
1 材料与方法
1.1 材料与试剂
1.1.1 样品
小麦样品:小麦样品采集于河南某种业公司,所采集的两个品种小麦分别是众麦1号(ZW1)和糯麦116(N116),两种小麦均在粮食仓库存放,在不同位置分别取3份装于无菌袋,-80 ℃保存。
1.1.2 主要试剂
土壤基因组试剂盒:美国Omega Bio-Tek公司;ExTaq脱氧核糖核酸(deoxyribonucleic acid,DNA)聚合酶:美国英杰生命技术有限公司。其他试剂均为国产分析纯。
1.2 仪器与设备
NR10QC色差仪:深圳市三思时科技有限翁司;BSA2202S电子天平:赛多利斯科学仪器(北京)有限公司;KDN-08凯氏定氮仪:上海新嘉电子有限公司;UV-1200型紫外可见分光光度计:上海美普达仪器有限公司;S-433D氨基酸分析仪:德国Sykam公司;FlavourSpec风味分析仪:德国GAS公司;7000-3气质联用仪、HP-5ms色谱柱(30 m×250 μm×0.25 μm):美国安捷伦公司。
1.3 方法
1.3.1 理化指标的检测
色度值:两个品种的小麦经人工去杂,剔除病害、杂粒和不饱满粒后,称取30 g籽粒,用色差计测量颜色参数。色差计先用白板校正,将种子倒满测量平皿,用直尺沿平皿表面刮平后进行测量,获得L*值、a*值、b*值,L*值越大,颜色越亮(白);a*值越大,颜色越偏红色;b*值越大,颜色越偏黄色。
淀粉含量测定:参考国标GB 5009.9—2016《食品中淀粉的测定》;支链淀粉含量测定:参考国标GB/T 15683—2008《大米直链淀粉含量的测定》;蛋白质含量测定:参考国标GB 5009.5—2016《食品中蛋白质的测定》;脂肪含量测定:参考国标GB 5009.6—2016《食品中脂肪的测定》;单宁含量测定:参考国标GB/T 15686—2008《高粱单宁含量的测定》。
1.3.2 高通量测序
小麦粉碎后,采用OMEGA Soil DNA Kit提取微生物基因组,DNA质检合格后,以其为模板对细菌的16S rDNA V5-V7区基因序列及真菌的ITS区基因序列进行聚合酶链式反应(polymerase chain reaction,PCR)扩增,细菌的PCR扩增引物为799F(5'-AACMGGATTAGATACCCKG-3')和1193R(5'-ACGTCATCCCCACCTTCC-3'),真菌的PCR扩增引物为ITS5F(5'-GGAAGTAAAAGTCGTAACAAGG-3')和ITS1R(5'-GCTGCGTTCTTCATCGATGC-3')。PCR扩增体系(25 μL):5×reaction buffer 5 μL,5×GC buffer 5 μL,脱氧核糖核苷三磷酸(deoxy-ribonucleoside triphosphate,dNTP)(2.5 mmol/L)2 μL,上下游引物(10 μmmol/L)各1 μL,DNA模板2μL,双蒸水(ddH2O)8.75μL,Q5DNAPolymerase 0.25μL。其余条件参照ZHANG Y D等[7]的方法。采用1%琼脂糖凝胶电泳对PCR扩增产物进行检测,将检验合格的PCR扩增产物送至上海派森诺生物技术有限公司进行高通量测序。
1.3.3 生信分析
采用Illumina平台对DNA片段进行双端测序,使用DADA2方法对序列进行去引物,质量过滤,去噪,拼接和去嵌合体,合并扩增子序列变异体(amplicon sequence variants,ASVs)特征序列和ASV表格,并去除singletons ASVs,基于相应功能基因的seeds蛋白序列,对核酸序列中的插入和缺失错误进行纠正。小麦源细菌16S rRNA基因在Greengenes数据库进行对比注释,真菌通过Unite 8数据库对比注释。使用QIIME2(2019.4)软件对微生物进行物种组成分析,以树图的形式绘制微生物分类等级树。使用PICRUSt 2软件预测样本功能丰度[8]。
1.3.4 风味物质检测
不同品种小麦的风味物质通过顶空固相微萃取-气相色谱-质谱联用(HS-SPME-GC-MS)结合气相色谱-离子迁移谱联用(GC-IMS)技术检测分析。
HS-SPME-GC-MS检测:称取小麦粉4.0 g,加入16.0 mL超纯水,超声30 min,8 000×g离心10 min,取上清8 mL,加入3.0 g氯化钠。具体分析条件参考胡雨楠等[9]的方法。利用Agilent Masshunter Qualitative Analysis 10依据美国国家标准技术研究所(national institute of standards and technology,NIST)14标准谱库对挥发性风味物质进行定性分析。利用SIMCA 14.0 软件对GC-MS结果进行正交偏最小二乘法判别分析(orthogonal partial least-squares discriminate analysis,OPLS-DA)筛选差异代谢物,并通过Prism 8和R-Studio v 4.1.1进行数据处理和可视化分析。
GC-IMS检测:称取小麦粉水提液2.0 mL,置于20 mL顶空瓶中,80 ℃孵育20 min后进样分析。分析条件:分析时间20 min,MXT-5色谱柱(15 m×0.53 mm×1.0 μm),柱温60 ℃,载气为氮气(N2),IMS温度45 ℃,进样体积500 μL,孵育时间20min,孵育温度80℃,进样针温度85℃,孵化转速500r/min,流速起始为2 mL/min,10 min后流速升至10 mL/min[10]。使用VOCal查看分析谱图和数据的定性定量,通过软件内置的NIST数据库和IMS数据库对物质进行定性分析;使用Reporter插件对比样品之间的谱图差异;使用Gallery Plot插件进行指纹图谱对比,比较不同样品之间的挥发性有机物差异。
1.3.5 数据处理
理化检测结果通过Prism 8进行t检验,计算样品间的差异显著性(P<0.05),数据可视化主要通过R studio v4.1.1完成。
2 结果与分析
2.1 不同品种小麦籽粒表皮的色度值
两个品种小麦籽粒表皮的颜色参数见图1。由图1可知,两个品种的小麦籽粒表皮颜色存在显著差异,ZW1小麦籽粒表皮的L*值显著高于N116小麦(P<0.05),说明ZW1小麦籽粒表皮颜色更亮;N116小麦籽粒表皮的a*值显著高于ZW1小麦,表明N116小麦籽粒表皮颜色更偏红;两种小麦籽粒表皮的b*值无显著差异(P>0.05)。结果表明,小麦外观特征可作为区分不同品种小麦的方法,通过大量数据采集进行色度值的区分有助于快速准确地鉴别小麦品种,对大曲生产过程中制曲原料的选择有辅助作用。
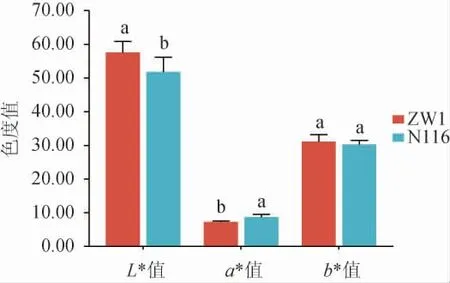
图1 不同品种小麦籽粒表皮的色度值Fig.1 Color values of grain epidermis of different wheat varieties
2.2 不同品种小麦的营养组分含量
两种小麦的营养组分见图2。由图2可知,N116小麦的平均蛋白质含量(15.16 g/100 g)和脂肪含量(1.61 g/100 g)均显著高于ZW1(11.79 g/100 g,1.41 g/100 g)(P<0.05),两种小麦总淀粉含量无显著性差异(P>0.05)。最值得注意的是,ZW1小麦中直链淀粉的含量(22.78 g/100 g)显著高于N116小麦(0.53 g/100 g)(P<0.05),说明两种小麦的淀粉种类存在巨大差异,ZW1小麦的淀粉中直链淀粉较高,而N116小麦中的淀粉几乎全部是支链淀粉。直链淀粉和支链淀粉都是淀粉中的多聚糖成分,前者的D-葡萄糖基主要以直链状结构α-(1,4)糖苷键连接而成,后者在分支位点主要以支链状结构α-(1,6)糖苷键连接而成[11]。梅怀文等[12]研究发现,在青稞酒的酿造过程中,直链淀粉在发酵过程中从占比15%左右降至0,而支链淀粉从60%左右降至12%左右。李秋涛等[13]比较了不同直、支链淀粉含量的大米、高粱的糊化情况和蒸煮香气,并进行了实验室和窖池发酵试验,结果表明,同种粮食直链淀粉含量越高,淀粉结构越紧密,糊化时间越长,粮香越浓;不同种类的粮食淀粉颗粒大小、结构不同,糊化时间也不同。杨佳等[14]将糯小麦以不同比例添加到普通小麦用于制曲,结果发现,糯小麦对大曲品质有积极影响,并认为这是由于糯小麦支链淀粉比例高,更容易吸收水分子,糊化起始温度低,糊化更充分,有利于微生物的繁殖和代谢产酶。从酒的香气角度讲,生产淡雅型酒用支链淀粉高的粮食原料较好,生产浓郁型酒用直链淀粉高的粮食原料较好。以上分析说明,制曲小麦淀粉中直链淀粉和支链淀粉的比例不同会对大曲培菌的过程产生一定影响,淀粉种类对微生物代谢的具体作用还需进一步研究。
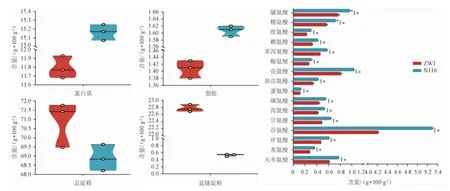
图2 不同品种小麦的营养组分含量Fig.2 Contents of nutrient components in different wheat varieties
此外,两种小麦水解氨基酸的含量也存在差异,在所有测得的16种氨基酸中,N116小麦的含量均高于ZW1小麦,这与N116小麦中蛋白质的含量显著高于ZW1小麦有直接关联。其中,谷氨酸、亮氨酸、脯氨酸和天冬氨酸的含量差异最为明显。侯阳阳等[15]在酿酒酵母(Saccharomyces cerevisiae)发酵模拟葡萄汁进入稳定期时分别补加了不同氨基酸,分析了酿酒酵母生长、发酵速率以及最终乙醇、有机酸和高级醇含量的变化,结果表明,丙氨酸和缬氨酸能显著增加酿酒酵母的生物量并提高发酵速率,提高最终乙醇和异丁醇含量,而高浓度的半胱氨酸和赖氨酸抑制酿酒酵母生长和发酵速率,显著增加了有机酸含量。张双梅等[16]在桑葚果汁中分别添加异亮氨酸、亮氨酸、苯丙氨酸和缬氨酸制备桑葚酒,探究外源添加氨基酸对桑葚酒风味和品质的影响,结果表明,外源添加单一氨基酸可显著提高桑葚酒的挥发性风味物质含量和口感评分。氨基酸是酵母可同化氮的主要来源之一,可被酵母吸收并用于生长和产生代谢产物,如产生高级醇及酯类物质,在酵母生长稳定期添加精氨酸,可促进酯类物质的生成[17]。不同种类的氨基酸经微生物代谢后可产生不同代谢物而影响发酵食品的风味和品质,如支链氨基酸(缬氨酸、亮氨酸、异亮氨酸)与苯丙氨酸可显著提高葡萄酒中相应高级醇及其乙酸酯的含量[18]。
总之,不同品种制曲小麦营养组分的差异可能对制曲过程中微生物的演替产生一定影响,微生物以此为底物进一步代谢产生不同的风味,最终造成大曲的品质差异。
2.3 不同品种小麦的微生物组成分析
由图3a可知,在细菌门水平,两种小麦源微生物相对丰度最高的细菌门均为变形菌门(Proteobacteria),相对丰度均>80%,其次为放线菌门(Actinobacteria)和厚壁菌门(Firmicutes),此外,拟杆菌门(Bacteroidetes)在N116小麦中的相对丰度(4.60%)明显高于ZW1小麦(0.39%)。在细菌科水平,两种小麦的微生物菌群组成有较大差异,ZW1小麦中相对丰度最高的细菌科为肠杆菌科(Enterobacteriaceae)(38.92%),其次为盐单胞菌科(Halomonadaceae)(11.85%)、草酸杆菌科(Oxalobacteraceae)(9.09%)和假单胞菌科(Pseudomonadaceae)(4.35%)。N116小麦中相对丰度最高的细菌科为盐单胞菌科(Halomonadaceae),相对丰度>40%,其次为肠杆菌科(Enterobacteriaceae)(20.61%)和草酸杆菌科(Oxalobacteraceae)(4.92%),此外,紫单胞菌科(Porphyromonadaceae)、普雷沃菌科(Prevotellaceae)、韦荣氏菌科(Veillonellaceae)和消化链球菌科(Peptostreptococcaceae)的相对丰度均在N116小麦中>1%,且未在ZW1小麦中检出。由图3b可知,两种小麦源真菌组成相似且单一,在真菌门水平上,子囊菌门(Ascomycota)相对丰度占绝对优势。在真菌科水平上,格孢腔菌科(Pleosporaceae)占据绝对优势,相对丰度>98%。KANG J M等[19]研究发现,部分肠杆菌科(Enterobacteriaceae)是馥郁香型白酒在冬季的固态糖化发酵过程中最重要的细菌;PANG X N等[20]通过研究清香型白酒原料预处理过程菌群的组成和功能发现,肠杆菌科(Enterobacteriaceae)的相对丰度与2-乙基-3,5-二甲基-吡嗪含量呈强正相关。草酸杆菌科(Oxalobacteraceae)通常在作物的根际被检出,因此不同种植区域的小麦携带的微生物可能存在差异,通过种植区的选择可以对制曲小麦的品质进行控制[21];ZOU W等[22]提出,部分紫单胞菌科(Por phyromonadaceae)与浓香型白酒的发酵存在密切关系,是窖泥、黄水中的优势微生物,这说明N116小麦中的紫单胞菌科(Porphyromonadaceae)可能参与制曲培菌过程中甚至白酒发酵过程中的微生物演替,而ZW1小麦中却未检出;SU C等[23]通过对小曲酒发酵剂的菌群研究发现,普雷沃菌科(Prevotellaceae)与十六烷酸甲酯、乙醛、3-辛酮和乙偶姻具有很强的相关性,且对酸度有一定影响,同样,普雷沃菌科(Prevotellaceae)只在N116小麦中被检出且作为优势微生物之一。综上,两个品种小麦携带的细菌菌群存在明显差异,而小麦源真菌组成高度相似,因此,后续研究小麦源微生物对大曲群落组装的作用应该将重点放在细菌菌群,这与之前的研究结论一致[5]。不同的细菌菌群结构可能对大曲培菌期的微生物群落组成产生不同的作用,进一步影响大曲的品质。
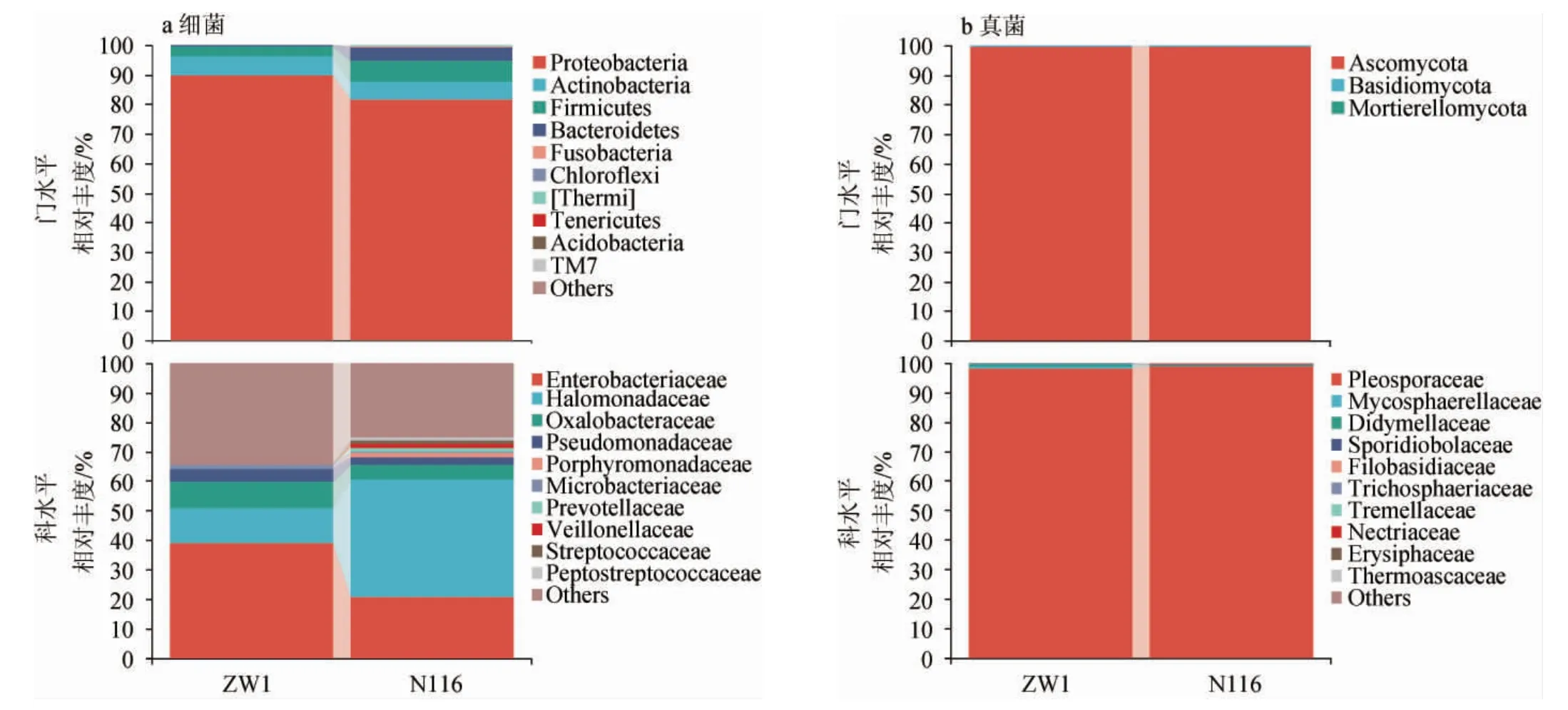
图3 众麦1号和糯麦116的细菌(a)和真菌(b)在不同分类学水平的群落结构Fig.3 Community structure of bacteria (a) and fungi (b) from wheat ZW1 and N116 at different taxonomic levels
基于两种小麦携带细菌和真菌菌群的组成分析结果,进一步深入分析细菌菌群的差异,结果见图4。由图4a可知,ZW1和N116小麦特有的ASVs数目分别为902个和752个,共有的ASVs数目为247个。由图4b可知,β-变形菌纲(Betaproteobacteria)和α-变形菌纲(Alphaproteobacteria)更多分布在ZW1小麦中,而拟杆菌纲(Bacteroidia)和梭菌纲(Clostridia)则主要分布于N116小麦中,这一结果从不同分类学水平说明了两种小麦细菌群落结构的差异。
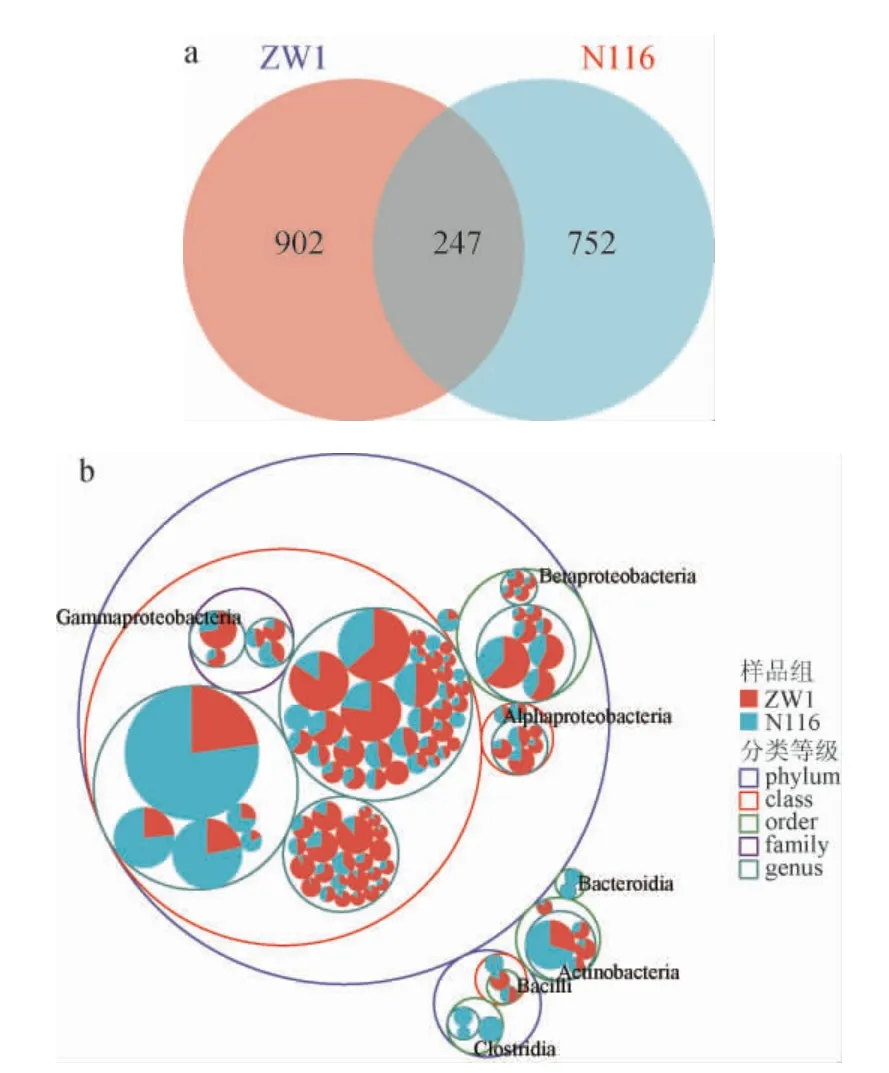
图4 众麦1号和糯麦116细菌菌群ASVs数目的韦恩图(a)及分类等级树图(b)Fig.4 Venn diagram (a) and classification tree (b) of ASVs number of wheat ZW1 and N116
2.4 PICRUSt 2功能预测
使用PICRUSt 2软件对不同品种小麦细菌菌群的基因功能进行预测,二级功能类群统计结果见图5。

图5 不同品种小麦细菌菌群的二级功能类群统计结果Fig.5 Statistical results of secondary functional groups of bacterial flora of different wheat varieties
由图5可知,N116小麦样品中的细菌菌群在8个代谢通路(氨基酸生物合成、芳香族化合物生物合成、脂肪酸和脂质生物合成、酒精降解、发酵、糖酵解、乙醛酸循环、糖酵解的超级通路)上的相对丰度更高,ZW1小麦样品的细菌菌群在13个代谢通路(碳水化合物生物合成、次生代谢物生物合成、氨基酸降解、芳香族化合物降解、碳水化合物降解、脂肪酸和脂质降解、戊糖磷酸途径等)中具有更高的丰度。进一步地,将通路与物种进行关联,使用分层的样本代谢通路丰度表进行通路的物种组成分析。本研究选取代谢通路统计结果中差异倍数较大且在发酵过程中有重要作用的通路加以说明,结果见图6。
微生物群落结构的研究结果显示,ZW1小麦源细菌中肠杆菌科(Enterobacteriaceae)的相对丰度明显高于N116小麦,由图6可知,肠杆菌科在关键的差异代谢通路中贡献最突出,尤其是糖类和氨基酸代谢相关的通路,包括D-葡萄糖酸降解Ⅰ、D-葡萄糖二酸和D-半乳糖酸降解的超通路、酮葡萄糖酸代谢、D-半乳糖酸降解Ⅰ、L-精氨酸和L-鸟氨酸降解的超通路、鸟氨酸降解超通路、L-精氨酸、腐胺和4-氨基丁酸降解的超通路。肠杆菌科是大曲发酵过程中的优势菌之一,许多研究都指出肠杆菌科与很多重要风味物质的产生具有很强的相关性[24],这佐证了其在糖类和氨基酸类物质代谢中的重要作用。值得注意的是,部分植物相关的肠杆菌科是条件致病菌,在低水分的介质中可存活较长时间导致感染[25]。这启示我们携带不同菌群的制曲原料可能对大曲培菌过程的部分代谢功能产生不同作用,同时也要警惕小麦源致病微生物可能对大曲菌群产生的不良影响。
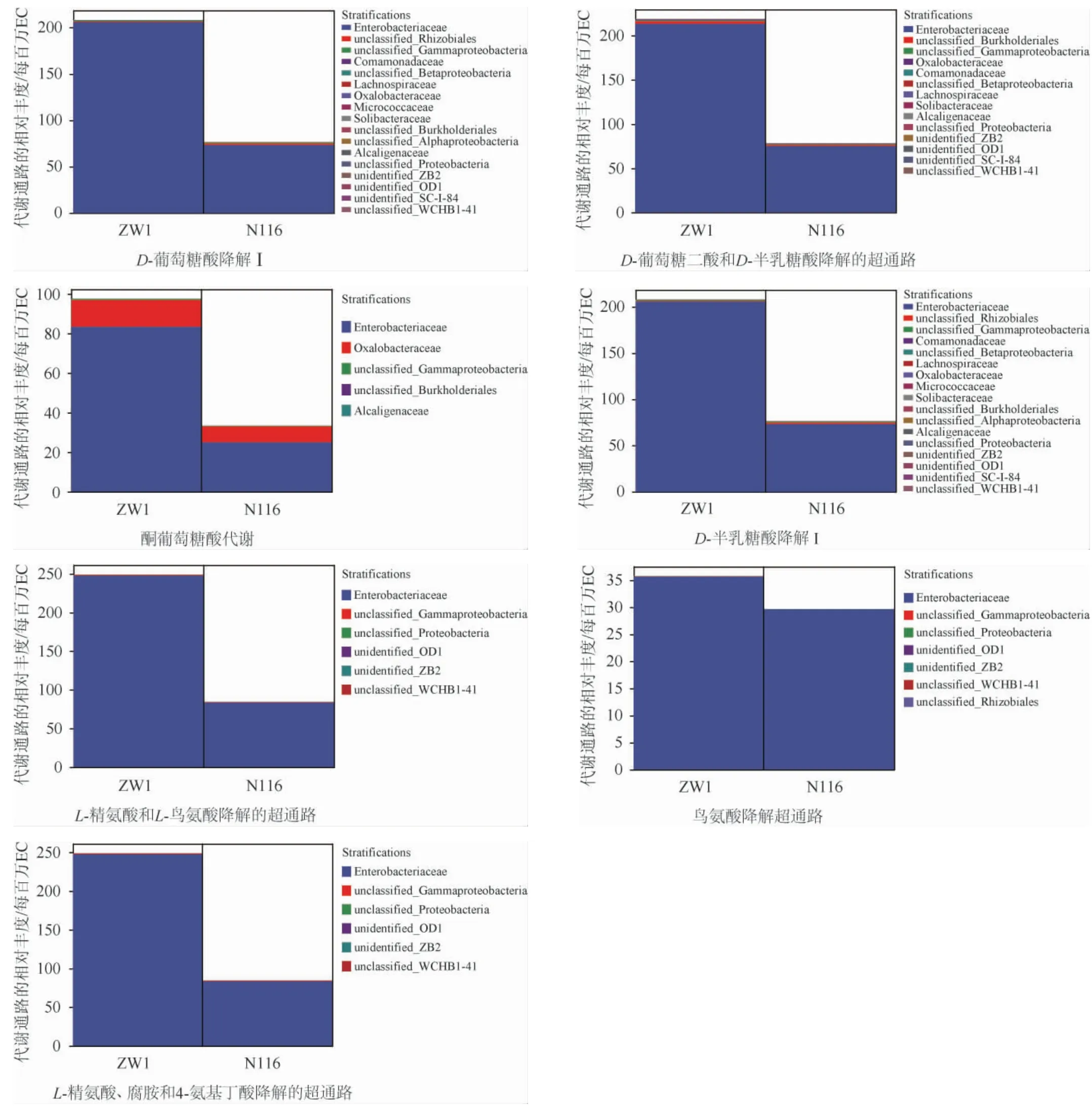
图6 PICRUSt2预测代谢途径的微生物群落组成Fig.6 Predicted microbial community composition of metabolic pathways by PICRUSt2
2.5 不同品种小麦挥发性风味物质分析
采用HS-SPME-GC-MS对ZW1和N116小麦的挥发性风味物质进行全面分析,结果见图7。
由图7a可知,采用HS-SPME-GC-MS从两个品种小麦中共筛选得到44种挥发性风味物质,包括1种醇类、4种醛酮类、6种酚酸类、17种酯类和16种其他类。由图7b可知,对解析出的小麦挥发性风味物质进行OPLS-DA发现,每种小麦样品组内聚类效果较好,样品重复性良好,结果具有较高的可信度,说明ZW1小麦和N116小麦的挥发性风味物质轮廓具有明显的差异。由图7c可知,从不同种类挥发性物质的含量来看,N116小麦中的酯类物质、酚酸类物质总含量高于ZW1小麦,具体主要体现在对甲酚、百里酚、4-叔丁基环己基甲基乙基膦酸酯、重氮乙酸,2-异丙基-5-甲基环己酯和咪唑-2-酰肼-1-羧酸甲酯等的含量。值得注意的是,百里酚是一种制作香精的原料,天然存在于一些植物中,具有抗真菌的功能,最突出的作用是杀虫,已有研究表明百里酚及其类似物可作为杀虫剂应用于病虫的防治[26]。本研究预测小麦中检出的百里酚可能是小麦种植过程中喷洒的杀虫剂的成分之一,因此可根据小麦的代谢物检测进行优选和质控。
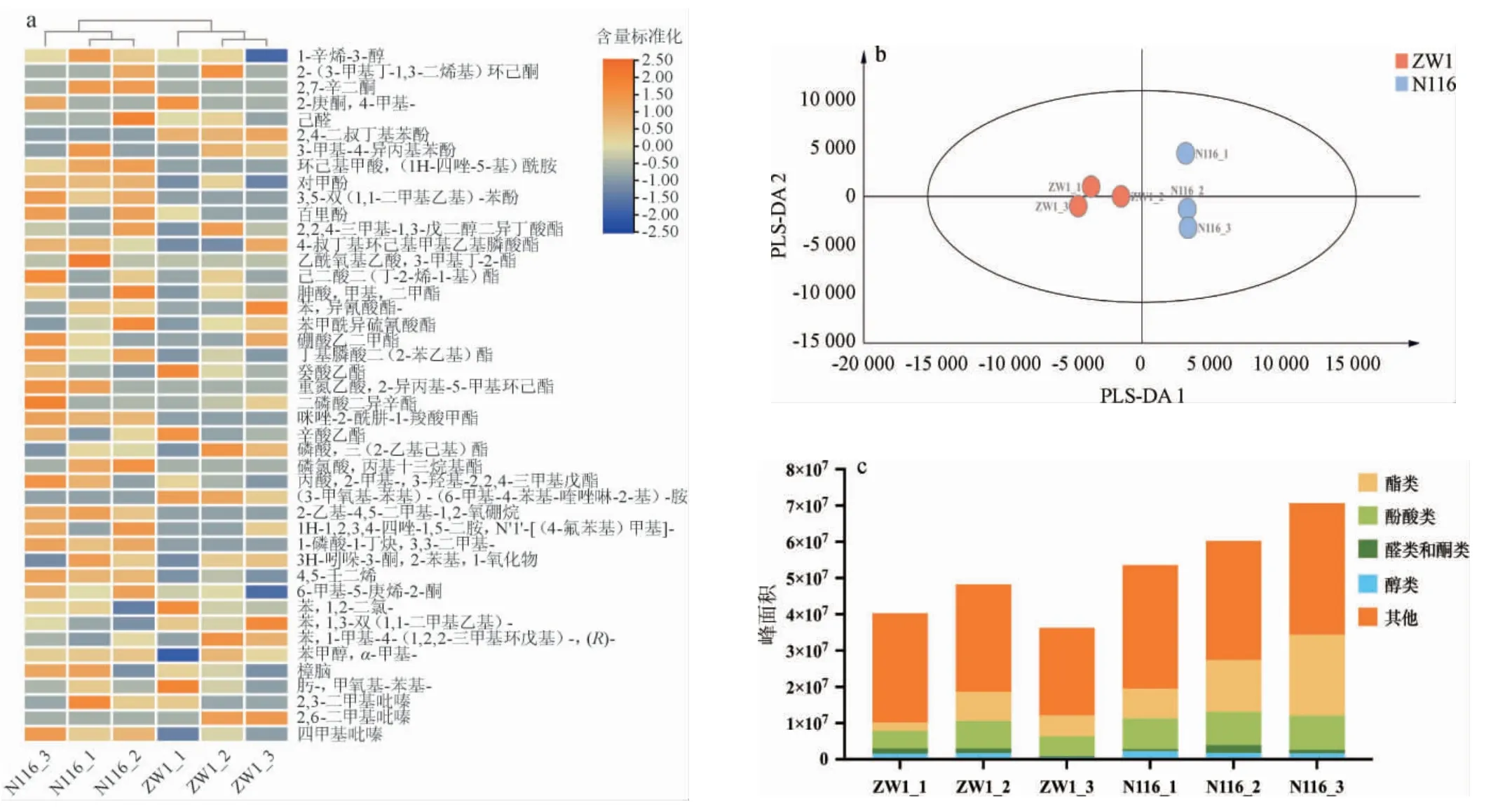
图7 不同小麦样品挥发性风味物质GC-MS分析结果Fig.7 Analysis results of volatile flavor components in different wheat samples by GC-MS
采用GC-IMS技术对ZW1和N116小麦的挥发性风味 物质进行分析,结果见图8。
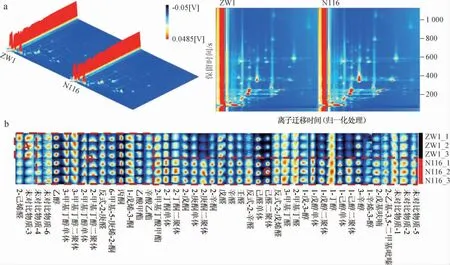
图8 GC-IMS检测不同小麦样品中挥发性风味物质的3D和2D谱图(a)和指纹图谱(b)Fig.8 3D and 2D spectrum (a) and fingerprint (b) of volatile flavor compounds in different wheat samples by GC-IMS
由图8a可知,两种小麦的挥发性风味物质的种类和含量存在差异,总的来说,N116小麦样品中挥发风味物质的种类和相对含量更高,即风味物质的丰富度更高。由图8b可知,图中A区域物质(2-己烯醛)在ZW1小麦样品中含量较高;B区域物质在ZW1和N116小麦样品中分布相似,主要包括乙醇、3-甲基丁醇、2-甲基丁醇、E-2-庚醛、6-甲基5-庚烯2-酮、丙酮、1-戊烯-3-酮、乙酸甲酯和辛酸乙酯;C区域物质在N116小麦样品中更丰富,主要有2-甲基丁酸甲酯、2-丁酮、2-戊酮、2-庚酮、2-辛酮、1-戊烯-3-醇、1-戊醇、1-丁醇、1-己醇、3-辛醇、1-辛烯-3-醇、2-戊基呋喃和2-乙基-3,5对甲基吡嗪等。2-己烯醛可以产生类似绿草的清新气味[27],2-甲基丁酸甲酯可以产生典型的甜瓜香气,2-丁酮可以产生略强烈、甜味、刺激性、类似丙酮样的风味,常在豆类中被检出[28-29],这表明N116小麦具有更丰富此类风味物质成分。
3 结论
通过对ZW1和N116两个品种制曲小麦的理化特性、微生物菌群组成和挥发性风味物质分析发现,两种小麦表皮色度存在差异,N116小麦籽粒的蛋白质和脂肪含量更高,而ZW1小麦籽粒中的直链淀粉含量更高。高通量测序结果表明,ZW1小麦中肠杆菌科(Enterobacteriaceae)的相对丰度明显高于N116小麦,肠杆菌科在一些糖类和氨基酸代谢相关的通路中功能丰度更高。N116小麦中的盐单胞菌科(Halomonadaceae)的相对丰度明显高于ZW1小麦。挥发性代谢物检测结果表明,两种小麦的风味特征存在较大差异,主要体现在酯类、醇类和醛酮类的含量上,总的来说N116小麦中的风味物质含量更丰富。本研究对两个品种的制曲小麦的微生物和风味特征作了全面的比较分析,为优选制曲小麦品种、质检和品控提供了理论支撑。
