肠炎沙门菌ArgG基因缺失株的构建及生物学特性分析
2023-03-08白和平陈钰斌张志强史秋梅吴同垒
白和平,张 鹿,陈钰斌,刘 畅,张志强,史秋梅,吴同垒
(河北科技师范学院 河北省预防兽医学重点实验室,河北 秦皇岛 066004)
肠炎沙门菌(Salmonellaenteritidis)宿主广泛,主要分布在人与动物消化道与生殖道内,幼龄动物感染呈败血症和系统性感染,成年动物感染呈隐性感染,造成长期排毒,且会垂直传播;可通过污染食物与饮水进行水平传播,其食源性感染一直居食源性细菌感染的前2位[1]。在欧洲、美国,肠炎沙门菌血清型被认为是暴发人类沙门菌病的主要原因[2];在我国,70%~80%细菌性食物中毒是由肠炎沙门菌引起的[3]。目前为止抗生素疗法依然是预防与治疗肠炎沙门菌的主要手段,随着耐药性肠炎沙门菌的不断出现,新型药物的研发跟不上菌株耐药性的变化,寻找有效措施抑制肠炎沙门菌的感染迫在眉睫,因此构建肠炎沙门菌减毒活疫苗成为研究热点[4]。相比于传统抗生素疗法,减毒活疫苗具有良好的免疫原性、风险低、无残留、免疫反应持久、特异性强等优点。
肠炎沙门菌通过食源途径感染机体要耐受消化道的极端pH、胆盐作用、吞噬细胞清除等多种杀伤作用,细菌的抗逆机制在这一过程中发挥关键作用[5]。ArgG基因编码精氨酰琥珀酸合成酶(ASS),研究发现,在单核细胞增多性李斯特菌中ArgG基因转录和表达对酸胁迫响应有关[6],在蜡样杆菌中ArgG基因与生物膜形成有关[7],因此推测其在肠炎沙门菌的侵袭和抗应激能力中具有重要作用。目前国内外对肠炎沙门菌ArgG基因生物学特性的相关研究尚未见报道,本试验以肠炎沙门菌ArgG基因为研究对象,采用λ-Red重组法构建肠炎沙菌ArgG基因缺失株,并通过分析ArgG基因缺失株的生物学特性以及毒力,探索ArgG基因的功能。
1 材料与方法
1.1 主要材料质粒pKD3、pKD46、pCP20、pBR322 由河北科技师范学院预防兽医学重点实验室保存;肠炎沙门菌标准菌株C50336购自中国菌种保藏中心。
细菌RNA提取试剂盒购自北京艾德莱生物科技有限公司;限制性内切酶及T4DNA连接酶均购自NEB公司;L-阿拉伯糖购自Sigma公司;DNA回收试剂盒购自Tiangen公司。
1.2 实验动物4~6周龄昆明鼠购自北京维通利华实验动物技术有限公司。
1.3 引物设计根据GenBank公布的肠炎沙门菌序列(CP023475.1),设计ArgG基因打靶引物P1、P2,P1、P2引物由两部分组成,加下划线部分与ArgG基因同源,未加下划线部分与pKD3氯霉素基因同源;并设计用于构建回补株引物P3、P4及鉴定引物P5、P6,P5、P6引物位于P1、P2引物外侧用于对缺失株的鉴定,引物均由生工生物(上海)股份有限公司合成(表1)。

表1 PCR引物信息
1.4 肠炎沙门菌C50336ΔArgG基因缺失株及回补株构建参照文献[8]方法,利用λ-Red同源重组方法构建肠炎沙门菌ArgG基因缺失株,以pKD-3质粒为模板,P1、P2为引物,扩增ArgG基因打靶片段,将ArgG基因打靶片段电转化入肠炎沙门菌C50336-pKD46感受态细胞,30℃过夜培养,挑取单克隆,以鉴定引物P5、P6进行PCR并测序鉴定。阳性克隆利用温度敏感性质粒pCP20替换氯霉素片段,将鉴定正确的ArgG基因缺失株命名为C50336ΔArgG。利用基因提取试剂盒提取野生株与ArgG基因缺失株DNA,以P5、P6鉴定引物进行扩增,根据扩增片段大小进行分析;并将ArgG基因缺失株扩增产物送生工生物(上海)股份有限公司进行测序。结合测序结果分析ArgG基因是否成功敲除。
以P3、P4引物扩增野生株ArgG基因,并将其克隆至pBR332质粒,电转入缺失株感受态中,构建回补株,利用P5、P6引物进行PCR并测序鉴定,鉴定无误后即获得回补株C50336ΔArgG/pBR322-ArgG。
1.5 生物学特性检测将WT(C50336菌株,下同)、KO(C50336ΔArgG,下同)菌株、RS(C50336ΔArgG/pBR322-ArgG,下同)接种于LB液体培养基过夜培养作为种子液,次日按1∶100接种于LB液体培养基与M9液体培养基,37℃、200 r/min振荡培养,每隔1 h取菌液样品测定D600值,根据D600值绘制生长曲线。同时,利用ATB全自动微生物鉴定仪与ID 32E生化鉴定试纸条分析WT、KO及RS菌株的生物学特性,试验操作严格按照相关说明书执行。
1.6 生物被膜形成能力检测采用结晶紫半定量染色法测定WT、KO及RS菌株的生物被膜形成能力。将按菌液1∶100转接入LB液体培养基,取96孔细菌培养板,每孔添加200 μL,30℃孵育72 h,小心弃掉培养液,使用超纯水清洗5次;甲醇固定10 min,小心弃掉甲醇,超纯水再清洗5次;结晶紫染色10 min,超纯水清洗至液体清澈透明,添加250 μL无水乙醇溶解结晶紫,及时测定D575值。
1.7 运动能力检测配制含0.3%琼脂的LB培养基,使用接种针将WT、KO及RS菌株穿刺接种于培养基中央,37℃正置培养6 h后测量运动直径,根据运动直径分析缺失株的运动能力。
1.8 体外应激试验参照文献[9]方法测定各菌株在不同条件下的生存能力,配制minimal培养基,分别在酸性应激条件 (pH 3.5)、碱性应激条件(pH 10)、氧化应激条件(10 mmol/L H2O2)及高渗条件(2.4 mol/L NaCl)下,37℃振荡培养30 min,对细菌培养物进行细菌计数。计算细菌存活率,细菌存活率=(当前菌数/初始菌数)×100%,同时做平行试验。
1.9 巨噬细胞存活能力检测将计数后的WT、KO及RS菌株,按照MOI值1∶100接种于生长良好的RAW264.7巨噬细胞培养孔内,孵育1 h后将培养液更换为含 20 mg/L 庆大霉素的 DMEM继续培养,于6,24 h,使用0.5% TritonX-100裂解细胞,并计算活菌数,分析菌株在胞内存活能力。
1.10 LD50的测定取55只小鼠随机分为11组,每组各5只。采用滴板计数法对WT、KO菌株进行计数,计数后的菌液进行倍比稀释,稀释5个梯度,1~5组腹腔注射WT菌株,6~10组注射KO菌株,11组注射等体积灭菌PBS,根据寇氏改良法测定LD50。
2 结果
2.1 肠炎沙门菌C50336ΔArgG基因缺失株的构建经用λ-Red重组法缺失肠炎沙门菌ArgG基因,获得ArgG基因缺失株C50336ΔArgG,并将ArgG基因电转入C50336ΔArgG感受态中,获得回补株C50336ΔArgG/pBR322-ArgG;利用检测引物分别扩增C50336、C50336ΔArgG::cat、C50336ΔArgG菌株ArgG基因,分别获得约1 400,1 400,490 bp条带(图1),符合预期。将扩增产物进行测序,结果显示,WT菌株携带ArgG基因,KO菌株不携带ArgG基因,综合分析表明成功构建了不携带ArgG基因缺失株肠炎沙门菌。
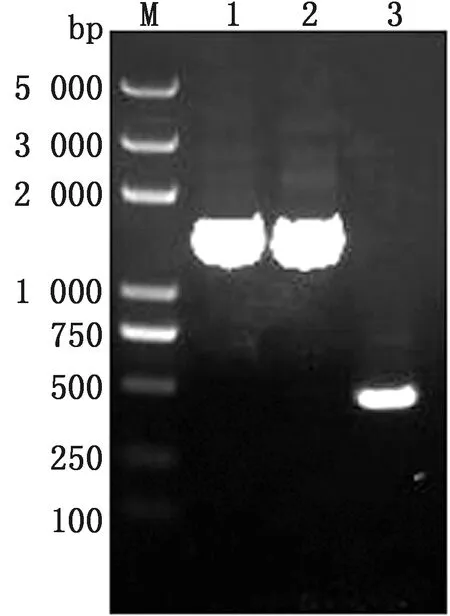
M.DL5000 DNA Marker;1.C50336;2.C50336ΔArgG::cat;3.C50336ΔArgG
2.2ArgG基因缺失后生化特性检测结果根据D600值绘制WT、KO及RS菌株在LB、M9培养基中生长曲线,结果显示,在37℃培养条件下,各菌株在LB培养基中生长速度无明显变化(图2A),但在M9培养基中,KO菌株不生长,WT与RS菌株生长速度无明显变化(图2B),表明缺失ArgG基因对肠炎沙门菌的生长有一定的影响。
经ABI自动微生物鉴定系统检测各菌株的生化特性,结果显示,ArgG基因缺失后肠炎沙门菌生化特性无变化(表2)。
2.3 生物被膜检测结果通过结晶紫半定量染色法测定WT、KO及RS菌株生物被膜形成能力,定量检测结果显示,WT菌株D575值为3.4(±0.2),KO菌株D575值为1.6(±0.2),RS菌株D575值为3.2(±0.2),KO菌株比WT菌株生物膜形成能力下降60%,表明缺失ArgG基因后肠炎沙门菌生物被膜形成能力显著下降(图3)。
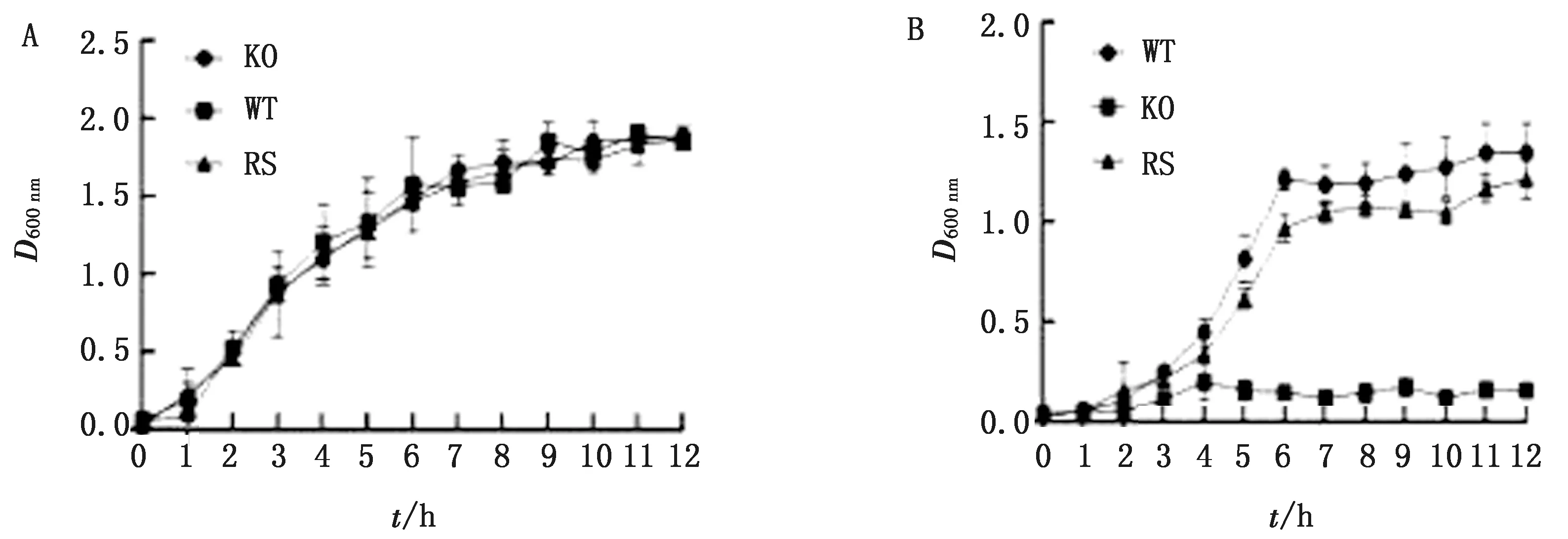
A.WT、KO及RS菌株在LB培养基的生长曲线测定;B.WT、KO及RS菌株在M9培养基的生长曲线测定
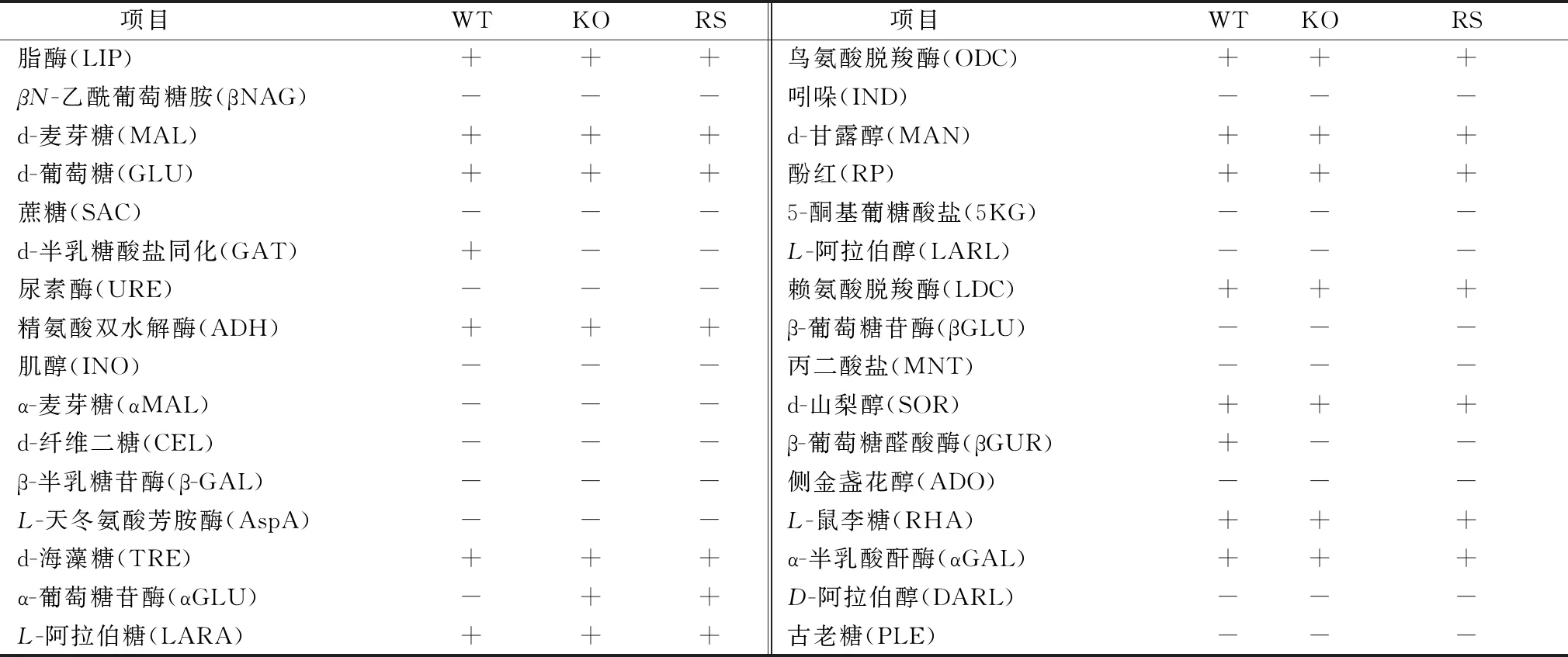
表2 生化鉴定试验结果

注:***表示P<0.001
2.4 缺失株运动能力检测取经37℃、6 h培养的半固体培养基,根据WT、KO及RS菌株的运动直径评估各菌株运动能力的变化。结果显示,WT菌株运动直径为(2.4±0.2)cm(图4A),KO菌株运动直径为(2.2±0.2)cm(图4B),RS菌株运动直径为(1.7±0.2)cm(图4C),表明ArgG基因缺失后对肠炎沙门菌运动能力的影响不明显。
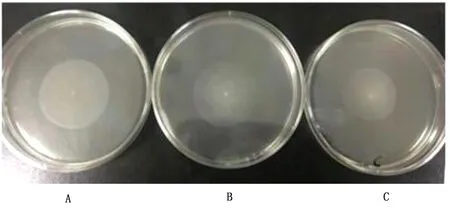
图4 WT(A)、KO(B)及RS(C)菌株的运动能力的测定
2.5 抗pH、氧化应激、高渗能力检测检测肠炎沙门菌野WT、KO及RS菌株对抗pH、氧化应激、高渗能力,结果显示,与WT菌株相比,KO菌株抵抗氧化应激、高渗能力变化不明显,但抗酸应激、碱应激能力分别下降约12%,10%,结果表明,ArgG基因参与肠炎沙门菌抵抗酸、碱应激环境(图5)。
2.6 巨噬细胞存活能力检测测定肠炎沙门菌WT、KO及RS在鼠源巨噬细胞RAW264.7的增殖能力。结果显示,WT菌株的胞内存活率(24 h/6 h)为64%,KO菌株胞的内存活率(24 h/6 h)为30%,与WT菌株相比下降了约34%(图6),表明缺失ArgG基因后肠炎沙门菌胞内存活能力下降明显。
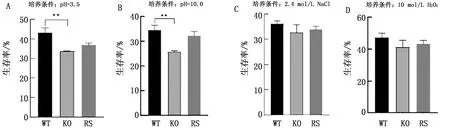
A~D.酸性应激、碱性应激、高渗应激、氧化应激对ArgG基因缺失株生长的影响。**表示0.001 **表示0.001 2.7 LD50试验取攻毒死亡小鼠脾脏、肝脏划线于HE琼脂培养基,培养24 h,在平板上生长出形态均一、中等大小、金属光泽的菌落,生化鉴定结果显示为肠炎沙门菌。采用寇氏改良法计算菌株的LD50,结果显示,WT菌株LD50为3.54×105CFU/mL,KO菌株的LD50为5.43×106CFU/mL,毒力下降约15倍。结果表明,在动物个体水平上,缺失ArgG基因后影响肠炎沙门菌的毒力。 在减毒活疫苗的研究中,广泛使用基因编辑技术,λ-Red重组系统是近些年发展起来的一种敲除系统,1998年,MURPHY等[10]首次利用λ-Red重组系统在大肠杆菌中进行基因敲除,由此在原核生物中建立了新的基因编辑技术,成为大肠杆菌基因敲除最常用的方法之一。近年来,也有报道其用于肠炎沙门菌、鸡白痢沙门菌、鼠伤寒沙门菌等菌株的基因敲除。 2009年,GERLACH等[11]提出的改进后Red同源重组方案,改进λ-Red同源重组法相比与传统的λ-Red同源重组法,该方法操作简单、周期短、无片段残留,不影响下一次同源重组效率。目前已广泛应用于易制作感受态的细菌如大肠杆菌的基因敲除,但在沙门菌中此方法尚未完全建立。本研究采用改进后λ-Red同源重组法成功构建了不含ArgG基因的肠炎沙门菌,为建立肠炎沙门菌特定靶基因无痕敲除方法提供科学参考。 本研究构建肠炎沙门菌ArgG基因缺失株并对其部分生物学特性进行研究,结果表明,野生株、缺失株与回补株32项生理生化特性指标并无明显差异,但缺失了ArgG基因的肠炎沙门菌在M9培养基中不生长,而野生株与回补株在M9培养基中生长曲线相同。表明ArgG基因影响肠炎沙门菌的生长和营养代谢过程,更间接说明了M9培养基中缺乏肠炎沙门菌生长代谢所必需的元素,这可能是敲除L-精氨酸合成途径ArgG基因后,导致L-精氨酸营养缺陷型,LB培养基中含有一定量的酵母粉,能够提供少量相应的氨基酸,但在M9培养基中L-精氨酸供应不足,影响KO菌株的正常生长和产物的积累。后续试验可以对对数期野生株与缺失株在M9培养基中增长差率为切入点,提取不同时间段野生菌株与缺失菌株的RNA,并以氨基酸代谢相关基因组件为靶基因,研究野毒株与缺失株在氨基酸转录水平上的差异[12]。 细菌对宿主细胞的黏附、侵袭在细菌定植过程中至关重要,并且生物被膜的形成与黏附有关。本研究中对肠炎沙门菌野生株、回补株、缺失株进行生物被膜形成能力的检测,结果显示缺失ArgG基因后肠炎沙门菌生物被膜形成能力显著下降。细菌的生物被膜由细菌及其分泌的糖、蛋白质和核酸等多种基质组成的细菌群落[13-14],缺失ArgG基因影响肠炎沙门菌的生物被膜形成能力的机制需要进一步研究。通过体外应激试验发现,肠炎沙门菌ArgG基因缺失后对体外环境的高渗、氧化应激抵抗能力下降不明显;但抗碱应激能力下降约10%,抗酸应激能力下降约12%。低pH是巨噬细胞杀伤病原的重要手段[15],为进一步验证ArgG缺失是否影响了肠炎沙门菌抵抗巨噬细胞杀伤能力,本试验采用鼠源巨噬细胞RAW264.7进行胞内存活和增殖试验,结果表明ArgG基因缺失能显著影响肠炎沙门菌在细胞内增殖,以上结果说明缺失ArgG基因可以抑制肠炎沙门菌侵袭、黏附、胞内增殖能力。 综上所述,本研究结果表明ArgG基因与肠炎沙门菌生长速度、生物被膜形成能力密切相关,在肠炎沙门菌致病过程中发挥重要作用。但本研究还有诸多需完善之处,如精氨酰琥珀酸合成酶为尿素循环的限速酶,也是瓜氨酸NO循环与合成的限速酶,通过影响哪些代谢途径进而影响细菌的生物表型发生改变?而每个代谢途径都有不同的底物、代谢产物、终产物,ArgG基因影响具体哪些物质的合成代谢?此外,肠炎沙门菌的ArgG缺失株对小鼠毒力有所下降,是否与生物学特性相关的毒力基因表达量有关。目前尚不明确,需进一步开展相关试验进行ArgG基因调控肠炎沙门菌生物表型的具体分子机制的研究。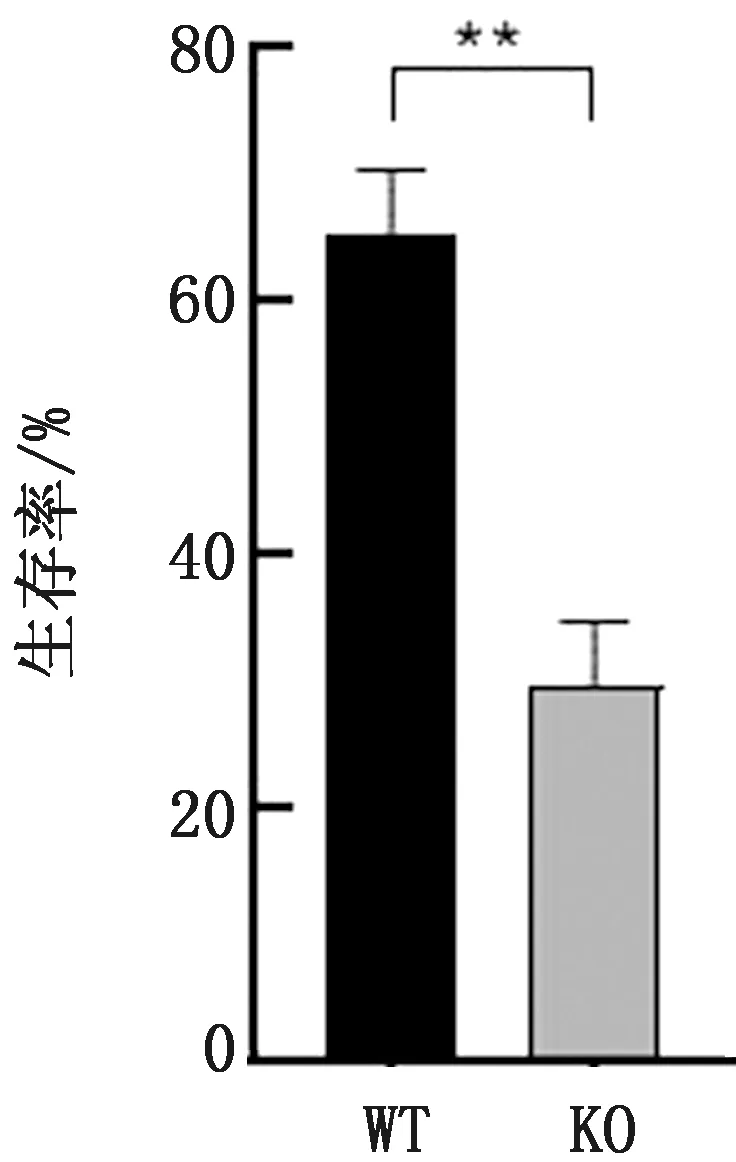
3 讨论
