外源性绵羊肺腺瘤病毒实时荧光RPA检测方法的建立
2023-03-08刘淑英
刘 然,张 琳,刘淑英*
(1.内蒙古农业大学 兽医学院,内蒙古 呼和浩特 010018;2.农业农村部动物临床诊疗技术重点实验室,内蒙古 呼和浩特 010018;3.内蒙古自治区基础兽医学重点实验室,内蒙古 呼和浩特 010018)
绵羊肺腺瘤(ovine pulmonary adenomatosis,OPA)是由绵羊肺腺瘤病毒(jaagsiekte sheep retrovirus,JSRV)引起的一种慢性、进行性、传染性的肺部肿瘤性疾病[1]。该病主要以患羊咳嗽、呼吸困难、消瘦、大量浆液性鼻液、Ⅱ型肺泡上皮细胞和无纤毛细支气管上皮细胞肿瘤性增生为特征[2]。其主要发病动物是绵羊,山羊相对较少,不感染其他动物[3],由于没有特效药和疫苗进行治疗和预防,给养羊业造成了巨大的经济损失,因此加强OPA的快速诊断对于预防和控制该病具有重要意义。
JSRV属于逆转录病毒属,结构基因主要是由5′-gag-pro-pol-env-3′构成,其中env基因编码的囊膜蛋白(envelope protein,Env)由跨膜蛋白(TM)和表面糖蛋白(SU)构成,是引起细胞转化和致瘤的主要蛋白[4-5]。ARNAUD等[6]发现绵羊基因组中存在约27个拷贝的内源性肺腺瘤反转录病毒(endogenous jaagsiekte sheep retrovious,enJSRV)在绵羊体内大量表达,使得绵羊对外源性绵羊肺腺瘤病毒(exogenous jaagsiekte sheep retrovirus,exJSRV)形成免疫耐受,以至于体内检测不到特异性抗体[7],因此常规的血清学方法无法用于OPA的诊断,只能通过临床症状、病理组织学方法,耗时长且过程繁琐,不利于该病防控,由此可见快速诊断方法的建立尤为重要。
近年来,分子生物学技术发展迅速,以此为基础的核酸检测是病原鉴定最常用的方法之一。目前JSRV的检测方法已有多种,但都耗费时间较长。重组酶聚合酶恒温扩增技术(recombinase polymerase amplification,RPA)是一种新型恒温扩增技术,利用重组酶、DNA聚合酶和单链结合蛋白代替了PCR反应中的热循环解链过程,能够在37~42℃对目的片段进行扩增[8-9],15~30 min即可通过扩增曲线实时观察结果。目前RPA已经在多种病原的检测中成功应用[10-13],但国内外尚无对JSRV的检测报道。本研究选择在exJSRVenv基因设计特异性引物和探针,以病羊肺组织提取RNA反转录为cDNA作为模板,建立了exJSRV的实时荧光RPA检测方法,以期为防控OPA提供技术手段。
1 材料与方法
1.1 毒株及病料JSRV感染阳性的肺组织由本实验室保存。本研究使用的其他病原核酸:小反刍兽疫病毒(peste des petits ruminants virus,PPRV)、羊败血性链球菌(ovine streptococcosis septicemia,OSS)由本实验室保存。牛肠道病毒 (bovine entero virus,BEV)、传染性鼻气管炎病毒(infectious bovine rhinotracheitis virus,IBRV)、牛副流感病毒3型(bovine parainfluenza virus type3,BPIV3)、肺炎支原体(Mycoplasmaovipneumoniae,MO)由内蒙古农业大学郝永清教授实验室提供。
1.2 主要试剂与仪器动物组织、细胞与昆虫总RNA快速提取试剂盒、血液/组织/细胞基因组DNA快速提取试剂盒和琼脂糖凝胶纯化回收试剂盒购自北京金佰特生物技术有限公司;反转录试剂盒购自Vazyme;TwistAmp exo Kit试剂盒购自英国TwistDx Inc公司;核酸恒温扩增仪AGS8800购自杭州安誉科技有限公司。
1.3 引物与探针的设计及合成参照GenBank上的JSRV登录号为AF105220、JQ837489、KP691837和DQ838493的env基因序列,通过比对分析内外源性env序列,运用Primer Premier 5.0设计1对PCR引物(表1),同时按照RPA引物探针设计原则设计4组引物和1条探针(表2),由生工生物工程(上海)股份有限公司合成。
1.4 exJSRV 荧光RPA方法的建立
1.4.1核酸提取及cDNA 制备 提取PPRV、BEV、BPIV3及JSRV的 RNA,使用酶标仪检测质量浓度与纯度,将上述总RNA分别反转录为cDNA备用,提取IBRV、OSS和MO的DNA备用。具体操作按照试剂盒说明书进行。
1.4.2cDNA的纯化 将上述制备的OPA病肺cDNA经PCR扩增env全长,取50 μL产物琼脂糖凝胶电泳后进行胶回收,纯化cDNA,于-20℃保存备用。具体操作按照试剂盒说明书进行。
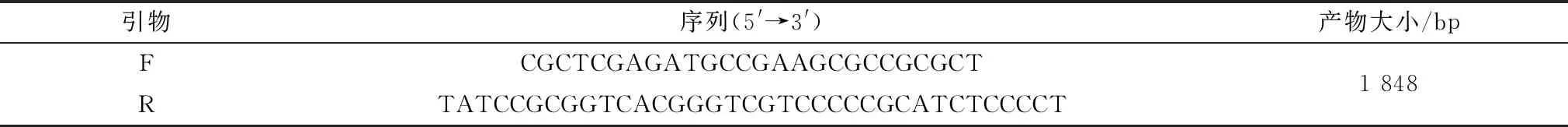
表1 PCR引物信息
1.4.3荧光RPA的反应体系和反应条件 使用TwistAmp exo Kit进行荧光RPA扩增,反应总体系50 μL。将Rehydration Buffer 29.5 μL,模板1 μL,上、下游引物各2.1 μL(10 μmol/L),探针0.6 μL(10 μmol/L),DNase/RNase-Free Deionized Water配成 47.5 μL的体系,混匀后移入RPA冻干酶粉反应管后,再加入2.5 μL浓度为0.28 mmol/L的MgAc溶液。混匀后将反应管放入恒温核酸扩增仪中,反应4 min后取出混合,再继续反应16 min,在整个反应过程中收集FAM荧光信号。在20 min内观察到指数级增长的扩增曲线判定为阳性,反之为阴性。
1.4.4最佳引物对及最佳反应温度的筛选 将4对引物进行荧光RPA检测,根据扩增效率筛选出最佳引物对。反应温度37~42℃条件下使用扩增效果最优引物对进行荧光RPA检测,筛选出最佳反应温度。

表2 RPA引物和探针信息
1.4.5特异性试验 利用已优化的反应条件和体系,将IBRV、OSS、MO、PPRV、BEV、BPIV3、JSRV核酸以及空白对照(以DNase/RNase-Free Deionized Water作为模板)进行荧光RPA检测,确定该方法的特异性。
1.4.6灵敏度试验 将上述制备及纯化后的cDNA,以此为标准品按照10倍倍比稀释后和空白对照进行荧光RPA检测,确定敏感性。同时进行PCR试验,比较二者的灵敏度差异。
1.4.7重复性试验 选取cDNA和纯化cDNA各两个质量浓度为模板以及空白对照进行荧光RPA检测,并重复3次,以验证建立的检测方法的稳定性。
1.4.8样品检测 为了验证所建立方法的可靠性,对本实验室保存的JSRV感染病羊肺部组织、鼻液、外周血白细胞(来自不同的病羊)、健康羊肺组织和空白对照进行荧光RPA检测。同时进行PCR试验,比较二者检测结果。
2 结果
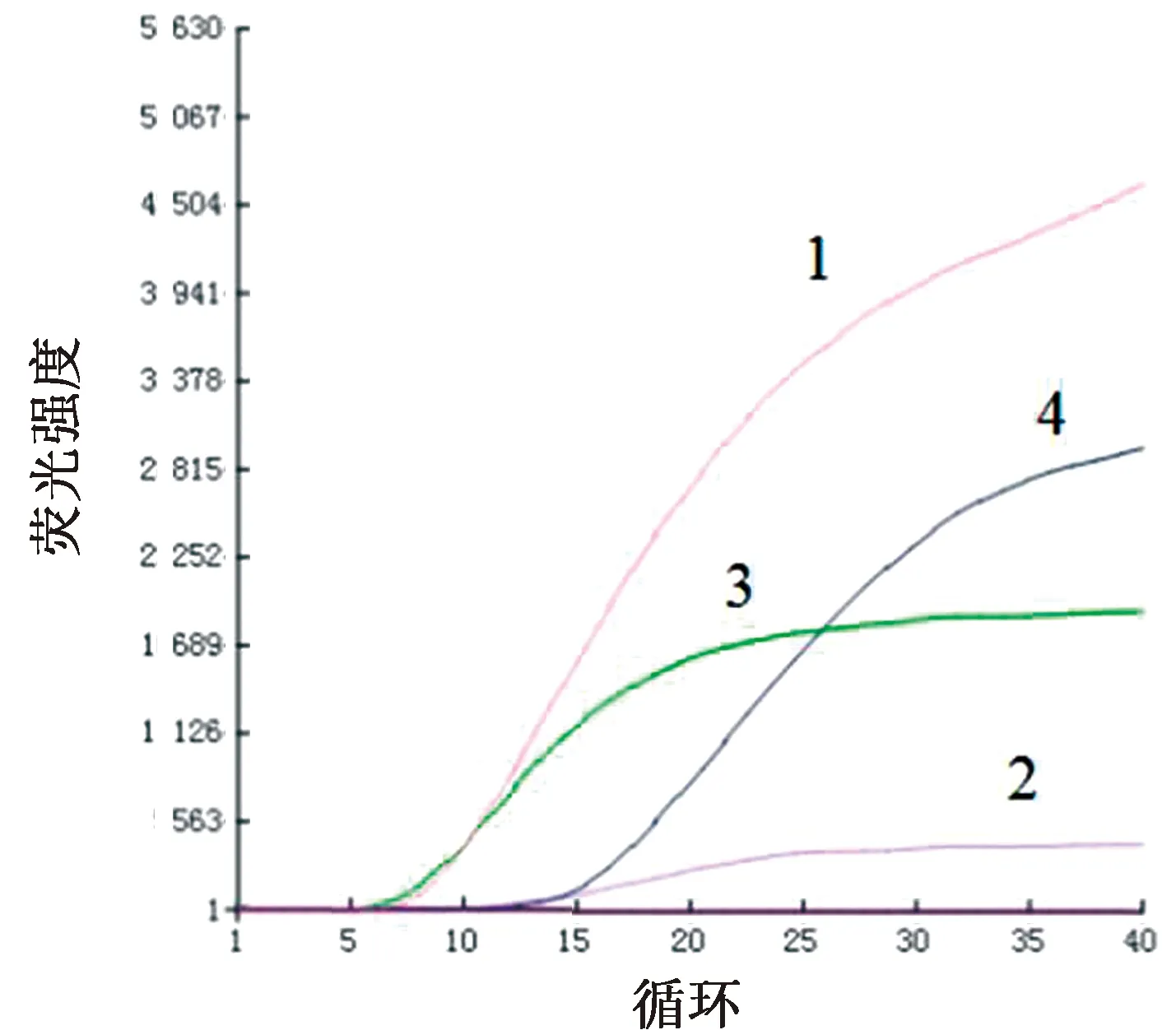
2.1 最佳引物及反应温度的筛选探针和4对引物(F1/R1、F2/R2、F3/R3和F4/R4)组合分别对JSRV进行检测,结果显示,4对引物均能扩增产生荧光信号,其中F1/R1扩增速度最快,且荧光强度值最强,因此选用此对引物进行后续试验(图1)。最佳温度筛选发现在40℃时Ct值11.52为最低,故确定该方法的最佳反应温度为40℃(图2)。
1.F1/R1;2.F2/R2;3.F3/R3;4.F4/R4
A~F.37~42℃的RPA检测结果,Ct值分别为15.36,13.51,12.77,11.52,12.23,12.42
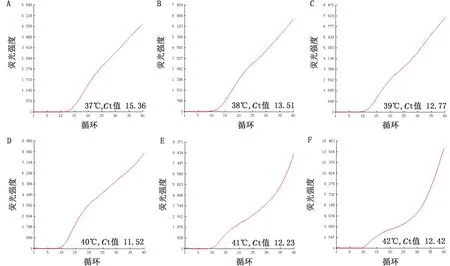
2.2 特异性试验分别以JSRV、PPRV、OSS、BEV、IBRV、BPIV3、MO核酸为模板进行荧光RPA检测,结果显示,除JSRV外,其他病原核酸和空白对照均无扩增(图3),表明该方法与PPRV、OSS、BEV、IBRV、BPIV3、MO无交叉反应,特异性强。
1.JSRV;2.PPRV;3.OSS;4.BEV;5.IBRV;6.BPIV3;7.MO;8.空白对照
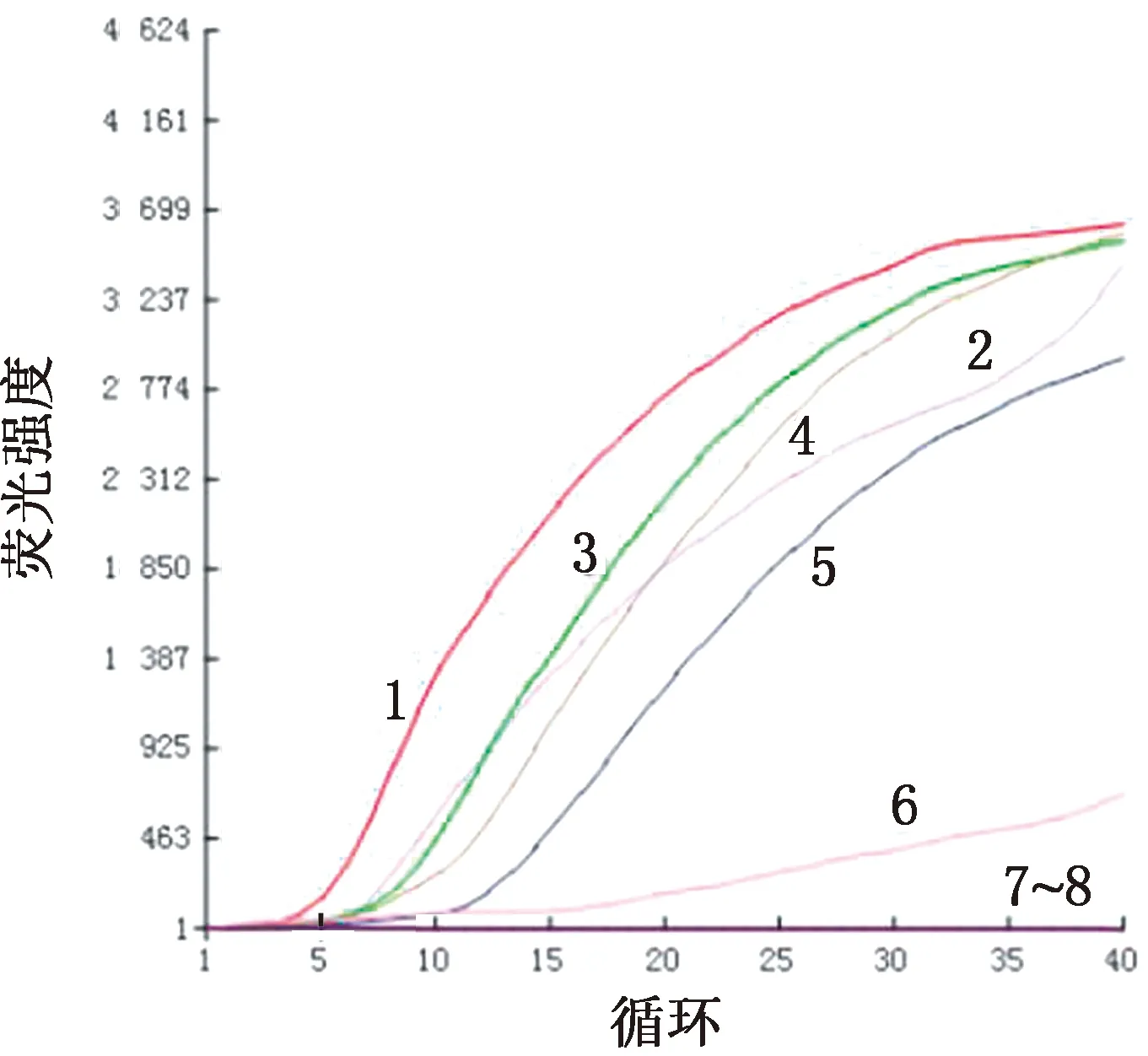
2.3 灵敏度试验将上述制备的病羊肺组织cDNA及纯化后的产物,分别进行10倍倍比稀释,以此作为模板进行灵敏度检测。结果显示,所建立的方法对JSRV未纯化cDNA的检测下限为106ng/L,而对纯化后cDNA的检测下限为10 ng/L(图4,5)。同时用上述方法进行PCR扩增,结果显示PCR灵敏度与RPA相同(图6,7)。说明只要模板中存在10 ng/L以上的病毒含量就能检测到。

1~7.cDNA质量浓度分别为109,108,107,106,105,104,103 ng/L;8.空白对照
1~7.cDNA质量浓度分别为106,105,104,103,102,10,1 ng/L;8.空白对照
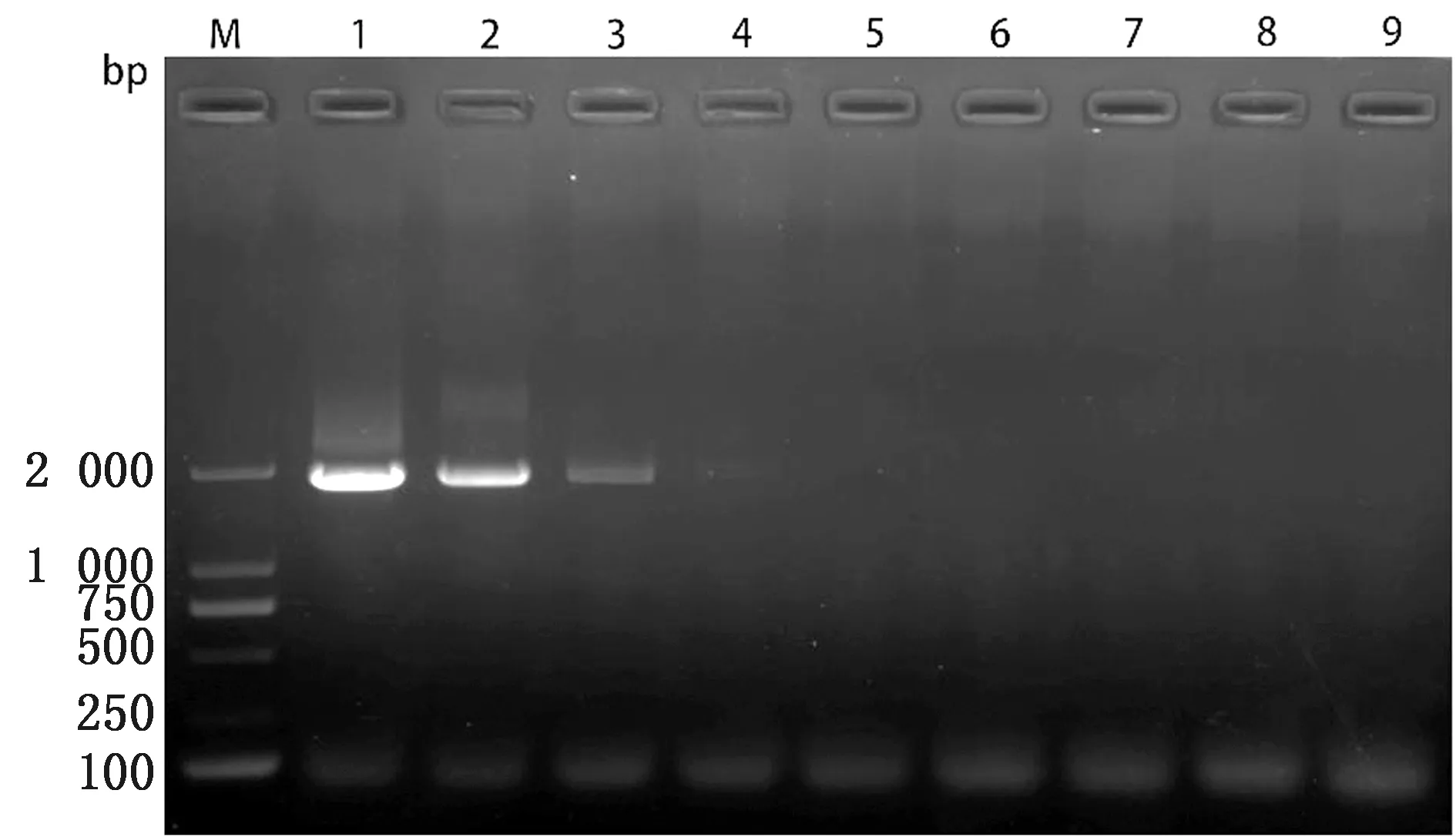
M.DL2000 DNA Marker;1~8.cDNA质量浓度分别为109,108,107,106,105,104,103,102 ng/L;9.空白对照
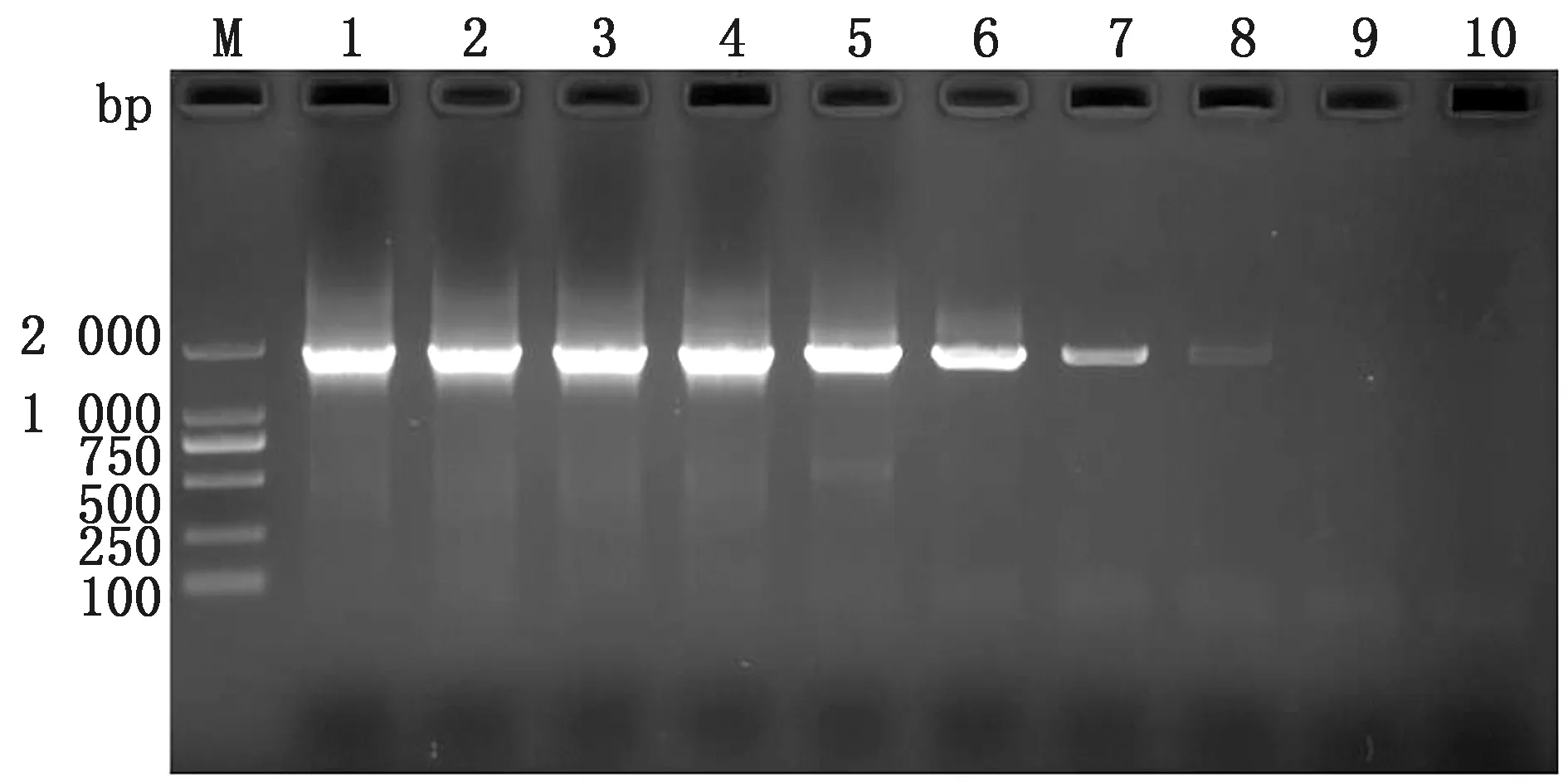
M.DL2000 DNA Marker;1~9.cDNA质量浓度分别为108,107,106,105,104,103,102,10,1 ng/L;10.空白对照
2.4 重复性试验病羊肺组织cDNA选取质量浓度108,107ng/L,纯化cDNA选取质量浓度103,102ng/L 进行荧光RPA重复性试验。结果显示该方法对于相同质量浓度的模板检测结果一致,在相同位置均可观察到相对应的荧光曲线,稳定性良好(图8)。
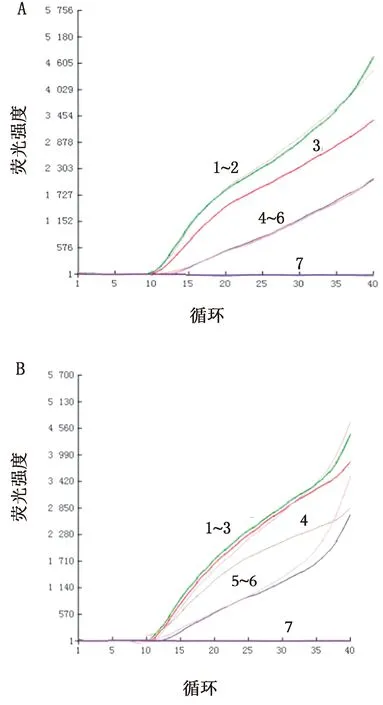
A.以病肺cDNA为模板(1~3.108 ng/L;4~6.107 ng/L;7.空白对照);B.以纯化cDNA为模板(1~3.103 ng/L;4~6.102 ng/L;7.空白对照)
2.5 样品检测仅病羊肺组织、鼻液和外周血白细胞核酸出现扩增曲线,与PCR检测结果一致,说明本研究建立的荧光RPA检测方法可有效检测出病羊体内的JSRV(图9,10)。
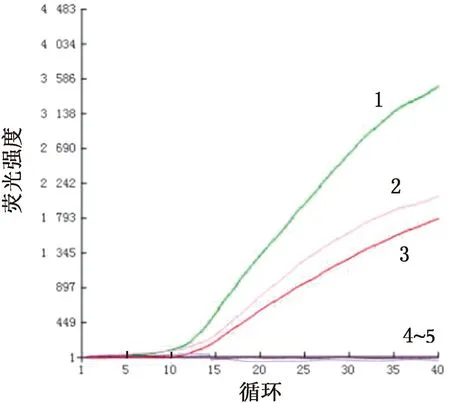
1.阳性肺组织;2.阳性鼻液;3.阳性外周血白细胞;4.健康肺组织;5.空白对照
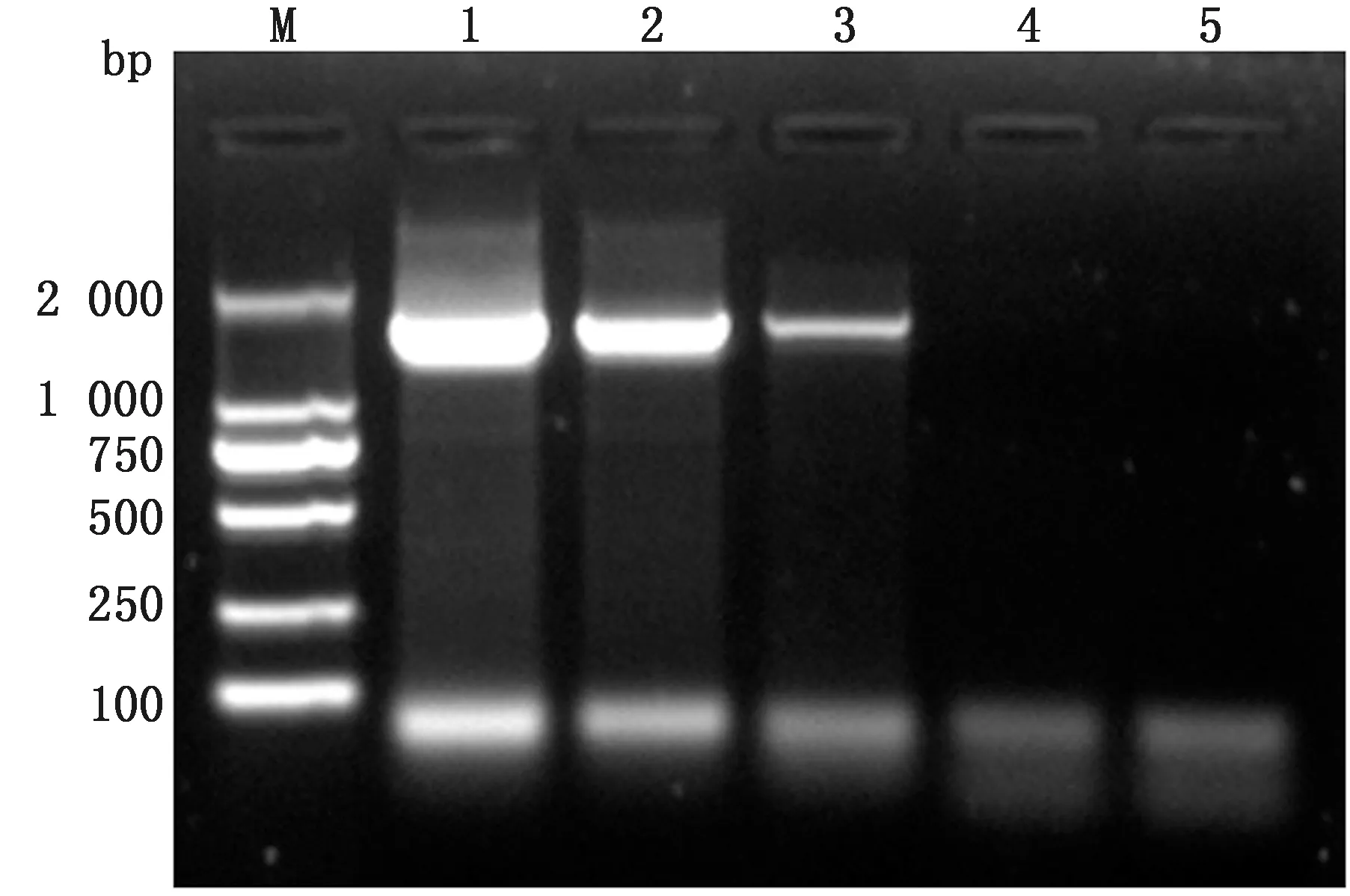
1.阳性肺组织;2.阳性鼻液;3.阳性外周血白细胞;4.健康肺组织;5.空白对照
3 讨论
2001年MAEDA等[14]发现JSRVenv基因在小鼠成纤维细胞(NIH3T3)中单独表达可引起细胞发生转化;本实验室张宇飞等[15]通过对内蒙株JSRVenv全长进行克隆表达,发现Env可以引起NIH3T3细胞发生恶性转化;杜方原等[16]、赵娟等[17]通过构建外源性绵羊肺腺瘤病毒囊膜基因(exJSRV-env) 的重组质粒,分别转染至小鼠成纤维细胞(NIH3T3)和永生化绵羊绒毛膜滋养层细胞(STCs)中,发现JSRV Env 蛋白可促进 NIH3T3 细胞和STCs细胞的增殖和恶性转化。以上研究结果表明 JSRV Env是致瘤作用的主要原因。由于内外源性JSRV基因组在同源性上高度相似,为了排除enJSRV的干扰,通过DNAMAN比对二者env序列,选择在env基因的TM区设计特异性引物和探针,以病羊肺组织提取的RNA反转录cDNA为模板进行exJSRV实时荧光RPA快速检测。
目前已经报道的JSRV的分子生物学检测方法有PCR、qPCR、LAMP、巢式PCR。PCR检测方法耗时长、检测步骤与程序相对复杂,结果需要进行琼脂糖凝胶电泳后才可得到[18];qPCR法虽然相对于PCR法来说,操作简单,但是检测仪器复杂昂贵,需对温度条件进行摸索[19];LAMP方法是等温扩增,但需要的引物设计难度较高,试验结果存在假阳性的问题[20];巢式PCR在进行第2次扩增时污染的几率较高[21]。而荧光RPA技术可以在恒温的条件下对目的片段进行扩增,与荧光探针结合后可以通过仪器实时反应扩增结果,相较于其他检测方法,能够在短时间内得到检测结果,同时所需仪器更加便携,方便基层检测,反应体系所需成分均以冻干粉的形式保存,储存条件要求不高,有利于现场检测。
本研究以JSRV的env基因高可变区为靶基因,按照TwistDX Inc公司引物和探针设计原则,使用固定探针筛选出了扩增效果最优的引物组合,确定了最佳反应条件和体系,建立了能够在40℃、20 min 检测出exJSRV的荧光RPA方法。所建立的方法具有良好的重复性,能够在相同位置出现扩增曲线;特异性强,对PPRV、BEV、BPIV3、IBRV、OSS和MO等继发呼吸道疾病的病原无交叉反应;在样品检测中,与PCR检测结果一致,检测最低质量浓度为106ng/L,纯化后检测最低质量浓度为10 ng/L,由于所提取病羊肺组织中的RNA及反转录得到的cDNA并非都是JSRV核酸,因此对检测模板进行纯化,目的是得到所建立方法能够检测到的最低值,对于临床应用中,模板中只要病毒载量达到10 ng/L就可以检测出。
RPA技术自2006年面世以来,已经建立了多种可现场特异性检测微量病原体DNA或RNA的检测方法。黄超华等[22]建立了猪圆环病毒2型RPA恒温扩增检测方法,能够在40℃、20 min内检测到87 ng/L的DNA模板;熊炜等[23]建立了对犬冠状病毒(CCV)的实时荧光RPA方法,能够在39℃、25 min内检测到104ng/L的cDNA模板;王潇等[24]建立了禽流感病毒H5亚型RT-exoRPA方法,能够在40℃、20 min内检测到8.9×102ng/L的RNA模板。以上检测方法的建立说明RPA技术已经成熟应用于各类病原体的检测,为本研究建立的JSRV荧光RPA方法提供可靠依据,该方法仅在20 min内检测到10 ng/L的cDNA,在检测时间和灵敏度方面优于上述其他方法。
综上所述,本研究建立的exJSRV的荧光RPA检测方法,特异性强、灵敏度高、反应快速、操作手法简单,是快速检测exJSRV的有效手段,对于基础设施较差的临床养殖场进行疾病筛查具有重要意义。
