2种苜蓿混合青贮饲料品质比较研究
2023-03-07王晓娜孙国君孙建政库倩倩沈思军王旭哲
王晓娜 孙国君 孙建政 库倩倩 沈思军 王旭哲
(石河子大学动物科技学院,石河子832000)
为了解决苜蓿鲜草糖分含量较低、苜蓿青贮难以调制的问题,传统的苜蓿青贮方法是将玉米等高糖饲料作物和苜蓿混合青贮,以改善苜蓿青贮的发酵品质。然而,目前仍存在诸多尚待解决的问题。青贮过程中由于自身植物酶和青贮中微生物共同作用,导致发酵时蛋白质水解,大量蛋白质转化成非蛋白氮,这降低了蛋白质品质[1-2]。苜蓿青贮蛋白质降解成非蛋白氮的现象贯穿整个青贮过程,新鲜牧草中79%以上氮以真蛋白质形式存在,青贮后紫花苜蓿的非蛋白氮达到52.1%~70.2%[3];青贮60 d后,苜蓿蛋白质损失率可达11%[4];同时,青贮饲料产生的有机酸和氨态氮降低了适口性和采食量。已有文献报道,用含有杀菌物质的植物同其他饲料作物混合青贮,同样可以获得高质量的青贮饲料[5]。松针中含有杀菌、抑菌活性物质,对细菌具有一定的抑制和杀灭作用。前人试验证明,在苜蓿青贮饲料中将落叶松针叶与苜蓿按1∶1比例混合制成青贮饲料,pH和产气量最低,在该青贮料中微生物的发酵过程和生命活动都受到极大的抑制[6]。本课题组前期研究也证实,松针与苜蓿混贮比例为3∶7和5∶5时青贮效果较好[7]。在前期研究基础上,本试验通过分析和比较2种苜蓿混合青贮饲料品质指标的差异,以期为松针的应用和提高青贮饲料品质提供新的技术措施。
1 材料与方法
1.1 试验材料
本试验所用苜蓿产自石河子大学动物科技学院试验田,于第二茬初花期(2019年6月下旬)刈割;樟子松松针采自石河子大学校园。
1.2 试验设计
试验分2个组,将苜蓿青草和樟子松松针切短至1~2 cm,以苜蓿鲜重计,在苜蓿鲜草中分别添加10%玉米粉(CAMS组)和30%松针(PAMS组),混合均匀后,密封于青贮罐中,每个组3个重复。分别于青贮发酵的第0、1、3、5、7、15、30、45和60天打开青贮罐,取样,备测。
1.3 指标测定
1.3.1 感官评价
青贮结束后,按照《青贮饲料质量评定标准(试行)》[8],从色泽、气味和质地3个方面对青贮饲料进行感官评价。
1.3.2 营养成分测定
青贮饲料中干物质(DM)含量采用烘干恒重法测定;粗蛋白质(CP)含量采用凯氏定氮法测定;中性洗涤纤维(NDF)和酸性洗涤纤维(ADF)含量采用范氏洗涤纤维法测定,具体测定方法参考《饲料分析及饲料质量检测技术》[9];可溶性碳水化合物(WSC)含量采用蒽酮-硫酸比色法[10]测定。
1.3.3 发酵品质指标测定
取青贮饲料样品20 g置于250 mL锥形瓶中,加约180 mL蒸馏水,于4 ℃冰箱中浸提24 h,先用4层粗纱布过滤,再用滤纸精滤后获得浸提液[11]。测定pH后,将浸提液装入离心管并置于-20 ℃冰箱中保存,测定氨态氮(NH3-N)、乳酸(LA)、乙酸(AA)、丙酸(PA)和丁酸(BA)含量。
pH采用雷磁PHSJ-3F pH计测定;NH3-N含量采用苯酚-次氯酸钠比色法[12]测定;乳酸含量采用对-羟基联苯比色法[13]测定;乙酸、丙酸和丁酸含量采用液相色谱法[14]测定。
1.3.4 微生物数量测定
微生物数量采用平板计数法进行计数。在超净台准确称取5 g样品,剪碎混匀后,放入有45 mL无菌水的锥形瓶中。在常温摇床上处理1 h后使用无菌水稀释10-1~10-8,选择适宜的梯度涂布。乳酸菌(lactic acid bacteria,LAB)在MRS培养基上37 ℃培养3 d后,选择有显著特征的菌落计数;酵母菌和霉菌分别在孟加拉红琼脂平板和葡萄糖麦芽浸膏琼脂平板上25 ℃恒温培养箱中培养3 d后计数;好氧细菌(aerobic bacteria,AB)在普通琼脂培养基上37 ℃培养24 h后计数[15];大肠杆菌(Escherichiacoli,EC)使用伊红美兰培养基培养48 h后计数。
1.3.5 霉菌毒素含量测定
采用酶联免疫吸附试验(ELISA)法检测总黄曲霉毒素(AFT)、玉米赤霉烯酮(ZEN)、呕吐毒素(DON)和T2毒素(T2)含量,使用百奥森(江苏)食品安全科技有限公司生产的ELISA检测试剂盒,按照试剂盒提供的方法进行测定。
1.4 数据处理与分析
试验数据采用Excel 2016初步整理后,使用SPSS 19.0统计软件进行数据分析,结果采用“平均值±标准差”表示,对同一组不同时间点平均值进行单因素方差分析(one-way ANOVA),并用Duncan氏法进行多重比较,对组间平均值进行t检验分析,以P<0.05作为差异显著判断标准。
2 结果与分析
2.1 2种苜蓿混合青贮饲料感官评价
2种苜蓿混合青贮饲料感官评价见表1。青贮结束时,2组青贮饲料未发现霉变现象,色泽、气味以及质地均符合优等青贮标准。与玉米粉与苜蓿混合青贮相比,松针与苜蓿混合青贮具有酸香味和松针清香味。

表1 2种苜蓿混合青贮饲料感官评价
2.2 2种苜蓿混合青贮饲料青贮过程中常规营养成分的变化
由表2可知,2组的DM含量均从青贮第3天开始显著下降(P<0.05),青贮第7天后均无显著变化(P>0.05);青贮前后,CAMS组和PAMS组的DM损失率分别为6.63%和5.27%,且PAMS组的DM损失率显著低于CAMS组(P<0.05)。CAMS组各时间点的CP含量显著高于PAMS组(P<0.05);青贮前后,CAMS组的CP含量降低了11.41%(P<0.05),PAMS组的CP含量降低了4.27%(P>0.05),且PAMS组的CP损失率显著低于CAMS组(P<0.05)。随着青贮时间的延长,2组的NDF和ADF含量均有升高趋势,但差异不显著(P>0.05);同一时间点2组的NDF和ADF含量之间无显著差异(P>0.05)。2组的WSC含量从青贮第0天至第30天显著下降(P<0.05),之后无显著变化(P>0.05);各时间点PAMS组的WSC含量显著低于CAMS组(P<0.05);CAMS组和PAMS组的WSC损失率分别为46.07%和38.35%,且PAMS组的WSC损失率显著低于CAMS组(P<0.05)。
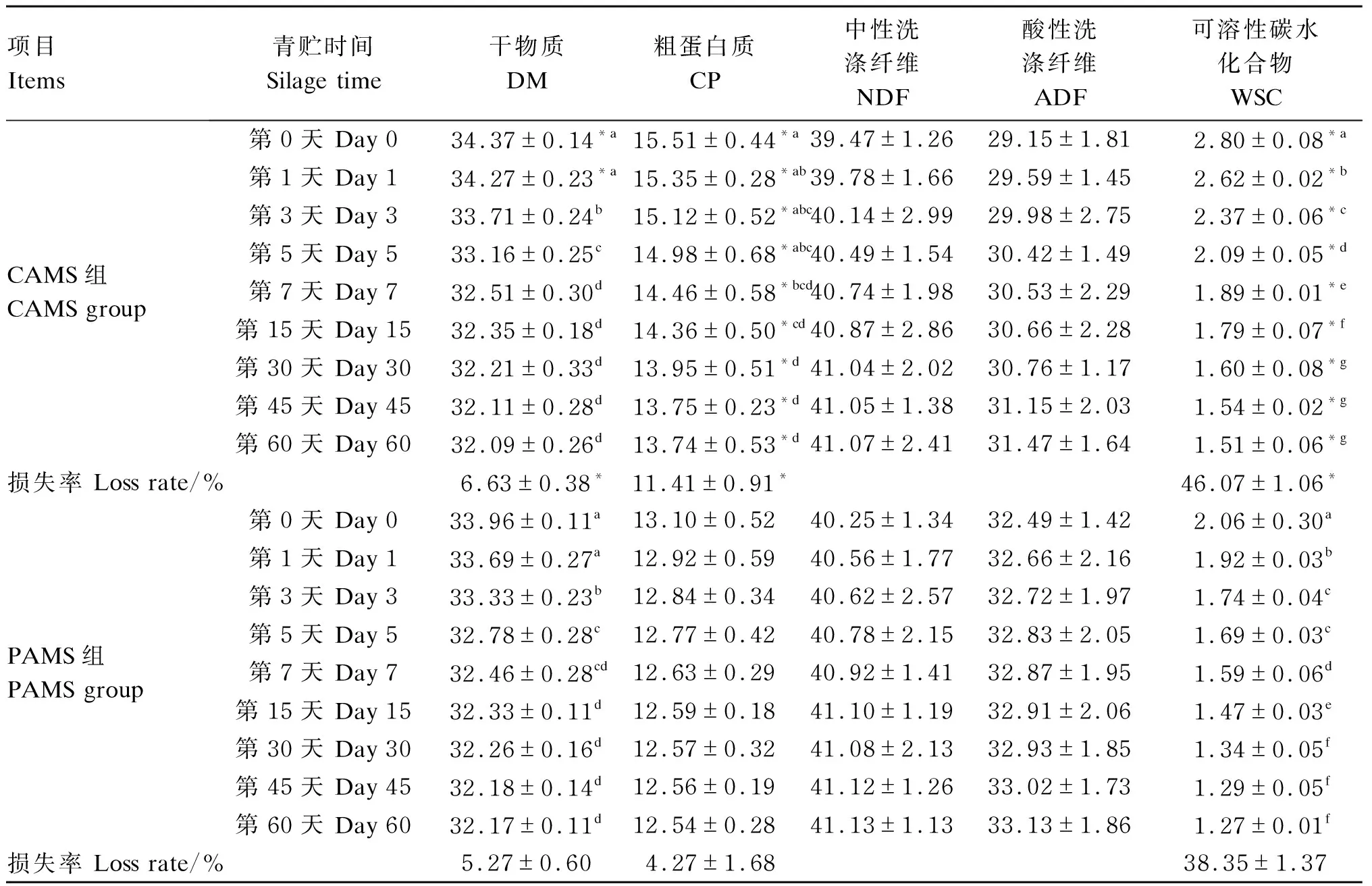
表2 2种苜蓿混合青贮饲料青贮过程中常规营养成分的变化(干物质基础)
2.3 2种苜蓿混合青贮饲料青贮过程中发酵品质的变化
由表3可知,2组的pH随着青贮时间的延长而下降。从青贮第0天至第45天,CAMS组的pH显著下降(P<0.05),之后至试验结束无显著变化(P>0.05);从青贮第3天至第15天,PAMS组的pH显著下降(P<0.05),第30天至青贮结束保持不变(P>0.05);青贮过程中,各时间点PAMS组的pH均显著高于CAMS组(P<0.05)。从青贮第0天至第45天,2组的乳酸含量均显著上升(P<0.05),随后保持不变直至青贮结束(P>0.05);各时间点PAMS组的乳酸含量显著低于CAMS组(P<0.05)。

表3 2种苜蓿混合青贮饲料青贮过程中发酵品质的变化
从青贮第0天至第45天,2组的乙酸含量均显著上升(P<0.05),随后保持不变直至试验结束(P>0.05);各时间点PAMS组的乙酸含量显著低于CAMS组(P<0.05)。青贮开始时,CAMS组和PAMS组均未检测到丙酸;从青贮第1天至第45天,CAMS组的丙酸含量显著升高(P<0.05),随后保持不变直至试验结束(P>0.05);从青贮第3天至第60天,PAMS组的丙酸含量显著升高(P<0.05);除前3 d外,其余时间点PAMS组的丙酸含量显著低于CAMS组(P<0.05)。青贮开始时,2组均未检测到丁酸;从青贮第5天至第45天,CAMS组的丁酸含量显著升高(P<0.05),随后保持不变直至试验结束(P>0.05);从青贮第15天至第60天,PAMS组的丁酸含量显著升高(P<0.05);除前7 d外,其余时间点PAMS组的丁酸含量显著低于CAMS组(P<0.05)。从青贮第0天至第45天,CAMS组和PAMS组的NH3-N/总氮(TN)值均显著上升(P<0.05),之后无显著变化(P>0.05);各时间点PAMS组的NH3-N/TN值显著低于CAMS组(P<0.05)。
2.4 2种苜蓿混合青贮饲料青贮过程中微生物数量的变化
由表4可知,从青贮第0天至第7天,2组的乳酸菌数量显著上升(P<0.05),之后逐渐显著下降(P<0.05),第30天至青贮结束无显著变化(P>0.05);在青贮的第1、3和5天,PAMS组的乳酸菌数量显著低于CAMS组(P<0.05),之后2组的乳酸菌数量无显著差异(P>0.05)。从青贮第0天至第5天,2组的酵母菌数量显著上升(P<0.05),之后逐渐显著下降(P<0.05),第45天至青贮结束无显著变化(P>0.05)。除青贮的第0、1天外,其他时间点PAMS组的酵母菌数量显著低于CAMS组(P<0.05);从青贮第3天至第7天,CAMS组的霉菌数量显著下降(P<0.05),之后至青贮结束未检测到霉菌;从青贮第0天至第5天,PAMS组的霉菌数量显著下降(P<0.05),之后至青贮结束未检测到霉菌;青贮第1、3和5天,PAMS组的霉菌数量显著低于CAMS组(P<0.05),青贮结束后,2组均未检测到霉菌。
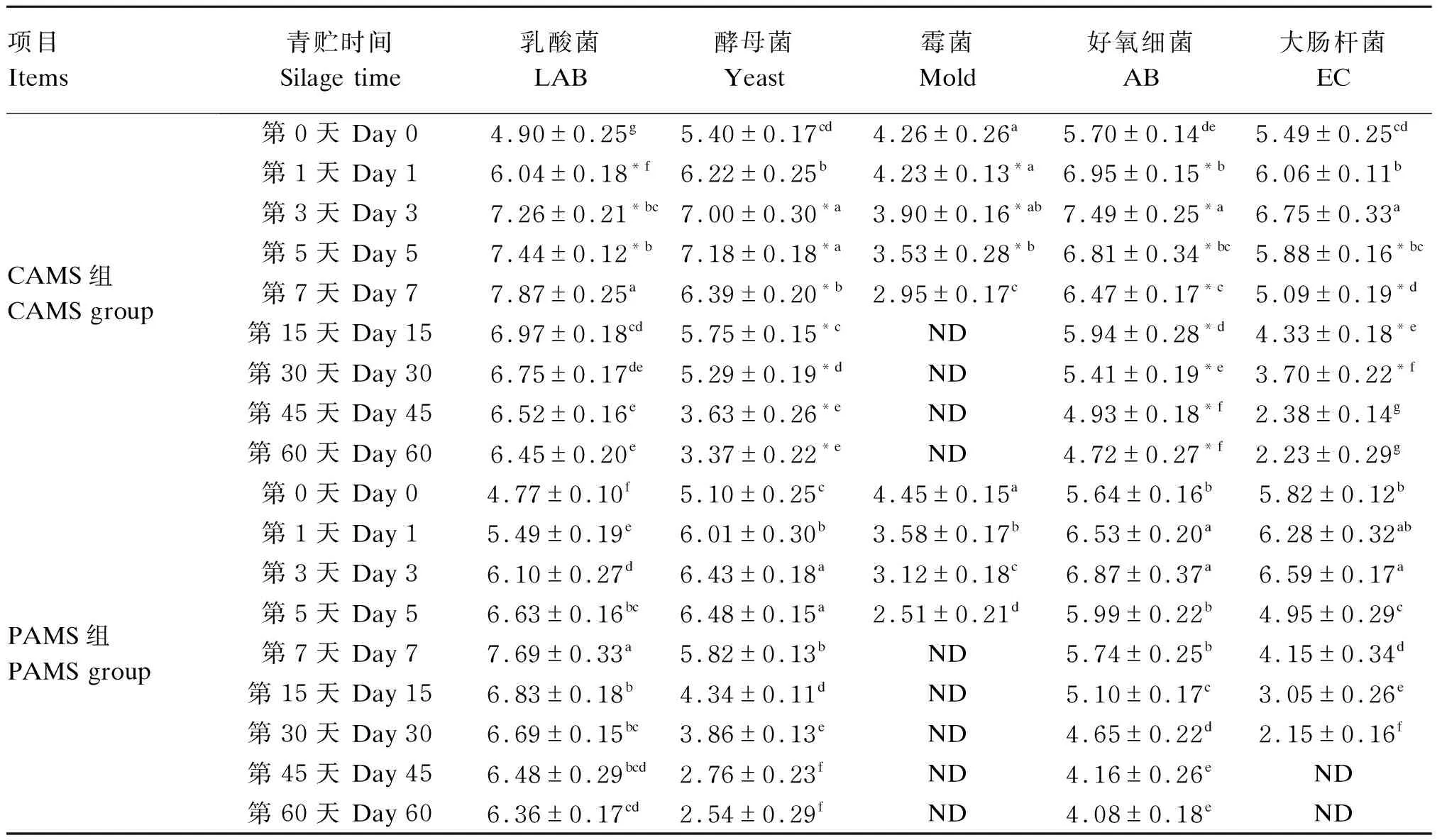
表4 2种苜蓿混合青贮饲料青贮过程中微生物数量的变化
从青贮第0天至第3天,2组的好氧细菌数量显著上升(P<0.05),之后逐渐显著下降(P<0.05),第45天后基本稳定至青贮结束(P>0.05);青贮过程中,PAMS组的好氧细菌数量均显著低于CAMS组(P<0.05)。从青贮第0天至第3天,CAMS组的大肠杆菌数量显著上升(P<0.05),之后逐渐显著下降(P<0.05),第45天后基本稳定至青贮结束(P>0.05);从青贮第5天至第30天,PAMS组的大肠杆菌数量显著低于CAMS组(P<0.05),青贮结束时,PAMS组未检测到大肠杆菌。
2.5 2种苜蓿混合青贮饲料青贮过程中霉菌毒素含量的变化
由表5可知,从青贮第0天至第15天,2组的总AFT含量显著上升(P<0.05),第30天至青贮结束无显著变化(P>0.05);同一时间点PAMS组的总AFT含量显著低于CAMS组(P<0.05)。从青贮第3天至第7天,CAMS组的ZEN含量显著上升(P<0.05),之后至青贮结束无显著变化(P>0.05);青贮前后,PAMS组的ZEN含量无显著差异(P>0.05);从青贮第3天开始,同一时间点PAMS组的ZEN含量显著低于CAMS组(P<0.05)。青贮前后,2组的DON含量无显著变化(P>0.05),且2组之间的DON含量无显著差异(P>0.05)。从青贮第0天至第30天,2组的T2毒素含量均显著升高(P<0.05);第30天之后无显著变化(P>0.05);同一时间点PAMS组的T2毒素含量显著低于CAMS组(P<0.05)。
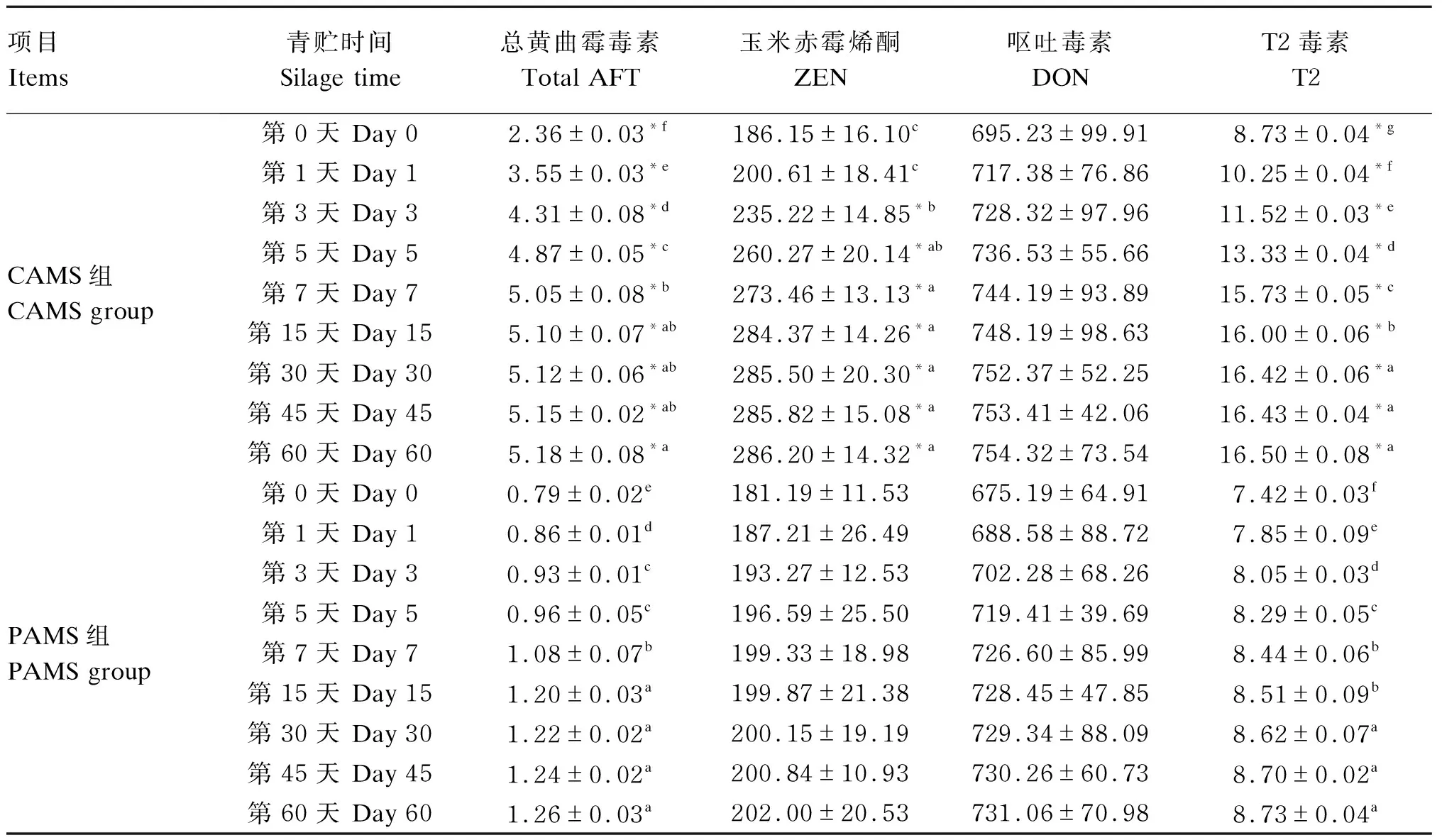
表5 2种苜蓿混合青贮饲料青贮过程中霉菌毒素含量的变化
3 讨 论
3.1 2种苜蓿混合青贮饲料感官评价
本试验感官评价表明,玉米粉与苜蓿混合青贮和松针与苜蓿混合青贮感官品质没有差异,评级均为优等。添加玉米粉增加了可溶性糖含量,可以促进乳酸菌发酵;添加松针提高了抗菌成分,因此2种处理方法均可抑制霉菌、酵母菌等有害微生物的生长繁殖,从而改善苜蓿混合青贮的品质。
3.2 2种苜蓿混合青贮饲料青贮过程中常规营养成分的变化
本试验中,随着青贮发酵的进行,2组的DM、CP和WSC含量均呈下降趋势。卢强等[16]试验发现,在苜蓿青贮第1周,DM耗损速率较快,本试验结果与之相似。其原因是苜蓿的真蛋白质在自身蛋白酶和微生物酶作用下,分解为非蛋白氮所致。青贮开始后,梭菌和腐败菌分解利用CP,导致其含量下降;随着青贮发酵的进行,梭菌和腐败菌被抑制,下降速度趋于平缓。青贮结束时,PAMS组的DM、CP和WSC损失率显著低于CAMS组。主要原因是松针精油对有害微生物有较强的抑制作用,有害微生物的作用程度低;玉米粉与苜蓿混合青贮含有较多的可溶性糖,微生物活动旺盛,有害微生物作用程度高,因而养分损失较多。
试验表明,添加玉米粉可显著降低苜蓿青贮NDF和ADF含量[17-18],原因是添加玉米粉可显著增加苜蓿青贮DM和可溶性糖的含量,导致纤维含量相对降低。本试验表明,2组的NDF和ADF含量青贮前后差异均不显著,可能是松针和玉米粉的添加量对混合苜蓿青贮的NDF和ADF含量未能产生明显影响。
3.3 2种苜蓿混合青贮饲料青贮过程中发酵品质的变化
Meeske等[19]研究发现,如果青贮原料DM含量比较高,则青贮饲料的pH未必需要小于4.2。本试验也表明,由于2组青贮原料DM含量较高,虽然pH高于4.2,但品质优良。现有文献报道,玉米粉含有较高的WSC,可促进乳酸菌增殖;随着玉米含量逐渐增加,苜蓿与玉米混合青贮的pH显著降低,乳酸含量显著升高[20-21]。本试验中,松针与苜蓿混合青贮可以利用松针中所含的抑菌物质抑制有害菌的繁殖,促进乳酸菌生长,所以与玉米粉与苜蓿混合青贮相比较,松针与苜蓿混合青贮中的乳酸含量低,pH高。乙酸由厌氧菌产生,过量的乙酸可降低动物的采食量;丙酸在正常青贮中含量很少,主要是丙酸杆菌、反刍硒单胞菌以及丙酸梭菌的产物[22];丁酸由丁酸梭菌分解氨基酸产生,会造成养分损失,意味着青贮饲料保存不良[23]。松针与苜蓿混合青贮的乙酸、丙酸和丁酸含量显著低于玉米粉与苜蓿混合青贮,这是由于青贮过程中乳酸菌等优势菌的大量繁殖,以及松针所含抑菌成分对上述菌群产生抑制作用所致。
NH3-N/TN值能够展示青贮饲料的CP以及氨基酸被降解的程度,该值越大,CP降解越多,且较高的NH3-N/ TN值可影响动物采食量[24]。研究表明,青贮中部分NH3-N是植物蛋白酶降解CP所产生,部分是由青贮中腐败菌降解蛋白质、氨基酸产生[25]。本试验中,由于松针所含抑菌成分抑制了梭菌等微生物的生长繁殖,从而减少了CP的分解。因此,PAMS组的NH3-N/值显著低于CAMS组。
3.4 2种苜蓿混合青贮饲料青贮过程中微生物数量的变化
青贮过程是一个复杂的微生物区系变化过程[26],涉及乳酸菌、酵母菌、霉菌及芽孢杆菌等多种微生物。微生物群落结构、演替过程及其代谢产物影响着青贮饲料的发酵品质[27]。本试验发现,青贮结束后,2组之间的乳酸菌数量无显著差异,且均未检测到霉菌;PAMS组的酵母菌、好氧细菌数量显著低于CAMS组,且松针与苜蓿混合青贮中未检测到大肠杆菌。一般认为,在苜蓿青贮中添加玉米粉可有效改善菌群结构,促进乳酸菌发酵,抑制腐败菌增殖,进而提高苜蓿青贮品质[28]。植物精油的主要成分是萜烯类化合物,具有很好的杀菌特性,对食物及植物来源真菌均具有抗菌作用[29-30]。有试验发现,在苜蓿青贮饲料中添加孜然精油和松针精油,可抑制酵母菌生长,增加乳酸菌数量,提高青贮饲料的发酵品质和有氧稳定性[31-32]。松针精油具有良好的抗菌活性、抗菌广谱性和高挥发性,对金黄色葡萄球菌、大肠杆菌、枯草杆菌、酵母菌、青霉菌和黑曲霉菌均具有抑制作用[33],且抑菌效果因菌种有所不同。孙建政等[34]研究发现,松针精油对酵母菌、梭状芽孢杆菌和串珠镰刀菌有着较强的抑制效果,对嗜酸乳杆菌则无抑制作用。在松针与苜蓿混合青贮中,松针精油抑制了有害微生物的增殖,提高了乳酸菌的数量,这是松针改善苜蓿青贮品质的主要原因。同时,这也表明在苜蓿混合青贮中添加松针对有害菌的抑制作用强于添加玉米粉。
3.5 2种苜蓿混合青贮饲料青贮过程中霉菌毒素含量的变化
霉菌毒素是霉菌在植物上生成的有毒代谢物,青贮饲料在收获前、发酵期间及开窖后都会受到霉菌毒素污染[35]。已有研究发现,在发霉饲料和没有被霉菌污染的青贮原料中均检测出霉菌毒素,青贮饲料中的ZEN和一些单端孢霉烯族毒素不受厌氧和酸性条件影响[36],青贮条件下不易被降解,可持续存在。据文献报道,植物精油不仅能有较抑制真菌生长,而且可抑制真菌产生霉菌毒素[37]。本试验表明,青贮结束时,松针与苜蓿混合青贮的总AFT、ZEN和T2毒素含量均显著低于玉米粉与苜蓿混合青贮,其原因可能是松针精油抑制了霉菌毒素的产生,其机制尚不明确。植物精油抑制真菌产生毒素的机理极为复杂,通常认为在较高浓度下,植物精油主要通过抑制真菌生长而抑制真菌毒素的产生;而在较低浓度下,植物精油则通过下调毒素关键调控和合成结构基因的表达而抑制真菌毒素的生物合成[38]。
4 结 论
① 松针与苜蓿混合青贮的DM、CP和WSC损失率及NH3-N/TN值,酵母菌、好氧细菌和大肠杆菌数量,以及总AFT、ZEN和T2毒素含量显著低于玉米粉与苜蓿混合青贮。
② 综合考虑,松针与苜蓿混合青贮的品质显著高于玉米粉与苜蓿混合青贮,松针可改善苜蓿青贮饲料的品质。
