奶牛围产后期血液代谢物动态变化规律研究
2023-03-14王菲菲孔维怡段静丹郭延生
王菲菲 孔维怡 段静丹 岳 康 刘 欣 郭延生
(宁夏大学农学院,银川750021)
目前普遍认为产前3周到产后3周是奶牛的围产期,其中产前3周称为围产前期,产后3周称为围产后期,围产期奶牛健康与其生产性能和繁殖性能密切相关[1]。尤其是围产后期受分娩、泌乳启动以及饲粮结构改变等诸多应激因素的影响,奶牛体内激素水平、代谢状态和免疫机能会发生巨大扰动,这增加了酮症、瘤胃酸中毒、乳腺炎、胎盘滞留、真胃变位和子宫炎等代谢性和炎性疾病患病风险[2]。因此,探究奶牛围产期代谢机能的变化规律对围产期的营养调控和疾病预防具有十分重要的意义。围绕奶牛围产期血液代谢物的变化国内外学者也做了大量研究。Douglas等[3]利用酶比色法发现,奶牛分娩后血清中棕榈酸、硬脂酸、油酸和亚油酸含量明显上升。Pilotto等[4]利用红外检测方法探究了奶牛围产期血液脂肪酸、β-羟基丁酸酯(BHB)和α-生育酚含量变化之间的关系,发现脂肪酸含量在奶牛分娩时达到最大值,BHB含量在奶牛分娩时增加了27%、产后30 d继续增加20%,α-生育酚含量在产犊时最低。代谢组学是通过研究生物体系受外部刺激所产生的代谢产物含量变化的一门科学[5]。与传统生理生化检测方法相比,代谢组学具有灵敏度和重复性高、样品处理简单以及可一次性测定体内大多数代谢物的优点[6]。Luo等[7]采用代谢组学技术研究了奶牛产前21 d到分娩当天血液代谢物的变化规律,发现分娩当天与氧化脂质相关的物质亚油酸、花生四烯酸、γ-亚麻酸和磷脂酰胆碱较产前21 d显著上调,而与氨基酸代谢相关的代谢物则表现出显著下调。不过,目前对于奶牛围产期血液代谢组动态变化规律的相关研究报道较少。因此,本研究采用高灵敏度和分辨率的超高液相色谱-串联质谱(UPLC-MS/MS)代谢组学技术研究了奶牛产后0(分娩当天)、7、14和21 d血液代谢物的变化情况,旨在评价奶牛围产后期体内代谢水平的变化规律,为围产后期营养调控和疾病预防提供一定的参考依据。
1 材料与方法
1.1 试验动物的选择、分组及采样
在宁夏某集约化奶牛养殖场,选择7头体重[(600±20) kg]、胎次(2~3次)和体况评分(3.2~3.5)相近的荷斯坦奶牛,分别在产后0、7、14和21 d于尾静脉采集血液。在产后21 d内每头奶牛血酮值均小于1.0,采食量和体温正常,体细胞数小于20万个/mL,经兽医诊断健康状况良好、无传染性和炎性等相关疾病。产后0 d血液样品依次标记为A-1~A-7(A组),产后7 d血液样品依次标记为B-1~B-7(B组),产后14 d血液样品依次标记为C-1~C-7(C组),产后21 d血液样品依次标记为D-1~D-7(D组);血液样品制备成血浆在-80 ℃环境中保存待测。围产后期采用统一的全混合日粮(TMR)饲喂,TMR组成及营养水平见表1。
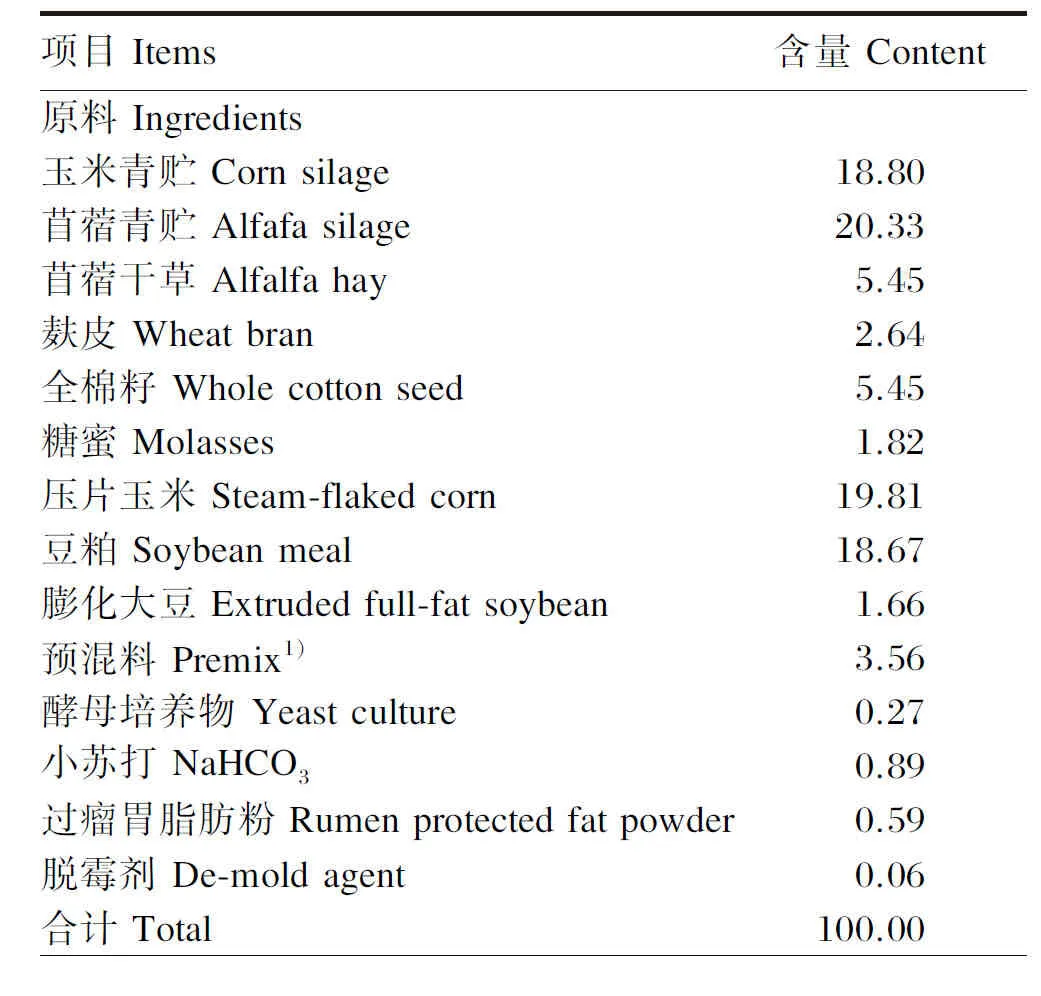
表1 奶牛围产后期TMR组成及营养水平(风干基础)

续表1项目 Items含量 Content营养水平 Nutrient levels2)泌乳净能 NEL/(MJ/kg)7.45粗蛋白质 CP19.10中性洗涤纤维 NDF26.20淀粉 Starch22.80钙 Ca1.27磷 P0.62
1.2 血液样品预处理
血液样品解冻后涡旋混匀,取50 μL于EP管中,加300 μL纯甲醇内标提取液;涡旋混匀,4 ℃ 12 396 ×g离心10 min,吸取200 μL上清液到新的EP管中,于-20 ℃静置30 min后以12 396 ×g再离心3 min,取150 μL上清液进行UPLC-MS/MS分析。
1.3 UPLC-MS/MS检测
超高液相色谱(UPLC)条件:色谱柱采用Waters ACQUITY UPLC HSS T3 C18(2.1 mm×100 mm,1.8 μm);流动相为0.1%甲酸超纯水(A)-0.1%甲酸乙腈(B);梯度洗脱0~10 min、95% A,10~11 min、10% A,11~14 min、95% A;流速0.4 mL/min;柱温40 ℃;进样量2 μL。
串联质谱(MS/MS)条件:电喷雾离子源(ESI)设为温度500 ℃,质谱电压为5 500和-4 500 V,离子源气体Ⅰ为55 psi、气体Ⅱ为60 psi,气帘气为25 psi。碰撞诱导电离设置为高,根据去簇电压和碰撞能扫描检测每个离子对。
质控过程:按一定比例混合血样提取液,制备质控(QC)样本,每10个检测分析样本中插入1个质控样本,监测分析样本在相同处理方法下的重复性;并通过对不同QC样本质谱检测分析的总离子流图进行重叠展示分析,判断代谢物提取和检测的重复性。
1.4 血液代谢组学分析
获得的原始数据导入Excel 2019,生成包含样品编号、代谢物名称和代谢物峰值的数据矩阵。将上述处理过的数据转换为csv格式导入MetaboAnalyst 5.0软件(https://www.metaboanalyst.ca/),进行主成分分析(PCA)和正交偏最小二乘判别分析(OPLS-DA),PCA用于观察组内变异情况和组间分离趋势,OPLS-DA用于筛选确定组间差异代谢物。采用Simca 14.1软件进行模型验证,将原始分类的Y矩阵、模拟200次不同排列的Y矩阵与R2Y、Q2Y进行线性回归,得到的回归直线与y轴的截距值分别为R2和Q2,用来衡量模型是否过拟合。根据OPLS-DA模型中变量重要性投影(variable importance in projection,VIP)值,选取VIP≥1的代谢物,同时结合单变量分析的差异倍数(fold change,FC)值,进一步筛选FC≥2或FC≤0.5且P<0.05的代谢物,视为最终的血液差异代谢物。将最终筛选出的血液差异代谢物聚类分析,绘制热图,考察差异代谢的可靠性。结合京都基因与基因组百科全书(KEGG)数据库、人类代谢数据库(HMDB)构建差异代谢物相关通路。
2 结 果
2.1 奶牛围产后期血液代谢轮廓变化规律
从奶牛血液中共鉴定出532种代谢物,其中包含脂质168种,氨基酸及其代谢物98种,有机酸及其衍生物78种,核苷酸及其代谢物39种,碳水化合物及其代谢物32种,苯及其衍生物23种,杂环化合物21种,醇、胺类17种,胆汁酸17种,辅酶和维生素14种,激素及激素相关物质9种和其他16种。QC样本质谱检测显示,代谢物检测总离子流的曲线重叠性高,表明质谱对同一样品不同时间检测时,信号稳定性较好,结果可靠。
采用PCA法考察奶牛产后0、7、14和21 d血液代谢轮廓的变化。首先,对0 d与7 d、7 d与14 d、14 d与21 d血液代谢轮廓分别进行了比较,结果显示产后0 d与7 d血液代谢轮廓存在明显差异(图1-a);7 d与14 d血液代谢轮廓虽有一定差异,但大部分已重合(图1-b);14 d与21 d血液代谢轮廓已完全重合(图1-c)。其次,对0、7、14和21 d血液代谢轮廓一起进行比较,也得到了相似的变化趋势(图1-d)。这说明奶牛在产后0~7 d代谢状态和代谢物水平发生了显著变化,之后基本趋于稳定。
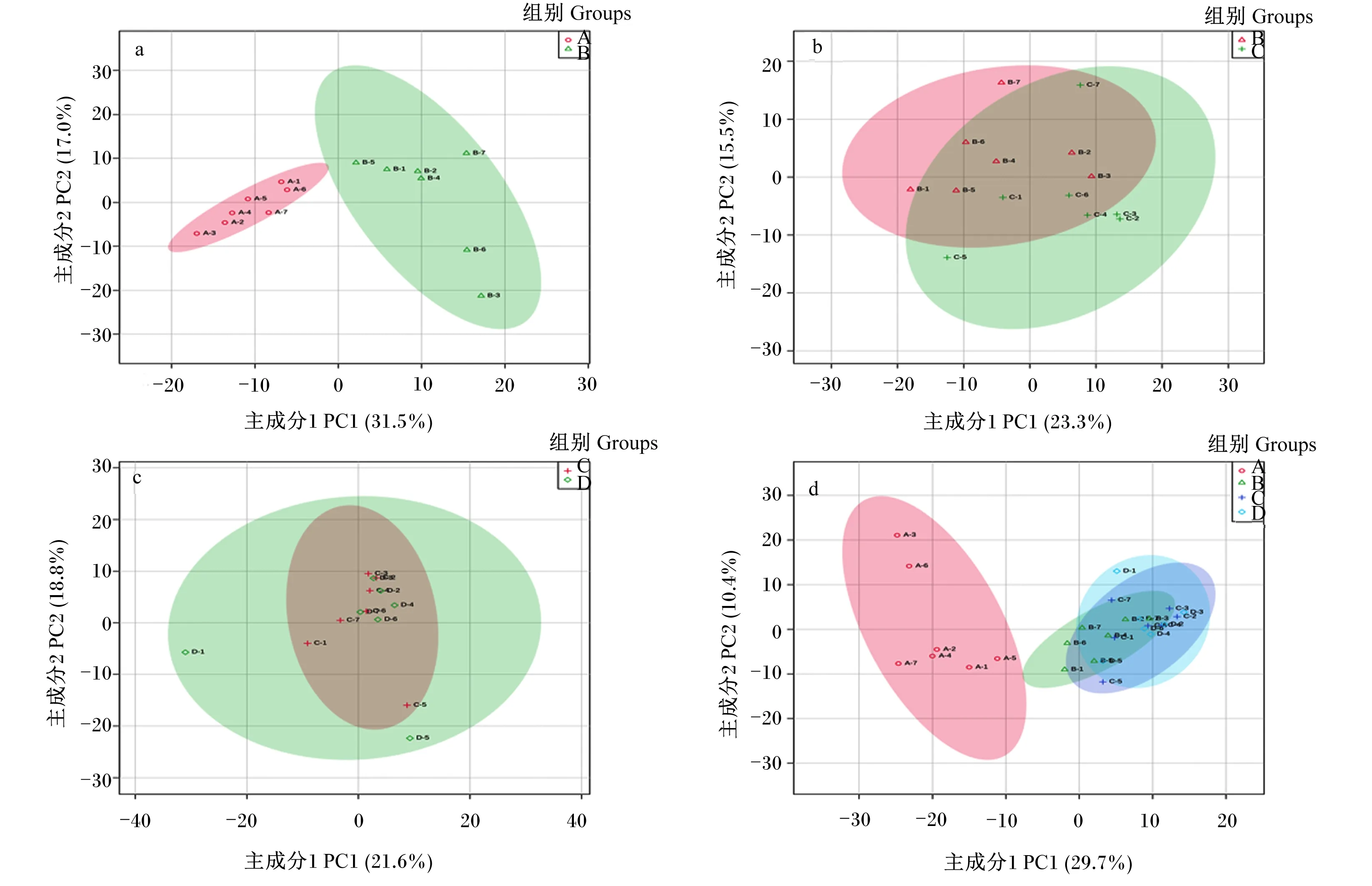
图1 奶牛围产后期血液代谢物PCA 2D散点图
2.2 奶牛围产后期血液差异代谢物的筛选及通路分析
采用OPLS-DA考察导致产后0 d与7 d血液代谢轮廓差异的相关代谢物。由图2-a可见,构建OPLS-DA模型能够将产后0 d与7 d血液样本明显区分开。OPLS-DA模型验证图(图2-b)显示,随着相关系数降低(置换保留度降低),Q2和R2逐渐降低,Q2回归曲线与纵坐标轴相交于0点以下且R2≤1,说明构建的模型置换检验过关,不存在过拟合现象,可用于差异代谢物的筛选。从该模型中选取VIP≥1的代谢物,通过单变量方差分析的P值(P<0.05)和FC值(FC≥2或FC≤0.5)筛选出了72个差异代谢物,19个差异代谢物在产后7 d显著升高(VIP≥1,P<0.05,FC≥2),见表2和图3;53个差异代谢物在产后7 d显著降低(VIP≥1,P<0.05,FC≤0.5),见表3和图3。
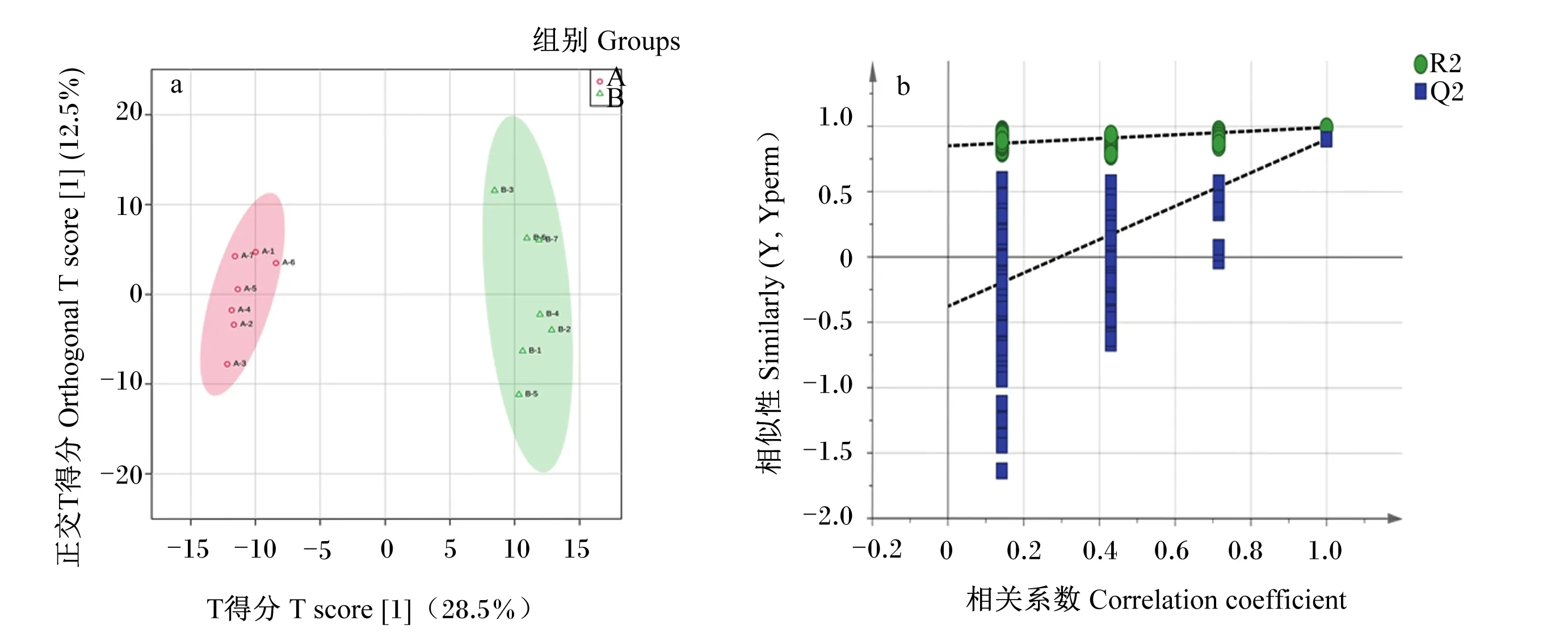
图2 奶牛产后0 d与7 d血液代谢物OPLS-DA得分图(a)和验证图(b)
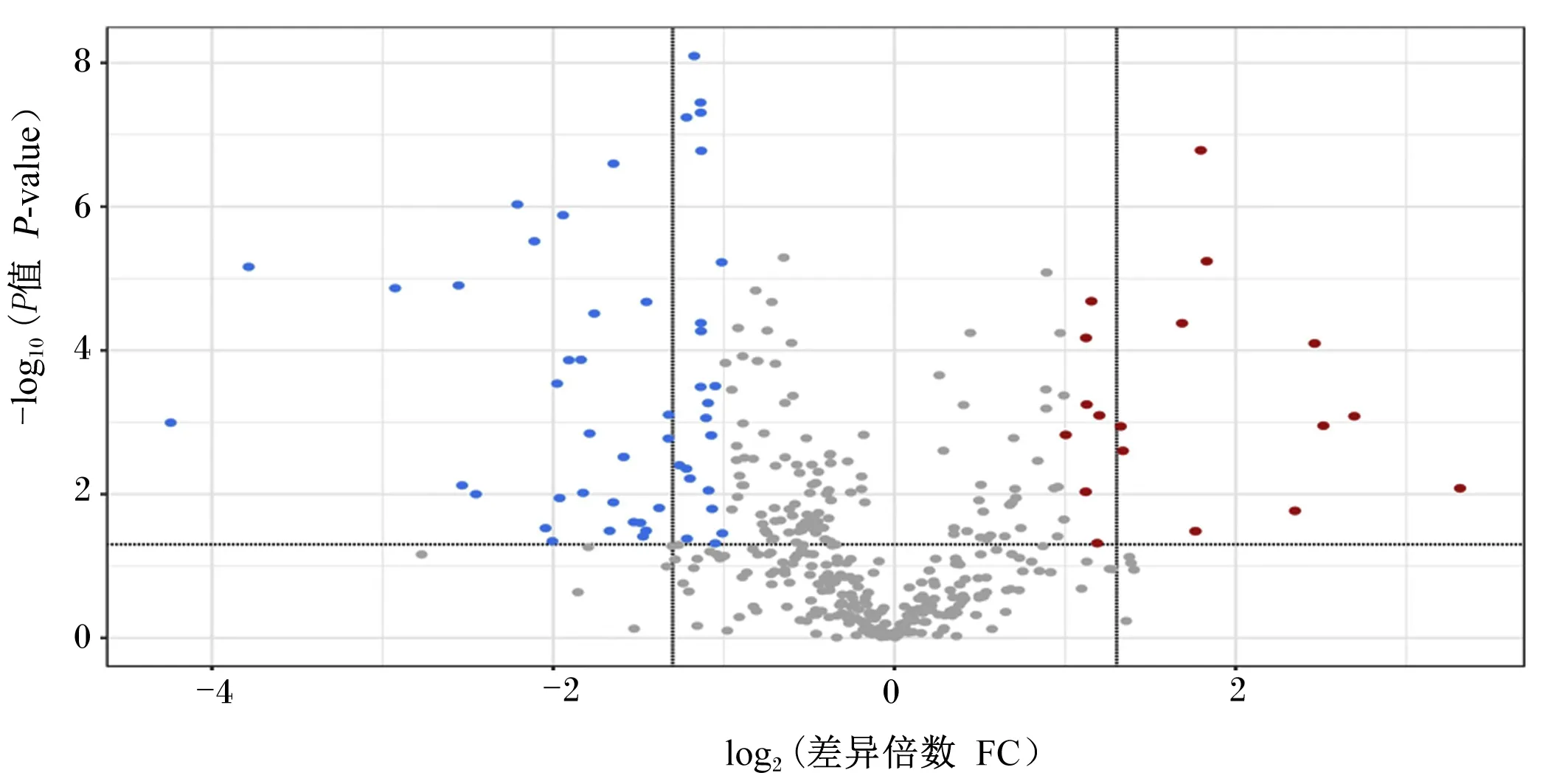
图中每一个点表示一种代谢物,蓝点代表下调的差异代谢物(P<0.05),红点代表上调的差异代谢物(P<0.05),灰色的点则代表差异不显著的代谢物(P>0.05)。
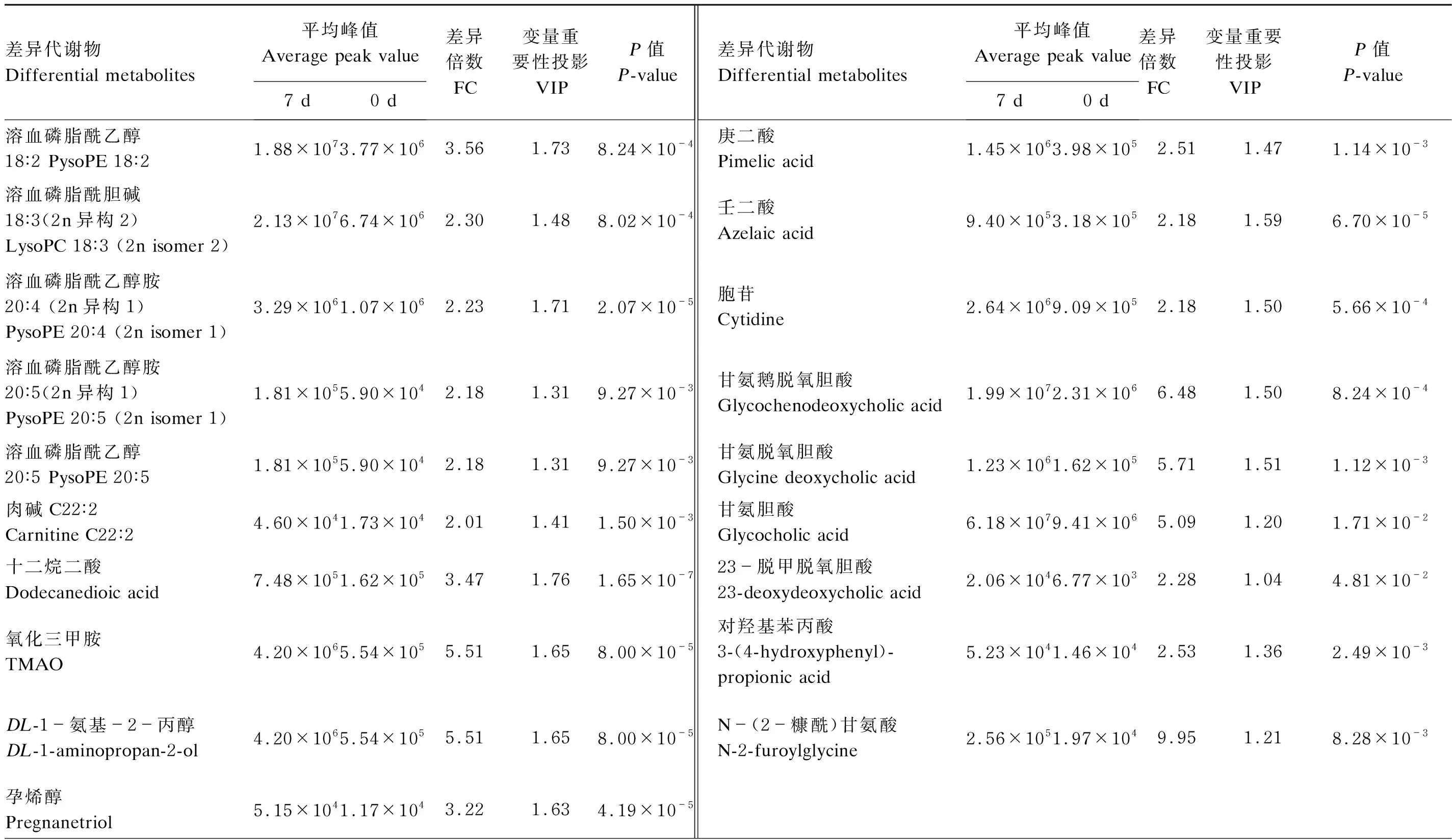
表2 奶牛产后7 d表达上调的血液代谢物及其相关参数
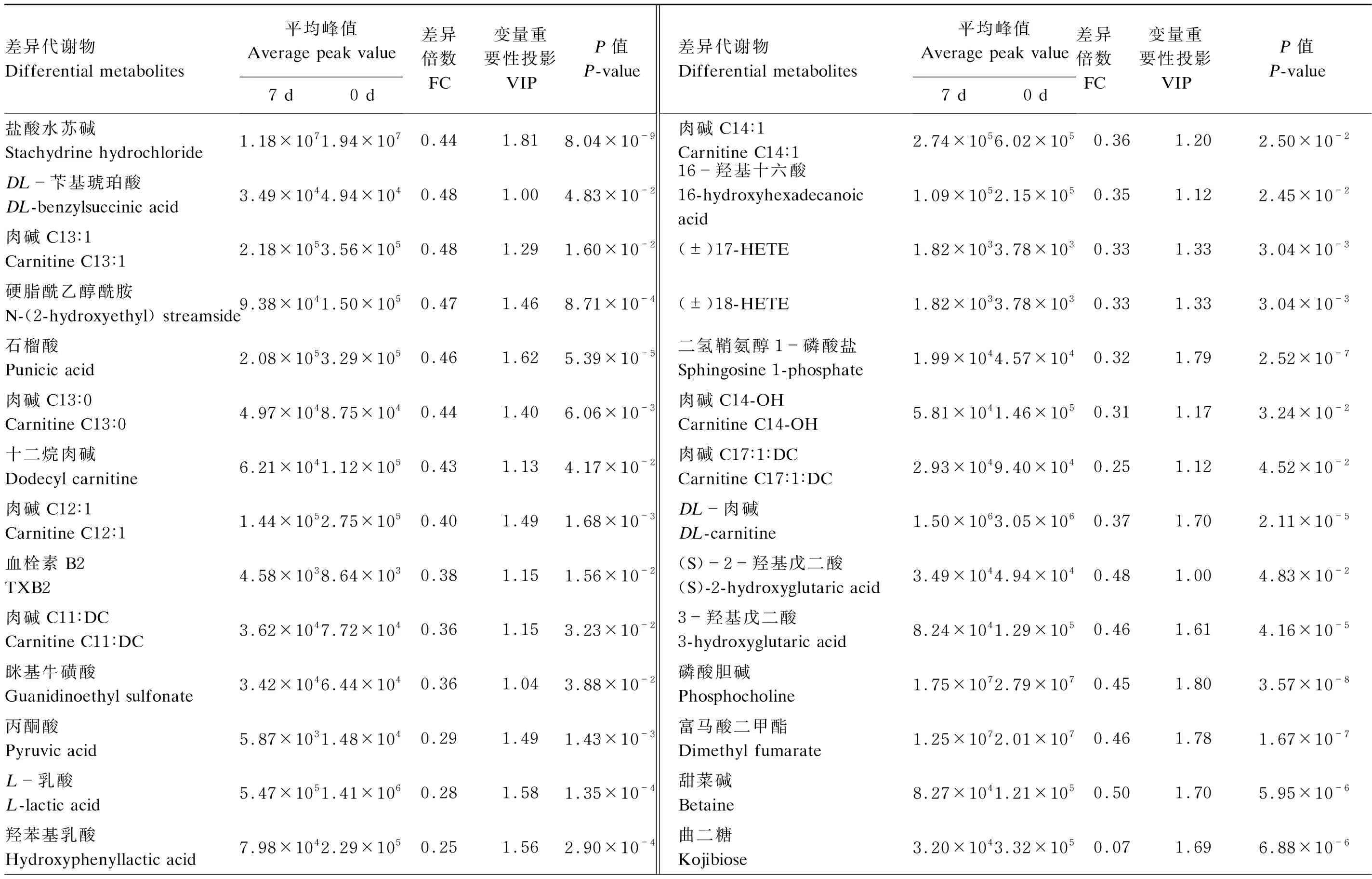
表3 奶牛产后7 d表达下调的血液代谢物及其相关参数
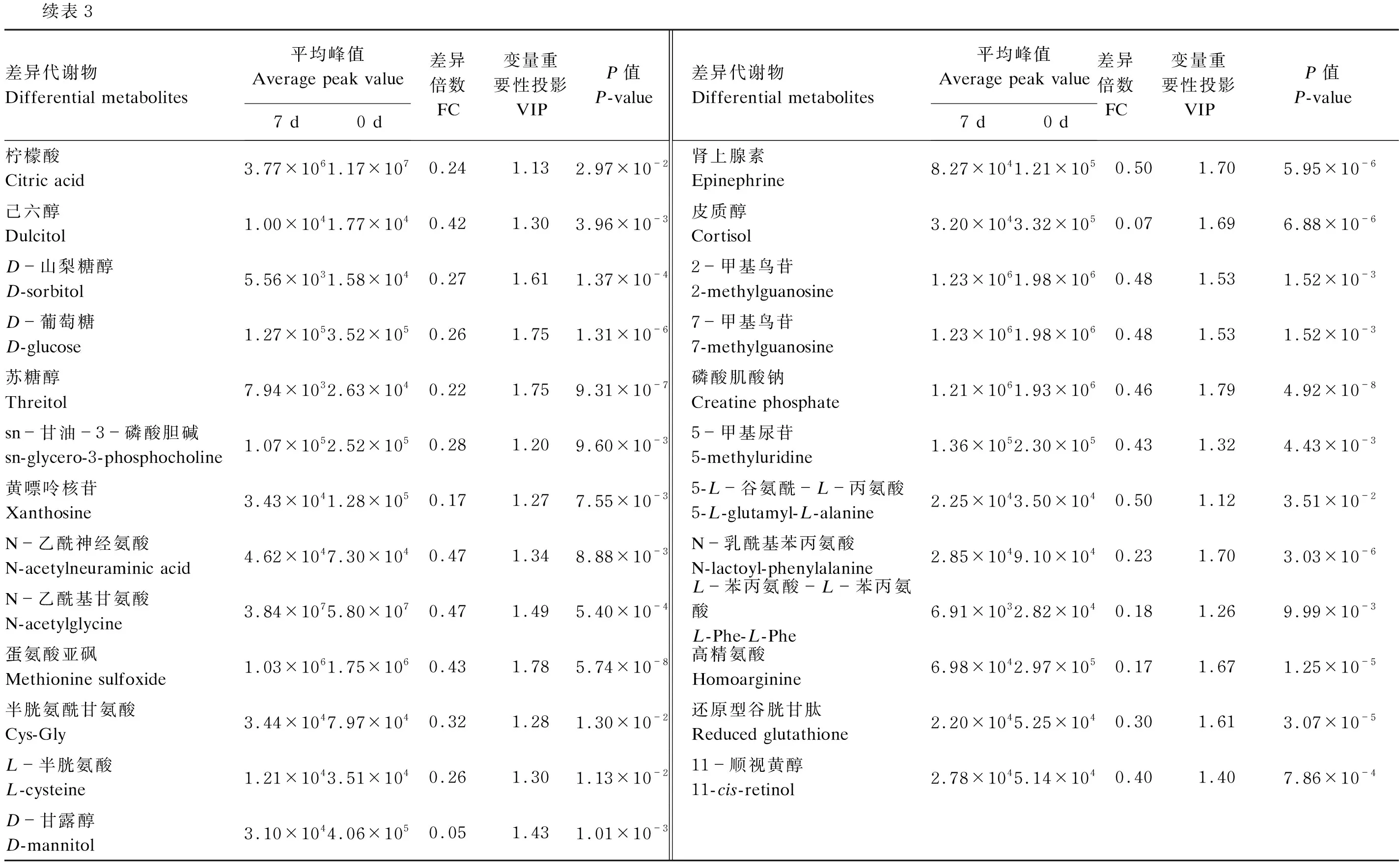
续表3差异代谢物Differential metabolites平均峰值Average peak value7 d0 d差异倍数FC变量重要性投影VIPP值P-value差异代谢物Differential metabolites平均峰值Average peak value7 d0 d差异倍数FC变量重要性投影VIPP值P-value柠檬酸 Citric acid3.77×1061.17×1070.241.132.97×10-2肾上腺素 Epinephrine8.27×1041.21×1050.501.705.95×10-6己六醇 Dulcitol1.00×1041.77×1040.421.303.96×10-3皮质醇 Cortisol3.20×1043.32×1050.071.696.88×10-6D-山梨糖醇 D-sorbitol5.56×1031.58×1040.271.611.37×10-42-甲基鸟苷 2-methylguanosine1.23×1061.98×1060.481.531.52×10-3D-葡萄糖 D-glucose1.27×1053.52×1050.261.751.31×10-67-甲基鸟苷 7-methylguanosine1.23×1061.98×1060.481.531.52×10-3苏糖醇 Threitol7.94×1032.63×1040.221.759.31×10-7磷酸肌酸钠 Creatine phosphate1.21×1061.93×1060.461.794.92×10-8sn-甘油-3-磷酸胆碱sn-glycero-3-phosphocholine1.07×1052.52×1050.281.209.60×10-35-甲基尿苷 5-methyluridine1.36×1052.30×1050.431.324.43×10-3黄嘌呤核苷 Xanthosine3.43×1041.28×1050.171.277.55×10-35-L-谷氨酰-L-丙氨酸 5-L-glutamyl-L-alanine2.25×1043.50×1040.501.123.51×10-2N-乙酰神经氨酸 N-acetylneuraminic acid4.62×1047.30×1040.471.348.88×10-3N-乳酰基苯丙氨酸 N-lactoyl-phenylalanine2.85×1049.10×1040.231.703.03×10-6N-乙酰基甘氨酸 N-acetylglycine3.84×1075.80×1070.471.495.40×10-4L-苯丙氨酸-L-苯丙氨酸 L-Phe-L-Phe6.91×1032.82×1040.181.269.99×10-3蛋氨酸亚砜 Methionine sulfoxide1.03×1061.75×1060.431.785.74×10-8高精氨酸 Homoarginine6.98×1042.97×1050.171.671.25×10-5半胱氨酰甘氨酸 Cys-Gly3.44×1047.97×1040.321.281.30×10-2还原型谷胱甘肽 Reduced glutathione2.20×1045.25×1040.301.613.07×10-5L-半胱氨酸 L-cysteine1.21×1043.51×1040.261.301.13×10-211-顺视黄醇 11-cis-retinol2.78×1045.14×1040.401.407.86×10-4D-甘露醇 D-mannitol3.10×1044.06×1050.051.431.01×10-3
将72个差异代谢物进行了聚类分析,结果显示这些差异代谢物能明显将产后0 d与7 d血液样品进行区分(图4),说明筛选出的差异代谢物能真实反映产后0 d与7 d血液代谢轮廓情况。通路分析结果显示,差异代谢物主要涉及能量代谢、脂代谢、胆汁酸代谢、激素代谢和氧化应激等通路(图5)。与能量代谢相关代谢物为丙酮酸、L-乳酸、D-葡萄糖和甜菜碱,与脂代谢相关代谢物有肉碱C11∶DC、肉碱C12∶1、肉碱C13∶0等和氧化三甲胺(TMAO),与氧化应激相关的代谢物有还原型谷胱甘肽和L-半胱氨酸,激素类物质包括肾上腺素和皮质醇,与胆汁酸代谢相关代谢物有甘氨胆酸、甘氨脱氧胆酸、23-脱甲脱氧胆酸和甘氨鹅脱氧胆酸。相关代谢物在产后0、7、14和21 d血液相对浓度变化趋势见图6。
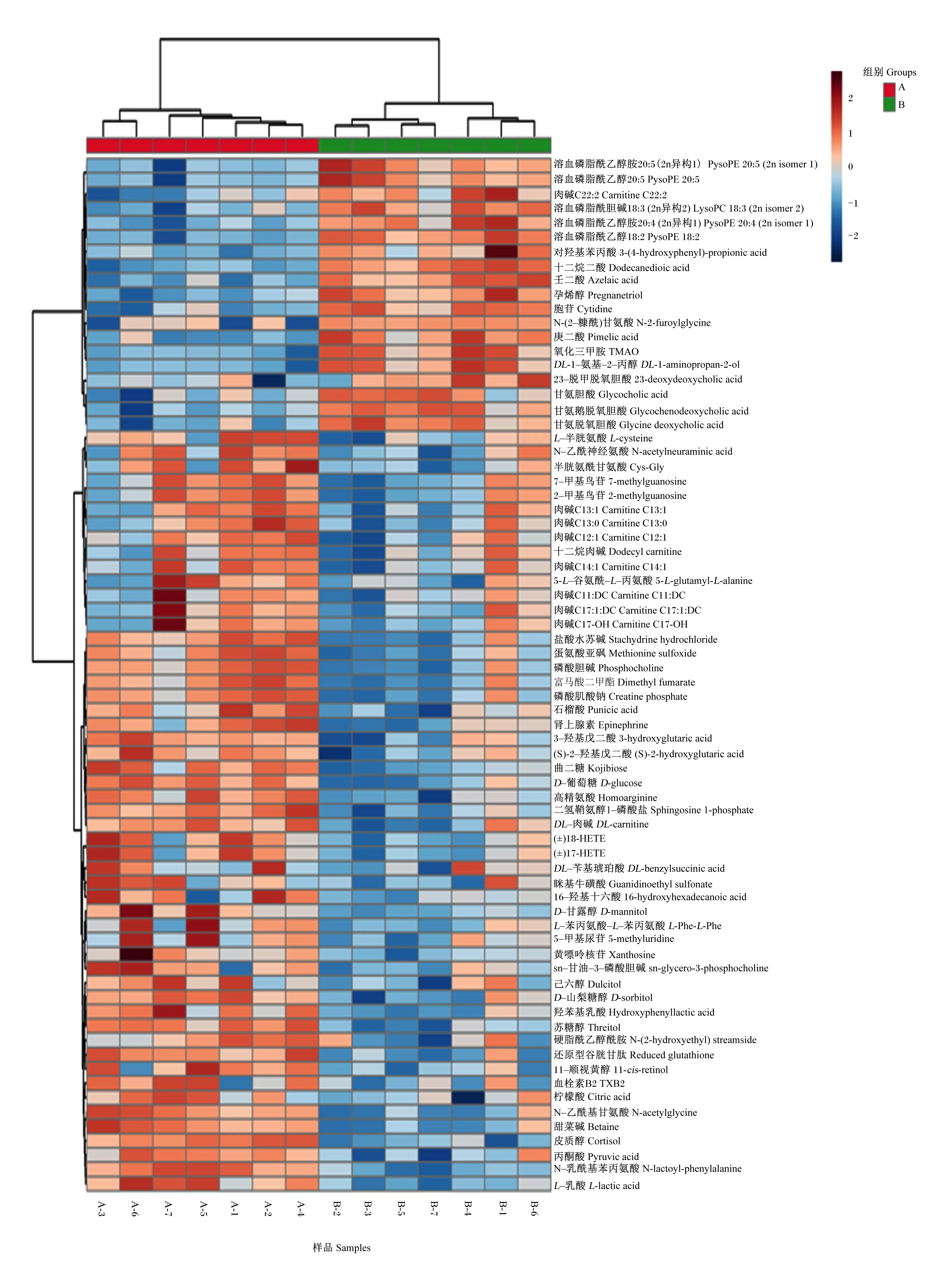
图4 奶牛产后0 d与7 d血液中72个差异代谢物聚类热图
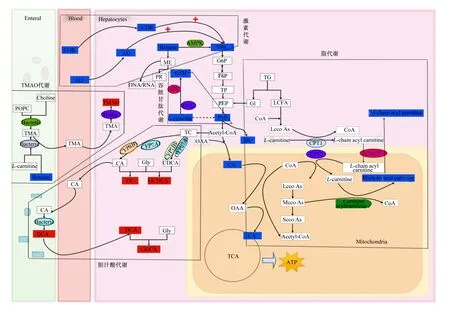
Enteral:肠内;TMAO:氧化三甲胺 trimethylamine oxide;POPC:磷脂酰胆碱 phosphatidylcholine;Choline:胆碱;Bacteria:细菌;TMA:三甲胺 trimethylamine;L-carnitine:L-肉碱;Betaine:甜菜碱;CA:柠檬酸 citric acid;DCA:脱氧胆酸 deoxycholic acid;Blood:血液;COR:皮质醇 cortisol;AD:肾上腺素 epinephrine;Hepatocytes:肝细胞;FMOs:黄素单氧酶 flavin monoxygenases;AMPK:腺苷酸活化蛋白激酶 adenosine monophosphate activated protein kinase;ME:甲基 methyl;PR:蛋白质 protein;GSH:谷胱甘肽 glutathione;GS:谷胱甘肽合成酶 glutathione synthetase;GCL:谷氨酸半胱氨酸连接酶 glutamate-cysteine ligase;L-cysteine:L-半胱氨酸;Glu:葡萄糖 glucose;G6P:葡萄糖-6-磷酸 glucose-6-phosphate;F6P:果糖-6-磷酸 fructose-6-phosphate;TP:磷酸丙糖 triose phosphate;PEP:磷酸烯醇式丙酮酸 phosphoenolpyruvic acid;Pyr:丙酮酸 pyruvic acid;Acetyl-CoA:乙酰辅酶A acetyl coenzyme A;TC:总胆固醇 total cholesterol;CYP8B1:甾醇12α-羟化酶 sterol 12α-hydroxylase;CYP7A1:胆固醇7α-羟化酶 cholesterol 7α-hydroxylase;CYP7B1:25-羟基胆固醇7α-羟化酶 25-hydroxycholesterol 7α-hydroxylase;CYP27A1:甾醇27α-羟化酶 sterol 27α-hydroxylase;Gly:甘氨酸 glycine;CDCA:鹅脱氧胆酸 chenodesoxycholic acid;GC:甘氨胆酸 glycocholic acid;GCDCA:甘氨鹅脱氧胆酸 glycochenodeoxycholic acid;GDCA:甘氨脱氧胆酸 glycine deoxycholic acid;OAA:草酰乙酸 oxaloacetic acid;TCA:三羧酸循环 tricarboxylic acid cycle;HL:乳酸 lactic acid;TG:甘油三酯 triglyceride;GI:甘油 glycerin;LCFA:长链脂肪酸 long-chain fatty acid;CoA:辅酶A coenzyme A;Lcco As:长链脂酰辅酶A long-chain fatty acyl CoA;Mcco As:中链脂酰辅酶A mid-chain fatty acyl CoA;Scco As:短链脂酰辅酶A short-chain fatty acyl CoA;CPT1:肉碱棕榈酰转移酶1 carnitine palmitoyl transferase 1;CPT2:肉碱棕榈酰转移酶2 carnitine palmitoyl transferase 2;CACT:肉毒碱/酰基肉毒碱转移酶 carnitine/acylcarnitine transferase;L-chain acyl carnitine:长链酰基肉碱 long-chain acyl carnitine;M-chain acyl carnitine:中链酰基肉碱 mid-chain acyl carnitine;Carnitine acyltransferase:肉碱酰基转移酶;Mitochondria:线粒体。

a:丙酮酸 pyruvic acid;b:L-乳酸 L-lactic acid;c:D-葡萄糖 D-glucose;d:甜菜碱 betaine;e:肉碱C11∶DC carnitine C11∶DC;f:肉碱C12∶1 carnitine C12∶1;g:肉碱C17∶1∶DC carnitine C17∶1∶DC;h:肉碱C14-OH carnitine C14-OH;i:肉碱C14∶1 carnitine C14∶1;j:肉碱C13∶1 carnitine C13∶1;k:肉碱C13∶0 carnitine C13∶1;l:还原型谷胱甘肽 reduced glutathione;m:氧化三甲胺 TMAO;n:L-半胱氨酸 L-cysteine;o:肾上腺素 epinephrine;p:皮质醇 cortisol;q:甘氨胆酸 glycocholic acid;r:甘氨脱氧胆酸 glycine deoxycholic acid;s:23-脱甲脱氧胆酸 23-deoxydeoxycholic acid;t:甘氨鹅脱氧胆酸 glycochenodeoxycholic acid。
3 讨 论
3.1 奶牛围产后期能量代谢动态变化规律
大部分奶牛(尤其是高产奶牛)无法短期内摄入足量干物质以满足分娩过程和产后泌乳启动对能量的需求[8],使其处于能量代谢负平衡(NEB)的应激状态[9]。葡萄糖是主要供能物质,奶牛泌乳时机体内需要动员大量的葡萄糖合成乳糖[10]。葡萄糖首先被氧化为丙酮酸,后者不仅可以通过有氧氧化途径进入三羧酸(TCA)循环产生柠檬酸,还可以通过无氧糖酵解途径产生乳酸。Zhang等[11]报道,血清中乳酸的主要来源是糖酵解,其特征是丙酮酸通过乳酸脱氢酶转化为乳酸。另有研究发现,甜菜碱是一种内源性的腺苷酸活化蛋白激酶(AMPK)激活剂,通过肝激酶B1(LKB1,AMPK上游主要的激酶)去磷酸化激活AMPK,在细胞能量稳态调节中起到关键作用,是脂代谢和糖代谢的主要调控因子,能够促进ATP的积累[12]。本试验结果显示,奶牛产后7 d血浆葡萄糖、丙酮酸、柠檬酸、乳酸和甜菜碱含量较产后0 d显著下调,而产后7、14和21 d之间,上述代谢物含量无显著差异。这表明奶牛在围产后期受泌乳启动的影响,能量需要激增,机体处于较分娩时更严重的NEB应激状态。
3.2 奶牛围产后期酰基肉碱(ACC)变化规律
目前关于ACC与动物生产性能和健康需求之间的关系还需深入研究[13]。奶牛从妊娠过度到哺乳期时,将脂肪酸完全氧化为二氧化碳(CO2)的能力降低,而不完全氧化为酸溶性代谢物的能力升高[14]。动物体内肉碱分为游离肉碱和ACC,主要分布在对能量需求较高的组织中,是参与细胞内能量代谢的关键物质[15]。游离肉碱又称左旋肉碱,是长链脂肪酸进入线粒体所必须的载体,β-氧化的关键步骤是形成ACC,在脂肪酸氧化代谢中起重要作用[16]。大多数高产奶牛在围产期都会经历NEB过程,会导致不同组织出现代谢紊乱,尤其是脂肪组织。位于细胞质的长链酰基辅酶A合成酶(ACSL)将脂肪酸转化为长链脂酰基辅酶A,然后在肉碱棕榈酰转移酶-1a(CPT-1a)的催化作用下,长链脂酰基辅酶A与游离肉碱发生酯交换反应生成ACC[17]。ACC先后通过线粒体外膜的电压依赖性阴离子通道(VDAC)和线粒体内膜的肉毒碱/酰基肉毒碱转移酶(CACT)进入线粒体基质,参与脂肪酸的β-氧化[18]。ACC的积累不仅反映了脂肪酸氧化能力的降低,也反映了脂肪酸向甘油三酯合成和胰岛素拮抗的脂质介质的分配[19]。ACC代谢也与非酒精性脂肪肝(FLD)发展有关,FLD患者肝酰基肉碱含量升高。有研究认为,肝脏ACC的积累可通过有机阳离子/肉碱转运蛋白-2机制促进其在循环中的积累[20]。如Rico等[21]发现,在产后动员更多脂肪酸的奶牛血浆肉碱C14∶0、肉碱C16∶0、肉碱C18∶0和肉碱C20∶0含量升高,同时血浆总ACC水平与循环总FA浓度以及神经酰胺呈正相关[13]。未被氧化的肝脏FA可以作为甘油三酯酯化反应的底物或用于合成神经酰胺,神经酰胺能拮抗胰岛素刺激的葡萄糖的摄取[21]。本研究结果显示,奶牛产后7~21 d血浆ACC(包括中链和长链酰基肉碱)含量较产后0 d显著下降,说明奶牛产后脂肪酸氧化能力较分娩前有一定程度的恢复。
3.3 奶牛围产后期TMAO变化规律
TMAO是一种肠源性菌群代谢产物,由肝脏中的黄素单氧酶(FMOs)氧化三甲胺(TMA)生成。肠道中部分菌群将直接摄入或间接产生的胆碱、磷脂酰胆碱、甜菜碱和游离肉碱分别通过胆碱-TMA裂解酶(CutC)、甘氨酸甜菜碱还原酶(GrdH)和肉碱加氧酶(CntA)转化为TMA,后者经肝门静脉转运至肝脏氧化生成TMAO[22]。Makrecka-Kuka等[23]报道,TMAO可减少心脏线粒体中丙酮酸和脂肪酸氧化,通过减少丙酮酸脱氢酶(PDH)底物通量,并抑制β-氧化,从而导致心脏细胞能量产生不足。也有学者发现,TMAO还与脂肪肝的形成有关,TMAO通过改变胆汁酸的合成和运输或阻断肝脏胰岛素信号通路,从而影响脂代谢、肝脏甘油三酯含量和葡萄糖稳态,进而促进脂肪肝的形成[24]。本试验结果显示,奶牛产后7 d血清TMAO含量较产后0 d显著上调,而与TMAO生成相关的代谢物,除了酰基肉碱外,还有甜菜碱和磷酸胆碱的含量也显著下调,而产后7、14和21 d之间上述代谢物含量无显著差异。这提示血清TMAO极可能是奶牛围产期后期NEB发展和脂肪肝形成的潜在生物标志物,但还需进一步试验验证。
3.4 奶牛围产后期氧化应激相关代谢物变化规律
饱和脂肪酸使线粒体超负荷工作导致氧化还原反应稳态失衡,导致大量活性氧(ROS)自由基生成,最终引起氧化应激。ROS的持续产生会激活丝氨酸/苏氨酸激酶信号级联反应,抑制胰岛素诱导的受体底物的感应[25]。据报道,氧化应激与非反刍动物胰岛素抵抗和FLD发展存在一定联系,胰岛素抵抗可以增加肝脏内脂质含量,并促进单纯性脂肪变性。氧化应激也可促进Kupffer细胞活化,激活氧化还原敏感转录因子,包括核因子-κB,并上调促炎因子肿瘤坏死因子-α(TNF-α),进一步降低抗氧化能力并促进肝细胞损伤[13]。Videla等[26]研究发现,大量ROS可引起肝脏脂肪酸去饱和作用降低和过氧化增强,使n-3长链多不饱和脂肪酸耗竭。多不饱和脂肪酸氧化形成具有多种炎症功能的氧化脂质。如由n-6花生四烯酸和亚油酸衍生的氧化脂质羟基十八烷二烯酸和羟基二十烷四烯酸具有促炎作用。围产期奶牛大多数经历氧化应激状态,氧化应激又会增强脂解作用,生成的不饱和脂肪酸既可以氧化为过氧化氢和异前列腺素[27],又可生成β-羟基丁酸盐,这可引起ROS介导的p38丝裂原活化蛋白激酶活化,促进肝细胞凋亡[28]。另外,脂肪酸可能通过ROS依赖的炎症机制诱导产生内核因子-κB,参与了FLD的病理变化。大量研究还表明,ROS或氧化脂质的积累可能会影响牛的免疫反应[13]。还原性谷胱甘肽(GSH)是体内重要的抗氧化剂和自由基清除物,不仅参与缓解机体氧化应激,还能够促进胆汁酸代谢和肠道消化吸收,增强肝脏脂肪代谢[29]。半胱氨酸是GSH的前体物,半胱氨酸在谷氨酸半胱氨酸连接酶(GCL)作用下先转变成γ-谷氨酰胺半胱氨酸,然后在谷胱甘肽合成酶(GS)作用下转化为GSH,参与缓解奶牛围产期氧化应激[30]。Li等[30]报道,甜菜碱除了能调节糖脂代谢外,还通过调节ROS的产生,保护牛乳腺上皮细胞免受热暴露诱导的氧化应激和凋亡,可用于缓解奶牛热应激和提高产奶量。本试验结果显示,奶牛产后7 d较0 d血浆GSH、L-半胱氨酸和甜菜碱的含量显著下降,而产后7、14和21 d这些代谢物含量均无显著差异,这提示健康奶牛围产后期抗氧化能力较产前下降。
3.5 奶牛围产后期皮质醇和肾上腺素的变化规律
已有研究证实,奶牛分娩时皮质醇、肾上腺素、去甲肾上腺素、催产素、加压素和内啡肽等激素的分泌水平会发生不同程度改变[31-32]。本研究采用UPLC-MS/MS代谢组学方法仅检测到了血浆中含有皮质醇和肾上腺素2种激素,结果显示奶牛产后0 d血浆皮质醇和肾上腺素含量显著高于产后7、14和21 d,而两者在7、14和21 d之间差异不显著。皮质醇主要功能是通过增强氨基酸糖异生的方式提高血糖浓度,尤其支持对葡萄糖需求高的生理活动例如生产和泌乳早期[33]。另外有研究发现,皮质醇还是与子宫炎、低钙血症和乳腺炎相关的应激和疼痛的一个既定的指标[34]。Sgorlon等[34]报道,当机体出现严重应激时血液中皮质醇含量显著增加。Vannucchi等[35]报道,奶牛在分娩后出现高血糖且与血液皮质醇含量呈正相关。由于剧烈疼痛以及胎儿和母体之间的相互作用,引起奶牛分娩时血浆中肾上腺素含量上升[36]。也有学者发现围产期奶牛NEB程度与哺乳早期脑垂体活动和肾上腺皮质反应性之间存在关联[37]。因此,奶牛产后0 d高血浆皮质醇和肾上腺素含量可能是围产前期代谢应激、分娩应激和疼痛的综合作用结果。
3.6 奶牛围产后期胆汁酸代谢变化规律
胆汁酸在肝脏中产生,其在胆汁酸稳态、营养吸收和胆固醇稳态等代谢过程中发挥重要的调节作用[38]。肝脏中生成的胆汁酸,首先进入肠道参与消化吸收,后经肠道重吸收,大约95%的胆汁酸经门静脉返回肝脏,仅有少部分进入血液循环[39]。另外,胆汁酸还可以通过激活法尼醇X受体(FXR)和G蛋白偶联的胆汁酸受体1(GPBAR1/TGR5)来充当信号分子。初级胆汁酸通过经典(中性)和替代(酸性)2种途径合成[40]。其中,经典途径占胆汁酸总合成的75%,肝脏中胆固醇在胆固醇7α-羟化酶(CYP7A1)作用下转化为7α-羟胆固醇,随后被甾醇12α-羟化酶(CYP8B1)氧化裂解为胆酸[41]。在替代途径中胆固醇在甾醇27α-羟化酶(CYP27A1)的催化下生成27α-羟基胆固醇,随后在25-羟基胆固醇7α-羟化酶(CYP7B1)作用下生成鹅脱氧胆酸[42]。游离胆汁酸包括胆酸、鹅脱氧胆酸、脱氧胆酸和石胆酸4种,这些结合胆汁酸可进一步与甘氨酸和牛磺酸结合生成次级胆汁酸包括甘氨胆酸、甘氨鹅脱氧胆酸和牛磺胆酸等。Li等[43]研究发现,胆汁酸在控制肠肝系统中葡萄糖和脂质的代谢以及外周组织的能量消耗方面也起着关键调节作用。Mazalli等[46]报道,奶牛泌乳启动后,肝脏中与胆汁酸合成相关基因的mRNA表达量升高。本试验采用UPLC-MS/MS代谢组学技术也发现了相似的结果,即奶牛产后7 d血浆中与胆汁酸代谢相关的物质甘氨胆酸、甘氨脱氧胆酸、23-脱甲脱氧胆酸和甘氨鹅脱氧胆酸含量显著高于产后0 d,而产后7、14和21 d之间这些代谢物含量无显著差异,推测这可能与奶牛分娩后泌乳启动、采食量和消化吸收逐渐恢复有关。
4 结 论
本试验采用UPLC-MS/MS代谢组学技术研究了奶牛产后0、7、14和21 d血液代谢物的动态变化规律,结果表明产后7 d内代谢轮廓发生了明显改变,围产后期奶牛处于代谢应激和氧化应激状态。
