真菌性角膜炎角膜组织NOD1、NF-κBp65表达的变化以及炎症细胞浸润情况△
2023-03-07李丽红胡竹林
李 妍 李丽红 戴 敏 闵 婕 胡竹林
真菌性角膜炎是病原菌和宿主共同作用的结果。疾病早期病原菌通过侵袭力、毒力、多种酶类及黏附机制致病,感染后组织的进一步损伤则主要是由宿主过强的免疫反应所致[1]。常规的抗真菌药物无法控制由于局部过度的炎症反应导致的角膜组织损伤[2-3]。细菌、病毒、真菌感染时NOD1/ NF-κB信号通路在组织发生的固有免疫反应中发挥重要作用,参与炎症反应的调控[4-5]。本研究通过构建树鼩茄病镰刀菌性角膜炎模型,探讨真菌性角膜炎角膜组织NOD1、NF-κBp65的表达变化以及炎症细胞浸润情况。
1 材料与方法
1.1 材料
1.1.1 实验动物取清洁级树鼩25只,年龄4~6个月,体重(130±10)g,雌雄不限(昆明医科大学动物实验中心提供)。将树鼩分成3组,实验组10只,空白对照组10只,正常对照组5只,均取右眼为实验眼。本研究经昆明医科大学伦理委员会审查,并获得通过(编号:kmmu2020175)。
1.1.2 真菌及培养基茄病镰刀菌购自美国ATCC公司,沙氏葡萄糖琼脂培养基购自梅里埃生物制品有限公司。
1.1.3 主要仪器及试剂手术显微镜(苏州六六视觉科技股份有限公司),流式细胞仪(美国BD公司),低温高速离心机(德国Heraeus 公司)。NF-κBp65抗体 和 NOD1抗体(美国CST公司)。
1.2 方法
1.2.1 真菌孢子制备方法将茄病镰刀菌接种到沙氏葡萄糖琼脂培养基中,置于26 ℃培养箱培养7 d。采用10 g·L-1亚甲基蓝染色并在显微镜下观察菌丝及孢子形态。用10 mL生理盐水反复冲洗培养皿菌丝表面,收集真菌孢子混悬液;随后用8层无菌脱脂纱布过滤菌丝,血细胞计数板调整孢子数量为1×109CFU·mL-1备用。
1.2.2 树鼩镰刀菌性角膜炎造模将树鼩用10 g·L-1戊巴比妥钠注射液(50 mg·kg-1)肌肉注射麻醉后,碘伏消毒实验眼3遍,盐酸奥布卡因滴眼液表面麻醉,聚维酮碘1 mL冲洗实验眼结膜囊。实验组用胰岛素针头(29 G) 在实验眼角膜上皮细胞层做“#”形划痕,结膜囊滴真菌孢子混悬液5 μL,覆盖软性角膜接触镜,眼睑间断缝合2针,24 h后进行后续实验;空白对照组实验眼结膜囊滴生理盐水5 μL,其余步骤同实验组;正常对照组不做任何处理。通过共聚焦显微镜检查及角膜组织真菌DNA鉴定来确定造模是否成功。
1.2.3 Western blot检测蛋白表达造模后第1天,将树鼩用10 g·L-1戊巴比妥钠注射液(50 mg·kg-1)深度麻醉后,剪断颈部血管,放血处死。提取角膜蛋白后采用BCA法进行蛋白定量。向120 g·L-1SDS PAGE预制胶孔加入50 μg蛋白样品,100 V电泳1 h后转膜。5 g·L-1脱脂奶粉(TBST缓冲液溶解)封闭后,加入一抗(抗NOD1抗体、抗NF-κBp65抗体及抗β-actin抗体,稀释度均为11000),4 ℃过夜。用TBST洗3次后加二抗辣根过氧化物酶标记的山羊抗兔IgG孵育1.5 h,再用TBST洗3次,之后用Western blot检测各蛋白表达情况。实验重复3次,将胶片扫描,用ImageJ软件对曝光的条带行灰度分析,并进行统计学处理。
1.2.4 HE染色观察炎症细胞浸润情况造模后第1天和第3天,取眼球组织进行固定、脱水、石蜡包埋制备石蜡组织块,组织切片,行HE染色,光学显微镜下进行观察。
1.2.5 免疫组织化学染色检测蛋白阳性表达情况造模后第1天和第3天,取石蜡组织块,进行免疫组织化学染色,脱蜡、梯度脱水,充分水洗,体积分数30% H2O2阻断10 min;PBS清洗3遍,每遍洗3 min;加50 g·L-1TritonX-100,37 ℃ 孵育10 min;再用PBS 清洗3遍,每遍洗3 min;加血清封闭,37 ℃孵育30 min;倒掉血清,加适当浓度的一抗,4 ℃过夜;PBS清洗3遍,每遍洗3 min;加通用试剂盒中的试剂A,37 ℃孵育20 min;PBS 清洗3遍,每遍洗3 min;加通用试剂盒中的试剂B,37 ℃ 孵育30 min;PBS清洗3遍,每遍洗3 min;采用DAB显色,梯度酒精脱水,二甲苯使切片透明化5 min;中性树胶封片。
1.3 统计学分析使用Graphpad Prism 8.0统计软件进行统计分析。计量资料以均数±标准差表示,所有实验至少重复3次,各测量指标的数据资料经Shapiro Wilk检验均呈正态分布,Levene检验方差齐性。组间比较均采用单因素方差分析。检验水准:α=0.05。
2 结果
2.1 树鼩镰刀菌性角膜炎造模情况实验组造模后第1天、第3天实验眼角膜基质层均可见菌丝,第3天明显增多,第7天由于角膜溃疡溶解穿孔,共聚焦显微镜仅显示大量坏死组织,无法分辨角膜组织结构。空白对照组实验眼可见正常基质细胞排列规则(见图1)。真菌DNA鉴定结果表明,实验组树鼩感染的菌株与接种的病原微生物一致。

图1 实验组和空白对照组实验眼角膜基质层共聚焦显微镜检查结果 A:实验组造模后第1天;B:实验组造模后第3天;C:实验组造模后第7天;D:空白对照组。
2.2 各组角膜组织中NOD1及NF-κBp65蛋白表达Western blot检测结果Western blot检测结果显示:造模后第1天,实验组角膜组织中 NOD1及NF-κBp65的蛋白相对表达量均明显升高,与正常对照组及空白对照组相比,差异均有统计学意义(均为P<0.05);正常对照组角膜组织中NOD1及NF-κBp65的蛋白相对表达量与空白对照组相比,差异均无统计学意义(均为P>0.05)(见图2)。
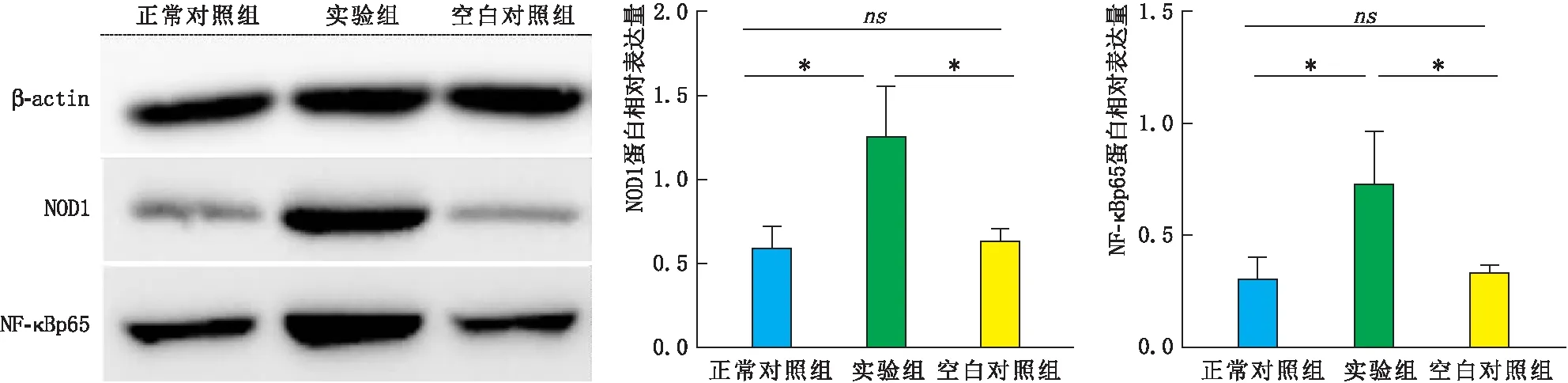
图2 各组角膜组织中NOD1 及 NF-κBp65蛋白表达情况 两组相比,*P<0.05;ns示差异无统计学意义。
2.3 各组角膜组织中NOD1蛋白表达免疫组织化学染色结果免疫组织化学染色结果显示:正常对照组(见图3A)及空白对照组(见图3B)角膜上皮细胞胞浆未见 NOD1 蛋白表达,染色阴性;实验组NOD1蛋白表达于角膜上皮细胞胞浆,表达强度与时间呈正相关;实验组造模后第1天,角膜上皮细胞胞浆可见少量NOD1蛋白棕色颗粒着染(见图3C),造模后第3天,NOD1蛋白棕色颗粒着染的阳性细胞明显增多,信号增强(见图3D)。
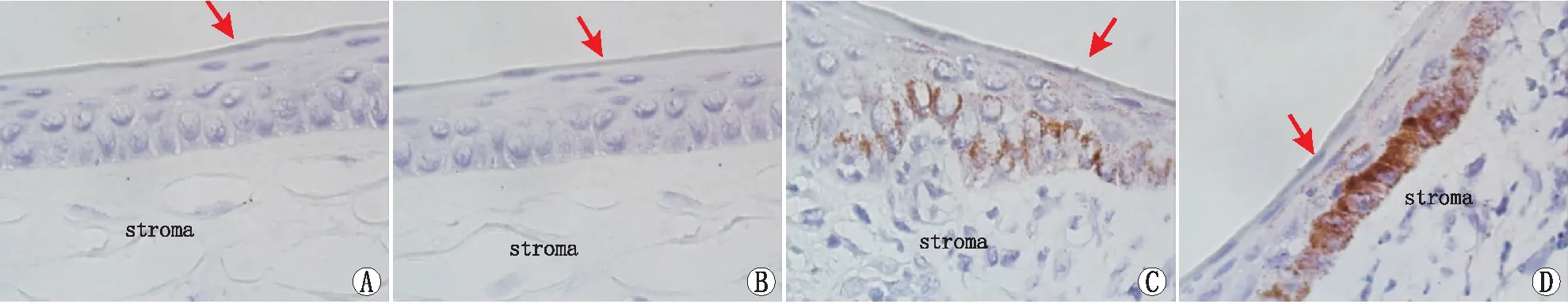
图3 各组角膜组织中NOD1蛋白表达免疫组织化学染色结果(×100) 红色箭头所指为角膜上皮细胞层,stroma 代表角膜基质层。A:正常对照组;B:空白对照组;C:实验组造模后第1天;D:实验组造模后第3天。
2.4 各组角膜组织中NF-κBp65蛋白表达免疫组织化学染色结果免疫组织化学染色结果显示:正常对照组及空白对照组角膜基质层及角膜内皮细胞层均未见NF-κBp65蛋白表达,染色阴性;实验组NF-κBp65蛋白表达于角膜基质层的中性粒细胞及角膜内皮细胞的细胞核内,表达强度与时间呈正相关;实验组造模后第1天,角膜基质层中性粒细胞及角膜内皮细胞均可见NF-κBp65蛋白棕色颗粒着染呈强阳性改变;造模后第3天,NF-κBp65蛋白棕色颗粒着染的阳性细胞明显增多,信号增强(见图4)。
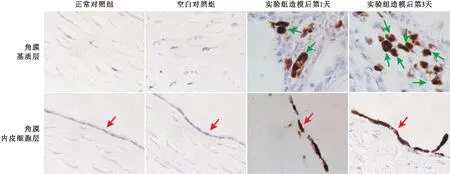
图4 各组角膜组织中NF-κBp65蛋白表达免疫组织化学染色结果(×100) 绿色箭头示中性粒细胞,红色箭头示角膜内皮细胞。
2.5 各组角膜组织中炎症细胞浸润情况HE染色结果显示:正常对照组角膜各层组织结构正常,未见炎症细胞浸润(见图5A)。空白对照组角膜上皮细胞层完整,前弹力层及浅基质层可见划痕导致的瘢痕改变,基质层间未见炎症细胞浸润(见图5B)。实验组造模后第1天,角膜水肿,上皮细胞层缺失,基质层见大量炎症细胞浸润,以中性粒细胞为主(见图5C);造模后第3天,角膜高度水肿,组织形态消失,炎症细胞浸润数量明显多于第1天,同样以中性粒细胞为主(见图5D)。
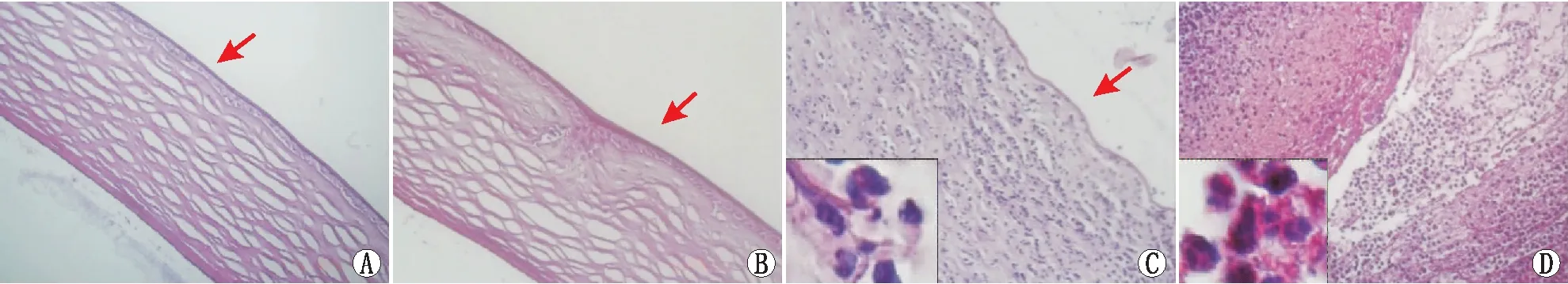
图5 各组角膜组织中炎症细胞浸润情况(×20) 红色箭头示角膜上皮细胞层。A:正常对照组;B:空白对照组;C:实验组造模后第1天;D:实验组造模后第3天。
3 讨论
真菌性角膜炎在我国某些地区已成为角膜盲的首要原因[6]。我国真菌性角膜炎的主要致病菌为镰刀菌属和曲霉菌属[7]。NOD样受体属于胞浆蛋白质NOD样受体家族,可与多种病原相关分子结合,导致其自身构象发生改变形成受体复合物,受体复合物通过同型CARD-CARD 相互作用将RIP2分子招募到周围。RIP2可引起IκB磷酸化降解,NF-κBp65活化并转位入细胞核内,编码白细胞介素6和肿瘤坏死因子α等炎症基因表达,诱导产生一系列炎症反应。NOD1/ NF-κBp65信号通路在天然免疫中发挥重要作用,参与对真菌、细菌、病毒等病原体的识别及清除[8-9]。因此,本实验通过构建树鼩镰刀菌性角膜炎模型,观察不同时间点NOD1及NF-κBp65的表达变化,观察中性粒细胞浸润情况,分析NOD1及NF-κBp65在茄病镰刀菌性角膜炎炎症反应中的促炎机制。
NOD1 受体介导了多种感染性疾病的免疫应答[10],在不同眼病中发挥不同的作用,表达下调可增加患者感染及非感染眼表疾病的易感性[2],表达上调可加重眼部炎症反应,诱导葡萄膜炎的产生[11]。本研究发现,与正常对照组及空白对照组相比,实验组角膜组织中 NOD1 蛋白表达明显增多,说明镰刀菌可激活NOD1,参与树鼩镰刀菌性角膜炎的病变过程。NF-κB信号通路在调控免疫和炎症反应中发挥非常重要的作用[12-14]。p65的磷酸化可通过修饰细胞核中NF-κB 从而实现基因的主动转录[15]。本实验结果发现,实验组角膜组织中NF-κBp65蛋白表达明显增多,提示镰刀菌可激活NF-κBp65。
为进一步了解 NOD1 及 NF-κBp65表达的细胞来源及关系,本实验采用免疫组织化学染色方法发现,实验组NOD1蛋白表达于角膜上皮细胞胞浆内,而 NF-κBp65 蛋白表达于角膜内皮细胞及被招募到角膜基质层的中性粒细胞的细胞核内。我们还发现,实验组造模后第1天时角膜组织大量炎症细胞浸润,以中性粒细胞为主;第3天时炎症细胞数量急剧增多,仍以中性粒细胞为主。同样,实验组NOD1及NF-κBp65的表达量在造模后第3天也升高,这与组织病理切片的炎症反应最重、中性粒细胞聚集最多的样本时间点吻合。
NOD1在角膜上皮细胞中大量表达,同时募集中性粒细胞及单核细胞至病变部位[16-17],而NF-κBp65则表达于中性粒细胞,中性粒细胞可在吞噬过程中触发呼吸爆发,形成活性氧,并释放颗粒中的防御素等消灭病原菌,参与炎症反应的起始过程[18]。与此同时,NOD1可激活IKK复合物、IKK可介导IκBα磷酸化及随后的降解反应,引起原型NF-κB异二聚体RelA/p65的快速和瞬时核转位,参与促炎反应的调控[15]。此外,NF-κB作为一种诱导型转录因子,可以激活各种基因的转录,从而增加炎症细胞因子、趋化因子和黏附分子的产生,在真菌性角膜炎中调节角膜上皮细胞的增殖、凋亡、形态变化及分化[19]。
综上所述,本研究结果提示,角膜上皮细胞中的NOD1受体通过激活NF-κBp65的核内转录及促进其在中性粒细胞中的表达,参与了树鼩镰刀菌性角膜炎的炎症反应。这表明NOD1、NF-κBp65与中性粒细胞在树鼩镰刀菌性角膜炎促炎机制中发挥重要的协同作用。
