Piezo拮抗剂GsMTx4通过激活Yap1/STAT3信号通路促进人视网膜微血管内皮细胞的血管生成△
2023-03-07梁晓茜陈王灵陈运信
梁晓茜 陈王灵 陈运信
视网膜新生血管性疾病是全球致盲的主要原因之一,内皮功能障碍是视网膜新生血管性疾病的主要特征[1]。该病发病机制尚不明确,但内皮功能障碍在缺血或炎症等缺氧刺激下促进新生血管的病理生长过程中起着重要作用[2]。激光光凝术是目前治疗视网膜新生血管的主要方法,但是可能会破坏有丝分裂后的视网膜神经元,永久性地影响视功能[3]。因此,迫切需要进一步阐明这类疾病的细胞和分子机制,找到新的治疗靶点。
Piezo是一种机械激活性离子通道,在内皮细胞血管生成和肿瘤细胞血管生成中扮演重要角色。Piezo不仅可以通过激活基质金属蛋白酶信号介导内皮细胞血管生成[4],而且还可以调控转录共激活剂Yes相关蛋白1(Yap1)介导多种肿瘤增殖和癌组织中的血管生成[5]。大量研究证实,Yap1与信号转导和转录因子3激活因子(STAT3)通过血管内皮生长因子(VEGF)信号参与血管生成[6-7]。最新研究表明,STAT3不仅增加小鼠视网膜内皮通透性,还可以增加视网膜血管渗漏,从而促进糖尿病视网膜病变的进展[8],也可以直接结合内皮细胞中的Yap1,进一步调控血管生成[9]。然而,在血管生成过程中,Piezo对Yap1和STAT3结合的调节作用以及是否参与视网膜新生血管性疾病的发生发展仍不清楚。本研究利用Piezo的拮抗剂GsMTx4阻断人视网膜微血管内皮细胞(hRMECs)中的Piezo表达,从而观察在血管生成过程中Piezo对Yap和STAT3结合的调节作用,并基于此探讨hRMECs血管生成的机制。本研究预期为视网膜新生血管性疾病的治疗提供新的靶点。
1 材料与方法
1.1 主要试剂及仪器细胞附着因子购于美国Cell Signaling公司。STAT3拮抗剂Stattic(HY-13818)、Yap1拮抗剂维替泊芬(VP;CL 318952)均购于美国MedChemExpress公司。CCK-8试剂盒购于北京Transgene公司。酶标仪购于美国Bio-Rad公司。TRIzol试剂盒购于上海碧云天公司。增强化学发光试剂盒购于美国阿默舍姆生命科学公司。蛋白A/G琼脂糖珠购于美国Santa Cruz Biotechnology公司。PrimeScript RT试剂盒、SYBR Green试剂盒购于日本TaKaRa生物科技有限公司。苯甲基磺酰氟(PMSF)购于美国默克Sigma-Aldrich公司。Piezo、Yap1、STAT3、GAPDH的一抗以及IgG的HRP偶联的二抗均购于美国Cell Signaling Technology公司。
1.2 细胞来源及培养hRMECs(K5336)购于美国EK-Bioscience公司。细胞在37 ℃、含体积分数5%二氧化碳、湿润无菌环境下常规培养。在涂有细胞附着因子的培养板中使用DMEM+体积分数10%胎牛血清的培养基培养细胞至对数生长期用于实验。
1.3 细胞分组和处理将hRMECs随机分为对照组、GsMTx4组、GsMTx4+VP组、GsMTx4+Stattic组共4组。对照组为正常培养24 h的hRMECs,GsMTx4组为使用含2.5 μmol·L-1GsMTx4的培养基孵育24 h的hRMECs,GsMTx4+VP组为使用含2.5 μmol·L-1GsMTx4和4 μmol·L-1VP的培养基孵育24 h的hRMECs,GsMTx4+Stattic组为使用含2.5 μmol·L-1GsMTx4和1.5 μmol·L-1Stattic的培养基孵育24 h的hRMECs。
1.4 CCK-8法检测各组hRMECs的增殖率将hRMECs按每孔1×104个细胞接种在96孔培养皿中,12 h后分组处理,之后更换为含有体积分数10% CCK-8的新鲜培养基100 μL,1 h后使用酶标仪测定各组细胞450 nm处的吸光度,计算细胞增殖率。
1.5 小管形成实验检测血管生成能力将hRMECs按1×105个·mL-1接种于基质胶覆盖的培养皿中,分组处理后,显微镜下观察各组细胞形态和芽细胞(小管分支)数的变化,并在200倍的显微镜下随机选择5个视野对小管分支进行计数,取5个视野的平均值统计分析。
1.6 qRT-PCR检测Piezo、Yap1、STAT3 mRNA的表达取对照组和GsMTx4组细胞,使用TRIzol试剂盒从细胞中分离总RNA,使用PrimeScript RT试剂盒行qRT-PCR检测,实验步骤按说明书进行。各指标引物序列:Piezo正向引物为5’-TCGAGCCGGCTTCGTACCGCTG-3’,反向引物为5’-GACAGTGAGTCTCACTTGGC-3’;Yap1正向引物为5’-GCGGGTCCTGCTTGTCGCGT-3’,反向引物为5’-TGCCTTTGGCTGACTG-3’;STAT3正向引物为5’-CATGGACAACTTGCGAGCACA-3’,反向引物为5’-GCTCTACAAGCTGGTCTTATCTCA-3’;GAPDH正向引物为5’-TGTGGGCATCAATGGATTTGG-3’,反向引物为5’-ACACCATGTATTCCGGGTCAAT-3’。以GAPDH为内参,使用2-ΔΔCt方法计算各mRNA相对表达量。实验重复3次。
1.7 Western blot检测Piezo、Yap1、STAT3蛋白的表达取对照组和GsMTx4组细胞,使用裂解缓冲液(PMSF)裂解,在125 g·L-1十二烷基硫酸钠聚丙烯酰胺凝胶中电泳分离,随后转移到硝酸纤维素膜上,使用标准的半干转进行印迹。Piezo(1800)、Yap1(1600)、STAT3(1800)、GAPDH(15000)一抗孵育12 h,然后用HRP偶联的二抗(12000)孵育2 h。免疫标记检测采用增强化学发光试剂盒。GAPDH作为内参蛋白。使用ImageJ软件进行灰度值分析,以量化条带的密度,并将其转换为数字形式进行统计分析。
1.8 免疫沉淀技术检测使用免疫沉淀技术检测
各组hRMECs中Yap1和STAT3的结合作用。全细胞裂解物的提取同Western blot。免疫沉淀:500 μg蛋白与2 μg特异性抗体在4 ℃恒温孵育12 h;接着加入40 μL 500 g·L-1蛋白A/G琼脂糖珠,继续孵育 2 h;然后用裂解缓冲液洗涤珠子5次,每次洗涤后,4 ℃下10 000 r·min-1离心30 s收集珠子,最后一次洗涤后,吸出并丢弃上清,然后用2×十二烷基硫酸钠聚丙烯酰胺凝胶负载缓冲液重悬,煮沸后持续5 min,将沉淀蛋白从微珠中洗脱。免疫沉淀或细胞裂解物使用Western blot进行分析,其中一抗为Yap1(1600)、STAT3(1800),二抗为HRP偶联抗体(12000)。
2 结果
2.1 GsMTx4对hRMECs血管生成的影响对照组hRMECs的增殖率、小管分支数分别为30.22%±2.96%和(49.89±6.34)个,GsMTx4组hRMECs的增殖率、小管分支数分别为47.63%±8.21%和(107.24±9.87)个,两组相比差异均有统计学意义(t=12.114、14.209,P=0.009、0.005),GsMTx4组hRMECs的增殖率、小管分支数均较对照组明显增加(图1)。
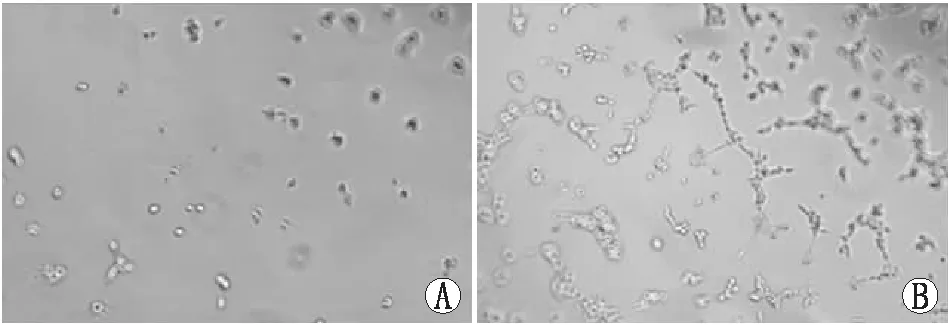
图1 小管形成实验检测对照组和GsMTx4组hRMECs的小管分支情况(×200) A:对照组;B:GsMTx4组。
2.2 GsMTx4对hRMECs中Yap1/STAT3信号通路的影响与对照组相比,GsMTx4组hRMECs中Piezo mRNA表达下调,而Yap1、STAT3 mRNA表达均明显上调,差异均有统计学意义(t=14.223、16.778、13.097,P=0.005、0.014、0.011);与对照组相比,GsMTx4组hRMECs中Piezo蛋白表达下调,而Yap1、STAT3蛋白表达均明显上调,差异均有统计学意义(t=11.982、13.215、10.210,P=0.012、0.006、0.022)(图2)。
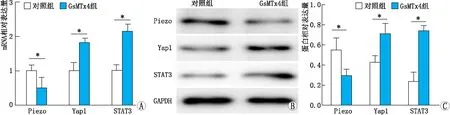
图2 对照组和GsMTx4组hRMECs中Piezo、Yap1、STAT3 mRNA和蛋白表达 A:qRT-PCR检测结果;B:Western blot检测结果;C:Wester blot检测结果分析。*示P<0.05。
2.3 GsMTx4对hRMECs中Yap1和STAT3结合作用的影响Yap1/STAT3信号通路被GsMTx4激活,进一步利用免疫沉淀技术观察GsMTx4对Yap1和STAT3结合作用的影响,结果显示,对照组hRMECs中Yap1和STAT3蛋白的相对结合量为1.00±0.01,而GsMTx4组hRMECs中Yap1和STAT3蛋白的相对结合量明显高于对照组,为12.35±0.20,两组相比差异有统计学意义(t=9.892,P=0.000)(图3)。表明GsMTx4有促进hRMECs中Yap1和STAT3蛋白结合的作用。
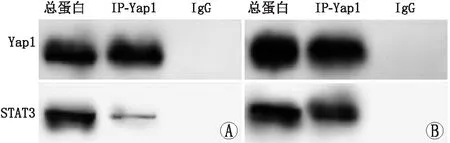
图3 免疫沉淀技术检测对照组和GsMTx4组hRMECs中Yap1和STAT3蛋白结合情况 A:对照组;B:GsMTx4组。
2.4 Yap1/STAT3信号通路拮抗剂阻断Yap1和STAT3的结合观察Yap1/STAT3信号通路拮抗剂对Yap1与STAT3蛋白结合作用的影响,结果显示,与GsMTx4组相比,GsMTx4+VP组和GsMTx4+Stattic组hRMECs中Yap1(P=0.011、0.016)和STAT3(P=0.017、0.012)的蛋白表达均下调,差异均有统计学意义(图4和表1)。设GsMTx4组hRMECs中Yap1和STAT3蛋白的相对结合量为1.00±0.00,则GsMTx4+VP组和GsMTx4+Stattic组hRMECs中Yap1和STAT3蛋白的相对结合量分别为0.13±0.01和0.15±0.01,3组总体相比差异有统计学意义(F=115.088,P=0.012)。两两比较结果显示,与GsMTx4组相比,GsMTx4+VP组和GsMTx4+Stattic组hRMECs中Yap1和STAT3蛋白的相对结合量均较弱,差异均有统计学意义(t=19.226、15.558,P=0.020、0.026)。
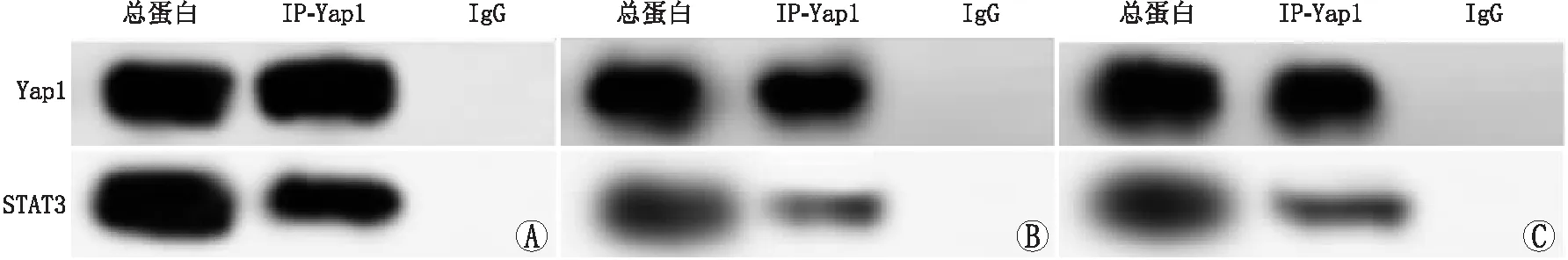
图4 免疫沉淀技术检测GsMTx4组、GsMTx4+VP组和GsMTx4+Stattic组hRMECs中Yap1和STAT3 蛋白表达 A:GsMTx4组;B:GsMTx4+VP组;C:GsMTx4+Stattic组。
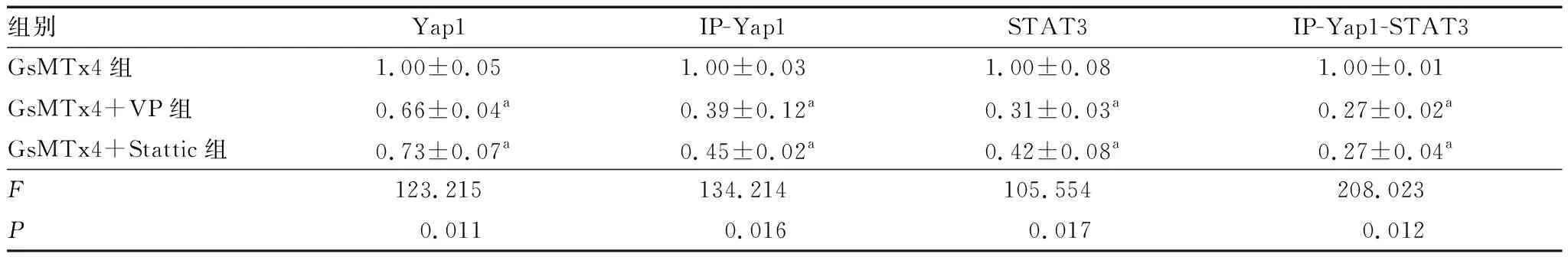
表1 各组Yap1和STAT3蛋白的相对表达量
2.5 Yap1/STAT3信号通路拮抗剂抑制hRMECs血管生成GsMTx4组、GsMTx4+VP组和GsMTx4+Stattic组hRMECs增殖率分别为46.69%±2.96%、37.22%±3.09%、32.02%±1.96%,小管分支数分别为(100.00±9.86)个、(48.09±7.25)个、(71.69±5.88)个。经统计学处理,与GsMTx4组相比,GsMTx4+VP组和GsMTx4+Stattic组hRMECs增殖率、小管分支数均下调,差异均有统计学意义(均为P<0.05)(图5)。
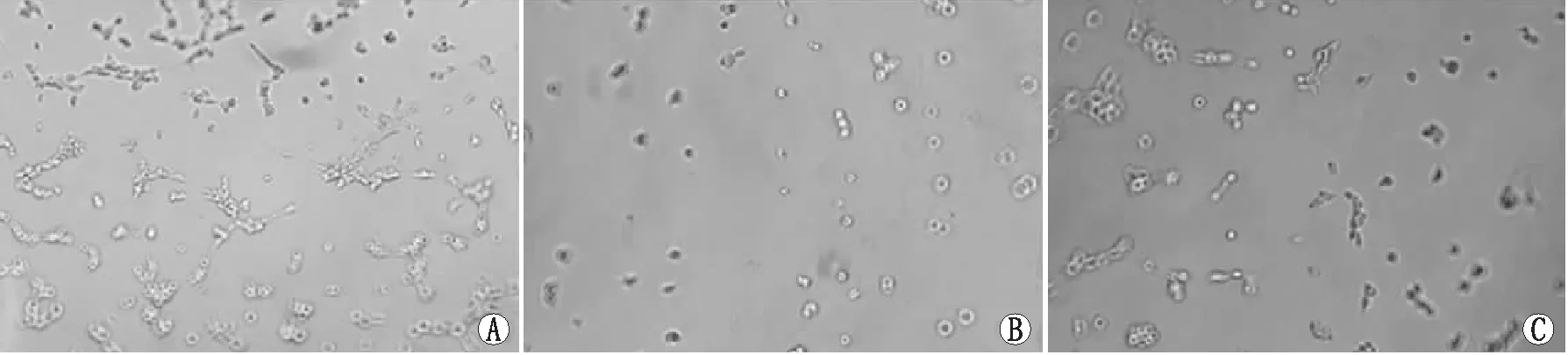
图5 小管形成实验检测GsMTx4组、GsMTx4+VP组和GsMTx4+Stattic组hRMECs的小管分支情况(×200) A:GsMTx4组;B:GsMTx4+VP组;C:GsMTx4+Stattic组。
3 讨论
视网膜新生血管疾病包括早产儿视网膜病变、增生型糖尿病视网膜病变、老年性黄斑变性等,是导致患者中度至重度视力丧失的最常见原因[10]。内皮源性血管收缩和血管扩张物质的失衡以及视网膜内皮细胞的血管生成作用改变是该类疾病发生发展的关键机制,尽管Yap1/STAT3信号通路已被证实是关键的血管生成调节机制,如Yap1参与血管生成,包括调节血管生成素-2表达[11],促进后大静脉发育[12],介导VEGF-VEGFR2信号[13]。特别是在脉络膜新生血管中,Yap1通过促进内皮细胞增殖促进脉络膜新生血管的形成[14],又如STAT3激活微小RNA-21下调基质金属蛋白酶组织拮抗剂3,促进缺血视网膜血管新生[15],然而Yap1/STAT3的结合作用是否也参与调控人视网膜内皮细胞的血管生成仍然未知。
Piezo是调控血管结构和生理力学平衡如内皮收缩的关键因子,可通过调控细胞外信号调节激酶(ERK)-VEGF调节糖尿病勃起功能障碍患者的血管生成[16-17]。然而,目前仍不清楚Piezo在视网膜内皮细胞的血管生成中的作用。在本研究中,我们观察到使用Piezo的拮抗剂GsMTx4不仅促进了hRMECs的增殖,还明显促进了小管的形成,这是血管生成的重要事件。而且我们还证实,Piezo的拮抗剂GsMTx4明显促进了Yap1蛋白和STAT3蛋白的直接结合。有研究显示,Yap1与STAT3结合后参与了hRMECs中VEGF的转录[18];STAT3在视网膜神经节细胞中也有表达[19],激活STAT3可促进眼部血管生成[20]。本研究结果表明,Piezo的拮抗剂GsMTx4具有促进hRMECs血管生成的作用,并且Yap1/STAT3信号通路可能参与了这个过程。
YAP1/STAT3信号通路是调控血管生成的关键通路之一。Zhao等[21]研究表明,激活YAP1/STAT3信号通路可以促进哮喘气道平滑肌细胞的血管生成,而YAP1敲减联合STAT3抑制剂(WP1066)都可以使细胞因子刺激的气道平滑肌细胞中的STAT3失活,从而进一步抑制VEGF的表达,阻碍血管生成。然而该研究并未探讨YAP1和STAT3是否具有直接结合的作用。在本研究中,Yap1拮抗剂VP和STAT3拮抗剂Stattic都减弱了hRECs中的Yap1和STAT3的结合作用,与此同时,我们通过CCK-8和小管形成实验观察到VP和Stattic都抑制了GsMTx4的促血管生成作用,二者对GsMTx4诱导下hRMECs的增殖和小管形成作用均具有明显的抑制作用。还有报道显示,抑制Yap1可减轻氧诱导视网膜病变小鼠模型新生血管的形成[22]。这表明Piezo的拮抗剂GsMTx4对视网膜新生血管性疾病有治疗作用,其中促进YAP1/STAT3信号通路的激活是其关键机制之一。
本研究结果仍有不足,细胞种类和动物模型的验证仍较为欠缺,因此,需进一步从多种视网膜内皮细胞和多种动物模型中验证GsMTx4诱导下hRMECs的增殖和小管形成作用是否与Yap1和STAT3的直接结合有关,并深入探讨GsMTx4如何有效缓解视网膜新生血管性疾病。
综上所述,Piezo拮抗剂GsMTx4通过激活Yap1/STAT3信号通路促进hRMECs的血管生成。本研究结果为预防视网膜新生血管性疾病提供了新的治疗靶点。
