转甲状腺素蛋白介导STAT4/miR-223-3p/FBXW7通路对高糖诱导的人视网膜内皮细胞新生血管生成的影响△
2023-03-07焦军杰姚文艳张前辉李秀娇马萧萧李晓鹏
焦军杰 姚文艳 张前辉 李秀娇 常 昆 马萧萧 李晓鹏
糖尿病视网膜病变(DR)是糖尿病常见的慢性并发症,其发病率较高,病变以视网膜缺血、缺氧、反复出血为特点,对患者视功能影响较大[1-2]。该病早期症状不明显,随着病情发展,患者视功能受到较大影响,DR是成年人失明最常见的原因之一[3-4]。DR中视网膜新生血管的生成是增生型DR(PDR)的重要标志,PDR对患者视功能影响更严重,通常预后较差。因此,了解DR患者视网膜新生血管的生成机制对控制PDR的发生发展具有重大意义。转甲状腺素蛋白(TTR)又被称为前白蛋白,主要由肝脏和脉络膜分泌,存在于血液和脑脊液中,其主要生理功能是转运甲状腺素和协同视黄醇结合蛋白共同转运维生素A[5]。有研究表明[6-7],TTR与DR的进程有关,正常结构TTR可以抑制视网膜新生血管生成,促进血管上皮细胞和内皮细胞凋亡,对阻遏DR病情发展具有重大意义。但TTR在DR中的作用机制仍不十分清楚。本研究旨在分析TTR在DR中抑制新生血管的机制,为临床治疗此类患者提供参考依据。
1 材料与方法
1.1 主要试剂和仪器TTR购于北京义翘神州科技有限公司;RIPA细胞裂解液购于北京索莱宝科技有限公司;TaqMan©MicroRNA Reverse Transcription kit逆转录试剂盒和Lipofectamine2000购于赛默飞世尔科技有限公司;CCK-8检测试剂盒购于美国Sigma公司;ELISA试剂盒购于武汉伊莱瑞特生物科技有限公司兔抗人信号转导和转录激活因子4(STAT4)、miR-223-3p、F-box WD 重复蛋白 7 (FBXW7)和血管内皮生长因子(VEGF)单克隆抗体均购于美国Santa Cruz公司;ECL化学发光检测试剂盒购于上海吉至生化科技有限公司。细胞培养箱购于上海玉研科学仪器有限公司;酶标仪购于北京泽平科技有限责任公司;凝胶成像系统购于杭州申花科技有限公司。
1.2 细胞来源及培养人视网膜内皮细胞(hRECs)购于中国科学院上海细胞库。将hRECs置于含体积分数10%胎牛血清和10 g·L-1青链霉素混合液的DMEM细胞培养基中,于37 ℃含体积分数5%CO2的培养箱中进行培养,选取对数生长期细胞进行实验。
1.3 TTR对hRECs生物学行为的影响
1.3.1 实验分组与转染方法实验随机分为3组,其中,对照组:正常处理细胞;HG组:用含有25 mmol·L-1葡萄糖的培养基孵育hRECs;HG+TTR组:用含有25 mmol·L-1葡萄糖的培养基孵育转染TTR的hRECs。各组细胞均置于37 ℃,含体积分数5%CO2的培养箱中培养24 h后用于后续实验。细胞转染方法:取对数生长期的hRECs以每孔2×105个接种至6孔板中,细胞长至约80%融合时,按照Lipofectamine2000试剂盒说明书转染TTR过表达质粒。
1.3.2 ELISA检测TTR蛋白含量将对照组、HG组和HG+TTR组的hRECs分组处理后接种于6孔板中,每组各设置3个复孔,分别培养24 h、48 h、72 h后,PBS洗2次,胰蛋白酶消化2 min后,3000 r·min-1离心5 min,采用ELISA检测试剂盒按说明书操作检测各时间点各组细胞上清液中TTR含量。
1.3.3 TTR对细胞增殖的影响将HG组和HG+TTR组的hRECs分组处理后以每孔5×103个接种于96孔板,分别于培养0 h、6 h、12 h、18 h、24 h时每孔加入10 μL的CCK-8溶液,37 ℃继续孵育2 h,于450 nm波长处采用酶标仪检测细胞吸光度,计算各组细胞活力。
1.3.4 血管生成实验采用基底膜基质进行血管生成实验。将基质装入48孔板中,每孔300 μL,在37 ℃下聚合30 min,将HG组和HG+TTR组hRECs以每孔3×104个接种后,在37 ℃孵育24 h。利用Olympus显微镜观察hRECs血管生成情况并拍照,以形成管状结构的面积占比代表血管生成率(血管生成率=管状结构的面积/培养孔面积×100%)。其中,每组细胞接种3个复孔,结果取平均值。
1.4 miR-223-3p对hRECs生物学行为的影响
1.4.1 实验分组实验随机分为3组,其中,HG+NC mimic组:用含有25 mmol·L-1葡萄糖培养基孵育转染NC mimic的hRECs;HG+miR-223-3p mimic组:用含有25 mmol·L-1葡萄糖培养基孵育转染miR-223-3p mimic的hRECs;HG+TTR+miR-223-3p mimic组:用25 mmol·L-1葡萄糖培养基孵育转染miR-223-3p mimic和TTR的hRECs。各组细胞均置于37 ℃含体积分数5%CO2的培养箱中培养24 h后进行后续实验。细胞转染方法参见1.3.1。
1.4.2 RT-PCR检测miR-223-3p表达将HG+NC mimic组、HG+miR-223-3p mimic组和HG+TTR+miR-223-3p mimic组细胞培养48 h,Trizol法提取细胞中总RNA,紫外分光光度计法测定RNA的浓度。按TaqMan©MicroRNA Reverse Transcription kit逆转录试剂盒说明书以RNA为模板进行逆转录获得cDNA并置于4 ℃保存,扩增后置于RT-PCR仪中进行测定,设置反应条件:95 ℃ 5 min预变性;95 ℃变性20 s,60 ℃ 退火5 s,70 ℃延伸200 s,共45个循环。以GAPDH为内参,引物序列如下:miR-223-3p上游引物为5’-CAGAAAGCCCAATTCCATCT-3’,下游引物为5’-GGGCAAATGGATACCATACC-3’;GAPDH上游引物为5’-GGCTCTCTGCTCCTCCCTGTTCTAG-3’,下游引物为5’-CGTCCGATACGGCCAAATCCGT-3’。采用2-ΔΔCt计算目标基因mRNA相对表达量。
1.4.3 miR-223-3p对细胞增殖的影响参见1.3.3方法检测HG+NC mimic组、HG+miR-223-3p mimic组和HG+TTR+miR-223-3p mimic组hRECs的细胞活力。
1.4.4 血管生成实验观察HG+NC mimic组、HG+miR-223-3p mimic组和HG+TTR+miR-223-3p mimic组hRECs的血管生成情况,详细方法见1.3.4。
1.5 STAT4与miR-223-3p的相互作用
1.5.1 生物信息学分析通过生物信息学在线数据库UCSC (http://genome.ucsc.edu/cgi-bin/hgNear)和PROMO (http://alggen.lsi.upc.es/cgi-bin/promo_v3/promo/promoinit.cgi?dirDB=TF_8.3)分析潜在的启动子,包括STAT4。
1.5.2 实验分组实验随机分为3组,其中,HG组:用含有25 mmol·L-1葡萄糖培养基孵育hRECs;HG+siNC组:用含有25 mmol·L-1葡萄糖培养基孵育转染siNC的hRECs;HG+siSTAT4组:用含有25 mmol·L-1葡萄糖培养基孵育转染siSTAT4的hRECs。细胞转染方法参见1.3.1。
1.5.3 RT-PCR检测miR-223-3p表达收集HG组、HG+siNC组和HG+siSTAT4组细胞,并提取细胞内总RNA,行RT-PCR检测各组细胞中miR-223-3p表达,具体方法参见1.4.2。引物序列如下:miR-223-3p上游引物为5’-CAGAAAGCCCAATTCCATCT-3’,下游引物为5’-GGGCAAATGGATACCATACC-3’;STAT4上游引物为5’-TTGTCTGCTCTACCATTCGCTG-3’,下游引物为5’-CTTTCTCTCCGCACAACGC-3’;GAPDH上游引物为5’-GGCTCTCTGCTCCTCCCTGTTCTAG-3’,下游引物为5’-CGTCCGATACGGCCAAATCCGT-3’。采用2-ΔΔCt计算目标基因mRNA相对表达量。
1.5.4 双荧光素酶报告实验构建野生型报告基因载体STAT4-WT与突变型报告基因载体STAT4-MT,将该载体分别与miR-NC或miR-223-3p mimic共转染到hRECs中。置于37 ℃、体积分数5% CO2培养箱继续培养48 h,用荧光素酶检测试剂盒测量各组细胞中的荧光素酶活性。
1.6 Western blot检测VEGF、TTR、STAT4和FBXW7蛋白表达细胞分组处理后加入RIPA蛋白裂解液,冰上裂解30 min后离心15 min,提取总蛋白,采用BCA试剂盒检测蛋白浓度。经100 g·L-1SDS-PAGE电泳后转移至PVDF膜上,脱脂奶粉封闭蛋白1 h,加入一抗 VEGF(11000)、TTR(11000)、STAT4(11000)和FBXW7(11000),4 ℃过夜孵育, PBS洗膜3次。添加HRP标记二抗( 110 000)于室温孵育2 h,PBS洗膜3次。最后滴入ECL显色,以GAPDH作为内参照,凝胶图像成像系统成像获得蛋白条带,ImageJ分析目的蛋白的灰度值。

2 结果
2.1 TTR过表达后在hRECs中含量变化培养24 h、48 h和72 h时,与对照组相比,HG组和HG+TTR组hRECs中TTR水平均显著升高(均为P<0.05);与HG组相比,HG+TTR组中TTR水平均显著升高(均为P<0.05)(表1)。

表1 各组hRECs中TTR水平
2.2 TTR过表达对hRECs增殖和血管生成的影响培养24 h时,与HG组相比,HG+TTR组hRECs细胞活力明显下降(P<0.05),其余时间点(0 h、6 h、12 h、18 h)两组间hRECs细胞活力相比差异均无统计学意义(均为P>0.05)(图1A)。培养24 h时,HG组和HG+TTR组hRECs血管生成率分别为(38.12±4.91)%、(19.46±2.12)%,HG+TTR组血管生成率明显小于HG组(P<0.05)(图1B)。
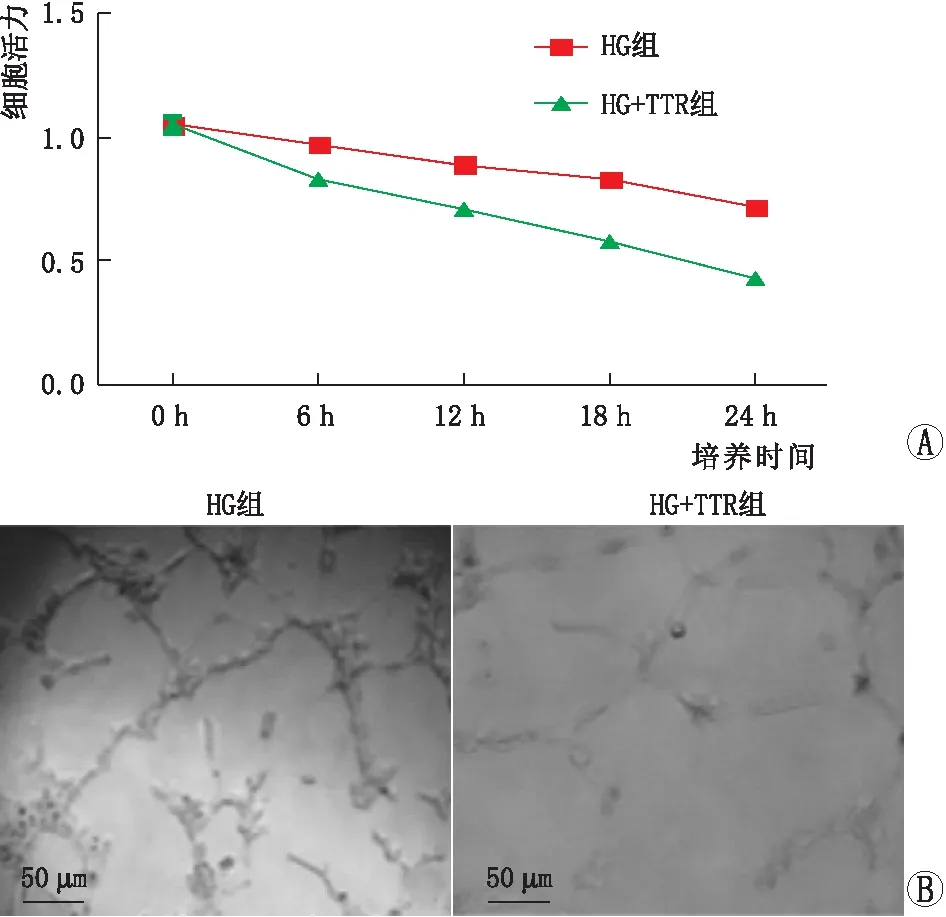
图1 TTR过表达对hRECs增殖和血管生成的影响 A:细胞活力实验;B:血管生成实验(×200)。
2.3 TTR逆转miR-223-3p对hRECs的作用RT-PCR结果显示,与HG+NC mimic组相比,HG+miR-223-3p mimic组hRECs中miR-223-3p表达上调(P<0.05);与HG+miR-223-3p mimic组相比,HG+TTR+miR-223-3p mimic组中miR-223-3p表达下调(P<0.05)(图2A)。细胞增殖实验结果显示,各组细胞活力随着时间增加而增加(均为P<0.05),培养72 h时,与HG+NC mimic组相比,HG+miR-223-3p mimic组hRECs的细胞活力明显增加(P<0.05);与HG+miR-223-3p mimic组相比,HG+TTR+miR-223-3p mimic组hRECs的细胞活力明显下降(P<0.05),且与HG+NC mimic组相比差异无统计学意义(P>0.05)(图2B)。血管生成实验结果显示,HG+NC mimic、HG+ miR-223-3p mimic组和HG+TTR+miR-223-3p mimic组hRECs血管生成率分别为(40.11±4.10)%、(61.52±6.25)%和(42.24±4.33)%,与HG+NC mimic组相比,HG+ miR-223-3p mimic组hRECs血管生成率增高(P<0.05);与HG+ miR-223-3p mimic组相比,HG+TTR+miR-223-3p mimic组hRECs血管生成率降低(P<0.05),且与HG+NC mimic组相比差异无统计学意义(P>0.05)(图2C)。

图2 TTR逆转miR-223-3p对hRECs的作用 A:RT-PCR检测各组细胞miR-223-3p mRNA表达;B:细胞活力实验;C:血管生成实验(×200)。1:HG+NC mimic组;2:HG+ miR-223-3p mimic组;3:HG+TTR+miR-223-3p mimic组。*示P<0.05。
2.4 STAT4与miR-223-3p启动子结合并调节其水平生物信息学分析结果显示,STAT4与miR-223-3p启动子区域相互作用(图3A)。双荧光素酶报告实验结果显示,STAT4-WT与miR-223-3p mimic共转染致荧光素酶活性降低(P<0.05)(图3B)。RT-PCR结果显示,HG组与HG+siNC组hRECs中miR-223-3p表达相比差异无统计学意义(P>0.05);与HG+siNC组相比,HG+siSTAT4组hRECs中miR-223-3p表达下降(P<0.05)(图3C)。
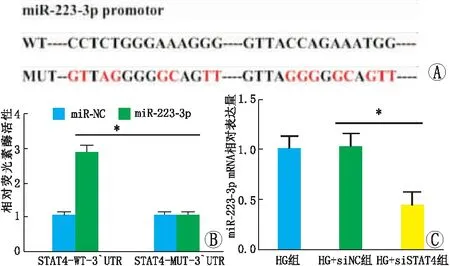
图3 STAT4与miR-223-3p启动子结合并调节其水平 A:STAT4与miR-223-3p启动子结合;B:双荧光素酶报告实验;C:RT-PCR检测各组细胞miR-223-3p mRNA表达。*示P<0.05。
2.5 TTR调控hRECs中STAT4、miR-223-3p、FBXW7和VEGF表达与HG组相比,HG+TTR组hRECs中miR-223-3p、STAT4蛋白表达均降低,FBXW7和VEGF蛋白表达均升高(均为P<0.05)。与HG+TTR组相比,HG+miR-223-3p mimic组hRECs中miR-223-3p、STAT4蛋白表达均升高,FBXW7和VEGF蛋白表达均降低(均为P<0.05)。与HG+miR-223-3p mimic组相比,HG+TTR+miR-223-3p mimic组hRECs中miR-223-3p、STAT4蛋白表达均降低,FBXW7和VEGF蛋白表达均升高(均为P<0.05)。与HG+TTR组相比,HG+TTR+miR-223-3p mimic组hRECs中miR-223-3p、VEGF、STAT4和FBXW7蛋白表达差异均无统计学意义(均为P>0.05)(图4)。
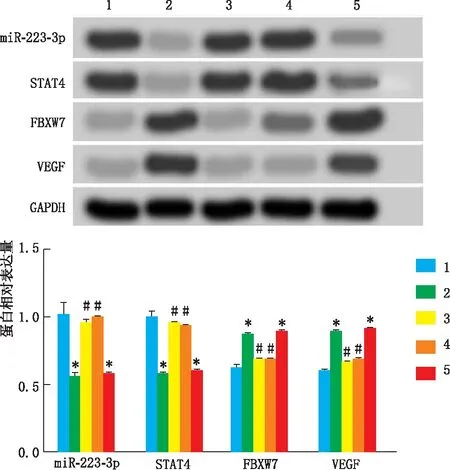
图4 各组细胞相关蛋白表达水平 1:HG组;2:HG+TTR组;3:HG+NC mimic组;4:HG+miR-223-3p mimic组;5:HG+TTR+miR-223-3p mimic组。与HG组相比,*P<0.05 ;与HG+TTR组相比,#P<0.05。
3 讨论
DR是糖尿病患者常见的并发症之一,严重时可致患者失明,该病现已成为世界范围内的公共卫生问题[8]。DR发病机制并不十分清晰,多认为与VEGF异常表达、小胶质细胞异常活化以及氧化应激反应有关。此外,目前尚无早期发现和干预的方法。因此,分析DR发病的作用机制,寻找治疗DR关键通路,可为临床治疗DR提供潜在的靶点。
本研究结果显示,培养24 h、48 h、72 h时,与对照组相比,HG组hRECs中TTR水平均显著升高(均为P<0.05);与HG组相比,HG+TTR组hRECs中TTR水平均显著升高;并且在HG处理hRECs中转染TTR,细胞活力明显下降。TTR是一种甲状腺激素结合蛋白,位于人类18号染色体(18q11.2~18q12.1),由肝脏或脉络膜产生后易位到血液或脑脊液中,以四聚体形式存在,其主要作用是运输全视黄醇结合蛋白和甲状腺素,其功能异常可导致神经系统相关疾病[9-10]。野生型TTR可引起各种形式的系统性淀粉样蛋白沉积[11]。现有研究显示[12],TTR异常表达与糖尿病和高度近视有关,提示TTR可能在DR发生发展中扮演重要角色。本研究还发现,培养24 h时,与HG组相比,HG+TTR组细胞活力下降;与HG组相比,HG+TTR组细胞血管生成减少,提示TTR处理hRECs可明显抑制细胞增殖和血管生成。基于此,我们推测hRECs损伤可促使DR的发生,提示TTR升高可能是DR发生的危险因素。
miRNAs是一种小分子无法编码的RNA,是转录后调节基因表达关键因子,参与细胞生长、增殖、迁移和侵袭等多种生物学过程[13-14]。国内外有多项研究表明,miRNA参与DR发生发展过程中的血管生成,能够逆转血脂异常,减缓DR发展进程,具有治疗DR的潜在价值[15-16]。本研究结果显示,培养72 h时,与HG+NC mimic组相比,HG+miR-223-3p mimic组hRECs细胞活力增加;与HG+miR-223-3p mimic组相比,HG+TTR+miR-223-3p mimic组hRECs的细胞活力下降;与HG+NC mimic组相比,HG+ miR-223-3p mimic组hRECs血管生成率增高;与HG+miR-223-3p mimic组相比,HG+TTR+miR-223-3p mimic组hRECs血管生成率降低。既往研究显示[7],TTR在HG诱导的hRECs中高表达,其可以抑制细胞增殖、迁移和血管生成,说明TTR对hRECs增殖和血管生成具有抑制作用,其机制可能与调节miR-223-3p表达相关。本研究进一步分析发现,STAT4与miR-223-3p启动子区域相互作用,双荧光素酶报告实验结果显示,STAT4-WT与miR-223-3p mimic共转染致荧光素酶活性降低,提示STAT4与miR-223-3p可能存在靶向关系。RT-PCR检测结果显示,与HG+siNC组相比,HG+siSTAT4组hRECs中miR-223-3p表达下降,说明STAT4和miR-223-3p存在靶向调节关系。在之前的实验中,TTR被证实可以抑制hRECs增殖和血管生成。本研究中,在HG处理后hRECs中添加外源性TTR后,细胞中miR-223-3p和STAT4蛋白表达均降低,FBXW7和VEGF蛋白表达均升高;而在HG处理后过表达miR-223-3p,细胞中miR-223-3p、STAT4蛋白表达均升高,FBXW7和VEGF蛋白表达均降低。TTR作为转运蛋白将甲状腺素转运至细胞核或线粒体,可参与眼部生长发育过程[17]。有研究显示[18],DR是一种炎症反应,其视网膜功能与血管生成有关,DR患者产生的晚期糖基化终末产物、活性物质等可使VEGF表达增加。VEGF是一种促新生血管因子,具有促进血管内皮有丝分裂的功能,对内皮细胞凋亡具有抑制作用,因此,它能促进细胞迁移、增殖来修复受损血管[19]。据报道[20],FBXW7在细胞信号转导及细胞增殖、分化、迁移和凋亡中均发挥重要作用,被认为是肿瘤抑制因子。已有研究证实,FBXW7是miR-223-3p 的直接结合靶标,miR-223-3p通过与FBXW7的3’-UTR结合来抑制FBXW7的表达[21]。结合本研究结果我们认为,TTR具有抑制DR新生血管生成的作用,其可能是通过介导STAT4/miR-223-3p/FBXW7信号轴实现的。
综上所述,TTR在HG处理的hRECs中高表达,且在添加外源性TTR后, hRECs增殖和血管生成被显著抑制,而加入TTR的同时转染miR-223-3p mimic则逆转了TTR对hRECs的抑制作用,且STAT4与miR-223-3p启动子结合并调节其水平,miR-223-3p与FBXW7靶向结合,推测TTR对hRECs的抑制作用可能是通过调控STAT4/miR-223-3p/FBXW7信号轴实现的。但本研究对于miR-223-3p和FBXW7的靶向关系并未深入研究,尚需进一步研究分析TTR抑制DR新生血管生成的具体机制。
