妊娠期糖尿病孕妇肠道菌群的组成变化及临床意义
2023-03-07曾智华陈秋玲彭冬梅邓燕霞
李 华,曾智华,陈秋玲,彭冬梅,邓燕霞
(长沙市妇幼保健院产科,湖南 长沙 410000)
妊娠期糖尿病(gestational diabetes mellitus,GDM)是最常见的妊娠并发症之一,与孕产妇和围产期结局风险增加有关[1]。然而,目前尚无可用于GDM的有效预测系统,其发病机制尚未完全阐明。微生物被认为是宿主新陈代谢和健康的重要贡献者之一,妊娠期间孕妇肠道微生物群发生显著变化,可能导致妊娠期代谢功能发生障碍,比如GDM。最近研究报告了GDM患者和血糖正常孕妇肠道微生物群的差异[2],尚无法判断因果关系。根据2021年《糖尿病的分类和诊断》指南[3],所有患者在诊断GDM后都应该接受教育性饮食干预,进行精准营养指导,但孕妇的遵守情况存在很大差异。因此,本研究的目的是评估GDM患者体内的肠道微生物群组成是否在妊娠中期至妊娠晚期发生了变化,对饮食建议依从性较高的患者与依从性较差的患者比较,是否呈现出不同的微生物模式。
1 资料与方法
1.1 一般资料
于2021年6月至12月从长沙市妇幼保健院连续招募了31名GDM患者作为研究对象。纳入标准:孕24~28周、汉族、经75g口服葡萄糖耐量试验(oral glucose tolerance test,OGTT)诊断的GDM。排除标准:双胎妊娠,怀孕期间使用过益生元/益生菌、抗生素或任何药物,怀孕前或怀孕期间的任何病理状况(已知的糖尿病、高血压、心血管疾病、肺部疾病、自身免疫病、肝脏或肾脏疾病、甲状腺功能障碍、癌症、其他疾病/病症),不遵守研究方案。所有研究对象都服用叶酸补充剂。每位研究对象都签署了书面知情同意书。
所有GDM患者都按照指南常规接受营养咨询和饮食指导(碳水化合物占总能量的45%,快速吸收的糖占<10%的总能量,蛋白质占总能量的18%~20%,脂肪占总能量的35%,每天至少摄入20~25g纤维,不饮酒)[4]。此外,建议每天进行30min的适度运动(即快走)。根据指南[3],在存在高血糖的情况下,医生会开具胰岛素治疗处方。
1.2 样本采集、人体测量和饮食信息
在诊断GDM(入组时,孕24~28周)时及在研究结束时(孕38周)或分娩前(如果是早产),从所有孕妇中收集问卷、人体测量值、空腹血液样本和粪便样本。研究人员通过建立微信群与患者保持持续联系,定期到医院产检,以了解孕期进展。研究对象在入组时和研究结束时完成了3天的饮食记录(2个工作日和1个休息日)。向所有研究对象提供有关如何使用常见家庭措施记录食物和饮料消耗的详细信息。
1.3 血样分析
通过葡萄糖氧化酶法测量孕妇血清葡萄糖,采用高效液相色谱法测定糖化血红蛋白(glycosylated hemoglobin,HbA1c)水平。通过脂肪酶/甘油激酶终点法测定甘油三酯,胆固醇过氧化物酶法测定胆固醇,直接免疫抑制法测定高密度脂蛋白(high density lipoprotein,HDL)-胆固醇。通过电化学发光法(罗氏公司)测定胰岛素。使用特种蛋白分析仪(深圳普门)免疫比浊法测定血清C-反应蛋白(C-reactive protein,CRP)值。
1.4 粪便DNA提取
从收集的孕妇粪便中提取核酸。使用RNeasy Power Microbiome KIT(美国Qiagen公司)从样品中提取总DNA。加入1μL RNase(美国Illumina公司)以消化DNA样品中的RNA,在37℃下孵育1h。使用QUBIT dsDNA检测试剂盒(美国Life Technologies公司)对DNA进行定量,并以5ng/μL进行标准化。
1.5 16S rRNA扩增子靶测序
使用从粪便样本中直接提取的DNA,通过扩增16S rRNA基因的V3~V4区域来评估微生物群。使用Agencourt AMPure试剂盒(美国Beckman Coulter公司)清洁PCR扩增子,并使用Nextera XT Index Kit(美国Illumina公司)标记所得产物。在第二个纯化步骤之后,使用QUBIT dsDNA检测试剂盒(美国Life Technologies公司)对扩增子产物进行量化。随后,汇集来自不同样品的等量扩增子。使用具有V3化学成分的MiSeq Illumina仪器(美国Illumina公司)进行测序,并生成250bp的双末端读数。
1.6 生物信息学分析
双端读取首先使用FLASH软件组装,并使用QIIME 1.9.0软件进行质量过滤。以97%的相似性挑选的操作分类单元(operational taxonomic unit,OTU)被稀释到每个样本的序列数量最少。通过QIIME获得的OTU显示达到的更高分类分辨率;当分类分配无法到达属时,会显示姓氏。
1.7 统计学方法
肠道微生物群α多样性通过Chao1指数评估,估计不同菌群的数量,并通过R语言中使用Vegan package68的多样性函数计算香农多样性指数以评估菌群丰富度。非正态分布的计量资料表示为中位数(四分位数)。通过配对样本t检验或Wilcoxon配对检验比较计量资料的组间差异。通过卡方检验比较分类变量之间的差异。Spearman非参数相关性分析用于分析微生物类群的相对丰度与饮食、代谢变量之间的关系。采用多元回归分析评估微生物类群丰度与营养摄入量之间的关联。以P<0.05为具有统计学意义。
2 结果
2.1 研究对象的一般资料
与入组时(孕24~28周)相比,研究结束时(孕38周)孕妇的体重、BMI、收缩压、空腹胰岛素、总胆固醇、CRP、甘油三酯均显著增加(P<0.05),见表1。

表1 入组时和研究结束时研究对象的一般资料Table 1 General characteristics of participants at the time of enrollment and at the end of the
2.2 遵守饮食建议情况
营养咨询后,35.5%(11/31)的孕妇表示遵守给定的饮食建议。依从者和非依从者入组时的特征比较差异无统计学意义(P>0.05);研究结束时,与非依从者相比,依从者的糖、饱和脂肪酸摄入量减少,纤维摄入量增加(P<0.05)。依从者的空腹血糖、空腹胰岛素、HOMA-IR、CRP水平的变化均显著小于非依从者(P<0.05),见表2。

表2 依从者与非依从者的特征变化Table 2 Characteristics changes of those with compliance and those without
2.3 入组时和研究结束时孕妇的微生物群组成变化
与孕妇入组时相比,研究结束时孕妇的微生物群α多样性值存在显著差异,表现在物种丰富度、菌种数量和香农指数显著升高(t值分别为6.752、7.623、6.539,P<0.05),见图1A。在属水平的箱线图显示,研究结束时Bacteroides、Collinsella和Rikenellaceae的丰度显著降低,而Blautia、Butyricicoccus、Clostridium、Coprococcus、Dorea、Faecalibacterium、L-Ruminococcus和Lachnospiraceae显著增加,见图1B。
2.4 饮食依从性与微生物群变化
入组时和研究结束时的微生物群在依从者和非依从者中的变化相似,见图1B。在妊娠进展期间,Blautia、Coprococcus、Dorea和Lachnospiraceae在两组中显著增加,而Rikenellaceae减少。在研究结束时检测到了特定的微生物群变化:依从者中的Bacteroides丰度显著减少,非依从者中Faecalibacterium和L-Ruminococcus丰度显著更高,见图1B。
2.5 微生物群与营养摄入及代谢的关联
Spearman相关性和多元回归分析结果显示,Faecalibacterium与蛋白质摄入呈正相关(ρ=0.34,P<0.05),与空腹血糖变化呈负相关(ρ=-0.56,P<0.05)。Rikenecellaceae与收缩压呈负相关(ρ=-0.53,P<0.05)。Blautia与HbA1c变化、空腹胰岛素变化和HOMA-IR变化呈负相关(ρ值分别为-0.53、-0.37、-0.37,P<0.05)。Butyricimonas、Collinsella与空腹胰岛素变化(ρ值分别为0.43、0.47,P<0.05)和HOMA-IR变化(ρ值分别为0.50、0.46,P<0.05)呈正相关,见表3。

注:A.箱线图描述GDM患者在入组时和研究结束时粪便微生物群的α多样性。B.箱线图显示OTU在属水平上的相对丰度,基于粪便样本中Wilcoxon配对检验差异显著(P<0.05)。

表3 研究结束时微生物群组成与饮食、代谢变量之间的关联Table 3 Relationships between microbiome composition and dietary and metabolic variables at the end of the study
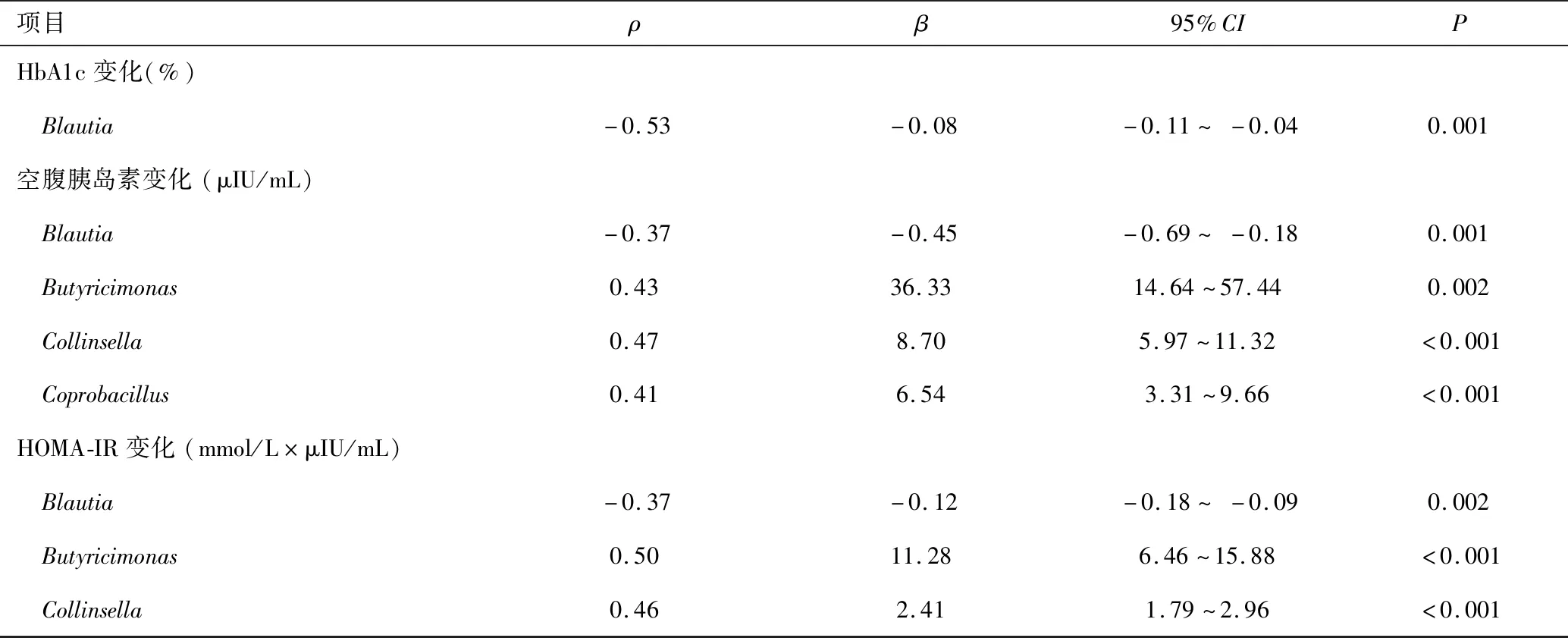
项目ρβ95%CIPHbA1c变化(%) Blautia-0.53-0.08-0.11~-0.040.001空腹胰岛素变化(μIU/mL) Blautia-0.37-0.45-0.69~-0.180.001 Butyricimonas0.4336.3314.64~57.440.002 Collinsella0.478.705.97~11.32<0.001 Coprobacillus0.416.543.31~9.66<0.001HOMA-IR变化(mmol/L×μIU/mL) Blautia-0.37-0.12-0.18~-0.090.002 Butyricimonas0.5011.286.46~15.88<0.001 Collinsella0.462.411.79~2.96<0.001
3 讨论
3.1 胰岛素敏感与微生物群丰度的关系
妊娠晚期胰岛素敏感性降低被认为有利于支持胎儿生长和增加营养吸收。临床研究发现,HbA1c水平与微生物群丰度相关[5]。动物研究中,移植了肥胖和瘦人粪便的小鼠显示出OTU丰度与空腹胰岛素和HOMA-IR水平呈正相关[6]。已发现较高的Bacteroides丰度与血浆葡萄糖水平升高相关[7]。在本研究中,Bacteroides与空腹胰岛素变化和HOMA-IR变化呈正相关,表明Bacteroides参与血糖的调节。
3.2 妊娠期饮食变化对微生物群组成的影响
本研究的大部分患者食用了低纤维和高脂肪的饮食,这是一种与GDM相关的不健康饮食模式。她们中的大多数(约2/3)在接受营养建议后并没有明显改变其饮食习惯,并且表现出比依从孕妇更差的代谢和炎症模式。孕妇增加了糖的摄入量,可能与胰岛素抵抗增加有关。本研究发现营养摄入与微生物丰度之间几乎没有关联。关于妊娠期肠道微生物群组成和饮食摄入的研究结果尚有争议。有研究发现,细菌群和膳食摄入量之间没有关系[8],也有研究认为膳食脂肪、维生素D与变形菌增加有关[9]。这些发现证实了二者关系的巨大异质性,并说明研究结果比较的困难,这可能是由于不同的饮食习惯、荷尔蒙变化导致的微生物群重塑以及由GDM引起的胰岛素抵抗。饮食模式的短期变化已被证明可以快速调节微生物群的组成。尽管人类肠道微生物群需要更长时间和持续的修改来塑造,但饮食改变后会发生快速但短暂的变化[10]。在本研究中,虽然微生物群在依从者和非依从者中的变化相似,但依从者的空腹血糖、胰岛素抵抗和CRP值波动更小。
3.3 微生物群对孕妇炎症、血糖、血压的影响
在正常怀孕期间,会出现低度炎症,并且GDM是一种促炎状态[11]。本研究观察到妊娠晚期CRP值较高。促炎和抗炎细菌种类的不平衡会引发人类的低度炎症和胰岛素抵抗[11]。Faecalibacterium作为一种抗炎共生细菌,随着妊娠的进展显著增加[12]。本研究中,我们发现Faecalibacterium丰度与空腹血糖值之间存在很强的负相关,支持了炎症与代谢异常之间的关联。因此,在宏基因组分析中,Faecalibacterium对2型糖尿病的诊断具有高度鉴别力[13]。此外,在人类粪便微生物群研究中发现,产丁酸盐的细菌与糖尿病呈负相关[14]。在本研究中,分析发现舒张压与Rikenellaceae之间的负相关关系。Rikenellaceae是一种丁酸盐生产者,Rikenellaceae对超重孕妇的血压具有保护作用,其产生丁酸盐的能力主要与维持正常血压有关[15]。
本研究也发现Collinsella和胰岛素/HOMA-IR值之间存在直接关联,这与其他研究报道一致[16],GDM患者乳酸的产生促使Collinsella丰度增加,Collinsella可以通过降低肝糖原生成和发挥促炎作用来影响新陈代谢。此外,我们观察到Blautia与HbA1c、IR呈负相关。研究表明,Blautia与高血糖症之间存在直接关联[17],其他研究也发现Blautia的丰度增加表明肠道炎症及血压值降低、1型糖尿病和肥胖症的风险降低,存活率增加[18]。
综上所述,GDM患者在妊娠期间检测到具有更高α多样性的微生物群组成的变化,以及代谢/炎症模式与特定细菌丰度之间的关联。这些结果可能有助于制订调节肠道微生物群的策略。
