非酿酒酵母属酵母的葡萄酒发酵应用研究进展
2023-03-07王春晓俞俊竹周文亚许引虎
王春晓,俞俊竹,周文亚,许引虎
非酿酒酵母属酵母的葡萄酒发酵应用研究进展
王春晓1,俞俊竹1,周文亚1,许引虎2
1贵州大学酿酒与食品工程学院/贵州省发酵工程与生物制药重点实验室,贵阳 550025;2国家酵母技术研究推广中心,湖北宜昌 443003
葡萄皮上天然存在着非酿酒酵母属酵母(non),主要在葡萄酒浸渍和发酵初期发挥作用,近年来非酿酒酵母属酵母在葡萄酒发酵中的应用受到越来越多的关注。相对于酿酒酵母,非酿酒酵母属酵母在酒精发酵中具有较弱的发酵力,可将还原糖转化为乙醇及其他代谢副产物,是生产复杂风味和低酒度葡萄酒的潜在优良酵母。不同非酿酒酵母属酵母菌种在葡萄酒发酵应用中具有不同的代谢特征,选择具有一定特征的优良非酿酒酵母属酵母应用于发酵中,可以提高葡萄酒的特色化品质。本研究在总结商业化非酿酒酵母属酵母的种类、酿造特点和应用方式的基础上,重点综述了不同非酿酒酵母属酵母对葡萄酒颜色、香气、口感和安全健康4个方面的积极作用、代谢机理和研究热点:具有高产酸、多糖、胞外丙酮酸及低吸附性等特性的非酿酒酵母属酵母可通过不同代谢机理促进葡萄酒颜色的稳定;不同非酿酒酵母属酵母通过低产乙醇、乙醛、降低挥发性酚类,高产乙酸乙酯、乙酸酯类化合物、乙酯类化合物、高级醇、与萜烯或硫醇释放相关的酶类等途径促进葡萄酒果味香气的提升,增加香气复杂性;非酿酒酵母属酵母通过高产甘油、多糖和乳酸,降解苹果酸等方式调节葡萄酒的口感特征;非酿酒酵母属酵母作为生物防治剂可以降低葡萄酒酿造中二氧化硫的用量,通过代谢降解作用减少有毒化合物,提升葡萄酒的安全质量。本文进一步解析了非酿酒酵母属酵母的基因组和微卫星位点分析研究现状,探讨了目前非酿酒酵母属酵母葡萄酒发酵应用研究的主要接种策略,提出了未来研究仍需关注的热点方向,为非酿酒酵母属酵母在葡萄酒酒精发酵中的应用研究提供理论参考。
混合发酵;颜色稳定性;香气复杂性;基因型;商业化
0 引言
葡萄酒酿造是一个复杂的生物化学过程,主要由酵母菌完成酒精发酵。非酿酒酵母属(non-)是相对于酿酒酵母属()提出的一个概念,主要是指在葡萄酒酿造中存在的除酿酒酵母属之外的所有酵母菌种[1]。Kurtzman等[2]鉴定了149个属的将近1 500个非酿酒酵母属菌种,然而据Jolly等[1]2014年的统计只有40余种分离自葡萄或葡萄醪,这一数字在2021年更新至293个菌种[3]。293个非酿酒酵母属菌种在分类地位上属于2个门、9个纲、18个目和37个科,其中191个非酿酒酵母属菌种属于子囊菌门(Ascomycota),101个菌种属于担子菌门(Basidiomycota),由于非酿酒酵母属酵母大多高产挥发酸,曾经一度被认为是葡萄酒酿造的败坏酵母[3-4]。近年来随着产区特色葡萄酒、自然葡萄酒、有机葡萄酒、生物动力葡萄酒等在市场推广和全球变暖对产区风土条件的影响[5–7],具有不同风土特色的葡萄酒越来越受到人们的关注,因此,一部分具有某些酿酒特征的非酿酒酵母属酵母得以筛选和商业化(表1),并主要以与酿酒酵母结合应用的方式赋予葡萄酒独特的风格[5,8-9]。
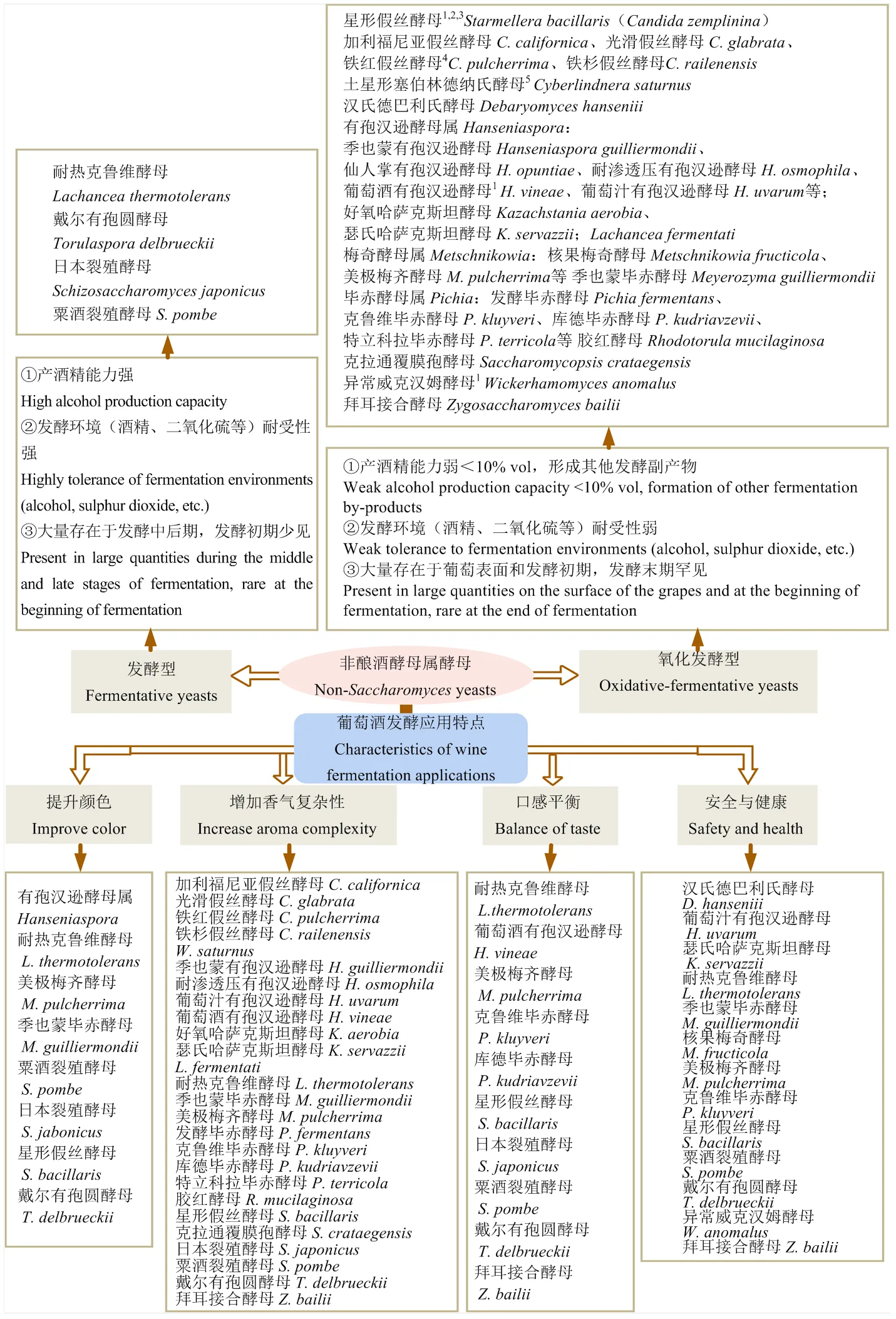
按照发酵能力和耐受性的强弱,非酿酒酵母属酵母可以分为两类(图1)[10]:一类为发酵型酵母,拥有较强的产酒精能力和耐受性,因此具备单菌种发酵的潜力,但目前仍主要以与酿酒酵母结合应用的方式提升葡萄酒的风味复杂性和酿造可控性[11-12]。戴尔有孢圆酵母()、粟酒裂殖酵母()和耐热克鲁维酵母()是目前主要商业化的发酵型非酿酒酵母属酵母(表1)。另一类为氧化发酵型酵母(也称为半发酵型酵母),产酒精能力和耐受性一般弱于酿酒酵母,单菌种发酵往往导致发酵迟缓或发酵中止,无法将葡萄醪中主要的葡萄糖和果糖代谢完全,因此需与代谢力强的酿酒酵母或发酵型非酿酒酵母属酵母结合使用来完成酒精发酵。目前商业化的氧化发酵型酵母主要包括美极梅奇酵母()、克鲁维毕赤酵母()和瑟氏哈萨克斯坦酵母()等(表1),葡萄酒有孢汉逊酵母()等其他具有代谢特色的酵母受到日益增加的研究关注,具有商业化应用的潜力。非酿酒酵母属酵母的研发推动了混合接种发酵方式在葡萄酒酿造工业中的应用,部分商业酵母为酿酒酵母与1—2种非酿酒酵母属酵母的混合菌剂(如Melody,表1)或非酿酒酵母属酵母之间的混合菌剂(如Thrill yeast,表1)。
不同非酿酒酵母属酵母菌种在葡萄酒酿造过程中所起的作用各具特色,归纳总结其代谢机理、发酵特征,对在葡萄酒酿造接种过程中根据葡萄酒酿造特性要求,选择相应的非酿酒酵母属酵母具有重要意义。本研究综述了可积极改善葡萄酒品质的非酿酒酵母属酵母菌种及其代谢机理和混合发酵应用研究热点,并总结了非酿酒酵母属酵母基因组和种内基因型分析方法(微卫星位点分析)的研究现状,为非酿酒酵母属酵母在葡萄酒发酵中的应用提供理论基础,为酿造多样化和特色化的葡萄酒提供理论参考。
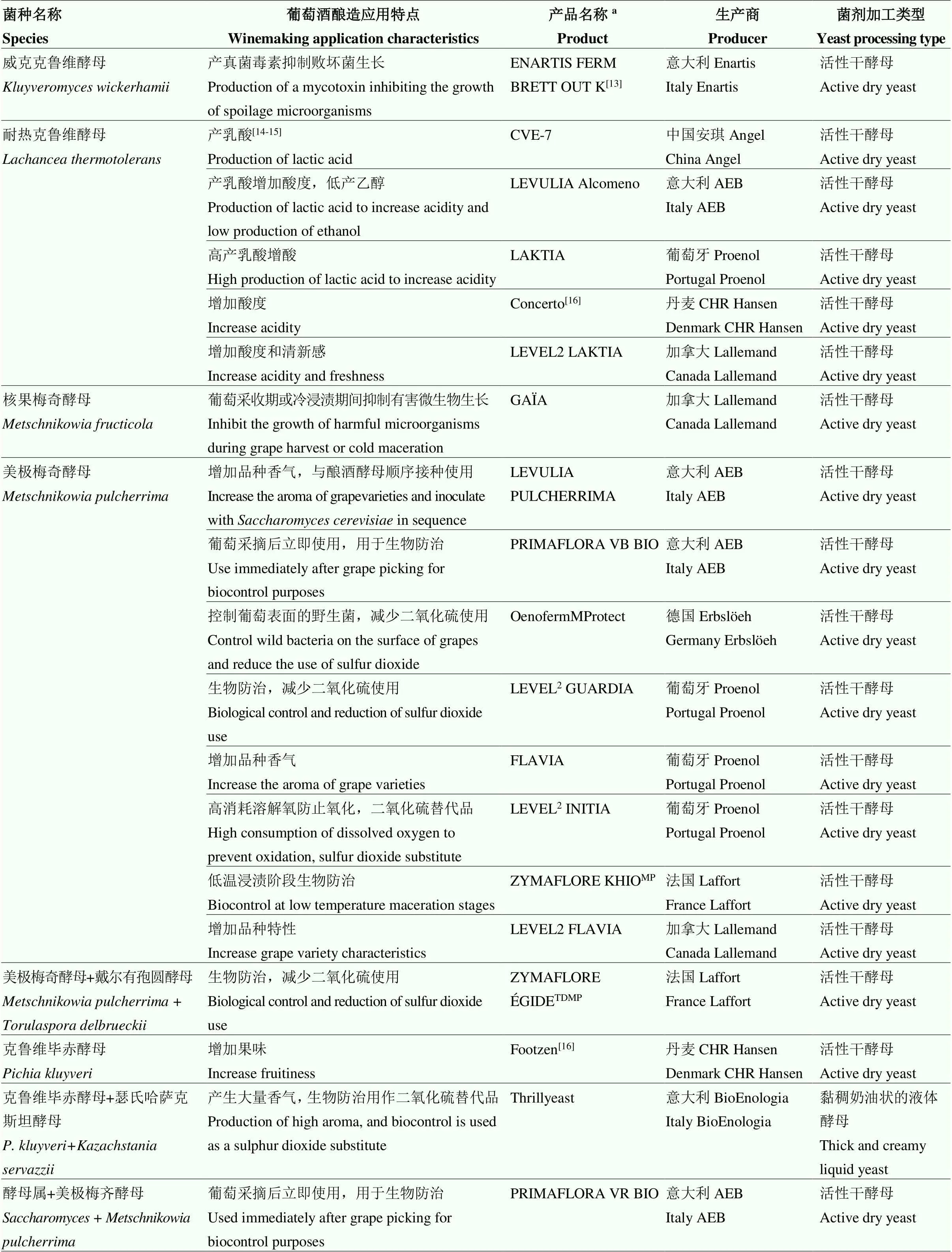
表1 已经商业化应用于葡萄酒酿造领域的非酿酒酵母属酵母
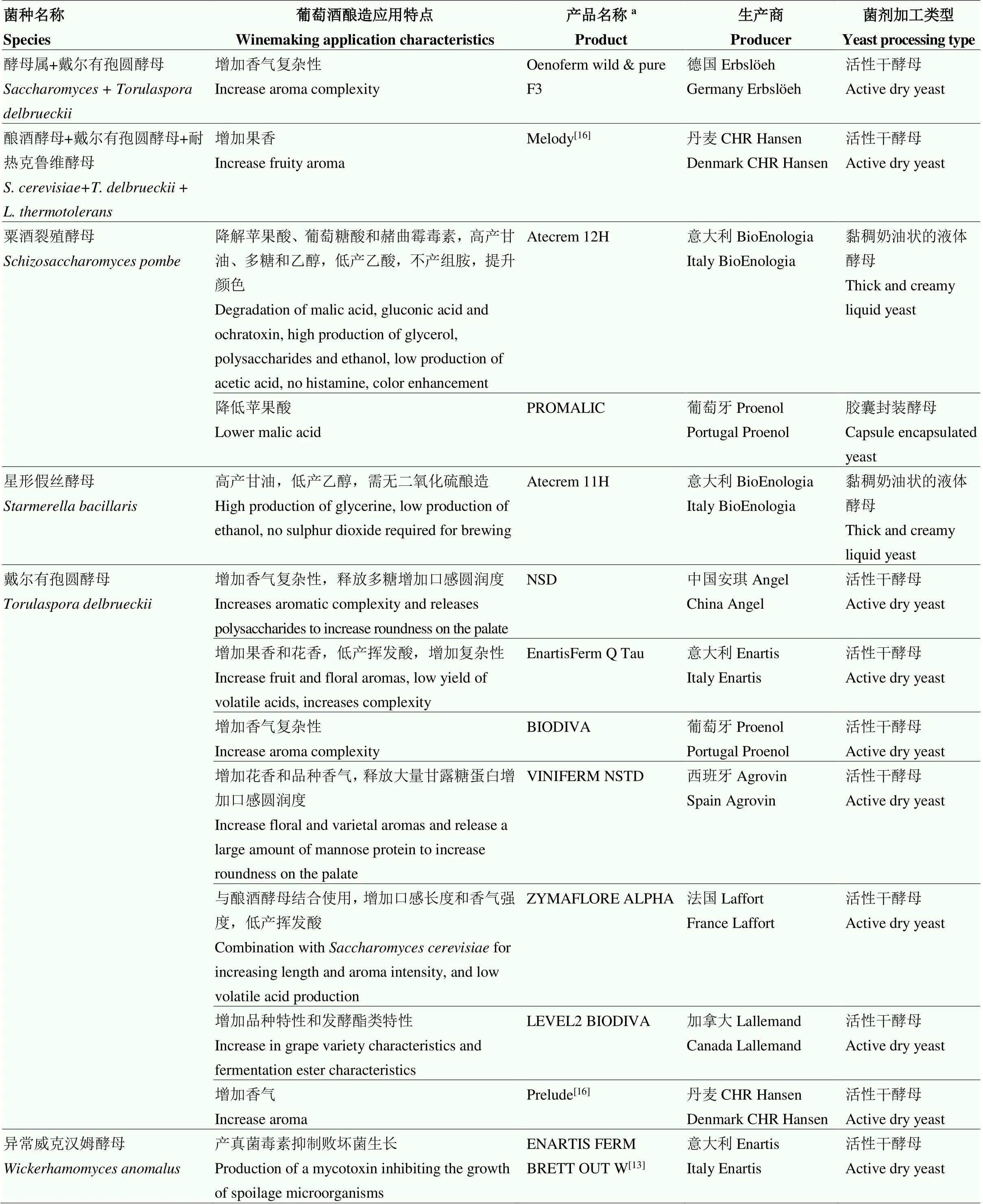
续表1 Continued table 1
a产品名称源自参考文献或网址(2022年2月4日检索结果):加拿大Lallemand(https://www.lallemandwine.com/)、意大利Enartis(https://www. enartis.com/)、法国Laffort(https://laffort.com/)、西班牙Agrovin(https://www.agrovin.com/)、葡萄牙Proenol(https://www.proenol.com/web/)、意大利BioEnologia(https://www.bioenologia.com/vino/)、德国Erbslöeh(https://erbsloeh.com/)、意大利AEB(https://www.enartis.com/)
aProduct name was derived from reference or website (search results on February 4, 2022): Canada Lallemand (https://www.lallemandwine.com/), Italy Enartis (https://www.enartis.com/), France Laffort (https://laffort.com/), Spain Agrovin (https://www.agrovin.com/), Portugal Proenol (https://www.proenol.com/web/), Italy BioEnologia (https://www.bioenologia.com/vino/), Germany Erbslöeh (https://erbsloeh.com/), Italy AEB (https://www.enartis.com/)
1有些菌株耐受10% vol左右酒精;22011年星形假丝酵母Candida stellata被重新归类为泽普林假丝酵母Candida zemplinina[1],2012年泽普林假丝酵母C. zemplinina更名为星形假丝酵母Starmerellabacillaris[21];3有些菌株产酒精能力强(11%—13% vol);4是美极梅齐酵母的无性型;5同土星拟威尔酵母
非酿酒酵母属酵母与酿酒酵母的结合应用促进了葡萄酒颜色、香气、口感和安全健康等方面的品质提升(图1):①非酿酒酵母属酵母通过5种不同的代谢机理改善花青素的聚合状态,从而提升葡萄酒颜色;②非酿酒酵母属酵母通过7种发酵相关代谢途径改善葡萄酒香气复杂性;③非酿酒酵母属酵母通过4种发酵副产物影响葡萄酒口感平衡;④非酿酒酵母通过3方面代谢提升葡萄酒的安全性与健康。
1 可提升葡萄酒颜色的非酿酒酵母属酵母
葡萄酒中的花青素源自葡萄果皮,主要有5种:矢车菊素、芍药素、飞燕草素、矮牵牛素和锦葵素[22]。在葡萄酒发酵和陈酿过程中,花青素经过一系列聚合作用不断变化,形成陈年葡萄酒中赋予颜色稳定性的花青素化合物,如吡喃型花青素类化合物[23]。吡喃型花青素类化合物包含多种类型,如vitisin A型、vitisin B型、portisin型和pinotins型等(图2),其中vitisin A型是陈年葡萄酒中含量最丰富的吡喃型花青素,其颜色深、稳定性好且耐二氧化硫漂白,因此,vitisin A型花青素的增加可提升葡萄酒颜色稳定性,而选择高产丙酮酸和乙醛的非酿酒酵母属酵母能提高葡萄酒中vitisins型吡喃花青素含量[24]。葡萄酒中vitisin A型花青素提供了橙红色,vitisin B型花青素提供了橘黄色,portisin型花青素则提供了蓝色、蓝紫色与紫红色,在发酵初期由于丙酮酸的生成,vitisin A型花青素累积速度高于vitisin B型花青素和portisin型花青素,多种吡喃型花青素在葡萄酒发酵过程中累积,提高了颜色稳定性[23,25]。
研究表明,高产丙酮酸[26],单菌种酒精发酵结束后发酵液中丙酮酸含量为287 mg·L-1,而酿酒酵母为89 mg·L-1[27],因为可通过苹果酸酒精发酵途径将苹果酸分解形成丙酮酸,从而增加胞外丙酮酸的含量[28]。释放到胞外的丙酮酸与花青素反应形成vitisin A型花青素(图2),因此,纯种发酵和混合发酵都增加了颜色强度、vistin A型花青素和总花青素的含量[27],且混合发酵时增加的接种比例能够加强红色色泽[29]。值得注意的是,丙酮酸含量并非越高越好,在模拟葡萄汁中加入880.6 mg·L-1的丙酮酸会对酿酒酵母形成压力,促进部分花青素转化形成山柰酚及其衍生物,最终造成颜色的损失[24]。因此,在筛选高产丙酮酸酵母时需综合分析其丙酮酸产量及对颜色的影响。除外,也具有苹果酸酒精发酵途径,研究表明,与酿酒酵母同时接种发酵对颜色的提升弱于顺序接种发酵(接种24 h后再接种酿酒酵母)[30]。接种后48—72 h再接种能显著增加葡萄酒中vistin A型花青素的含量,推断可能与在酒精发酵过程中高产丙酮酸有关,但仍需证实[31]。除vitisin A型花青素外,酵母菌酒精发酵过程中形成的乙醛能形成乙基桥(CH-CH3)将单体花青素与黄烷醇缩合形成更稳定的聚合色素——vitisin B型花青素[23,32]。葡萄酒中丙酮酸和乙醛的含量决定了vitisin A型与vitisin B型含量。在酵母菌相应酶的催化作用下,vitisin A型花青素还可以进一步与乙烯基黄烷-3-醇、羟基肉桂酸、乙烯基苯酚反应形成portisin型花青素(图2)。季也蒙毕赤酵母()具有最高的羟基肉桂酸脱羧酶活性,可以产生pinotins型花青素。
非酿酒酵母属酵母还可通过降低pH、细胞壁的低吸附性、促进花青素和黄烷醇低聚物的形成、促进或调解单宁与花色素之间的聚合等方式提升葡萄酒颜色(图2)。可代谢丙酮酸形成大量乳酸[14-15,33],降低葡萄酒pH,从而提升葡萄酒的颜色强度和稳定性。酵母菌细胞壁上球状的甘露糖蛋白更易与酚类物质发生相互作用,因此对花青素具有一定的吸附作用[34]。与酿酒酵母和分别混合发酵酿造的葡萄酒中花青素的含量高于这两个菌单独发酵所酿葡萄酒中的花青素含量,说明对花青素的吸附性较弱[27]。、、可促进花青素和黄烷醇形成低聚物,从而提升葡萄酒颜色[28,31]。高产的多糖(混合发酵产生多糖的含量是酿酒酵母发酵产生多糖的2倍多)可能通过疏水作用和氢键与单宁结合,促进单宁与花色素聚合物的稳定性,而高产的乙醛也可以调节单宁与花色素之间的聚合反应[30]。
非酿酒酵母属酵母对葡萄酒颜色提升的研究目前集中于8个菌种(图1),它们提升葡萄酒颜色的机理各不相同,且需要从发酵、陈酿等工艺环节评价颜色的稳定性,增加了研究复杂性。这8种可提升葡萄酒颜色的非酿酒酵母属酵母在应用时需注意评价不同接种方式(同时接种、顺序接种、接种比例)对颜色提升的影响,获取所需最佳接种方案。若需要筛选提升葡萄酒颜色的非酿酒酵母属酵母可关注发酵过程是否高产丙酮酸或乙醛、是否具有高羟基肉桂酸脱羧酶活性或低吸附性、是否降低pH、是否促进花青素和黄烷醇低聚物的形成等。而发酵产物如多糖、乙醛等对陈酿过程中单宁与花色素聚合物的促进机理还需进一步研究解析。

以矢车菊素为例展现花青素及吡喃型花青素类化合物的结构式。①释放胞外丙酮酸,形成vitisin A型:日本裂殖酵母、粟酒裂殖酵母;②高产乳酸,降低葡萄酒pH值,提升颜色强度和稳定性:耐热克鲁维酵母;③释放胞外乙醛,形成vitisin B型:酿酒酵母等;④细胞壁对花青素的低吸附性:耐热克鲁维酵母;促进花青素和黄烷醇形成低聚物:美极梅齐酵母、星形假丝酵母、戴尔有孢圆酵母;⑤vitisin A型进一步与乙烯基黄烷-3-醇/羟基肉桂酸/乙烯基苯酚形成portisin型:日本裂殖酵母、粟酒裂殖酵母
2 可增加葡萄酒香气复杂性的非酿酒酵母属酵母
许多非酿酒酵母属酵母引起研究者的关注是因为它们对葡萄酒香气复杂性的贡献[19],尤其是品尝时可感知的果香等香气,如贡献于草莓和猕猴桃香气(甲基丙酸乙酯)及黑莓香气(甲基丙酸乙酯)的[35],贡献于烘烤焦糖和干果果仁香气的[36],贡献于琼瑶浆典型性香气的[37],贡献于甜香和花香的克拉通覆膜孢酵母()和[38]等。目前关于非酿酒酵母属酵母对葡萄酒香气特征的影响研究是葡萄酒发酵中非酿酒酵母属酵母的主要研究内容之一。与葡萄酒果味直接相关的化合物主要包括酯类、挥发性硫醇、内酯、呋喃酮、高级醇等,有些化合物如乙酸和乙酸乙酯可通过进一步的化学反应形成与果味直接相关的化合物[35],有些化合物的浓度高低会对果味的感知产生不同的影响,如低乙醇含量促进果味感知[10]。因此,本研究主要分析了可以增加葡萄酒香气复杂性的非酿酒酵母属酵母及主要代谢机理(图3),包括低产乙醇、高产乙酸乙酯、高产乙酸酯类化合物、高产乙酯类化合物、高/低产高级醇类化合物、高产与萜烯或硫醇释放相关的酶类、高/低产乙醛、降低挥发性酚类。
2.1 产乙醇能力
由于全球变暖对产区风土条件的影响导致成熟葡萄的含糖量增加,因此所酿造葡萄酒的酒度提升,高酒度会掩盖果味[6],而低乙醇含量促进果味的感知[10]。因此,优选非酿酒酵母属酵母、、和被用来与酿酒酵母开展混合发酵,实现低残糖和低乙醇的酿造目标。
2.2 产乙酸乙酯能力
乙酸乙酯的含量超过12 mg·L-1会产生不愉快气味[9],超过200 mg·L-1会产生败坏风味[44],而很多可以增加香气复杂性的非酿酒酵母属酵母同时也高产乙酸乙酯,如图3所示。有8种酵母为高产乙酸乙酯酵母,而的乙酸乙酯产量具有菌株差异。近年来,部分研究指出乙酸乙酯可能会通过转酯作用形成酯类[55];与酿酒酵母混合发酵结束后,乙酸乙酯含量为600—700 mg·L-1经过,24个月陈酿后降为140—170 mg·L-1,乙酸乙酯在葡萄酒陈酿期间的降低可能与水解或酯化反应有关[30]。因此,酒精发酵结束后的高乙酸乙酯似乎充当了葡萄酒陈酿过程中挥发性酯类化合物演化的储存库,而高产乙酸乙酯酵母可考虑筛选用于陈酿型葡萄酒酿造中。
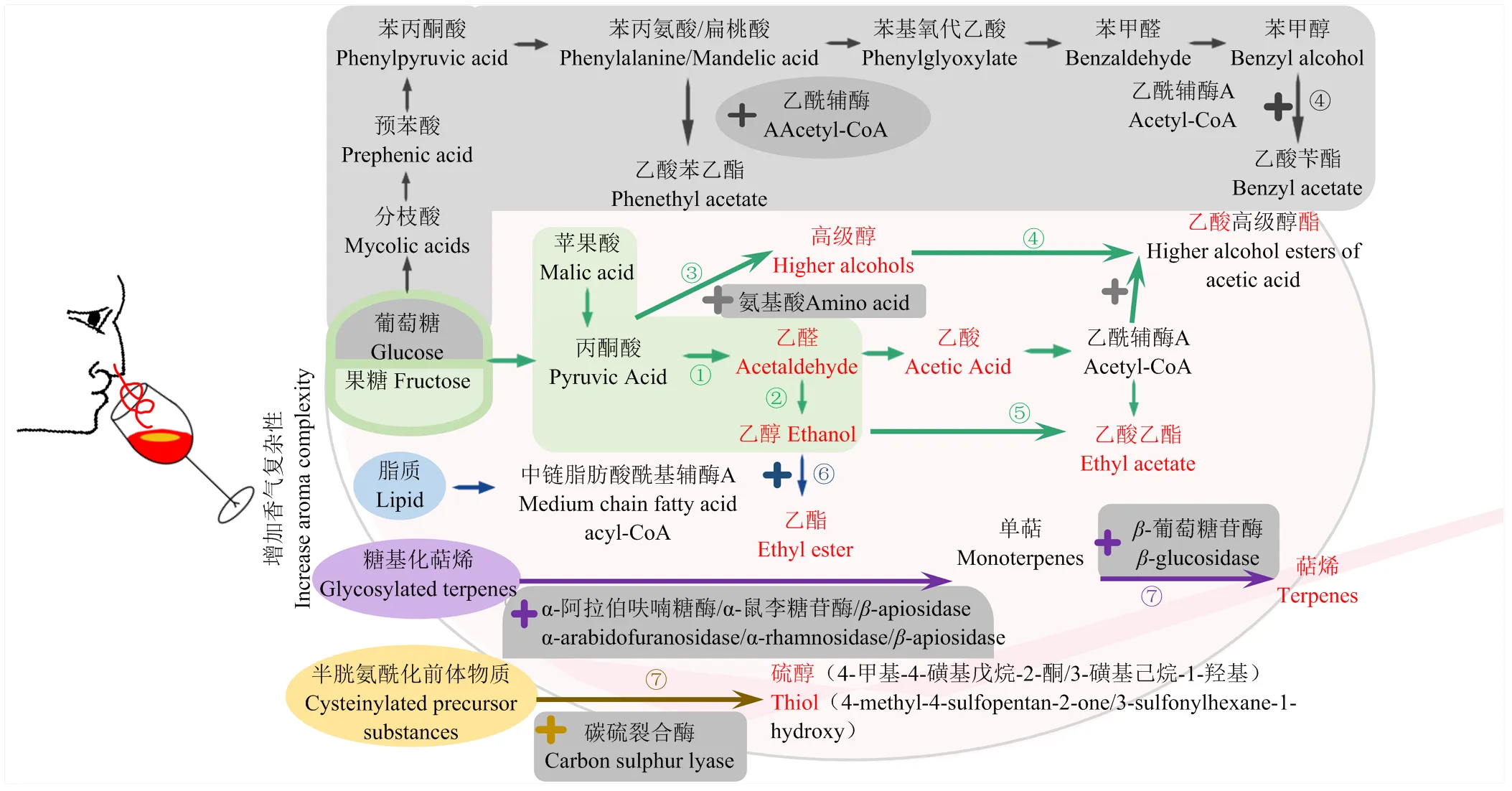
①高产乙醛:日本裂殖酵母、粟酒裂殖酵母、星形假丝酵母;低产乙醛、乙酸或3-羟基丁烷-2-酮:耐热克鲁维酵母、L. fermentati、美极梅奇酵母、特立科拉毕赤酵母、库德毕赤酵母、星形假丝酵母、戴尔有孢圆酵母;②降低乙醇:耐热克鲁维酵母、美极梅奇酵母、星形假丝酵母、戴尔有孢圆酵母;③高产高级醇类化合物(Ehrlich途径、糖代谢合成途径):葡萄酒有孢汉逊酵母、季也蒙毕赤酵母、美极梅奇酵母、发酵毕赤酵母、胶红酵母、日本裂殖酵母;低产高级醇类化合物:有孢汉逊酵母属、星形假丝酵母、粟酒裂殖酵母、接合酵母属;④高产乙酸酯类化合物:加利福尼亚假丝酵母、土星形塞伯林德纳氏酵母、季也蒙有孢汉逊酵母、耐渗透压有孢汉逊酵母、葡萄汁有孢汉逊酵母、有孢汉逊酵母属、好氧哈萨克斯坦酵母、瑟氏哈萨克斯坦酵母、美极梅奇酵母、克鲁维毕赤酵母、特立科拉毕赤酵母、库德毕赤酵母;葡萄酒有孢汉逊酵母通过分枝酸-预苯酸途径高产乙酸酯类化合物;⑤高产乙酸乙酯:季也蒙有孢汉逊酵母、葡萄酒有孢汉逊酵母、葡萄汁有孢汉逊酵母、特立科拉毕赤酵母、库德毕赤酵母、克鲁维毕赤酵母、日本裂殖酵母、拜耳接合酵母;⑥高产乙酯类化合物:有孢汉逊酵母属、葡萄汁有孢汉逊酵母、克鲁维毕赤酵母、库德毕赤酵母、特立科拉毕赤酵母、克拉通覆膜孢酵母、星形假丝酵母、戴尔有孢圆酵母、拜耳接合酵母;⑦高产酶类,释放萜烯类化合物或品种硫醇等:加利福尼亚假丝酵母、铁红假丝酵母、有孢汉逊酵母属、葡萄汁有孢汉逊酵母、耐热克鲁维酵母、美极梅奇酵母、克鲁维毕赤酵母、库德毕赤酵母、胶红酵母、星形假丝酵母、克拉通覆膜孢酵母、戴尔有孢圆酵母
2.3 产乙酸酯能力
除乙酸乙酯之外的其他乙酸酯大多由Ehrlich途径或糖代谢合成途径形成的高级醇与乙酸酯化形成,研究发现高产乙酸酯类的非酿酒酵母属酵母通常只高产其中某些乙酸酯,这可能与酵母菌的特殊代谢途径有关,如通过分枝酸-预苯酸途径生成乙酸苯乙酯和乙酸苄酯(图3)。非酿酒酵母属酵母对氮源的消耗与产生的香气种类相关,在模拟汁中分别加入24种不同氮源作为单一氮源,总酵母可同化氮含量控制在200 mg·L-1时发现、和的单菌种发酵虽然体现了氨基酸利用和所产香气的差异,但是不论氮源是什么,这3个菌种都可以产生所有的发酵类香气(高级醇和酸、中链脂肪酸和它们的乙酸或乙酯类衍生物),说明了中心碳代谢(如糖代谢合成途径)对香气的重要作用[46]。高产乙酸酯的非酿酒酵母属酵母除了包含大家熟知的、和外,最近有研究表明和可增加乙酸酯含量,尤其是乙酸苯乙酯和乙酸异戊酯含量,赋予了西拉红葡萄酒更高的果酱和红色水果香气[17]。
2.4 产酯能力
酯类通常给葡萄酒带来果香和花香,非酿酒酵母属酵母不但可以通过高级醇和乙酸之间的酯化作用形成乙酸高级醇酯,还可以通过脂质代谢形成的中链脂肪酸与乙醇酯化形成乙酯类化合物,目前高产乙酯类的非酿酒酵母属酵母有9种,其中、、和为高产乙酸酯和乙酯类化合物的菌种(图3)。拜尔结合酵母()因高产酯酶,在与酿酒酵母混合发酵中能产生大量乙酯如乙酸乙酯、己酸乙酯、辛酸乙酯和癸酸乙酯等[54]。中国本土非酿酒酵母属酵母和共同与酿酒酵母进行顺序接种发酵,增加了葡萄酒中大部分乙酯的浓度,贡献了菠萝香气[56]。
2.5 产高级醇能力
葡萄酒中高级醇含量高于300 mg·L-1时会产生不愉快的味道[30],超过400 mg·L-1会产生香气负面效应[44]。低含量的高级醇通常赋予葡萄酒果香,研究表明高产高级醇的菌种包含6种,低产高级醇的菌种包含4种(图3),由于高级醇可以进一步酯化形成乙酸酯,因此,不建议简单通过酒精发酵结束后高级醇的含量来筛选非酿酒酵母属酵母。此外,有些酵母菌的高级醇产量呈现明显的菌株差异,如在不同的研究报道中有些菌株高产高级醇,有些低产[9]。
2.6 产酶能力
目前发现12种非酿酒酵母属酵母因高产酶类增加品种香气或典型性,部分酵母是高产相关糖苷酶释放萜烯类化合物如和[45],而有些酵母是高产碳硫裂合酶形成挥发性硫醇[57],产生热带水果的品种香气,如[9]。因此,非酿酒酵母属酵母筛选中通常会检测-葡萄糖苷酶等相关酶的活性[58],和高产-D-木糖苷酶活性,和高产-L-鼠李糖苷酶和-L-阿拉伯糖苷酶[59-60]。研究人员从中国河北葡萄酒产区筛选了高产-葡萄糖苷酶的胶红酵母(),在与酿酒酵母顺序接种发酵中,该酵母显著增加了萜烯类和-大马酮含量,带给葡萄酒强烈的花香和果香味[48],且随着接种比例增加而增加[49-50]。
2.7 产乙醛能力
葡萄酒中乙醛的感知阈值是100 mg·L-1,高含量乙醛会给葡萄酒带来氧化味[30]。因具有苹果酸酒精发酵途径而高产乙醛、乙醇和乙酸乙酯(图3),研究发现与酿酒酵母酒精发酵刚结束时乙醛含量为18—36 mg·L-1,其中混合发酵高于酿酒酵母纯种发酵,顺序接种混合高于同时接种混合,而经过24个月陈酿后,几种发酵之间差异不大,降至7—8 mg·L-1,说明乙醛在陈酿过程中发生了进一步转化[30]。
2.8 降低挥发性酚
挥发性酚浓度低时呈现烟熏味,浓度高时呈现汗味[10],因此,可降低挥发性酚类的非酿酒酵母属酵母如spp获取研究者的关注[43]。
研究人员早期对非酿酒酵母属酵母的研究多开展以模拟汁或葡萄汁为原料的非酿酒酵母属酵母纯种发酵试验,如在模拟汁纯种发酵中可产生8—19 mg·L-1乙偶姻,在葡萄汁发酵中可产生17.1—34.4 mg·L-1乙偶姻,而不产乙偶姻[61]。研究发现大多非酿酒酵母属酵母的产乙醇能力弱于酿酒酵母,但可产大量发酵副产物,对葡萄酒的香气产生积极的影响。因此,近年来对非酿酒酵母属酵母的研究大多直接对比混合发酵与酿酒酵母纯种发酵之间的差异,混合发酵常用两种接种方式,同时混合接种方式(将非酿酒酵母属酵母和酿酒酵母以一定的比例接种,一般为1﹕1或非酿酒酵母属比例更高)和顺序接种方式(先接种非酿酒酵母属酵母,接种后24、48或72 h后再接种酿酒酵母),由于顺序接种方式给予非酿酒酵母属酵母较充分的代谢时间,因此获取的香气复杂性和感官评价往往高于同时混合接种方式,而混合发酵方式在香气改善方面往往优于酿酒酵母纯种发酵[58,62-63]。部分研究还尝试应用2种以上非酿酒酵母属酵母与酿酒酵母开展混合发酵[39]。因此,图3中高产或低产的结论大多获取自非酿酒酵母属酵母在与酿酒酵母混合发酵时相对于酿酒酵母纯种发酵时的表现,研究结论受所用葡萄品种(是否富含糖基化萜烯或半胱氨酰化前体物质)、非酿酒酵母属酵母菌株(纯种发酵是否提升香气复杂性)、对照酿酒酵母菌株(是否嗜杀、是否提升香气复杂性)等因素的影响,不同研究所获取的非酿酒酵母属酵母增加香气复杂性的结论之间往往无法直接对比评价。建议设定数值化参数标准或开展同一模拟汁条件下发酵试验,以便于横向比较非酿酒酵母属酵母的香气改善能力,提升高产或低产结论判断的准确性。
3 可改善葡萄酒口感平衡的非酿酒酵母属酵母
葡萄酒的主要成分是来自于葡萄浆果的水分(70% —90%),其次是乙醇(7%—17%),这两种物质是葡萄酒口感平衡物质的主要载体[22]。而甘油、多糖和乳酸是酵母菌酒精发酵代谢产生的可影响葡萄酒口感平衡的主要物质(图4)。
3.1 产甘油和多糖能力
甘油是最主要的酒精发酵副产物,酿酒酵母可发酵形成一定量的甘油,非酿酒酵母属酵母可能比酿酒酵母多产零点几到4 g·L-1的甘油,从生物化学的角度来看,非酿酒酵母属酵母拥有较弱的乙醇脱氢酶活性,但是有更强的3-磷酸甘油脱氢酶活性[9]。目前已报道有6种非酿酒酵母属酵母高产甘油如,在与酿酒酵母的混合发酵过程中提升甘油产量,增加葡萄酒的柔和度和酒体。、和既可以提升甘油,又可以在发酵过程中释放多糖,增加的甘油和多糖会提高口感的甜度,降低收敛性[30]。研究表明,葡萄酒中的多糖来源于葡萄(阿拉伯糖蛋白)或酵母菌的细胞壁成分(甘露糖蛋白),酵母菌细胞壁最外面存在甘露糖蛋白,由85%—90%的甘露糖和10%—15%的蛋白组成。酵母在出芽生长的过程中通过控制性水解母细胞的细胞壁可释放甘露糖蛋白,因此,非酿酒酵母属酵母的酿造应用特征之一是释放更多的多糖[9,64]。在发酵过程中释放的多糖成分主要为半乳糖-甘露糖蛋白,与其他酵母释放的甘露糖蛋白一样,可以与多酚类物质如单宁聚合,降低收敛性[65],其在混合发酵产生的多糖是酿酒酵母单菌种发酵的2倍多[30]。酵母多糖除了可改善口感平衡,还可提升葡萄酒蛋白和酒石酸盐的稳定性,保留葡萄酒香气物质[30,65]。
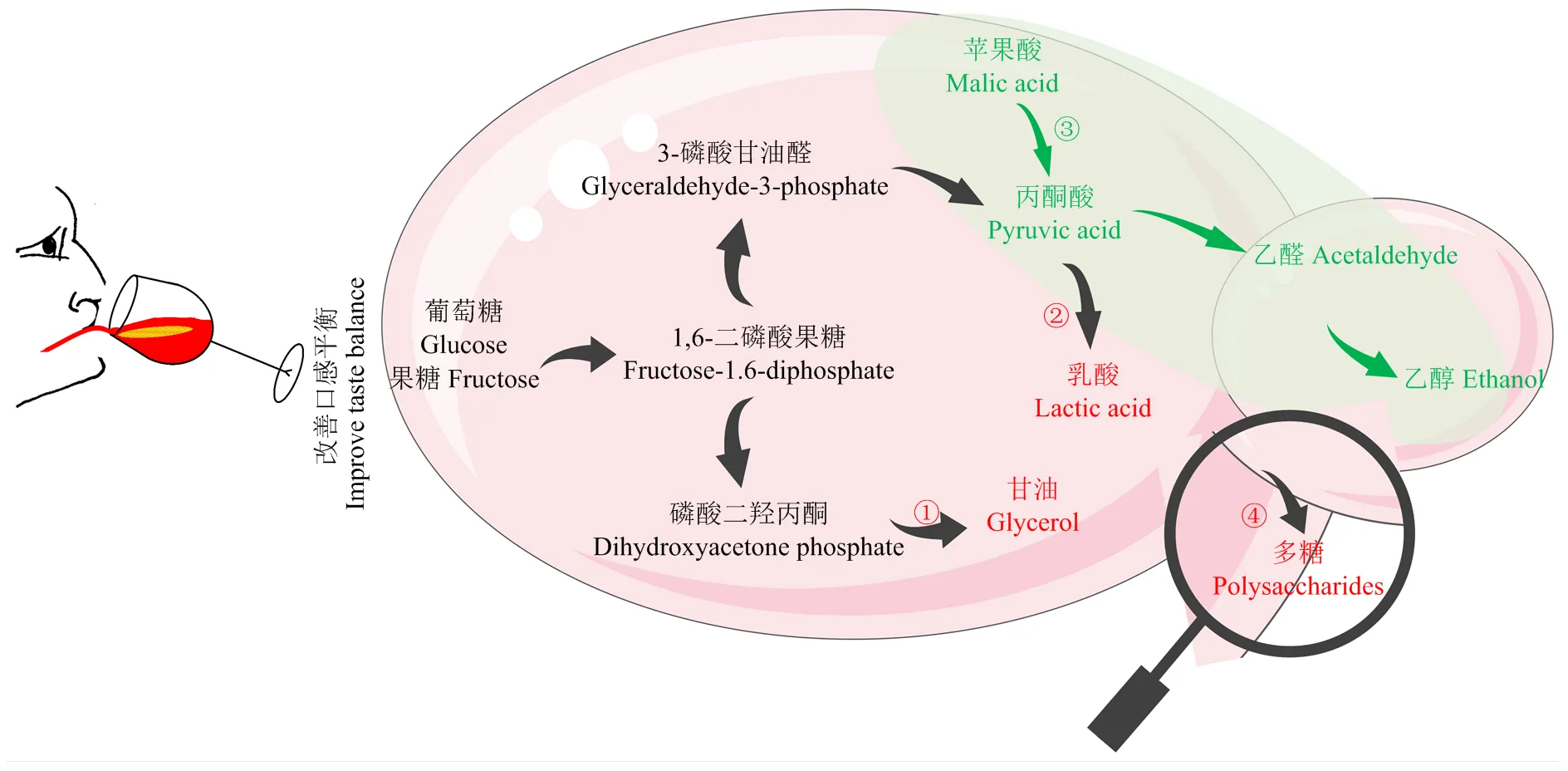
①高产甘油:耐热克鲁维酵母、美极梅齐酵母、克鲁维毕赤酵母、库德毕赤酵母、星形假丝酵母、日本裂殖酵母、戴尔有孢圆酵母;②产生乳酸:耐热克鲁维酵母;③降低苹果酸(苹果酸酒精发酵):美极梅齐酵母、库德毕赤酵母、日本裂殖酵母、粟酒裂殖酵母、戴尔有孢圆酵母;④产生多糖如甘露糖蛋白等:耐热克鲁维酵母、粟酒裂殖酵母、日本裂殖酵母、戴尔有孢圆酵母、拜耳接合酵母
3.2 降低苹果酸和产乳酸能力
拥有较强的乳酸脱氢酶活性,可代谢丙酮酸生成乳酸(图4),乳酸的酸感类似于柠檬水果,可增加葡萄酒口感的清新感。研究表明,某些菌株可产高达16 g·L-1乳酸,明显降低葡萄酒的pH(可降0.5左右),因此,可用于气候炎热的葡萄酒产区如中国新疆产区增加葡萄酒的酸度[6,14-15,28]。与之相反,气候冷凉区的葡萄酒往往因含有较高的苹果酸而需要降低酸度,维持葡萄酒的生物稳定性[9]。裂殖酵母和拥有苹果酸酒精代谢途径(图4),可将苹果酸完全代谢形成乙醇和二氧化碳。一方面,具有特定的苹果酸通透酶转运体(mae1p)从而促进苹果酸盐进入细胞质;另一方面,的苹果酸脱氢酶亲和力是酿酒酵母的15倍,可在细胞质中代谢苹果酸[28]。对苹果酸的降解率普遍在75%—100%,可明显提升葡萄酒的pH,若接种高浓度的则能完全降解苹果酸至含量为0.096 mg·L-1[29]。、和也具有在混合发酵过程中降低苹果酸的能力,如对苹果酸的降解率可达91.6%,但降酸机理尚不明确[9,45,66-67,69]。
值得注意的是,接种方式对改善葡萄酒口感平衡的影响,非酿酒酵母属酵母纯种发酵和与酿酒酵母混合发酵的对比研究将促进对非酿酒酵母属酵母改善葡萄酒口感平衡方面的认识。此外,对于高产甘油、产生多糖等尚缺乏标准化的数值范围界定,一般对比于酿酒酵母纯种发酵。因此,建议开展同一模拟汁条件下的发酵试验,便于不同研究者比较非酿酒酵母属酵母的口感平衡改善能力,提升高产或低产结论判断的准确性。
4 可提升葡萄酒安全与健康的非酿酒酵母属酵母
在葡萄酒酿造中应用非酿酒酵母属酵母面临的主要质疑是是否会产生影响葡萄酒质量或安全的物质。近年来,相关研究表明某些非酿酒酵母属酵母具备生物防治作用,酿造过程中可降低有毒化合物的产量,产生生物活性物质,因此可提升葡萄酒安全质量与健康属性。
4.1 生物防治作用
布鲁塞尔酒香酵母()因大量产生挥发性酚类物质——4-乙基酚和4-乙基愈创木酚,使葡萄酒产生不好的动物类气味而被认为是葡萄酒败坏性酵母[70-71]。研究表明,酿酒酵母、、、和可分泌毒素抑制的生存[18,72-73],可通过分泌-1,3-葡聚糖酶、明胶酶和蛋白酶降解真菌细胞壁从而抑制的生长[74],因此,非酿酒酵母属酵母可以通过生物防治作用提升葡萄酒的安全性。、和对灰霉菌有拮抗作用,还可拮抗链格孢属真菌,还可拮抗曲霉和青霉,对曲霉具有拮抗作用[18],因此,非酿酒酵母属酵母可用作抗真菌剂喷洒在葡萄上提高最终酒的质量[75]。非酿酒酵母属酵母作为生物防治剂,一方面可以降低二氧化硫的用量,因为二氧化硫虽然可抑菌和抗氧化,但对人体具有毒性或引起过敏反应,因此国际组织一直在呼吁降低二氧化硫在葡萄酒中的用量,现代的消费者群体也更倾向于选择使用较少防腐剂的食物[18,72]。另一方面,酿酒商在实践中发现,红葡萄酒发酵过程中使用非酿酒酵母属酵母替代二氧化硫作为生物保护剂可增加果味,经检测主要增加了乙酯类化合物的含量,这些酯类贡献于红色浆果和新鲜水果香气[35]。目前,已经应用于葡萄酒酿造生物防治的商业非酿酒酵母属酵母包括、、、和(表1)。
4.2 降低有毒化合物
葡萄酒酿造中应用非酿酒酵母属酵母可减少可能出现的有毒化合物如赭曲霉毒素A、氨基甲酸乙酯(发酵型食品中的一种致癌物质)和生物胺[76]。①葡萄采收前败坏性真菌侵染会产生赭曲霉毒素A,一方面,等前述生物防治剂可喷洒在葡萄表面抑制赭曲霉毒素真菌的生长,从而减少该毒素的产生[9];另一方面,通过细胞壁吸收作用能在发酵过程中去除70%的赭曲霉毒素A[77]。②氨基甲酸乙酯主要由乳酸菌产生,是尿素与乙醇在葡萄酒陈酿期间通过化学反应生成,葡萄酒工业中最常用的方法是使用商业脲酶去除尿素,从而避免氨基甲酸乙酯的生成。具有脲酶活性,因此应用于避免氨基甲酸乙酯的生成[9]。③葡萄酒中生物胺的含量为痕量至150 mg·L-1,部分来自于葡萄,部分是在酒精发酵、苹乳发酵和陈酿过程中产生。有些非酿酒酵母属酵母高产氨基酸,如在酒精发酵过程中会产生高浓度的赖氨酸、鸟氨酸和酪氨酸[9]。从原理上讲,酵母菌可将精氨酸转化为胍丁胺,鸟氨酸转化为腐胺,甲硫氨酸转化为亚精胺和精胺;赖氨酸为尸胺,组氨酸为组胺,色氨酸为色胺,酪氨酸为酪胺[77]。具有脱羧酶活性的苹果酸乳酸菌能将某些氨基酸转化为生物胺[9]。白葡萄酒中主要的生物胺是腐胺、尸胺和乙醇胺,红葡萄酒中主要的生物胺是组胺、酪胺和腐胺,通常红葡萄酒中生物胺的含量高于其他葡萄酒,而健康葡萄酒中生物胺的含量应小于50 mg·L-1[77]。人体中的单胺氧化酶可作用于生物胺起脱毒作用,但乙醇抑制该酶活性,因此,大量饮用葡萄酒时需关注生物胺的影响。目前避免葡萄酒中生物胺生成的主要方法是使用优选的不具有脱羧酶活性的苹果酸乳酸菌。有些非酿酒酵母属酵母可通过避免苹果酸乳酸发酵的发生来控制生物胺的生成,如具有较强苹果酸代谢能力的[9]。和结合使用,可以避免苹乳发酵,产生更少生物胺和氨基甲酸乙酯的前体物质[77]。此外,H525具有胺氧化酶活性,可以降解生物胺[77]。
4.3 合成生物活性物质
葡萄酒因富含具有极强抗氧化性的多酚类物质而被认为有益于健康[22],最新的研究表明,酵母菌可以在酒精发酵过程中合成生物活性物质如褪黑素、血清素和羟酪醇,使用色氨酸N15标记和酪氨酸C13标记发现,酵母菌在酒精发酵过程中可以以色氨酸为前体物质合成褪黑素,以酪氨酸或Erlich途径的中间产物形成羟酪醇[78]。非酿酒酵母属酵母、、、和都可以在酒精发酵中产生胞内和胞外褪黑素,其中胞内褪黑素主要在酒精发酵前6 h内产生,因此,褪黑素可能有助于酵母菌适应新的发酵环境。非酿酒酵母属酵母与酿酒酵母混合发酵没有改变褪黑素的形成规律,和相对高产褪黑素[79]。
5 非酿酒酵母属酵母的基因组和种内基因型分析方法研究现状
新一代测序技术的发展促进了不同葡萄酒产区本土非酿酒酵母属酵母的资源调查[80]和非酿酒酵母属酵母的基因组及种内基因型分析方法的发展[81]。本研究列举的可积极贡献于葡萄酒发酵的非酿酒酵母属酵母中只有1个菌种尚无基因组序列,9个菌种、、、、、、、和基因组测序菌株数量超过10个(表2),基于基因组信息开发的种内基因型分析方法主要为微卫星基因分型,其多态性和稳定性可以用于大量菌株和不同实验室菌株之间的种群遗传分析,为葡萄酒发酵过程中特定基因型非酿酒酵母属酵母的追踪监控提供可靠的分子依据。然而,目前微卫星位点分析只集中于5个非酿酒酵母属酵母菌种、和(表2),今后应加大对各产区广泛存在的本土非酿酒酵母属酵母和具有葡萄酒发酵应用价值的非酿酒酵母属酵母的微卫星位点分析。此外,关于大部分非酿酒酵母属酵母有性生殖的数据比较少(表2),至今仍然不能成功进行非酿酒酵母属酵母的经典遗传操作[81-82],因此,对于非酿酒酵母属酵母相应基因功能的认识往往通过与酿酒酵母功能基因的比对和代谢物质分析来完成。有研究者指出可通过原生质体融合实现种内或种间杂交,最终确定与葡萄酒发酵应用特点相关的基因,为葡萄酒质量的准确控制提供理论基础。
6 结论与展望
非酿酒酵母属酵母曾经一度被认为是导致葡萄酒败坏的罪魁祸首,但实际上无论是否接种酿酒酵母,酒精发酵前期的葡萄醪中都存在大量非酿酒酵母属酵母如等。因此,近年来葡萄酒发酵研究热点转向控制性地应用非酿酒酵母属酵母,主要采用与酿酒酵母同时接种混合发酵和顺序接种混合发酵两种方式,将非酿酒酵母属酵母在颜色、香气、口感和安全健康等方面的优势与酿酒酵母强发酵和强耐受的特点结合起来,酿造具有产区特色的高质量葡萄酒。
为更好地应用非酿酒酵母属酵母,未来研究者们仍需关注以下6个方面:
第一,关注中国本土野生酵母菌的发掘与应用,促进本土非酿酒酵母属酵母商业化。近年来,中国葡萄酒在国际赛事上频频获奖,分离自新疆、宁夏产区的酿酒酵母CECA、CEC01和分离自东北产区的CVE-7,已经成功商业化并走出国门服务于世界葡萄酒产业(表1)。而中国不同葡萄酒产区的非酿酒酵母属酵母多样性分析研究,展现了各个产区不同风土条件下丰富的非酿酒酵母属酵母资源[37,58,80,88],分离自新疆的优选和分离自辽宁的优选及已被安琪公司加工成活性干酵母用于研究[56]。进一步开发具有中国产区特色的优选非酿酒酵母属酵母,对保护中国本土酵母资源,酿造具有中国不同产区特色的葡萄酒具有重要意义。

表2 非酿酒酵母属酵母的基因组相关信息
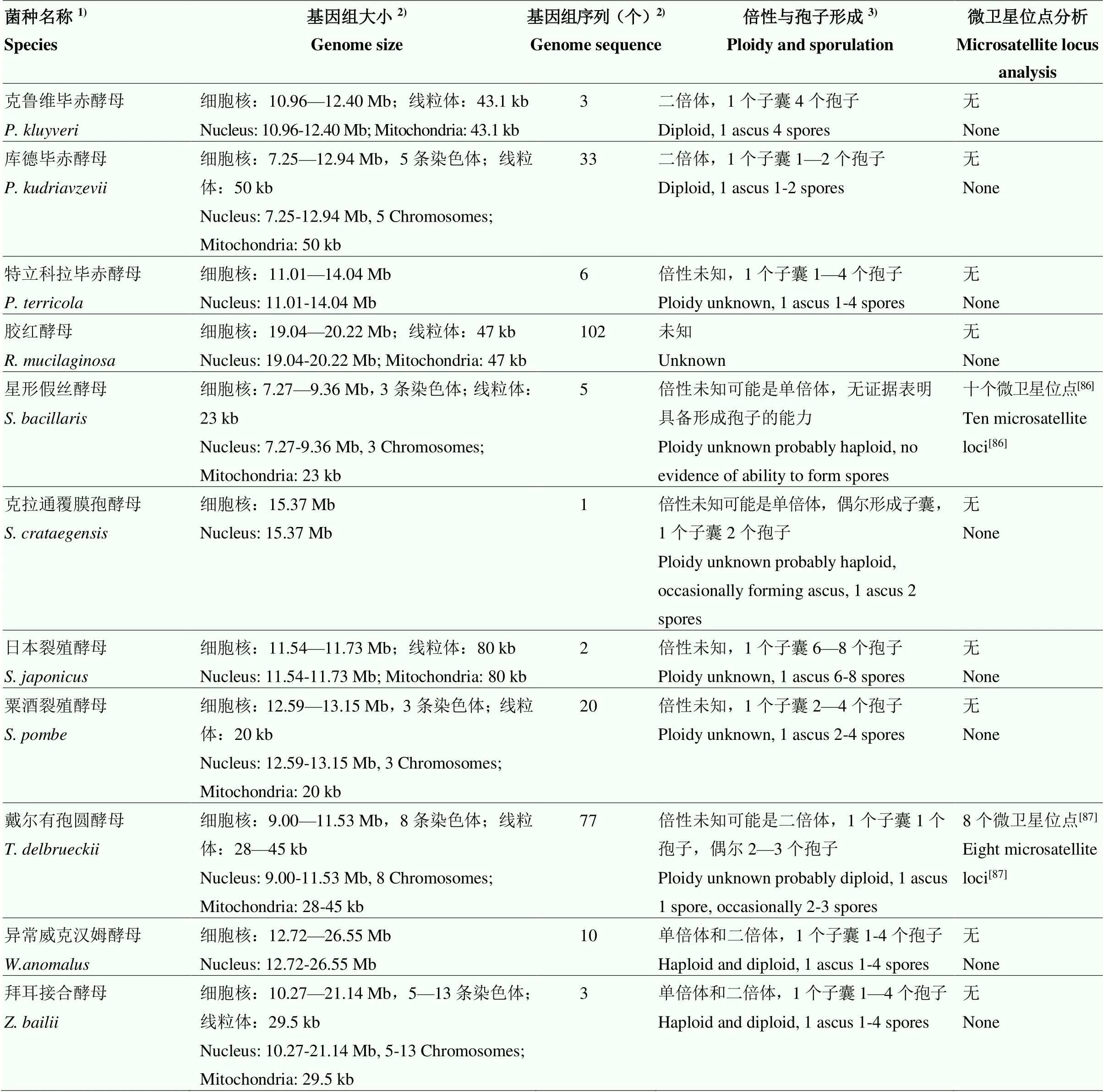
续表2 Continued table 2
1)只包含本研究列举的具有葡萄酒发酵应用特点的非酿酒酵母属酵母;2)基因组大小和序列信息获取自NCBI网址(http://www.ncbi.nlm.nih.gov/ genome/)2022年6月22日检索结果和参考文献[81];3)倍性和孢子形成信息参考文献[2,81]
1)This only included the non-yeast which had the trait of wine fermentation applications;2)Genome size and sequence information obtained from NCBI web site (http://www.ncbi.nlm.nih.gov/genome/) search results and references on 22 June, 2022[81];3)References for information on ploidy and spore formation[2,81]
第二,关注非酿酒酵母属酵母基因组和种内基因型分析。如前所述,野生酵母菌可能在葡萄酒发酵过程中存在并发挥作用,因此,分析主导酵母菌的基因型将有利于控制和认识葡萄酒质量的改变,尤其是对应用多种非酿酒酵母属酵母的葡萄酒发酵来说,基因型分析可确认发酵过程的主导菌。
第三,关注非酿酒酵母属酵母的纯种发酵和混合发酵代谢研究,增加对非酿酒酵母属酵母贡献的认识。非酿酒酵母属酵母早期的研究以纯种发酵为主,但其大多无法主导酒精发酵全过程,近年来,大多数研究直接以与酿酒酵母混合发酵某个葡萄品种的方式并对比酿酒酵母纯种发酵来认识非酿酒酵母属酵母的贡献,为在葡萄酒工业中直接应用非酿酒酵母属酵母提供了研究基础。但此方法从理论上无法辨别葡萄酒质量的提升是否真正来自于非酿酒酵母属酵母本身的代谢优势。一方面,研究表明混合发酵过程中酿酒酵母与非酿酒酵母属酵母之间的相互作用改变了二者在纯种发酵下的代谢模式,如非酿酒酵母属酵母激发酿酒酵母糖代谢相关基因的表达[89],具有嗜杀性的酿酒酵母在混合发酵中产生了更高浓度的果味酯类物质[90],非酿酒酵母属酵母和酿酒酵母之间对营养的竞争极大促进了香气化合物的产生[91],具有相互抑制作用的(低产甘油)和酿酒酵母(高产甘油)在混合发酵中增加了甘油产量[92]。代谢组学分析表明,共同接种导致了新化合物的生成,酵母之间的相互作用影响了戊糖磷酸和氨基酸合成途径[93],因此,以酿酒酵母与非酿酒酵母属酵母纯种发酵和不同比例的接种发酵作为对比,将有利于正确认识非酿酒酵母属酵母的酿造应用特点。另一方面,葡萄营养成分(碳源、氮源等)与发酵工艺(接种顺序、通氧等)的不同可能会影响酵母之间的相互作用,进而影响葡萄酒的风味[94]。如铵能促进和对氨基酸的吸收,而不影响酿酒酵母对氨基酸的吸收[12],因此,顺序接种混合发酵中非酿酒酵母属酵母对氮源的利用是否会导致酿酒酵母的代谢调节值得思考。非酿酒酵母属酵母的嗜果糖特性[95],非酿酒酵母属酵母的脂类代谢与酒精发酵耐受性的关联[96],发酵初期通风对酵母菌乳酸代谢的促进[41],顺序接种发酵对葡萄酒品质的提升优于同时接种发酵[47]等,说明原料和工艺都会影响非酿酒酵母属酵母在混合发酵中的表现,因此,筛选和应用非酿酒酵母属酵母时需综合考量这些因素的影响。
第四,关注最终成品葡萄酒质量与非酿酒酵母属酵母代谢特点之间的关联。过去一直认为酒精发酵过程中高产乙醛和乙酸乙酯的酵母会给葡萄酒带来不良风味,但最近有研究发现24个月的陈酿会降低葡萄酒中乙醛和乙酸乙酯的含量[30],因此,鼓励研究者从最终产品考量具有极端突出代谢特点的非酿酒酵母属酵母菌株。此外,葡萄酒的颜色、香气和口感随着后续工艺和时间不断发生变化,因此,非酿酒酵母属酵母的代谢对最终成品的贡献值得探究。
第五,关注非酿酒酵母属酵母对葡萄与葡萄酒安全与健康的影响。非酿酒酵母属酵母是否可能取代二氧化硫,是否可以有效去除葡萄酒中的毒性成分,是否可能促进有益成分如褪黑素等的分泌需要更多的研究证实。
第六,关注非酿酒酵母属酵母商业菌剂的加工类型(活性干酵母、黏稠奶油状的液体酵母、活性冷冻酵母、胶囊封装酵母等)对非酿酒酵母属酵母活性的影响[16]。目前,酿酒酵母主要加工成活性干酵母应用于葡萄酒工业,非酿酒酵母属酵母对极端环境的耐受性弱于酿酒酵母,因此,需要关注加工过程对非酿酒酵母属酵母活性的影响。
[1] JOLLY N P, VARELA C, PRETORIUS I S. Not your ordinary yeast: Non-yeasts in wine production uncovered. FEMS Yeast Research, 2014, 14(2): 215-237. doi: 10.1111/1567-1364.12111.
[2] KURTZMAN C P, FELL J W, BOEKHOUT T. The Yeasts: A Taxonomic Study. 5th ed. Amsterdam: Elsevier, 2011.
[3] DRUMONDE-NEVES J, FERNANDES T, LIMA T, PAIS C, FRANCO-DUARTE R. Learning from 80 years of studies: A comprehensive catalogue of non-yeasts associated with viticulture and winemaking. FEMS Yeast Research, 2021, 21(3): foab017. doi: 10.1093/femsyr/foab017.
[4] PADILLA B, GIL J V, MANZANARES P. Past and future of non-yeasts: From spoilage microorganisms to biotechnological tools for improving wine aroma complexity. Frontiers in Microbiology, 2016, 7: 411.
[5] MAS A, PADILLA B, ESTEVE-ZARZOSO B, BELTRAN G, REGUANT C, BORDONS A. Taking advantage of natural biodiversity for wine making: The wildwine project.Agriculture and Agricultural Science Procedia, 2016, 8: 4-9.
[6] BERBEGAL C, FRAGASSO M, RUSSO P, BIMBO F, GRIECO F, SPANO G, CAPOZZI V. Climate changes and food quality: The potential of microbial activities as mitigating strategies in the wine sector. Fermentation, 2019, 5: 85.
[7] LAIRÓN-PERIS M, PÉREZ-TRAVÉS L, MUÑIZ-CALVO S, GUILLAMÓN J M, HERAS J M, BARRIO E, QUEROL A. Differential contribution of the parental genomes to a×hybrid, inferred by phenomic, genomic, and transcriptomic analyses, at different industrial stress conditions. Frontiers Media, 2020, 8: 129.
[8] ALBERTIN W, ZIMMER A, MIOT-SERTIER C, BERNARD M, COULON J, MOINE V, COLONNA-CECCALDI B, BELY M, MARULLO P, MASNEUF-POMAREDE I. Combined effect of thelag phase and the non-consortium to enhance wine fruitiness and complexity. Applied Microbiology and Biotechnology, 2017, 101(20): 7603-7620.
[9] BENITO S, CALDERÓN F. The influence of non-species on wine fermentation quality parameters. Fermentation, 2019, 5: 54.
[10] BORREN E, TIAN B. The important contribution of non-yeasts to the aroma complexity of wine: A review. Foods, 2020, 10: 13.
[11] TAILLANDIER P, LAI Q P, JULIEN-ORTIZ A, BRANDAM C. Interactions betweenandin wine fermentation: Influence of inoculation and nitrogen content. World Journal of Microbiology and Biotechnology, 2014, 30(7): 1959-1967.
[12] PRIOR K J, BAUER F F, DIVOL B. The utilisation of nitrogenous compounds by commercial non-yeasts associated with wine. Food Microbiology, 2019, 79: 75-84.
[13] ROUDIL L, RUSSO P, BERBEGAL C, ALBERTIN W, SPANO G, CAPOZZI V. Non-commercial starter cultures: scientific trends, recent patents and innovation in the wine sector. Recent Patents on Food, Nutrition & Agriculture, 2020, 11(1): 27-39.
[14] 唐冲, 成池芳, 许引虎, 段长青, 燕国梁. 耐热克鲁维酵母在葡萄酒发酵中的研究进展. (2022-04-15) [2022-06-25].食品科学:1-12. DOI:10.7506/spkx1002-6630-20211223-266.
TANG C, CHENG C F, XU Y H, DUAN C Q, YAN G L. Research progresses ofin wine fermentation. (2022-04-15) [2022-06-25].Food Science:1-12. doi:10.7506/spkx1002- 6630-20211223-266. (in Chinese)
[15] 董琦楠, 李莹, 叶冬青, 刘延琳. 耐热克鲁维酵母在葡萄酒酿造中的研究进展. 微生物学通报, 2022, 49(5): 1941-1954. doi: 10.13344/j.microbiol.china.210653.
DONG Q N, LI Y, YE D Q, LIU Y L. Research progress ofin winemaking. Microbiology China, 2022, 49(5): 1941-1954. doi: 10.13344/j.microbiol.china.210653. (in Chinese)
[16] VEJARANO R, GIL-CALDERÓN A. Commercially available non-yeasts for winemaking: Current market, advantages over, biocompatibility, and safety. Fermentation, 2021, 7(3): 171.
[17] LIN M M-H, BOSS P K, WALKER M E, SUMBY K M, JIRANEK V. Influence ofspp. on the chemical and sensory profile of red wines.International Journal of Food Microbiology, 2022, 362: 109496.
[18] GIANVITO P D, ENGLEZOS V, RANTSIOU K, COCOLIN L. Bioprotection strategies in winemaking. International Journal of Food Microbiology, 2022, 364: 109532.
[19] TUFARIELLO M, FRAGASSO M, PICO CARBAJO J, PANIGHEL A, CASTELLARIN S D, FLAMINI R, GRIECO F. Influence of non-on wine chemistry: A focus on aroma-related compounds. Molecules, 2021, 26: 644.
[20] CLEMENTE-JIMENEZ J M, MINGORANCE-CAZORLA L,MARTÍNEZ-RODRÍGUEZ S, HERAS-VÁZQUEZ F J L, RODRÍGUEZ- VICO F. Molecular characterization and oenological properties of wine yeasts isolated during spontaneous fermentation of six varieties of grape must. Food Microbiology, 2004, 21(2): 149-155.
[21] WANG C X, ESTEVE-ZARZOSO B, MAS A. Monitoring of,, and(synonym) populations during alcoholic fermentation by fluorescence in situ hybridization. International Journal of Food Microbiology, 2014, 191: 1-9.
[22] 李华, 王华, 袁春龙. 葡萄酒工艺学. 北京: 科学出版社, 2007: 24-27.
LI H, WANG H, YUAN C L. Wine Technology. Beijing: Science Press, 2007: 24-27. (in Chinese)
[23] 王二雷, 刘彦君, 刘静波. 吡喃型花青素类化合物的研究进展. 食品工业科技, 2018, 39(12): 325-333. doi: 10.13386/j.issn1002-0306. 2018.12.059.
WANG E L, LIU Y J, LIU J B. Research advances in pyranoanthocyanin compounds. Science and Technology of Food Industry, 2018, 39(12): 325-333. doi: 10.13386/j.issn1002-0306.2018. 12.059. (in Chinese)
[24] LI X S, TENG Z J, LUO Z Y, YUAN Y B, ZENG Y Y, HU J, SUN J X, BAI W B. Pyruvic acid stress caused color attenuation by interfering with anthocyanins metabolism during alcoholic fermentation. Food Chemistry, 2022, 372:131251.
[25] 张宁, 赵旭, 兰义宾, 石英, 段长青, 吴广枫. 中国东亚种红葡萄酒的颜色特征及酚类组成研究. 中国酿造, 2022, 41(5): 34-41. doi: 10.11882/j.issn.0254-5071.2022.05.007.
ZHANG N, ZHAO X, LAN Y B, SHI Y, DUAN C Q, WU G F. Color features and phenolic composition of red wines made from East Asianspecies native to China. China Brewing, 2022, 41(5): 34-41. doi: 10.11882/j.issn.0254-5071.2022.05.007. (in Chinese)
[26] BENITO S, PALOMERO F, MORATA A, CALDERÓN F, PALMERO D, SUÁREZ-LEPE J A. Physiological features ofof interest in making of white wines. European Food Research and Technology, 2013, 236(1): 29-36.
[27] BENITO Á, CALDERÓN F, BENITO S. The combined use ofand- Effect on the anthocyanin wine composition. Molecules, 2017, 22(5): 739.
[28] MORATA A, ESCOTT C, BAÑUELOS M A, LOIRA I, DEL FRESNO J M, GONZÁLEZ C, SUÁREZ-LEPE J A. Contribution of non-yeasts to wine freshness. A review. Biomolecules, 2020, 10(1): 34.
[29] 赵美, 田秀, 李敏, 高娉娉, 梁丽红, 韩舜愈, 王婧. 粟酒裂殖酵母与酿酒酵母共同接种发酵对‘黑比诺’干红葡萄酒品质的影响. 食品科学, 2021, 42(24): 108-116. doi: 10.7506/spkx1002-6630- 20201012-100.
ZHAO M, TIAN X, LI M, GAO P P, LIANG L H, HAN S Y, WANG J. Effect of mixed culture fermentation withandon the quality of ‘Pinot Noir’ dry red wine. Food Science, 2021, 42(24): 108-116. doi: 10.7506/ spkx1002-6630-20201012-100. (in Chinese)
[30] PORTARO L, MAIOLI F, CANUTI V, PICCHI M, LENCIONI L, MANNAZZU I, DOMIZIO P./mixed starter cultures: New perspectives for the improvement ofaroma, taste, and color stability. LWT, 2022, 156: 113009.
[31] VELENOSI M, CRUPI P, PERNIOLA R, MARSICO A D, SALERNO A, ALEXANDRE H, ARCHIDIACONO N, VENTURA M, CARDONE M F. Color stabilization of Apulian red wines through the sequential inoculation ofand. Molecules, 2021, 26(4): 907.
[32] 胡苑. 干红葡萄酒陈酿衍生色素颜色稳定性的研究[D]. 烟台: 烟台大学, 2021.
HU Y. Study on the color stability of red wine derived pigments during aging [D]. Yantai: Yantai University, 2021. (in Chinese)
[33] HRANILOVIC A, GAMBETTA J M, SCHMIDTKE L, BOSS P K, GRBIN P R, MASNEUF-POMAREDE I, BELY M, ALBERTIN W, JIRANEK V. Oenological traits ofshow signs of domestication and allopatric differentiation. Scientific Reports, 2018, 8(1): 14812.
[34] MORATA A, ESCOTT C, LOIRA I, DEL FRESNO J M, GONZÁLEZ C, SUÁREZ-LEPE J A. Influence ofand non-yeasts in the formation of pyranoanthocyanins and polymeric pigments during red wine making. Molecules, 2019, 24(24): 4490.
[35] WINDHOLTZ S, REDON P, LACAMPAGNE S, FARRIS L, LYTRA G, CAMELEYRE M, BARBE J-C, COULON J, THIBON C, MASNEUF-POMARÈDE I. Non-yeasts as bioprotection in the composition of red wine and in the reduction of sulfur dioxide. LWT, 2021, 149: 111781.
[36] 李婧. 冰葡萄酒发酵过程中酵母菌群落演潜规律及优良菌株的筛选[D]. 大连: 大连理工大学, 2020.
LI J. The dynamic changes of yeast populations during icewine fermentation and screening of the yeast strains [D]. Dalian: Dalian University of Technology, 2020. (in Chinese)
[37] HAN X Y, QING X, YANG S Y, LI R L, ZHAN J C, YOU Y L, HUANG W D. Study on the diversity of non-yeasts in Chinese wine regions and their potential in improving wine aroma by-glucosidase activity analyses.Food Chemistry, 2021, 360: 129886.
[38] GE Q, GUO C F, YAN Y, SUN X Y, MA T T, ZHANG J, LI C H, GOU C L, YUE T L, YUAN Y H. Contribution of non-yeasts to aroma-active compound production, phenolic composition and sensory profile in Chinese Vidal icewine. Food Bioscience, 2021, 46: 101152.
[39] BINATI R L, LEMOS JUNIOR W J F, LUZZINI G, SLAGHENAUFI D, UGLIANO M, TORRIANI S. Contribution of non-yeasts to wine volatile and sensory diversity: A study on,spp. andstrains isolated in Italy. International Journal of Food Microbiology, 2020, 318: 108470.
[40] SCANSANI S, VAN W N, NADER K B, BEISERT B, BREZINA S, FRITSCH S, SEMMLER H, PASCH L, PRETORIUS I S, VON WALLBRUNN C, SCHNELL S, RAUHUT D. The film-formingspp. in a winemaker’s toolbox: A simple isolation procedure and their performance in a mixed-culture fermentation ofL. cv. Gewürztraminer must.International Journal of Food Microbiology, 2022, 365: 109549.
[41] Yan G l, Zhang B q, Joseph L, Waterhouse A L. Effects of initial oxygenation on chemical and aromatic composition of wine in mixed starters ofand. Food Microbiology, 2020, 90:103460.
[42] HONG M N, LI J, CHEN Y w, QI B y, HUANG Y p, WU J, YUE H B, TONG Z Q, LIU Y N, WANG F. Impact of mixed non-yeast during fermentation on volatile aroma compounds of Vidal blanc icewine. LWT, 2021, 145: 111342.
[43] 孙玉霞, 赵新节. 美极梅奇酵母的代谢特性及其在葡萄酒生产中的应用前景. 食品与发酵工业, 2021, 47(4): 305-311. doi: 10.13995/j.cnki.11-1802/ts.025251.
SUN Y X, ZHAO X J. Metabolic characteristics ofand its application in wine production. Food and Fermentation Industries, 2021, 47(4): 305-311. doi: 10.13995/j.cnki. 11-1802/ts.025251. (in Chinese)
[44] LAI Y T, HSIEH C W, LO Y C, LIOU B K, LIN H W, HOU C Y, CHENG K C. Isolation and identification of aroma-producing non-yeast strains and the enological characteristic comparison in wine making. LWT, 2022, 154: 112653.
[45] BELDA I, RUIZ J, BEISERT B, NAVASCUÉS E, MARQUINA D, CALDERÓN F, RAUHUT D, BENITO S, SANTOS A. Influence ofin varietal thiol (3-SH and 4-MSP) release in wine sequential fermentations. International Journal of FoodMicrobiology, 2017, 257: 183-191.
[46] SEGUINOT P, BLOEM A, BRIAL P, MEUDEC E, ORTIZ-JULIEN A, CAMARASA C. Analysing the impact of the nature of the nitrogen source on the formation of volatile compounds to unravel the aroma metabolism of two non-strains. International Journal of Food Microbiology, 2020, 316: 108441.
[47] SHI W K, WANG J, CHEN F S, ZHANG X Y. Effect ofandon wine flavor and quality through simultaneous and sequential co-fermentation with. LWT, 2019, 116: 108477.
[48] 李爱华, 王星晨, 彭文婷, 李朔, 陶永胜. 胶红酵母与酿酒酵母混合酒精发酵中酵母生长与糖苷酶活动力学. 西北农业学报, 2018, 27(6): 896-903. doi: 10.7606/j.issn.1004-1389.2018.06.018.
LI A H, WANG X C, PENG W T, LI S, TAO Y S. Kinetics of biomass and glycosidase activities during mixed alcoholic fermentation of selectedand. Acta Agriculturae Boreali-Occidentalis Sinica, 2018, 27(6): 896-903. doi: 10.7606/j.issn.1004-1389.2018.06.018. (in Chinese)
[49] WANG X C, LI A H, DIZY M, ULLAH N, SUN W X, TAO Y S. Evaluation of aroma enhancement for ‘Ecolly’ dry white wines by mixed inoculation of selectedand. Food Chemistry, 2017, 228: 550-559.
[50] 马娜, 王星晨, 孔彩琳, 陶永胜. 胶红酵母与酿酒酵母共发酵对干红葡萄酒香气与色泽的影响. 食品科学, 2021, 42(2): 97-104. doi: 10.7506/spkx1002-6630-20191112-158.
MA N, WANG X C, KONG C L, TAO Y S. Effect of mixed culture fermentation withandon the aroma and color of red wine. Food Science, 2021, 42(2): 97-104. doi: 10.7506/spkx1002-6630-20191112-158. (in Chinese)
[51] NISIOTOU A, SGOUROS G, MALLOUCHOS A, NISIOTIS C-S, MICHAELIDIS C, TASSOU C, BANILAS G. The use of indigenousandstrains as a tool to create chemical complexity in local wines.Food Research International, 2018, 111: 498-508.
[52] ENGLEZOS V, RANTSIOU K, CRAVERO F, TORCHIO F, POLLON M, FRACASSETTI D, ORTIZ-JULIEN A, GERBI V, ROLLE L, COCOLIN L. Volatile profile of white wines fermented with sequential inoculation ofand. Food Chemistry, 2018, 257: 350-360.
[53] LEE P R, SAPUTRA A, YU B, CURRAN P, LIU S Q. Effects of pure and mixed-cultures ofandon the volatile profiles of grape wine. Food Biotechnology, 2012, 26(4): 307-325. doi: 10.1080/08905436.2012.723606.
[54] GARAVAGLIA J, SCHNEIDER R DE C DE S, CAMARGO MENDES S D, WELKE J E, ZINI C A, CARAMÃO E B, VALENTE P. Evaluation ofBCV 08 as a co-starter in wine fermentation for the improvement of ethyl esters production. Microbiological Research, 2015, 173: 59-65.
[55] MARTÍNEZ-AVILA O, SÁNCHEZ A, FONT X, BARRENA R. Bioprocesses for 2-phenylethanol and 2-phenylethyl acetate production:current state and perspectives.Applied Microbiology and Biotechnology, 2018, 102(23): 9991-10004.
[56] ZHANG B Q, TANG C, YANG D Q, LIU H, XUE J, DUAN C Q, YAN G L. Effects of three indigenous non-yeasts and their pairwise combinations in co-fermentation withon volatile compounds of Petit Manseng wines.Food Chemistry, 2022, 368: 130807.
[57] 张清安, 陈博宇. 葡萄酒中与风味相关4类含硫化合物的研究进展. 中国农业科学, 2020, 53(5): 1029-1045. doi: 10.3864/j.issn.0578- 1752.2020.05.014.
ZHANG Q A, CHEN B Y. Research progress of four sulfur compounds related to red wine flavor. Scientia Agricultura Sinica, 2020, 53(5): 1029-1045. doi: 10.3864/j.issn.0578-1752.2020.05.014. (in Chinese)
[58] ZHANG P Z, ZHANG R G, SIRISENA S, GAN R Y, FANG Z X. Beta-glucosidase activity of wine yeasts and its impacts on wine volatiles and phenolics: A mini-review.Food Microbiology, 2021, 100: 103859.
[59] 任学梅, 姚红红, 严幻汝, 祝霞, 杨学山. 高产糖苷酶非酿酒酵母菌株筛选、鉴定及其发酵过程中酶活性变化. 食品科学, 2022, 43(20): 198-206.
REN X M, YAO H H, YAN H R, ZHU X, YANG X S. Screening and identification of non-yeast strains with high glycosidase production and changes in enzyme activities during their fermentation. Food Science, 2022, 43(20): 198-206. (in Chinese)
[60] 马延琴, 徐晓裕, 李甜, 李春燕, 蒋霞, 王斌, 史学伟. 酿酒葡萄表皮产酶非酿酒酵母的筛选及其产酶特性研究. 中国酿造, 2021, 40(12): 149-154. doi: 10.11882/j.issn.0254-5071.2021.12.027.
MA Y Q, XU X Y, LI T, LI C Y, JIANG X, WANG B, SHI X W. Screening of non-from wine grape epidermis and its enzyme-producing ability. China Brewing, 2021, 40(12): 149-154. doi: 10.11882/j.issn.0254-5071.2021.12.027. (in Chinese)
[61] ROMANO P, SUZZI G. Higher alcohol and acetoin production bywine yeasts. Journal of Applied Bacteriology, 1993, 75(6): 541-545.
[62] PUERTAS B, JIMENEZ-HIERRO M J, CANTOS-VILLAR E, MARRUFO-CURTIDO A, CARBÚ M, CUEVAS F J, MORENO- ROJAS J M, GONZÁLEZ-RODRÍGUEZ V E, CANTORAL J M, RUIZ-MORENO M J. The influence of yeast on chemical composition and sensory properties of dry white wines. Food Chemistry, 2018, 253: 227-235.
[63] Zhu L X, Wang G, Aihaiti A. Combined indigenous yeast strains produced local wine from over ripen Cabernet Sauvignon grape in Xinjiang. World Journal of Microbiology and Biotechnology, 2020, 36(8): 122.
[64] DOMIZIO P, LIU Y, BISSON L F, BARILE D. Use of non-wine yeasts as novel sources of mannoproteins in wine. Food Microbiology, 2014, 43: 5-15.
[65] DOMIZIO P, LENCIONI L, CALAMAI L, PORTARO L, BISSON L F. Evaluation of the yeastfor use in wine production. American Journal of Enology and Viticulture, 2018, 69(3): 266-277.
[66] KIM D H, HONG Y A, PARK H D. Co-fermentation of grape must byandreduces the malic acid content in wine. Biotechnology Letters, 2008, 30(9): 1633-1638.
[67] HONG S K, LEE H J, PARK H J, HONG Y A, RHEE I K, LEE W H, CHOI S W, LEE O S, PARK H D. Degradation of malic acid in wine by immobilizedcells with oriental oak charcoal and alginate. Letters in Applied Microbiology, 2010, 50(5): 522-529. doi: 10.1111/j.1472-765X.2010.02833.x.
[68] BELDA I, NAVASCUÉS E, MARQUINA D, SANTOS A, CALDERON F, BENITO S. Dynamic analysis of physiological properties ofin wine fermentations and its incidence on wine quality. Applied Microbiology and Biotechnology, 2015, 99(4): 1911-1922.
[69] 白玉峰, 张文霞, 田亚楠, 张秀艳. 宁夏贺兰山东麓降L-苹果酸葡萄酒酵母的筛选. 中国酿造, 2021, 40(1): 49-54. doi: 10.11882/ j.issn.0254-5071.2021.01.010.
BAI Y F, ZHANG W X, TIAN Y N, ZHANG X Y. Screening of yeast strains with L-malic acid degradation ability from Eastern Foothills of Helan in Ningxia. China Brewing, 2021, 40(1): 49-54. doi: 10.11882/j.issn.0254-5071.2021.01.010. (in Chinese)
[70] MILHEIRO J, FILIPE-RIBEIRO L, VILELA A, COSME F, NUNES F M. 4-Ethylphenol, 4-ethylguaiacol and 4-ethylcatechol in red wines: Microbial formation, prevention, remediation and overview of analytical approaches. Critical Reviews in Food Science and Nutrition, 2019, 59(9): 1367-1391. doi: 10.1080/10408398.2017.1408563.
[71] FLEET G H. Wine yeasts for the future. FEMS Yeast Research, 2008, 8(7): 979-995. doi: 10.1111/j.1567-1364.2008.00427.x.
[72] KUCHEN B, MATURANO Y P, MESTRE M V, COMBINA M, TORO M E, VAZQUEZ F. Selection of native non-yeasts with biocontrol activity against spoilage yeasts in order to produce healthy regional wines. Fermentation, 2019, 5: 60.
[73] COMITINI F, AGARBATI A, CANONICO L, GALLI E, CIANI M. Purification and characterization of WA18, a new mycocin produced byactive in wine againstspoilage yeasts. Microorganisms, 2020, 9: 56.
[74] YAN W, GAO H, QIAN X J, JIANG Y J, ZHOU J, DONG W L, XIN F X, ZHANG W M, JIANG M. Biotechnological applications of the non-conventional yeast.Biotechnology Advances, 2021, 46: 107674.
[75] BENITO S. The impacts ofyeast strains on winemaking. Applied Microbiology and Biotechnology, 2018, 102(16): 6775-6790.
[76] BENITO S. The impacts ofon winemaking. Applied Microbiology and Biotechnology, 2019, 103(11): 4291-4312.
[77] WANG B S, TAN F L, CHU R C, LI G Y, LI L B, YANG T Y, ZHANG M X. The effect of non-yeasts on biogenic amines in wine. Trends in Food Science & Technology, 2021, 116: 1029-1040.
[78] GALLARDO-FERNÁNDEZ M, VALLS-FONAYET J, VALERO E, HORNEDO-ORTEGA R, RICHARD T, TRONCOSO A M, GARCIA-PARRILLA M C. Isotopic labelling-based analysis elucidates biosynthesis pathways infor melatonin, serotonin and hydroxytyrosol formation. Food Chemistry, 2022, 374: 131742.
[79] MORCILLO-PARRA M Á, GONZÁLEZ B, BELTRAN G, MAS A, TORIJA M J. Melatonin and glycolytic protein interactions are related to yeast fermentative capacity.Food Microbiology, 2020, 87: 103398.
[80] WANG C X, WU C, QIU S Y. Yeast diversity investigation ofFöex during spontaneous fermentations using culture- dependent and high-throughput sequencing approaches. Food Research International, 2019, 126: 108582.
[81] MASNEUF-POMAREDE I, BELY M, MARULLO P, ALBERTIN W. The genetics of non-conventional wine yeasts: Current knowledge and future challenges. Frontiers in Microbiology, 2016, 6: 1563.
[82] 梁树英, 王春晓. 基于倍性的葡萄酒相关酵母酿造特性研究进展. 食品与发酵科技, 2022, 58(1): 121-130. doi: 10.3969/j.issn.1674- 506X.2022.01-017.
LIANG S Y, WANG C X. Research progress in wine-making characteristic of wine-related yeast based on ploidy. Sichuan Food and Fermentation, 2022, 58(1): 121-130. doi: 10.3969/j.issn.1674-506X. 2022.01-017. (in Chinese)
[83] ALBERTIN W, SETATI M E, MIOT-SERTIER C, MOSTERT T T, COLONNA-CECCALDI B, COULON J, GIRARD P, MOINE V, PILLET M, SALIN F, BELY M, DIVOL B, MASNEUF- POMAREDE I.from winemaking environments show spatial and temporal genetic clustering.Frontiers in Microbiology, 2016, 6: 1569.
[84] HRANILOVIC A, BELY M, MASNEUF-POMAREDE I, JIRANEK V, ALBERTIN W, FAIRHEAD C. The evolution ofis driven by geographical determination, anthropisation and flux between different ecosystems. PLoS ONE, 2017, 12(9): e0184652.
[85] WRENT P, RIVAS E M, PEINADO J M, DE SILÓNIZ M I. Development of an affordable typing method forusing microsatellite markers. International Journal of Food Microbiology, 2016, 217: 1-6.
[86] MASNEUF-POMAREDE I, JUQUIN E, MIOT-SERTIER C, RENAULT P, LAIZET Y, SALIN F, ALEXANDRE H, CAPOZZI V, COCOLIN L, COLONNA-CECCALDI B, ENGLEZOS V, GIRARD P, GONZALEZ B, LUCAS P, MAS A, NISIOTOU A, SIPICZKI M, SPANO G, TASSOU C, BELY M, ALBERTIN W. The yeast(synonym) shows high genetic diversity in winemaking environments. FEMS Yeast Research, 2015, 15(5): fov045. doi: 10.1093/femsyr/fov045.
[87] ALBERTIN W, CHASSERIAUD L, COMTE G, PANFILI A, DELCAMP A, SALIN F, MARULLO P, BELY M, SCHACHERER J. Winemaking and bioprocesses strongly shaped the genetic diversity of the ubiquitous yeast. PLoS ONE, 2014, 9(4): e94246.
[88] 田进, 吴成, 杨金仙, 王春晓. 葡萄酒有孢汉逊酵母属分子指纹图谱分析. 菌物学报, 2020, 39(4): 755-765. doi: 10.13346/j. mycosystema.190404.
TIAN J, WU C, YANG J X, WANG C X. The molecular fingerprinting analysis ofin wine. Mycosystema, 2020, 39(4): 755-765. doi: 10.13346/j.mycosystema.190404. (in Chinese)
[89] MENCHER A, MORALES P, CURIEL J A, GONZALEZ R, TRONCHONI J.represses aerobic respiration insuggesting a direct response to co-cultivation. Food Microbiology, 2021, 94: 103670.
[90] LI Y Q, HU K, XU Y H, MEI W C, TAO Y S. Biomass suppression ofby killerhighly increased fruity esters in mixed culture fermentation. LWT, 2020, 132: 109839.
[91] ROLLERO S, BLOEM A, BRAND J, ORTIZ-JULIEN A, CAMARASA C, DIVOL B. Nitrogen metabolism in three non-conventional wine yeast species: A tool to modulate wine aroma profiles. Food Microbiology, 2021, 94: 103650.
[92] TANGULER H. Evaluation ofinoculum level on fermentation and flavor compounds of white wines made from emir (L) grown in anatolia. Food Biotechnology, 2012, 26(4): 351-368.
[93] ROULLIER-GALL C, BORDET F, DAVID V, SCHMITT-KOPPLIN P, ALEXANDRE H. Yeast interaction on Chardonnay wine composition: Impact of strain and inoculation time. Food Chemistry, 2022, 374: 131732.
[94] 战吉宬, 曹梦竹, 游义琳, 黄卫东. 非酿酒酵母在葡萄酒酿造中的应用. 中国农业科学, 2020, 53(19): 4057-4069. doi: 10.3864/j.issn. 0578-1752.2020.19.018.
ZHAN J C, CAO M Z, YOU Y L, HUANG W D. Research advance on the application of non-in winemaking. Scientia Agricultura Sinica, 2020, 53(19): 4057-4069. doi: 10.3864/j.issn. 0578-1752.2020.19.018. (in Chinese)
[95] LIU H, LI X, DENG J Z, DAI L Y, LIU W, PAN B L, WANG C T, ZHANG D J, LI Z J. Molecular mechanism of the response ofto D-fructose stress by the glutathione metabolism pathway. FEMS Yeast Research, 2020, 20(5): foaa034. doi: 10.1093/femsyr/foaa034.
[96] MBUYANE L L, BAUER F F, DIVOL B. The metabolism of lipids in yeasts and applications in oenology. Food Research International, 2021, 141: 110142.
Research Progress on the Application of Non-During Wine Fermentation
WANG ChunXiao1, YU JunZhu1, ZHOU WenYa1, XU YinHu2
1School of Liquor and Food Engineering, Guizhou University/Key Laboratory of Fermentation Engineering and Biological Pharmacy of Guizhou Province, Guiyang 550025;2National Center for Yeast Technology Research and Promotion, Yichang 443003, Hubei
Non-yeast are naturally present on grape skin, which mainly play their roles in the maceration and initial stage of fermentation during winemaking process. More and more concerns have been recently focused on the application of non-yeast in wine fermentation. Non-yeast often have weaker fermentation ability thanand can convert the reducing sugar into ethanol and other fermentation by-products. Therefore, non-are the potential excellent yeast for producing wine with complex flavor traits and lower ethanol degree. Different non-yeast species have different metabolic characteristics in wine fermentation applications. The selection of non-yeasts with certain characteristics for application in fermentation can improve the specialized quality of wine. This review was based on the initial summary on the species, winemaking traits, and application ways of commercial non-yeast, and emphasized on the positive role of non-in wine color, aroma, taste, safety and health, their metabolic mechanisms and corresponding research hotspot. The positive role of non-in wine color included the promotion of high acid production, high polysaccharide production, high extracellular pyruvate production and low sorption properties. Different non-yeast could promote the fruity aroma enhancement in wine by low production of ethanol, acetaldehyde, and volatile phenols, and high production of ethyl acetate, acetic acid ester, ethyl ester, higher alcohols, and enzymes related with the release of terpene and mercaptan, and therefore improve the aroma complexity of wine. Non-yeast could regulate wine mouthfeel traits by high production of glycerol, polysaccharide, and lactic acid, and degradation of malic acid. In addition, non-yeast could improve the safety quality of wine by decreasing the SO2dosage as biological control agent, and reducing the content of toxic compounds through metabolic degradation during alcoholic fermentation. This review further analyzed the current research status on genome and microsatellite loci analysis. The main inoculation strategies were discussed on application of non-yeast during wine fermentation, and six aspects were posed for further research concern. This review provided theoretical references for the research on application of the non-yeasts in wine alcoholic fermentation.
mixed fermentation; color stability; aroma complexity; genotype; commercialization

10.3864/j.issn.0578-1752.2023.03.011
2022-04-30;
2022-07-22
国家自然科学基金青年科学基金(32160544,31801523)、贵州省科技计划(黔科合支撑[2022]重点006号)、贵州省教育厅青年科技人才成长项目(黔教合KY字[2018]120)、贵州大学引进人才科研项目(贵大人基合字[2017]44号,贵大培育[2020]50号)、贵州省发酵工程与白酒酿造人才基地(黔人领发[2018]3号)、遵义市创新人才团队培养项目(遵义科人才[2020]9)
通信作者王春晓,Tel:18111908483;E-mail:cxwang@gzu.edu.cn
(责任编辑 赵伶俐)
