黄瓜果实维生素C合成关键基因克隆与分析
2023-03-07王壮壮董邵云周琪苗晗刘小萍徐奎鹏顾兴芳张圣平
王壮壮,董邵云,周琪,苗晗,刘小萍,徐奎鹏,顾兴芳,张圣平
黄瓜果实维生素C合成关键基因克隆与分析

1中国农业科学院蔬菜花卉研究所/农业农村部园艺作物生物学与种质创制重点实验室/蔬菜生物育种全国重点实验室,北京 100081;2青岛农业大学园艺学院,山东青岛 266000
【目的】鉴定调控黄瓜果实中L-半乳糖途径维生素C(Vc)合成相关基因的位置、数量及表达特征,同时对关键基因进行克隆分析,旨在为黄瓜果实中Vc合成调控研究奠定基础。【方法】根据已报道的拟南芥中L-半乳糖途径合成Vc相关基因,利用蛋白编码的氨基酸序列在黄瓜9930_V2参考基因组数据库中进行BLAST比对,确定黄瓜中的同源基因,借助TBtools软件绘制基因在染色体上的位置。通过qRT-PCR分析上述基因在果实Vc含量差异显著的两份黄瓜材料中的表达量。利用PCR扩增对限速酶GDP-L-半乳糖磷酸化酶(GGP)及GDP-甘露糖-3′ 5′-差向酶(GME)同源基因进行克隆,测序分析这些基因在高Vc含量与低Vc含量黄瓜果实中的序列差异。构建系统进化树,分析黄瓜果实GME、GGP与其他物种中同源基因的亲缘关系。【结果】在黄瓜基因组中比对到21个参与L-半乳糖途径合成Vc相关酶PMI、PMM、GMPase、GME、GGP、GPP、GalDH、GalLDH的同源基因,7条染色体均有分布,在5号染色体和1号染色体上分布最多。通过对21个基因在两份果实Vc含量高低差异显著的两份材料CG45(高Vc含量)和R48(低Vc含量)的表达量分析,发现调控PMI、PMM、GMPase、GME、GalLDH这5个酶的基因在CG45和R48中有极显著的表达差异。对Vc合成限速酶GGP和GME相关基因在CG45和R48两份材料中进行克隆发现,在R48中基因全长为3 537 bp,在CG45中基因全长为3 541 bp,该基因在两份材料存在多个SNP位点差异和Indel差异,有一个突变位点位于CDS区,且导致了氨基酸序列的改变。通过对调控Vc合成限速酶GME、GGP蛋白性质分析,发现限速酶GME、GGP在不同物种的蛋白性质差异不大,均为亲水性蛋白,功能相对保守。进化树分析发现不同物种亲缘关系较近的聚类在一起,进化过程高度保守。【结论】鉴定出21个分布于7条染色体上的黄瓜果实Vc合成的L-半乳糖途径相关基因,推测关键酶PMI、PMM、GMPase、GME、GalLDH、GGP可能影响黄瓜果实中Vc含量变化,调控Vc合成限速步骤关键酶GME、GGP功能相对保守,Vc合成限速步骤关键酶GME基因在高Vc和低Vc两份材料中的一个SNP位点变异导致氨基酸序列的变化。
黄瓜;Vc;基因克隆;表达分析
0 引言
【研究意义】维生素C(Vc)是一种水溶性维生素,广泛存在于植物体内,参与植物细胞分裂和细胞膨大等生长发育过程[1],在植物抗逆如抗盐[2]、抗旱[3]、抗寒[4]等方面发挥着重要作用。Vc是人体维持正常生命活动不可缺少的营养元素,由于人体编码Vc生物合成最后一步酶的基因突变或缺失已演变为无功能状态,因此只能依赖饮食供应[5],因Vc还原态具有治疗坏血病的作用,因此又称其抗坏血酸(ascorbic acid,AsA)。植物普遍都能合成Vc,不同植物的Vc含量并不相同,且同类植物不同品种、不同发育阶段Vc含量也有很大差异[6-7]。由于Vc极易被氧化,蒸煮会导致蔬菜Vc破坏严重[8],生食蔬果是补充Vc的最佳途径。黄瓜是我国重要的蔬菜产品,2021年,我国黄瓜年均播种面积129.25万hm2、产量7 559.77万t[9],生产规模位居世界前列。黄瓜以生食为主,生食可以使黄瓜中的Vc最大程度被人体摄入。提高果实中Vc含量的目的是提高人体Vc摄入量,对黄瓜而言,花后10 d左右的瓜是人们最佳食用的商品瓜,鉴定该阶段限制黄瓜果实中Vc含量关键基因对提高黄瓜中Vc含量有重要意义。【前人研究进展】目前,植物体Vc合成途径研究较为深入,L-半乳糖途径[10]、肌醇途径[11]、D-半乳糖醛酸途径[12]和L-古洛糖途径[13]是被众多学者论证的途径。大量研究表明,L-半乳糖途径显著影响植物中Vc含量,很多学者也都在围绕此途径展开对植物体Vc合成机制的研究。随着编码L-半乳糖-1-磷酸化酶(GGP)的两个基因和的发现[14-15],L-半乳糖途径的所有关键酶基因都已确定,途径涉及的酶包括甘露糖-6-磷酸异构酶(PMI)、甘露糖磷酸变位酶(PMM)、GDP-甘露糖焦磷酸化酶(GMPase)、GDP-甘露糖-3′5′-差向酶(GME)、GDP-L-半乳糖磷酸化酶(GGP)、L-半乳糖-1-磷酸化酶(GPP)、L-半乳糖脱氢酶(GalDH)、L-1,4-半乳糖内酯脱氢酶(GalLDH)。L-半乳糖途径中,GGP是L-半乳糖途径最主要的限速酶[16],GME是Vc合成过程中唯一的差向异构酶,在拟南芥[17]、猕猴桃中[18]的研究表明GME和GGP协同调控Vc含量。目前黄瓜Vc相关的研究主要对植株研究较多,有学者克隆出黄瓜中L-半乳糖-1,4-内酯脱氢酶cDNA全长,并进行了遗传转化[19];在研究UV-B对黄瓜幼苗AsA及其基因表达的影响时发现,UV-B诱导了与L-半乳糖和肌醇途径以及抗坏血酸-谷胱甘肽系统有关的基因表达,从而增加了Vc水平[20];Zhang等[21]从转录水平和酶活性水平研究了缺氮条件下黄瓜幼苗抗坏血酸生物合成和循环途径中关键酶的变化,结果表明参与黄瓜叶片抗坏血酸-谷胱甘肽循环途径和肌醇途径中的抗坏血酸氧化酶(AO)、谷胱甘肽还原酶(GR)和肌醇加氧酶(MIOX)可能在AsA积累中发挥作用。【本研究切入点】关于黄瓜果实Vc合成关键酶基因的克隆与表达分析尚未见报道。本研究以拟南芥中Vc合成的L-半乳糖途径为参考,研究黄瓜果实中Vc合成的L-半乳糖途径。【拟解决的关键问题】鉴定黄瓜果实中参与Vc合成的L-半乳糖途径相关酶的基因。利用qRT-PCR技术分析这些基因在高含量Vc黄瓜果实与低含量Vc黄瓜果实中的表达情况。克隆限速酶基因,分析这些基因在不同材料中的序列差异。
1 材料与方法
1.1 植物材料
本研究试验材料为黄瓜果实Vc含量高低差异显著的自交系R48(低)和CG45(高),材料均为欧洲类型黄瓜,遗传背景清晰。试验材料于2021年3月定植在连栋大棚(山东寿光),田间正常管理。材料来源于中国农业科学院蔬菜花卉研究所黄瓜遗传育种课题组。
1.2 试验方法
1.2.1 黄瓜Vc合成相关基因鉴定及染色体定位 根据文献[22]获得12个拟南芥中参与Vc合成的关键酶基因,在TAIR数据库(https://www.arabidopsis.org)获得相关基因蛋白序列。通过在葫芦科基因组网站(http://cucurbitgenomics.org)利用BLAST方法从黄瓜基因组(9930_V2)比对同源基因,利用TBtools软件绘制基因在黄瓜染色体的位置。
1.2.2 样品取样和Vc含量测定 CG45与R48在盛瓜期取中间节位果实,每份材料3个生物学重复,每个重复取3条商品瓜(花后10 d,单性结实)。每条瓜横向取中间位置两片,每片厚度约0.5 cm,液氮冷冻,放于-80℃冰箱冷藏,用于后续提取RNA、DNA。每条瓜横向切取上、中、下3个部位共100 g,迅速用打浆机粉碎,取5 g匀浆精细研磨,利用Vc在紫外区265 nm处有最大吸收,快速测定[23]。
1.2.3 黄瓜果实总RNA提取 将冷藏的样品放于组织研磨仪中研磨,根据TIANGEN植物总RNA提取试剂盒提取果实RNA,具体按照试剂盒操作说明进行。提取后取2 μL RNA用于琼脂糖凝胶电泳检测RNA完整性。取2 μL RNA用TaKaRa反转录试剂合成cDNA,反转录后取1 μL cDNA检测浓度,并稀释至100 ng·μL-1用于荧光定量PCR。
1.2.4 荧光定量引物设计 根据BLAST比对到的21个同源基因,利用DNAMAN软件对其进行荧光定量引物设计。在NCBI通过Primer-Blast模拟扩增,检测引物特异性,选出合适的引物由上海生工合成,引物序列见表1。
1.2.5 qRT-PCR扩增 以R48和CG45黄瓜果实cDNA为模板,利用荧光定量PCR仪进行荧光定量分析。根据溶解曲线获得CT值,利用Excel软件对数据进行处理,根据2-△△CT方法计算各基因相对表达量[24]。以作为内参基因,误差线代表3个生物学重复的标准误差。
1.2.6 关键酶GME与GGP相关基因的克隆 在黄瓜基因组数据库(9930_V2)找到相关基因,通过Primer5.0设计引物扩增相关基因(表2)。扩增体系为20 μL,PCR程序为95℃ 3 min;95℃ 15 s、55℃ 15 s、72℃ 3 min、35个循环后72℃延伸5 min,4℃保存。扩增产物用琼脂糖检测后送上海生工测序。
1.2.7 Vc合成关键酶GME、GGP进化树构建及理化性质分析 在黄瓜基因组数据库(9930_V2)找到黄瓜GME、GGP基因蛋白序列,通过在NCBI上进行BLAST搜索,利用MEGA-X软件对不同物种同源基因进行进化树构建,分析亲缘关系。在ExPASy主页(https://web.expasy.org),利用ProtParam分析软件分析蛋白的等电点(pI)、分子量(Mw)、总平均疏水性(GRAVY)、不稳定系数(II)。
2 结果
2.1 黄瓜Vc合成相关基因
根据拟南芥中Vc合成的L-半乳糖途径关键酶氨基酸序列,在黄瓜基因组网站比对到21个参与黄瓜Vc合成的基因(表3)。黄瓜基因组中,除、、为单拷贝,其余均为多拷贝。PMI存在两个同源基因,GME存在3个同源基因,GPP、GalDH存在4个同源基因,GMPase存在5个同源基因。
2.2 黄瓜Vc合成相关基因在染色体的位置
根据基因在染色体物理位置,将这21个基因定位在黄瓜7条染色体上,由图1可知,在5号染色体上分布的基因最多,有5个;其次是1号染色体,有4个;2号和3号染色体较少,均包含3个;4号和7号染色体最少,均包含2个。从物理位置来看,黄瓜中与Vc合成相关的基因分布均匀,不存在大的基因簇。
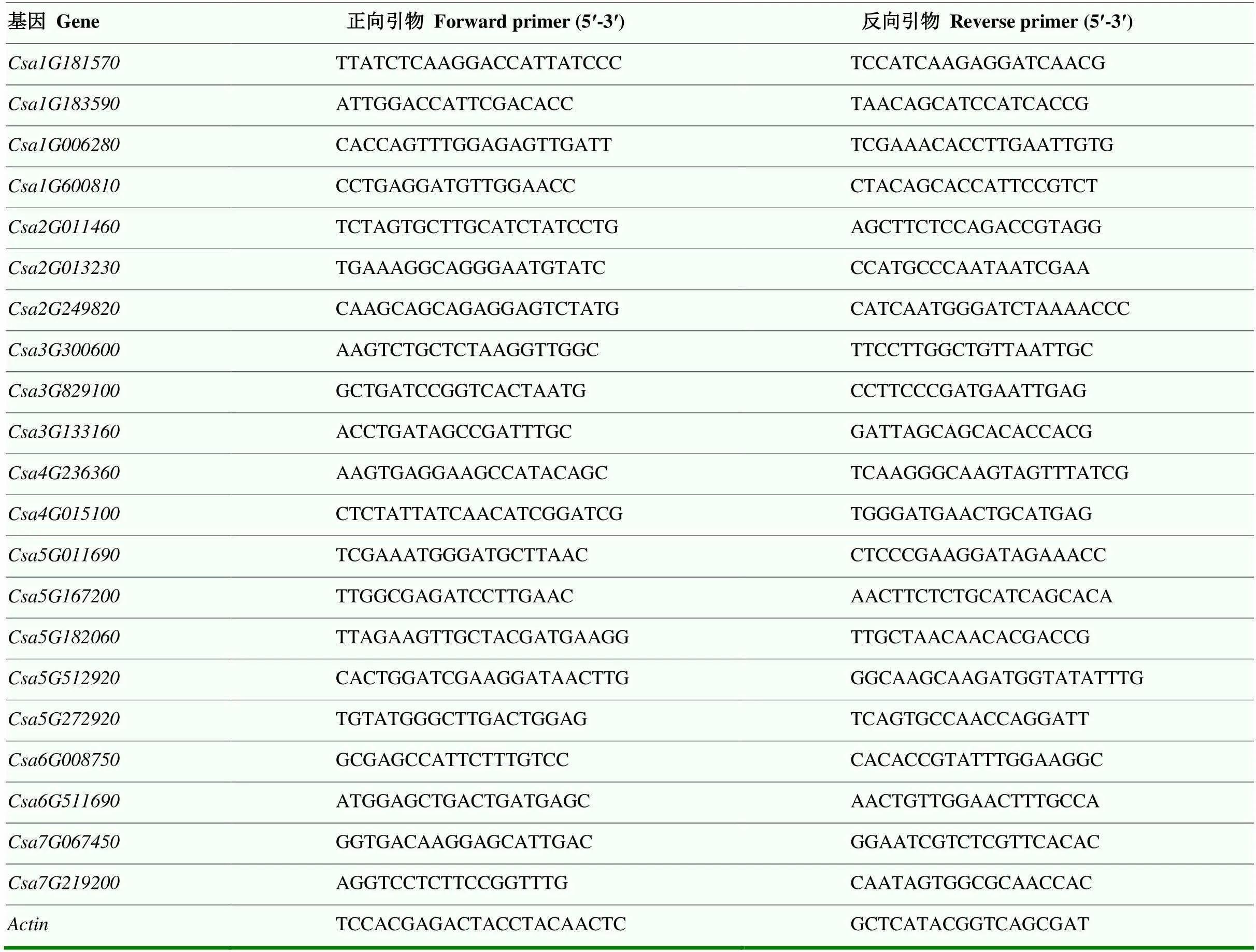
表1 L-半乳糖途径同源基因荧光定量引物

表2 GME、GGP相关基因扩增引物
2.3 黄瓜果实Vc含量差异显著材料的关键酶基因表达量分析
对两份材料R48和CG45的果实Vc含量进行测定,R48为16.83 mg/100 g,CG45为31.4 mg/100 g,两份材料果实中Vc含量差异显著。通过对黄瓜中比对到的21个基因在R48和CG45黄瓜果实中的表达量进行分析,发现所有基因在R48中的表达量均低于在CG45的表达量,有9个基因在两份材料的表达量呈极显著性差异,分别为PMI、PMM、GMPase、GME、GalLDH这5个酶的相关基因(图2)。通过对L-半乳糖途径通路的21个基因在两份材料果实中的表达分析,推测GGP可能是限制黄瓜果实Vc含量的主要限速酶(图3)。
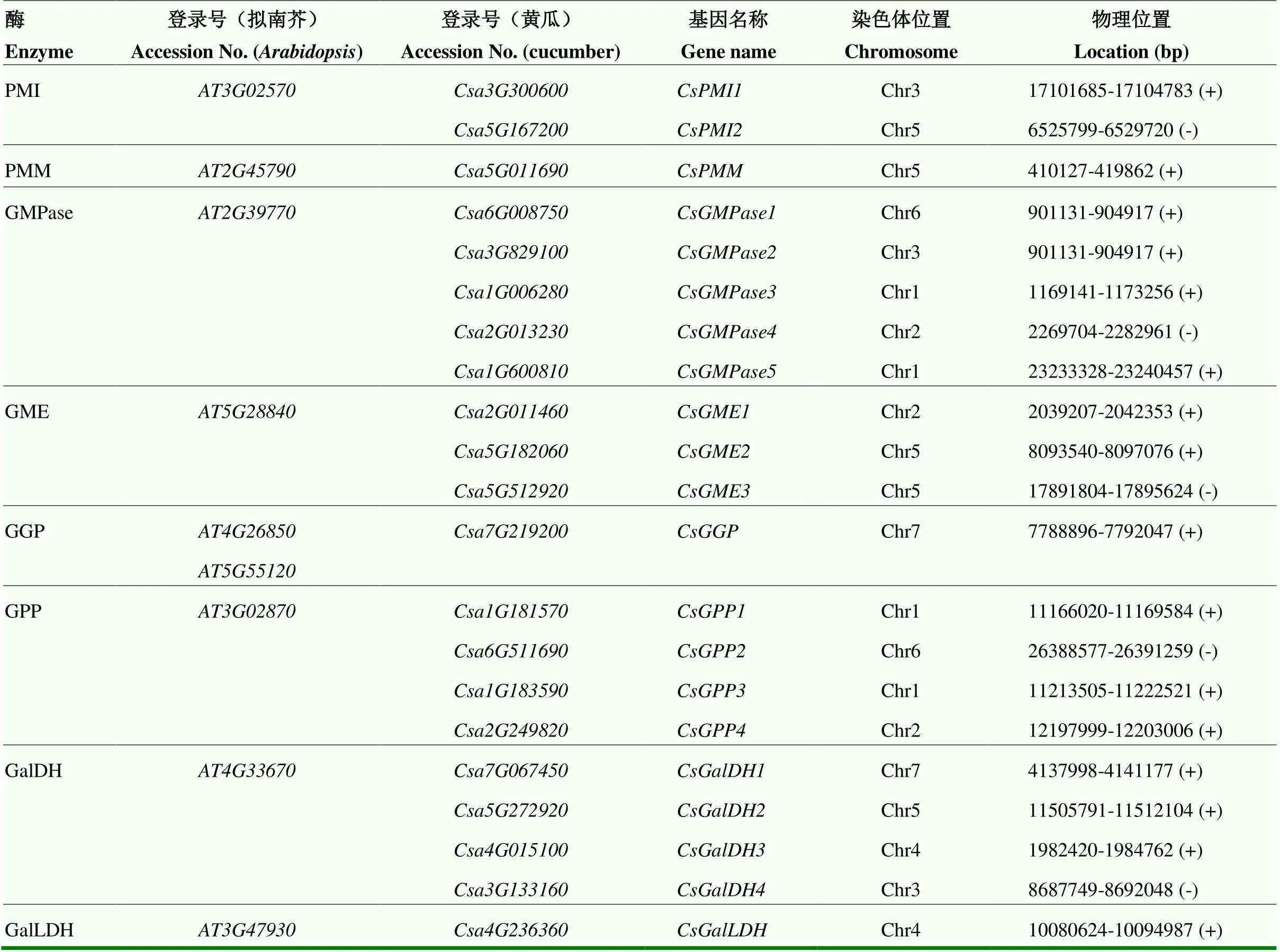
表3 黄瓜中Vc合成关键酶及相关基因
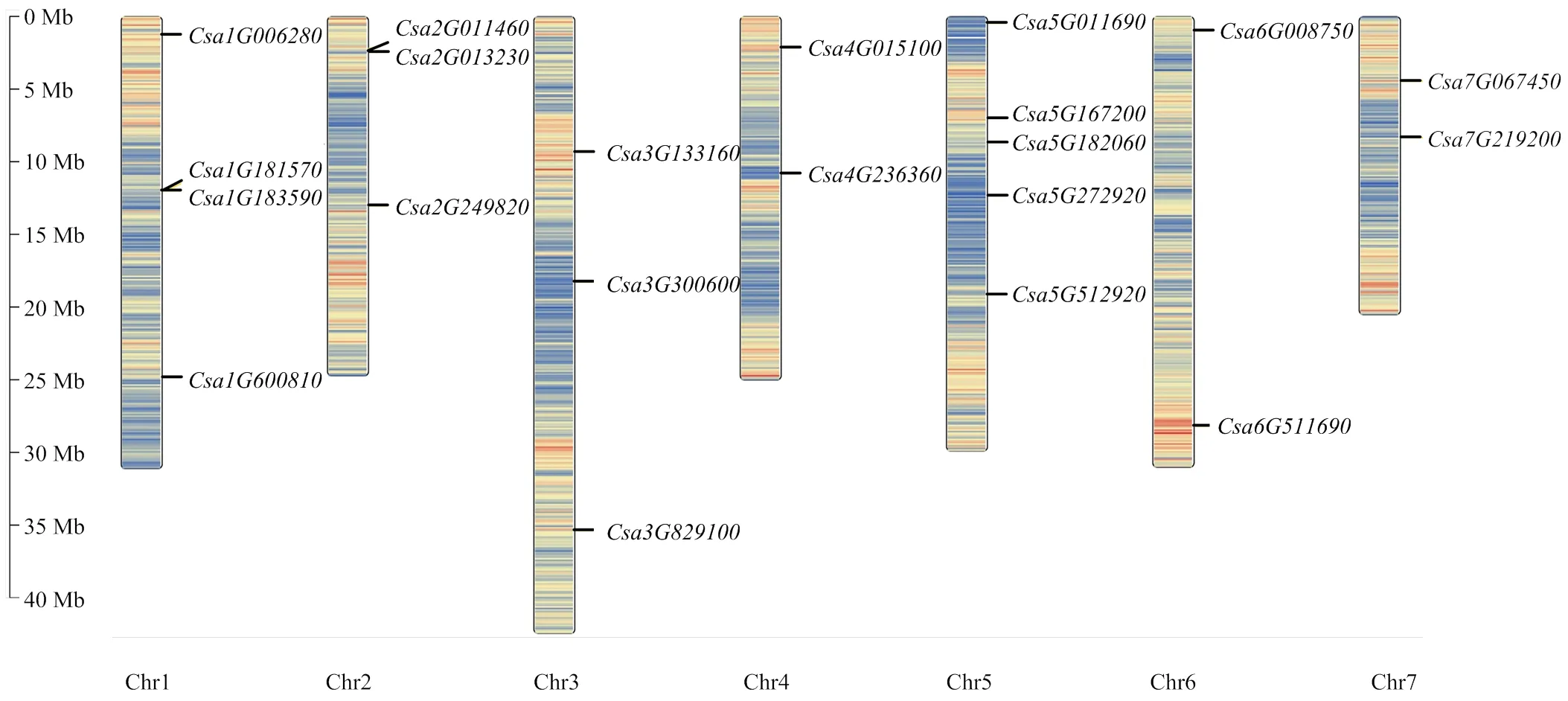
图1 黄瓜Vc合成相关基因在染色体的位置
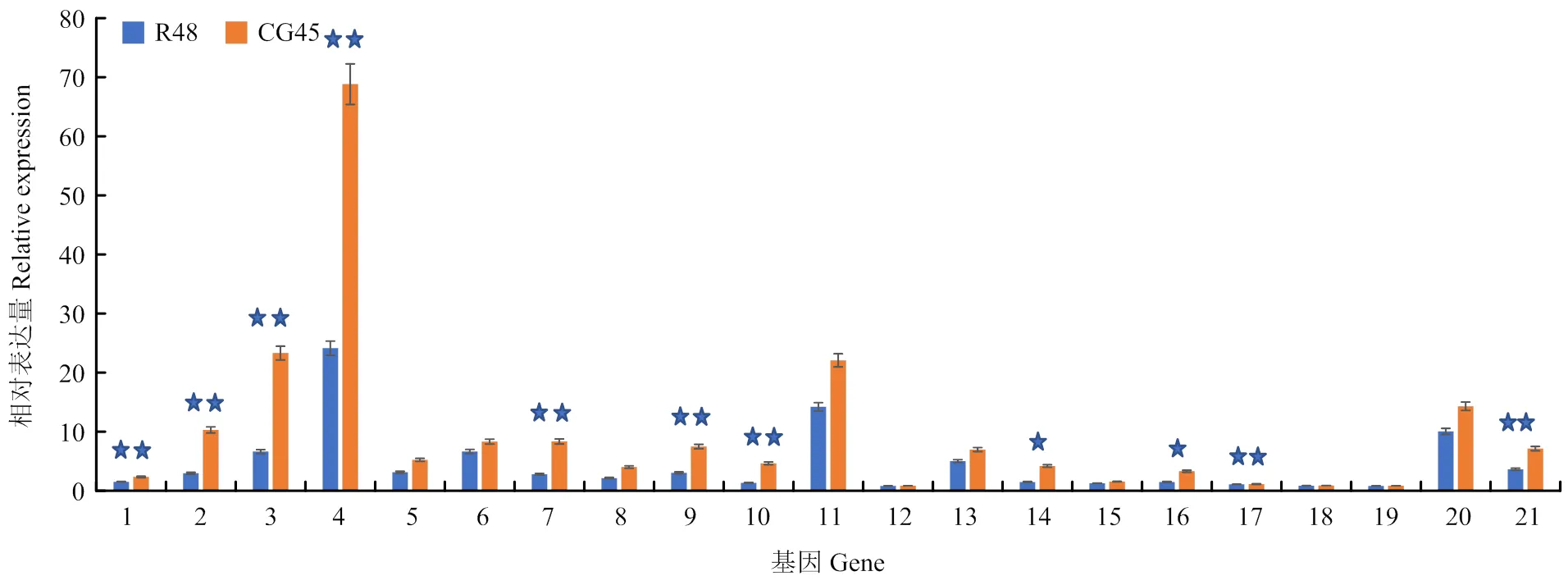
表示差异极显著;表示差异显著 indicate extremely significant differences; indicate significant difference
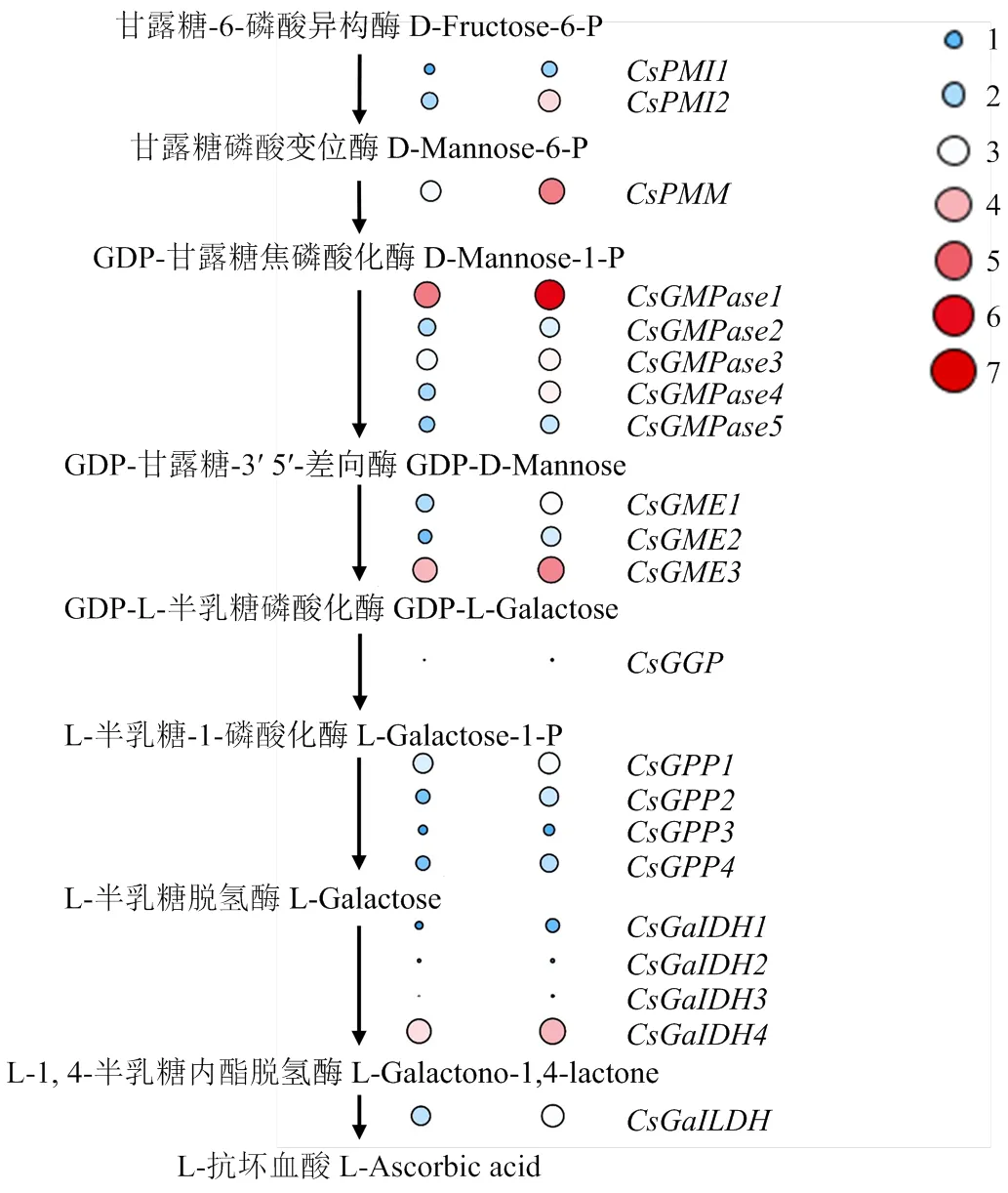
左列圆圈为R48相对表达量,右列圆圈为CG45相对表达量
2.4 黄瓜果实中GME与GGP酶相关基因克隆与序列分析
GME和GGP为Vc合成途径的限速酶,分别扩增R48与CG45中GME和GGP基因序列,GME有3个拷贝,对表达量差异极显著的进行克隆。在两份材料中全长均为3 122 bp,且没有序列差异(附图1)。在两份材料的序列有所不同,在R48中全长为3 537 bp,在CG45中全长为3 541 bp,该基因在两份材料存在多个位点差异(附图2),其中一个突变位点位于CDS区,且导致了氨基酸序列的改变(图4)。黄瓜中仅有一个拷贝,序列长度为3 152 bp,在两份材料中没有序列差异(附图3)。通过鉴定基因保守结构域(NCBI Conserved Domain Search (nih.gov)),发现特定匹配在UGD_SDR_e,属于NADB_Rossmann超级家族,该突变位点也位于此区间(图5)。
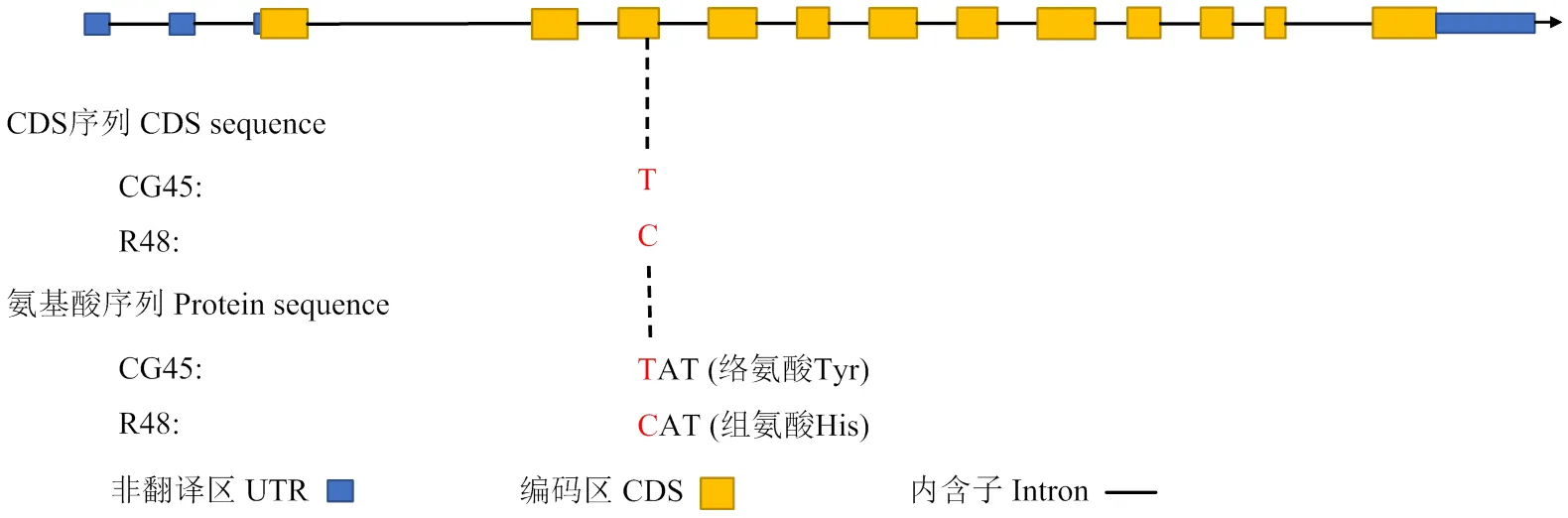
图4 CsGME2在两份材料序列分析

图5 CsGME2保守结构域分析
2.5 黄瓜中GME的理化性质和进化树分析
GME是Vc合成途径中唯一的差向异构酶,包含376个氨基酸,分子量为42.52 kD,等电点为5.94,不稳定系数为41.85,总平均疏水性-0.411。不同物种GME氨基酸长度差异不大,氨基酸长度在376—409 aa,分子量在42.48—46.50 kD,等电点在5.74—6.21,不稳定系数在40左右,稳定性较好,总平均疏水性均为负值,说明GME具有亲水性(表4)。对不同植物来源的GME氨基酸序列进行进化树分析,结果表明黄瓜和同属葫芦科的甜瓜进化过程亲缘关系最近(图6)。
2.6 黄瓜中GGP基本理化特性分析及进化树构建
GGP是L-半乳糖途径的限速酶。含有445个氨基酸,分子量为49.99 kD,等电点为5.18,总平均疏水性为-0.224,不稳定系数为44.23,推测黄瓜中GGP表现为亲水性,且不稳定。由表5可知,不同物种中GGP基因有较大差异,编码的氨基酸长度在443— 537 aa,分子量介于 49.28—60.04 kD,不稳定系数均大于40,且总平均疏水性均为负值。说明在不同物种中,GGP均为亲水性蛋白,且不稳定。对不同植物来源的GGP氨基酸序列进行进化树分析,结果表明黄瓜和同属葫芦科的甜瓜进化关系最近,其次是冬瓜(图7)。
3 讨论
3.1 黄瓜果实L-半乳糖途径Vc合成相关基因鉴定和肌醇途径分析
Vc作为蔬菜和水果的一个重要品质指标,提高蔬菜瓜果中Vc含量是一个重要的研究方向。L-半乳糖途径是目前公认的植物中合成Vc的主要途径,本研究根据拟南芥L-半乳糖途径合成Vc的9个关键酶的氨基酸序列,在黄瓜基因组比对到21个同源基因,发现编码GPP的基因在黄瓜基因组有4个基因拷贝,基因注释均为肌醇单磷酸酶,在水稻基因组中,编码GPP的同源基因也被注释为肌醇单磷酸酶。研究表明,拟南芥中GPP不仅能催化L-半乳糖1-磷酸合成L-半乳糖,而且还具有肌醇单磷酸酶活性,是影响肌醇和Vc合成的双功能酶,在拟南芥中作为肌醇单磷酸酶的活性较低[25]。在黄瓜中比对到的这4个基因是否也具有双功能作用,还有待进一步研究。不过,外施肌醇可以提高黄瓜幼苗的Vc含量[26],外施肌醇后番茄的Vc含量也有所提高[27]。综上,推测肌醇途径可能参与黄瓜中Vc的合成。
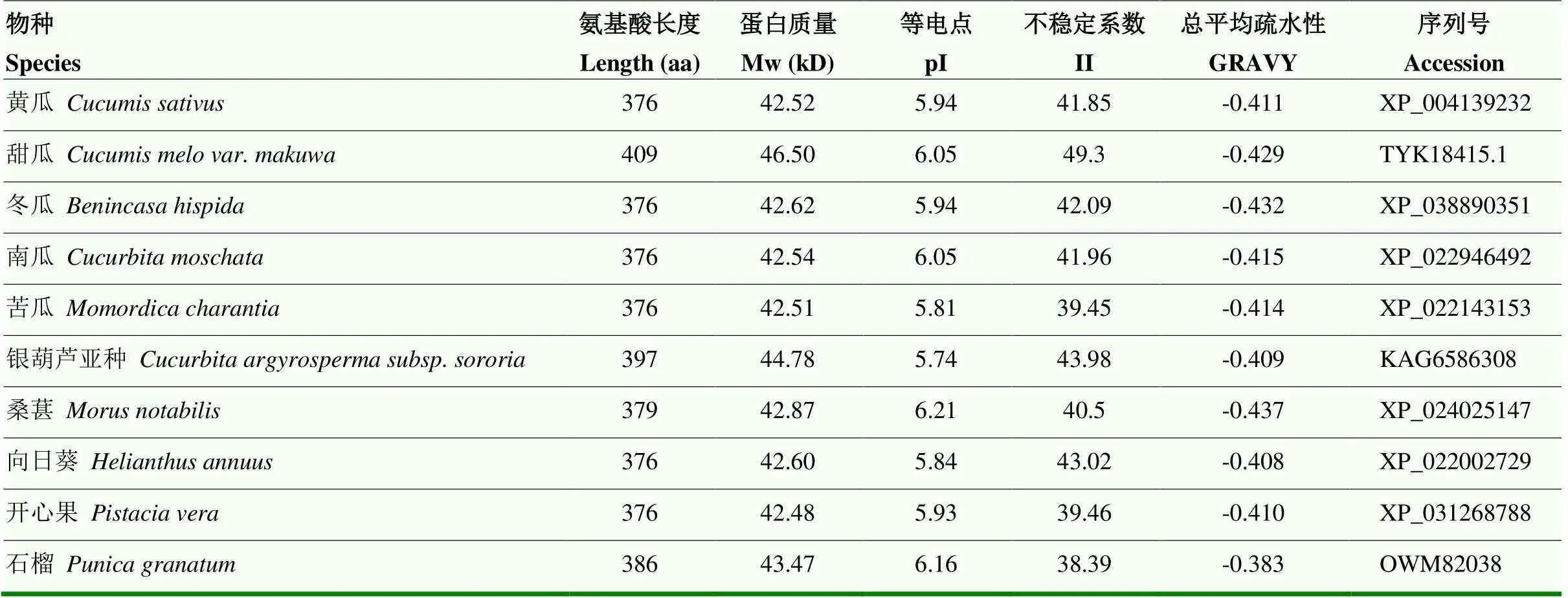
表4 不同物种GME理化性质
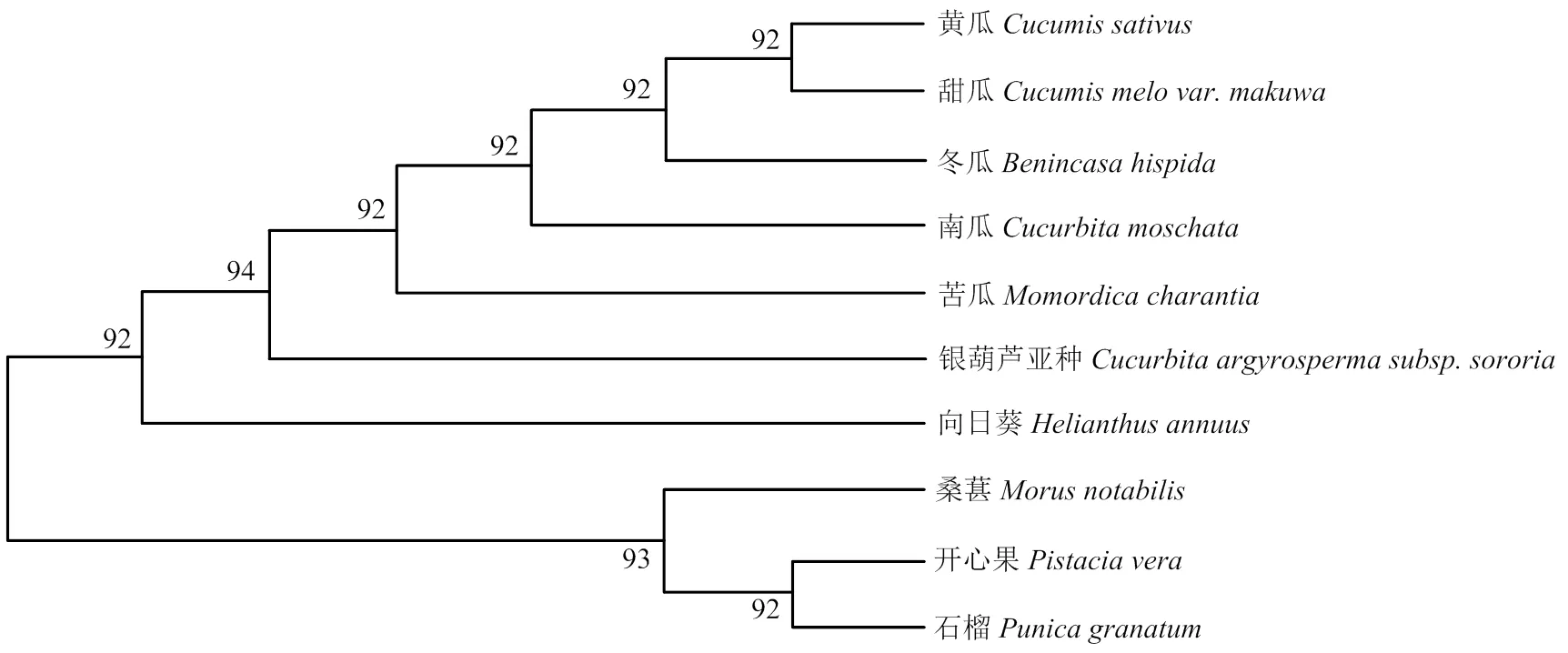
图6 黄瓜和其他物种GME进化树
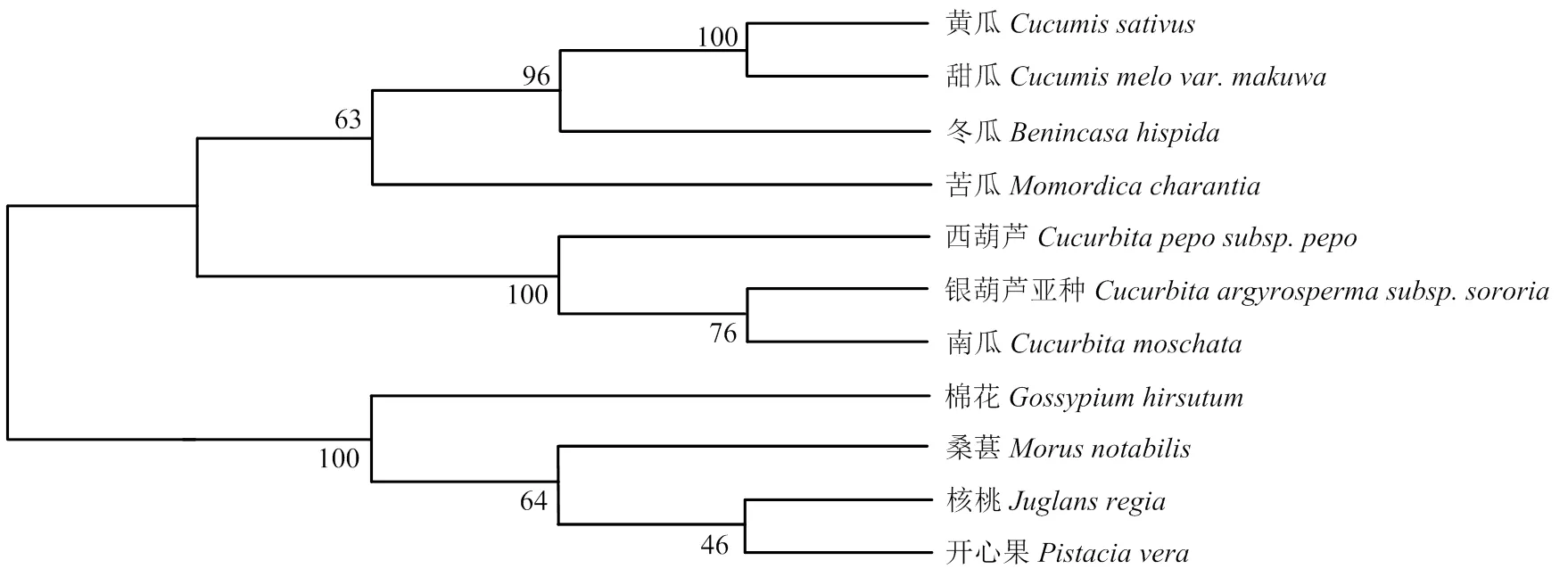
图7 黄瓜和其他物种GGP进化树
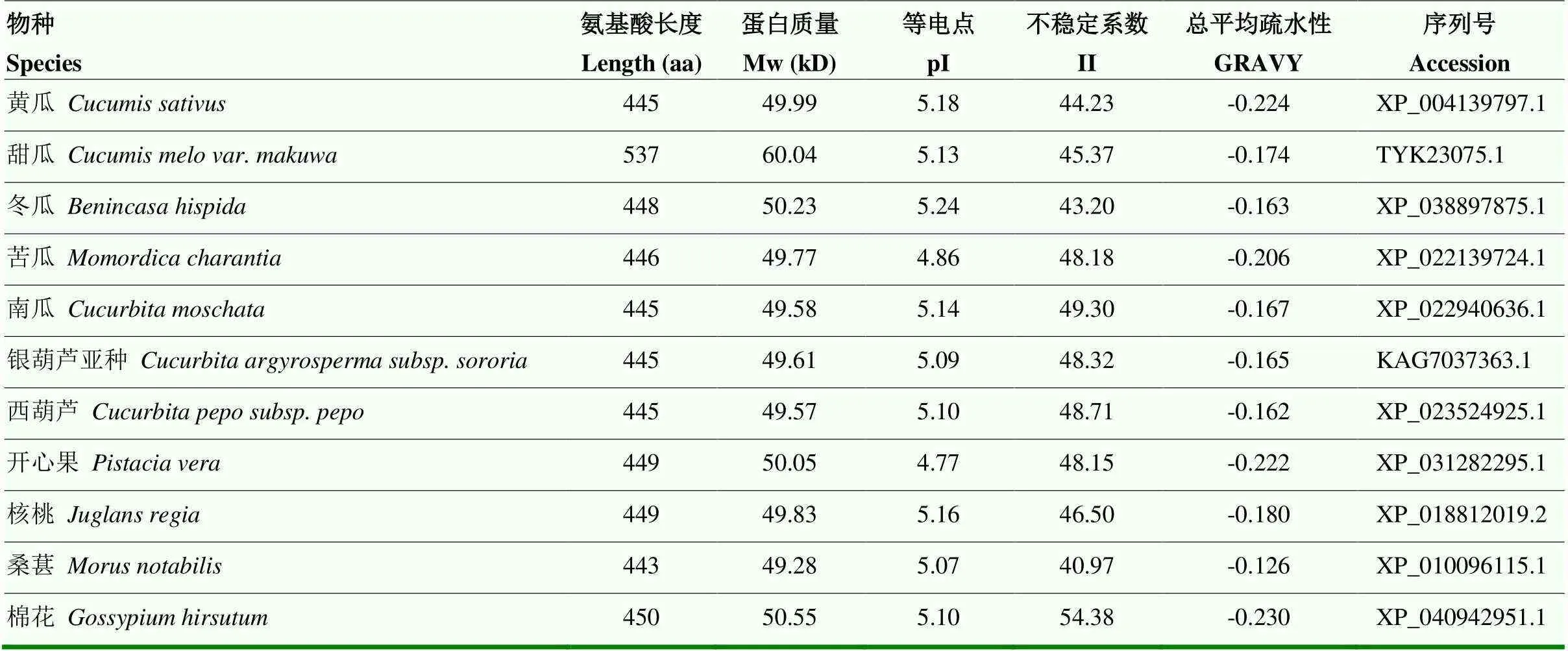
表5 不同物种GGP理化性质
3.2 GME和GGP在黄瓜果实合成Vc中的作用
GME是双功能酶,既能通过3′,5′-表异构化将GDP-D-甘露糖转化为GDP-L-半乳糖-1-磷酸,又能通过5′-表异构化将GDP-D-甘露糖催化为GDP-L-古洛糖-1-磷酸[28]。有研究表明,拟南芥GME和GGP协同调控Vc含量[17],在Vc含量不同的猕猴桃中,GME、GGP的表达量与Vc含量呈正相关[18]。Stevens等[29]利用3个遗传群体对番茄Vc含量进行QTL定位,发现9号染色体上1个QTL位点与GME相关联。本研究对GME的相关基因克隆分析,发现在不同材料间有个SNP差异,导致氨基酸发生改变。Vc合成过程的相关酶中GME是最保守的蛋白[30],本研究通过对黄瓜与其他物种GME的理化性质分析和进化树构建,发现GME在不同物种间氨基酸数量和蛋白质量变化较小,保守度都较高。综上,预测GME酶也可能是黄瓜果实中Vc合成的限速酶。
GGP是L-半乳糖途径最主要的限速酶[16],拟南芥中编码GGP的两个基因和在黄瓜基因组比对到的为同一基因,推测该基因在合成Vc过程中发挥重要作用。GGP是催化抗坏血酸合成的第一步,GGP表达降低和抗坏血酸含量缺乏导致番茄坐果率和产量降低[31]。用猕猴桃或拟南芥GGP基因转化草莓、马铃薯和番茄会导致Vc含量显著增加[32]。本试验对不同材料的表达量分析,发现限速酶GGP的相关基因表达量则极低。Zhang等[33]对6个参与Vc生物合成的拟南芥或油菜关键基因在水稻中的过表达,发现转植株的Vc含量最高,转基因株系的株高、根长、鲜重明显高于对照植株,表明GGP可能是水稻Vc生物合成的关键限速步骤。GGP作为限速酶在多种植物中已被证实受光调控,如拟南芥[26]、猕猴桃[34],在连续高光强下诱导基因表达,暗处理抑制基因表达[35]。因此,黄瓜中编码GGP的基因表达量低是否与光调控相关有待进一步研究。
4 结论
在黄瓜基因组中共鉴定出21个分布在7条染色体上的参与L-半乳糖途径合成Vc的基因,调控PMI、PMM、GMPase、GME、GalLDH这5个酶的相关基因在Vc含量高、低差异显著的两份材料R48和CG45果实中表达量差异显著。调控Vc合成限速步骤关键酶GME、GGP功能相对保守,在两份材料中的序列存在多个SNP和InDel变异,且编码区一个SNP突变位点导致氨基酸序列发生改变。本研究明确了黄瓜果实中L-半乳糖途径合成Vc的基因,分析了关键酶基因的序列差异,为揭示黄瓜果实Vc合成调控网络奠定了基础。
致谢:感谢中蔬生物科技(寿光)有限公司彭立鑫、王利丽对文章相关图的绘制提供的帮助。
[1] FOYER C H, KYNDT T, HANCOCK R D. Vitamin C in plants: Novel concepts, new perspectives, and outstanding issuesAntioxid Redox Signal, 2020, 32(7): 463-485.
[2] ALVES R C, ROSSATTO D R, SILVA J S, CHECCHIO M V, OLIVEIRA K R, OLIVEIRA F D A, DE QUEIROZ S F, DA CRUZ M A P, GRATAO P L. Seed priming with ascorbic acid enhances salt tolerance in micro-tom tomato plants by modifying the antioxidant defense system components. Biocatalysis and Agricultural Biotechnology, 2021, 31: 101927.
[3] KHAZAEI Z, ESTAJI A. Effect of foliar application of ascorbic acid on sweet pepper () plants under drought stressActa Physiologiae Plantarum, 2020, 42(7): 118.
[4] LUKATKIN A S, ANJUM N A. Control of cucumber (L) tolerance to chilling stress - Evaluating the role of ascorbic acid and glutathioneFrontiers in Environmental Science, 2014, 2. https://doi.org/10.3389/fcns.2014.00062.
[5] LYKKESFELDT J. On the effect of vitamin C intake on human health: How to (mis)interprete the clinical evidence.Redox Biology, 2020, 34: 101532.
[6] RIVELLI A R, CARUSO M C, MARIA S D, GALGANO F. Vitamin C content in leaves and roots of horseradish (): Seasonal variation in fresh tissues and retention as affected by storage conditions. Emirates Journal of Food and Agriculture, 2017, 29(10): 799-806.
[7] 孙小娟, 刘庆帅, 员盎然, 张妍, 霍俊伟, 秦栋, 姜婷. 黑穗醋栗果实生长发育过程中抗坏血酸含量及相关酶活性的变化. 中国农业科学, 2019, 52(1): 98-110. doi: 10.3864/j.issn.0578-1752.2019.01.010.
SUN X J, LIU Q S, YUAN A R, ZHANG Y, HUO J W, QIN D, JIANG T. The changes in the contents of ascorbic acid and the activities of related enzymes in black currant fruits during the process of its growth and development. Scientia Agricultura Sinica, 2019, 52(1): 98-110. doi: 10.3864/j.issn.0578-1752.2019.01.010. (in Chinese)
[8] KINYI H W, TIRWOMWE M, NINSIIMA H I, MIRUKA C O, ADADI P, PARISE A. Effect of cooking method on vitamin C loses and antioxidant activity of indigenous green leafy vegetables consumed in western Uganda. International Journal of Food Science, 2022, 2022: 2088034.
[9] https://www.fao.org/faostat/zh/#data.
[10] SMIRNOFF N, WHEELER G L, JONES M A. The biosynthetic pathway of vitamin C in higher plantsNature, 1998, 393(6683): 365-369.
[11] LORENCE A, CHEVONE B I, MENDES P, NESSLER C L. Myo- inositol oxygenase offers a possible entry point into plant ascorbate biosynthesis. Plant Physiology, 2004, 134(3): 1200-1205. doi: 10. 1104/pp.103.033936.
[12] DAVEY M W, GILOT C, PERSIAU G, STERGAARD J, HAN Y, BAUW G C, VAN MONTAGU M C. Ascorbate biosynthesis incell suspension culturePlant Physiology, 1999, 121(2): 535-543.
[13] WAGNER C, SEFKOW M, KOPKA J. Construction and application of a mass spectral and retention time index database generated from plant GC/EI-TOF-MS metabolite profilesPhytochemistry, 2003, 62(6): 887-900.
[14] SMIRNOFF N, DOWDLE J, ISHIKAWA T. The role of VTC2 in vitamin C biosynthesis inComparative Biochemistry and Physiology. Part A. Molecular & Integrative Physiology, 2007, 146(4): S250.
[15] DOWDLE J, ISHIKAWA T, GATZEK S, ROLINSKI S, SMIRNOFF N. Two genes inencoding GDP-l-galactose phosphorylase are required for ascorbate biosynthesis and seedling viability. Plant Journal, 2007, 52(4): 673-689.
[16] TAO J J, HAO Z, HUANG C H. Molecular evolution of GDP-L- galactose phosphorylase, a key regulatory gene in plant ascorbate biosynthesis. AoB Plants, 2020, 12(6): 55.
[17] YOSHIMURA K, NAKANE T, KUME S, SHIOMI Y, MARUTA T, ISHIKAWA T, SHIGEOKA S. Transient expression analysis revealed the importance ofexpression level in light/dark regulation of ascorbate biosynthesis in. Bioscience, Biotechnology, and Biochemistry, 2014, 78(1): 60-66. doi: 10.1080/09168451.2014. 877831.
[18] BULLEY S M, RASSAM M, HOSER D, OTTO W, SCHÜNEMANN N, WRIGHT M, MACRAE E, GLEAVE A, LAING W. Gene expression studies in kiwifruit and gene over-expression inindicates that GDP-L-galactose guanyltransferase is a major control point of vitamin C biosynthesis. Journal of Experimental Botany, 2009, 60(3): 765-778. doi: 10.1093/jxb/ern327.
[19] 苑志明, 劳杉杉, 秦智伟, 周秀艳. 黄瓜L-半乳糖-1,4-内酯脱氢酶cDNA全长的克隆和遗传转化东北农业大学学报, 2012, 43(7): 100-103.
YUAN Z M, LAO S S, QIN Z W, ZHOU X Y. Cloning and genetic transformation of cDNA full-length of L-galactono-1,4-lactone dehydrogenase from. Journal of Northeast Agricultural University, 2012, 43(7): 100-103. (in Chinese)
[20] LIU P, LI Q, GAO Y N, WANG H, CHAI L, YU H J, JIANG W J. A new perspective on the effect of UV-B on l-ascorbic acid metabolism in cucumber seedlingsJournal of Agricultural and Food Chemistry, 2019, 67(16): 4444-4452.
[21] ZHANG X, YU H J, ZHANG X M, YANG X Y, ZHAO W C, LI Q, JIANG W J. Effect of nitrogen deficiency on ascorbic acid biosynthesis and recycling pathway in cucumber seedlings. Plant Physiology and Biochemistry, 2016, 108(7): 222-230.
[22] BULLEY S, LAING W. The regulation of ascorbate biosynthesis. Current Opinion in Plant Biology, 2016, 33: 15-22.
[23] 高海荣, 赵爱娟, 王睿颖, 穆兵. 紫外法快速测定中原地区12种蔬菜VC含量. 湖北农业科学, 2017, 56(6): 1131-1133, 1136. doi: 10. 14088/j.cnki.issn0439-8114.2017.06.035.
GAO H R, ZHAO A J, WANG R Y, MU B. The rapid determination of vitamin C content in 12 kinds of central plains vegetables by UV spectrophotometry. Hubei Agricultural Sciences, 2017, 56(6): 1131-1133, 1136. doi: 10.14088/j.cnki.issn0439-8114. 2017.06.035. (in Chinese)
[24] JAROSOVA J, KUNDU J K. Validation of reference genes as internal control for studying viral infections in cereals by quantitative real- time RT-PCR. BMC Plant Biology, 2010, 10(1): 146.
[25] TORABINEJAD J, DONAHUE J L, GUNESEKERA B N, ALLEN- DANIELS M J, GILLASPY G E. VTC4 is a bifunctional enzyme that affects myoinositol and ascorbate biosynthesis in plants. Plant Physiology, 2009, 150(2): 951-961. doi: 10.1104/pp.108.135129.
[26] 苗田田, 李强, 余宏军, 刘鹏, 郝佳, 蒋卫杰. 外施肌醇对黄瓜幼苗低温抗性的影响. 中国蔬菜, 2021(2): 72-79. doi: 10.19928/j.cnki. 1000-6346.2021.1001.
MIAO T T, LI Q, YU H J, LIU P, HAO J, JIANG W J. Effects of exogenous myo-inositol on low temperature resistance of cucumber seedlings. China Vegetables, 2021(2): 72-79. doi: 10.19928/j.cnki. 1000-6346.2021.1001. (in Chinese)
[27] MUNIR S, MUMTAZ M A, AHIAKPA J K, LIU G Z, CHEN W F, ZHOU G L, ZHENG W, YE Z B, ZHANG Y Y. Genome-wide analysis of Myo-inositol oxygenase gene family in tomato reveals their involvement in ascorbic acid accumulation. BMC Genomics, 2020, 21(1): 284.
[28] WOLUCKA B A, VAN MONTAGU M. GDP-mannose 3',5'- epimerase forms GDP-L-gulose, a putative intermediate for the de novo biosynthesis of vitamin C in plants. The Journal of Biological Chemistry, 2003, 278(48): 47483-47490.
[29] STEVENS R, BURET M, DUFFÉ P, GARCHERY C, BALDET P, ROTHAN C, CAUSSE M. Candidate genes and quantitative trait loci affecting fruit ascorbic acid content in three tomato populations. Plant Physiology, 2007, 143(4): 1943-1953. doi: 10.1104/pp.106.091413.
[30] WOLUCKA B A, VAN MONTAGU M, The VTC2 cycle and the de novo biosynthesis pathways for vitamin C in plants: An opinion. Phytochemistry, 2007, 68(21): 2602-2613.
[31] ALEGRE M L, STEELHEART C, BALDET P, ROTHAN C, JUST D, OKABE Y, EZURA H, SMIRNOFF N, GERGOFF GROZEFF G E, BARTOLI C G. Deficiency of GDP-l-galactose phosphorylase, an enzyme required for ascorbic acid synthesis, reduces tomato fruit yield. Planta, 2020, 251(2): 54.
[32] BULLEY S, WRIGHT M, ROMMENS C, YAN H, RASSAM M, LIN-WANG K, ANDRE C, BREWSTER D, KARUNAIRETNAM S, ALLAN A C, LAING W A. Enhancing ascorbate in fruits and tubers through over-expression of the l-galactose pathway gene GDP-l- galactose phosphorylase. Plant Biotechnology Journal, 2012, 10(4): 390-397.
[33] ZHANG G Y, LIU R R, ZHANG C Q, TANG K X, SUN M F, YAN G H, LIU Q Q. Manipulation of the rice L-galactose pathway: Evaluation of the effects of transgene overexpression on ascorbate accumulation and abiotic stress tolerance. PLoS ONE, 2015, 10(5): e0125870.
[34] LI J, LIANG D, LI M J, MA F W. Light and abiotic stresses regulate the expression of GDP-L-galactose phosphorylase and levels of ascorbic acid in two kiwifruit genotypes via light-responsive and stress-inducible cis-elements in their promoters. Planta, 2013, 238(3): 535-547.
[35] YABUTA Y, MIEDA T, RAPOLU M, NAKAMURA A, MOTOKI T, MARUTA T, YOSHIMURA K, ISHIKAWA T, SHIGEOKA S. Light regulation of ascorbate biosynthesis is dependent on the photosynthetic electron transport chain but independent of sugars in. Journal of Experimental Botany, 2007, 58(10): 2661-2671. doi: 10. 1093/jxb/erm124.
Cloning and Analysis of Key Genes for Vitamin C Synthesis in Cucumber Fruit
WANG ZhuangZhuang1, 2, DONG ShaoYun1, ZHOU Qi1, MIAO Han1, LIU XiaoPing1, XU KuiPeng2, GU XingFang1, ZHANG ShengPing
1Institute of Vegetable and Flowers, Chinese Academy of Agricultural Sciences/Key Laboratory of Biology and Genetic Improvement of Horticultural Crops, Ministry of Agricultureand Rural Affairs/State Key Laboratory of Vegetable Biobreeding, Beijing 100081;2College of Horticulture, Qingdao Agricultural University, Qingdao 266000, Shandong
【Objective】The aim of this study was to identify the location, quantity and expression characteristics of genes involved in regulating the synthesis of vitamin C (Vc) by L-galactose pathway in cucumber fruits, and to clone the key genes, so as to lay a foundation for the regulation of Vc synthesis in cucumber.【Method】According to the reported Vc-related genes within the L-galactose pathway in, the encoded amino acid sequence was used for BLAST in Cucumber 9930_V2 reference genome database. TBtools software was used to map the gene position on cucumber chromosomes. The expression of these genes in two cucumber accessions with significant differences in fruit Vc content was analyzed by qRT-PCR. The homologous genes encoding rate limiting enzymes GDP-L-galactose phosphorylase (GGP) and GDP mannose-3'5'- epimerase (GME) were cloned by PCR amplification, and the sequence differences of these genes in cucumber with high Vc and low Vc were analyzed by sequencing. Phylogenetic tree was constructed to analyze the relatedness cucumber GME, GGP and homologs in other species.【Result】Twenty one homologous genes involved in the synthesis of Vc related enzymes, including PMI, PMM, GMPase, GME, GGP, GPP, GalLDH, and GalLDH in L-galactose pathway, were compared in cucumber and were obtained by BLAST, which were distributed on seven chromosomes, with the most numbers on chromosome 5 and chromosome 1. By analyzing the expression of these genes in R48 (with low Vc) and CG45 (with high Vc), it was found that the genes regulating PMI, PMM, GMPase, GME and GalLDH were significantly different between the two materials. The sequence analysis of Vc synthesis rate-limiting enzyme GGP and GME related genes showed that the full length ofgene was 3 537 bp in R48 and 3 541 bp in CG45. There were multiple SNP sites and Indel difference between the two materials, among which one mutation site was located in the CDS region, and resulted in the amino acids changes. Through the analysis of the protein properties of rate limiting enzymes GME and GGP regulating vitamin C synthesis, it was found that the protein properties of GME and GGP in different species were not significantly different, which were hydrophilic proteins and their functions were relatively conservative. Evolutionary tree analysis found that the clusters with close genetic relationship among different species were highly conservative during evolution.【Conclusion】Twenty one L-galactose pathway related genes of cucumber Vc synthesis were identified, which were distributed on seven chromosomes. It was speculated that the key enzymes including PMI, PMM, GMPase, GME, GalLDH and GGP might affect the Vc content in cucumber fruits. The functions of key enzymes GME and GGP regulating the rate limiting step of Vc synthesis were relatively conservative. The SNP site ongene in the two materials of high Vc and low Vc resulted in changes in amino acid sequence.
cucumber; vitamin C; gene clone; expression analysis

10.3864/j.issn.0578-1752.2023.03.009
2022-04-13;
2022-06-13
国家现代农业产业技术体系(CARS-23)、中国农业科学院创新工程(CAAS-ASTIP-2017-IVF)、农业农村部园艺作物生物学与种质创制重点实验室项目、蔬菜生物育种全国重点实验室项目
王壮壮,E-mail:wangzhuangz2021@163.com。董邵云,E-mail:dongshaoyun@caas.cn。王壮壮和董邵云为同等贡献作者。通信作者顾兴芳,E-mail:guxingfang@caas.cn。通信作者张圣平,E-mail:zhangshengping@caas.cn
(责任编辑 赵伶俐)
