不同草氨酸钠添加量对瘤胃体外发酵参数、乳酸产量和细菌数量的影响
2023-03-06胡光辉宗玉洁霍永久
■蒋 慧 林 淼 胡光辉 宗玉洁 霍永久
(扬州大学动物科学与技术学院,江苏扬州 225009)
为了达到奶牛高产奶量的生产目的,日粮多配合为精料比例高于60%的高淀粉低纤维日粮,这种模式带来了瘤胃酸中毒(ruminal acidosis,RA)的风险[1]。瘤胃急性酸中毒(acute ruminal acidosis,ARA)是由于瘤胃中大量碳水化合物快速降解产生有机酸过高积累[2],当瘤胃pH降到4.5以下时,大量瘤胃细菌死亡,而牛链球菌(Streptococcus bovis)耐受高酸度,继续产生更多的乳酸,导致瘤胃急性酸中毒的发生[3]。相反,瘤胃pH 未降至5 以下,而是低于5.6,并持续超过3 h/d,就会发生瘤胃亚急性酸中毒(sub- acute ruminal acidosis,SARA)[4]。据报道,欧美国家奶牛SARA患病率为11%~26%,每年造成的直接经济损失高达上亿美元。我国由于优质粗饲料资源匮乏,优质燕麦草需要大量进口,导致部分牧场饲喂劣质粗饲料,而SARA 带来了瘤胃内环境失衡,采食量下降,饲料转化率下降,并降低了乳品质和繁殖性能,甚至继发乳房炎、蹄叶炎、肝脓肿等疾病,给我国牛奶业造成巨大的经济损失。解决瘤胃酸中毒问题对保障奶牛健康、保证我国畜牧产业健康高效发展至关重要。
乳酸积累导致瘤胃酸中毒在国际上被广泛认可[5]。乳酸的产生会导致挥发性脂肪酸(VFA)积累以及瘤胃壁病变的发生[6]。乳酸(CH3CHOHCOOH)有两种旋光活性异构体,三种存在形式,即L-乳酸、D-乳酸和外消旋混合物(DL-乳酸)[7]。乳酸的电离常数(pKa)为3.9,低于VFA(4.8),因此乳酸对于降低瘤胃pH的贡献高于VFA。除此之外瘤胃中的乳酸还能够促进VFA的吸收[8],因此当瘤胃发生酸中毒时,乳酸的积累为主要原因。在无氧呼吸链最后一步乳酸脱氢酶(LDH)可将丙酮酸转化为乳酸。草氨酸钠(Oxamate sodium,OS)分子式为C2H2NNaO3,相对分子质量为111.03 u,溶解度为10 mg/mL,是LDH 抑制剂。草氨酸钠多被用于治疗癌症,LDH 被认为是癌症治疗的最有希望的靶点,因为其抑制作用是几乎可以完全阻断糖酵解,提供强大的细胞抑制作用[9]。草氨酸钠是否能抑制瘤胃乳酸产生菌的产乳酸过程,降低乳酸积累,目前尚未明确。因此,本试验拟探讨添加草氨酸钠对乳酸产量的影响,并摸索不影响瘤胃发酵的适宜添加量,以期为减少瘤胃乳酸的产生、降低瘤胃酸中毒的发生风险提供参考。
1 材料及方法
1.1 试验材料
液体培养基的配制:液体培养基选用在Menke人工唾液[10]中加乳酸菌培养基(MRS)固体粉末,比例为每升(L)人工唾液中加MRS(购自青岛海博生物技术有限公司)60 g。将配制好的液体培养基按照每管8 mL 的体积添加入厌氧发酵管中,用1 mol/L 的HCl和NaOH 调培养液pH 至6.8,加塞压盖,抽气2 min,通CO210 s,重复操作3个循环,121 ℃灭菌20 min后4 ℃冰箱保存备用。
MRS主要成分是蛋白胨10.0 g/L、牛肉浸粉8.0 g/L、酵母浸粉4.0 g/L、葡萄糖20.0 g/L、磷酸氢二钾2.0 g/L、柠檬酸氢二铵2.0 g/L、乙酸钠5.0 g/L、硫酸镁0.2 g/L、硫酸锰0.04 g/L、吐温-80 1.0 g/L。Menke人工唾液主要由蒸馏水、A液、B液、C液组成,比例为水∶B液∶C液=2∶1∶1,A液按0.1 mL/800 mL 添加。A液(L):二水氯化钙13.2 g、四水氯化锰10.0 g、六水氯化钴1.0 g、六水三氯化铁8.0 g;B液(L):碳酸氢铵4.0 g、碳酸氢钠35.0 g;C 液(L):磷酸氢二钠5.7 g、磷酸二氢钾6.2 g、七水硫酸镁0.6 g。
草氨酸钠溶液的配制:草氨酸钠购自北京索莱宝科技有限公司。分别取0、0.02、0.05、0.10 g 和0.15 g草氨酸钠加入到10 mL 三蒸水中,涡旋混匀,制得不同浓度梯度的草氨酸钠溶液,4 ℃冰箱中保存备用。
气体收集瓶的准备:准备54个西林瓶,真空泵抽气2 min,向其中通N210 s,重复操作3 个循环,替换其中的空气,最后抽真空,备用。
瘤胃液的采集:1.5 L保温瓶中通CO22 min,迅速采集3 头瘘管牛瘤胃液,经4 层纱布过滤混合后加入保温瓶中,立即带回实验室,置于39 ℃恒温培养箱中,备用。
1.2 体外培养方法
采用单因素试验设计,设置5 组,每组3 个平行。将预先准备好的(以MRS和Menke人工唾液按比例混合的液体培养基为发酵底物)厌氧培养管15支从4 ℃冰箱中取出,分别加入不同浓度草氨酸钠1 mL,最终浓度分别为0(对照组)、2、5、10 mmol/L和15 mmol/L。预热至39 ℃后,迅速用1 mL注射器加入新鲜瘤胃液0.3 mL,置于39 ℃培养箱中培养至72 h。
1.3 样品采集与指标测定
1.3.1 常规发酵指标
分别发酵2、4、6、12、24、48 h和72 h,测量厌氧发酵管中气体压强(DPG1000B15PSIG-5, CeComp Electronics Inc.)。
产气量测定:参考Osmond 等[11]的产气量计算公式计算产气量:
式中:Vχ——39 ℃时产气量(mL);
Vj——产气瓶顶部空间体积(mL);
Ppsi——气体测量系统自动记录的压力(psi)。
气体成分测定:分别在发酵24、48 h和72 h收集培养管气体5 mL,加入到准备好的真空西林瓶中,利用气相色谱仪测定CH4、H2、CO2的含量。气相色谱仪型号为AgilentJ&WGCcolumns DB-FFAP[length(m):30;Diam(mm):0~320;Film(μm):0~25],柱温80 ℃;TCD检测器温度110 ℃;桥流50 mA,载气为氩气。
VFA含量测定:培养72 h时,迅速取出培养管,置于冰水中终止发酵,打开厌氧发酵管,立即测量pH(雷磁PHS-25)。发酵液一部分用于化学指标测定,另一部分用于提取总菌DNA。取发酵液于50 mL离心管中,12 000 r/min离心10 min,取上清液,4 ℃冰箱保存,用来测VFA、氨态氮、乳酸。取上清液1 mL,加0.2 mL 20%含60 mmol/L巴豆酸的偏磷酸,混匀后在-20 ℃冰箱中过夜,解冻后12 000 r/min离心10 min(4 ℃),取上清液过0.22 μm 水相滤膜,取1 μL 用气相色谱分析。VFA混标(含乙酸55.95 mmol/L、丙酸16.03 mmol/L、异丁酸4.31 mmol/L、丁酸8.72 mmol/L、异戊酸3.65 mmol/L、戊酸3.68 mmol/L)处理同样品。
氨态氮含量测定:参考冯宗慈等[12]的方法。
乳酸含量测定:取发酵72 h后上清液1 mL,采用乳酸(LD)测试盒(南京建成生物工程研究所有限公司)测定上清液中乳酸浓度。
1.3.2 细菌荧光定量
培养液细菌DNA 的提取:取发酵液1 mL,12 000 r/min 离心10 min(4 ℃),吸尽上清液,保留沉淀,用天根生化科技(北京)有限公司生产的粪便基因组DNA 提取试剂盒(DP328)提取沉淀中的细菌DNA,以获得的DNA 为模板,与PCR 反应液[Super Real 彩色荧光定量预混试剂,天根生化科技(北京)有限公司]混合后使用罗氏lightcycler®96 和序列检测软件进行荧光定量PCR 分析,建立20 μL 反应体系,反应体系组成见表1,冰上配制反应体系。相对定量PCR 反应步骤为:95 ℃预变性900 s;95 ℃变性10 s,60 ℃退火/延伸20~32 s,72 ℃延伸10 s,并采集荧光信号,共40 个循环。以瘤胃液总菌(general bacteria)DNA 作为内参基因,矫正试验组基因,通过相对定量求得目标菌基因表达量是瘤胃液总菌基本表达量的倍数。

表1 相对定量PCR扩增体系
Primer 5.0设计埃氏巨型球菌、牛链球菌、反刍兽新月单胞菌16S rRNA 扩增引物(见表2)。引物由金唯智生物科技有限公司合成。

表2 RT-qPCR引物序列
1.4 数据分析
试验数据用SPSS 21.0 进行单因素方差分析,用Duncan’s法进行多重比较,P<0.05表示差异显著。
2 结果与分析
2.1 产气量
产气量变化情况见表3。由表3可知,各组产气量随时间增加逐渐上升。与对照组相比,添加2 mmol/L和5 mmol/L草氨酸钠对产气量无显著影响(P>0.05),但添加10 mmol/L 和15 mmol/L 草氨酸钠显著降低了48 h和72 h产气量。

表3 不同草氨酸钠添加量对产气量的影响(mL)
2.2 气体成分
发酵气体成分以百分比表示,气体成分含量见表4。添加不同浓度草氨酸钠的24 h 氢气、甲烷、二氧化碳比例无显著差异(P>0.05);添加草氨酸钠量为15 mmol/L 时的48 h 氢气比例显著降低(P<0.05),甲烷和二氧化碳比例未发生显著变化,且72 h时氢气和二氧化碳比例显著降低(P<0.05),甲烷含量未发生显著变化。
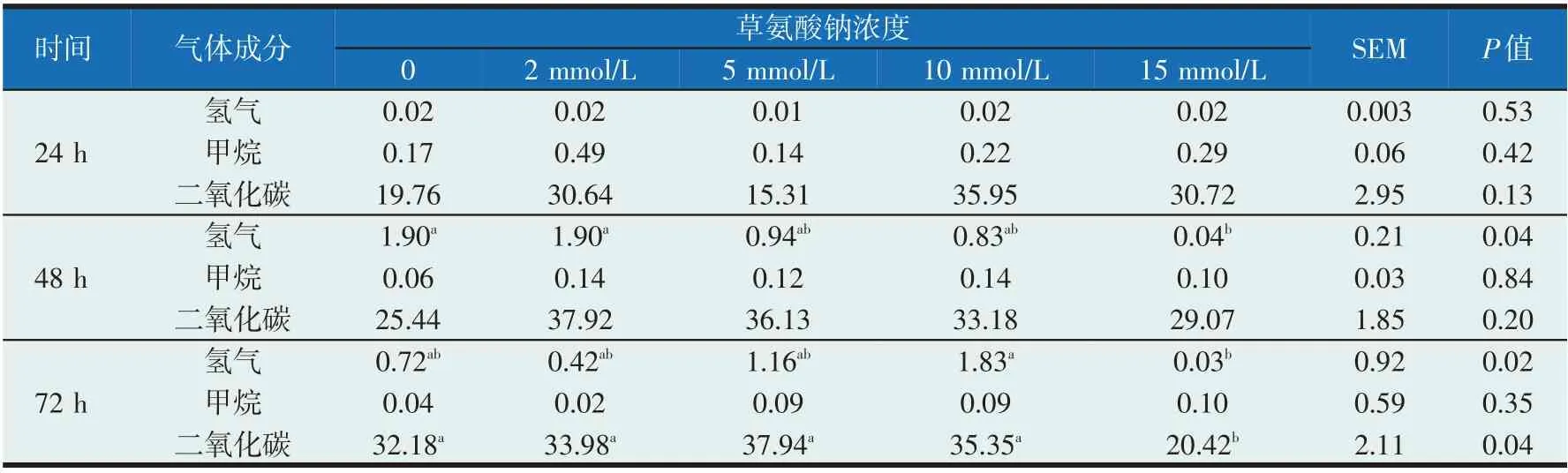
表4 不同草氨酸钠添加量对气体成分的影响(%)
2.3 不同浓度草氨酸钠对pH、VFA、氨态氮、乳酸含量以及瘤胃细菌相对丰度的影响
不同浓度草氨酸钠对体外发酵72 h 的发酵参数影响见表5。由表5可知,添加2、5、10 mmol/L草氨酸钠,对pH、VFA、氨态氮含量无显著影响。但当草氨酸钠添加量为15 mmol/L时,培养液pH和氨态氮含量显著降低(P<0.05),乙酸含量显著增加(P=0.02),丙酸、丁酸含量显著降低(P<0.05),异丁酸、异戊酸含量未发生显著变化(P>0.05)。在草氨酸钠添加量为10 mmol/L和15 mmol/L 时,均显著降低乳酸含量(P<0.05)。添加草氨酸钠对牛链球菌和反刍兽新月单胞菌的相对丰度没有显著影响,但当草氨酸钠添加量≥10 mmol/L时,显著降低了埃氏巨型球菌相对丰度(P<0.05)。

表5 不同草氨酸钠添加量对瘤胃发酵参数、乳酸含量及瘤胃细菌相对丰度的影响
3 讨论
3.1 草氨酸钠对瘤胃发酵产气和VFA产量的影响
产气量和气体成分能够反映瘤胃内细菌的真实生长状况,是评价瘤胃健康状态的重要指标[13],总产气量越大说明饲料可发酵碳水化合物含量越高,微生物活性越强,反之,总产气量越小说明饲料可发酵碳水化合物含量越低,微生物活性越弱。本试验体外发酵48 h 及72 h,添加10 mmol/L、15 mmol/L 草氨酸钠显著减少了气体的产生,说明高浓度草氨酸钠抑制了瘤胃发酵,可能降低了瘤胃微生物活性。而本试验24 h 产气量未受到影响的原因可能是草氨酸钠对乳酸脱氢酶的抑制作用可能存在时间依赖关系,需要进一步研究论证。何大伟等[14]研究认为草氨酸钠对胆管癌细胞株Hucct-1 的半数抑制浓度为50 mmol/L,Cassim 等[15]添加100 mmol/L 草氨酸钠后显著抑制乳酸脱氢酶及糖酵解基因的表达。
VFA是瘤胃降解碳水化合物的最终产物,包括乙酸、丙酸、丁酸、戊酸、异丁酸、异戊酸,乙酸比例最高,其次为丙酸和丁酸[16]。VFA是反刍动物主要的能量来源,乙酸和丙酸分别是脂肪和葡萄糖的主要前体[17]。乙酸是合成乳脂的重要前体物质[18],乙酸被瘤胃壁吸收后,大部分被运送到外周组织用于三羧酸循环氧化供能或者用于脂肪酸合成;丙酸是反刍动物肝脏糖异生产生葡萄糖的主要物质;丁酸在被瘤胃、网胃壁吸收后主要转化为β-羟丁酸,为机体组织,尤其是肌肉组织提供能量[19]。在本试验中添加草氨酸钠浓度达到15 mmol/L 时,乙酸含量大约增加至其他各组的1.5 倍,而丙酸、丁酸和戊酸都有所下降。瘤胃中LDH受到抑制后,葡萄糖无氧分解第一阶段产生的丙酮酸在丙酮酸脱氢酶的作用下生成乙酰辅酶A,乙酰辅酶A在磷酸转乙酰基酶的作用下转变为乙酰磷酸,乙酰磷酸在乙羧基酶的作用下转变为乙酸[20]。丙酮酸也可通过延琥珀酸途径最终生成丙酸,由此可见丙酮酸是重要的有机化学中间体[21]。在奶牛瘤胃中,氢气和二氧化碳是甲烷产生的前体物质[22-23],当添加草氨酸钠浓度为15 mmol/L,发酵72 h 时二氧化碳和氢气含量显著减少,但甲烷含量未发生显著变化,可能原因是瘤胃产甲烷菌未受到草氨酸钠的抑制,减少的二氧化碳和氢气部分被用于产生甲烷[24]。当瘤胃产乳酸途径被抑制时,丙酮酸主要用于合成乙酸。此外瘤胃中乙酸产生菌也常利用二氧化碳和氢气合成乙酸[25],这可能是瘤胃中氢气和二氧化碳减少而乙酸含量增加的原因之一。
3.2 草氨酸钠对氨态氮含量的影响
发酵底物被瘤胃微生物降解以后,一部分游离于细菌细胞外,一部分被细菌利用以合成微生物蛋白,瘤胃中的氨态氮含量反映着瘤胃内含氮物的发酵情况[26],除了主要的纤维素降解细菌之外,大部分瘤胃细菌都有部分蛋白降解功能[27]。当添加草氨酸钠浓度在10 mmol/L以下时,对氨态氮含量没有显著影响,当草氨酸钠添加达到15 mmol/L 时,氨态氮含量显著下降,可能原因是添加高浓度的草氨酸钠抑制了瘤胃菌对蛋白质的降解能力,导致氨态氮的合成减少[28]。也有可能是瘤胃内微生物利用氨态氮合成生物蛋白的能力增强,导致培养液中氨态氮含量减少[29]。
3.3 草氨酸钠对pH、乳酸含量及相关乳酸菌的影响
正常情况下,瘤胃乳酸的代谢途径主要有琥珀酸、丙烯酸、乙酸和丁酸途径。在琥珀酸途径中,乳酸在乳酸脱氢酶的作用下生成丙酮酸,丙酮酸沿苹果酸、琥珀酸途径,最终生成丙酸。在丙烯酸途径中,L 型乳酸通过丙酰辅酶A 转移酶转化为乳酰辅酶A,随后脱水生成丙烯酰辅酶A,最终丙烯酰辅酶A加氢还原成丙酸。在乙酸和丁酸途径中,乳酸经丙酮酸生成乙酰辅酶A,乙酰辅酶A分别在磷酸乙酰转移酶、丁酰辅酶A脱氢酶作用下分别生成乙酸和丁酸[30]。本试验中添加草氨酸钠浓度在10 mmol/L时显著降低乳酸含量,但不影响pH。但草氨酸钠浓度达到15 mmol/L时,pH 显著下降,虽然与VFA 相比乳酸pKa 较低,但乳酸含量减少导致的pH升高不足以抵消乙酸含量大量增加而导致的pH降低,从而使培养液pH降低。过去的数十年间,人们一直在肿瘤的能量代谢中寻找癌症的“阿喀琉斯之踵”(Achilles’heel of caner)[31],很多具有抑制肿瘤能量代谢关键酶的小分子药物已被用于临床研究[32],其中草氨酸钠是肿瘤细胞糖酵解过程的关键合成限速酶之一。在肿瘤细胞研究中,人们发现LDH-A表达与正常细胞相比是升高的[33],Zhao等[34]发现LDH-A 的上调可以促进癌细胞的糖酵解过程。LDH 是由两个亚基组成的四聚体,包括LDH-A 和LDH-B[35],其催化丙酮酸转化为乳酸,同时将烟酰胺腺嘌呤二核苷酸(NADH,还原性辅酶Ⅰ)转化为NAD+,反应方向由LDH 中的LDH-A 和LDH-B 的比例调节,LDH-A 将丙酮酸还原为乳酸,同时将NADH被氧化为NAD+[36]。草氨酸钠是丙酮酸的电子等排体,可以与丙酮酸竞争LDH,当草氨酸钠与LDHNADH 复合物结合时,LDH 活性位点关闭,活性被抑制[37],侯若冰等[38]研究认为,草氨酸钠对LDH 的抑制机理为:①草氨酸钠与丙酮酸的稳定构象态在结构上极为相似,导致酶不能有效识别底物;②草氨酸钠各原子所带净电荷的优势使其更易与酶活性中心结合;③草氨酸钠通过对LDH的诱导契合作用使LDH活性中心的空间变小。
奶牛瘤胃中常见的产乳酸菌包括牛链球菌(Streptococcus bovis)、溶纤维丁酸弧菌(Butyrivibrio fibrisolvens)、乳酸杆菌(Lactic acid bacteria);奶牛瘤胃中常见的乳酸利用菌包括埃氏巨型球菌(Megasphaera elsdenii)、反刍兽新月单胞菌(Selenomonus ruminantium)等[36]。牛链球菌是奶牛瘤胃中的主要乳酸产生菌,当瘤胃发酵速率较慢时,牛链球菌主要产生乙酸盐、甲酸盐和乙醇[39],果糖1,6-二磷酸(FDP)作为LDH 的变构激活剂,依赖于发酵速率,当发酵速率较快时,FDP较多,导致LDH的激活,催化乳酸的产生[40],因此添加草氨酸钠抑制LDH 酶活性,即使在高精料条件下发酵速率较快,也可以抑制乳酸的产生。在本试验中对埃氏巨型球菌、牛链球菌、反刍兽新月单胞菌qPCR 结果表明,添加草氨酸钠浓度达到10 mmol/L 时显著降低埃氏巨型球菌相对丰度,反刍兽新月单胞菌相对丰度也有所下降但差异不显著,牛链球菌相对丰度未发生明显变化。产生上述现象的原因可能是乳酸产量下降,导致乳酸利用菌底物减少,导致乳酸利用菌相对丰度下降。
4 结论
草氨酸钠可以抑制瘤胃乳酸的积累,但15 mmol/L草氨酸钠提高了乙酸产量,降低了pH。因此,在本试验条件下草氨酸钠抑制瘤胃乳酸积累的适宜添加量为10 mmol/L。
