乙醚-乙醇联合4%中性缓冲甲醛固定法对细胞蜡块免疫组化染色的效果
2023-03-04王伟力
王伟力
胸腹腔积液是临床常见的病症,发病机制较为复杂,由炎症、肿瘤等多种因素导致[1]。胸腹腔积液检查对判定良、恶性疾病的诊断及治疗具有重要的意义[2-3]。脱落细胞学检查是病理诊断常规方法之一,常规的细胞学涂片存在细胞数量少、细胞结构损坏和细胞涂片厚薄不均等缺陷,导致抗原丢失,细胞学诊断的阳性率较低,易发生漏诊[4-6];并且,细胞涂片上肿瘤细胞数量有限,诊断医师较难判断肿瘤细胞的来源,也无法进行免疫组化或基因检测等后续检测[7]。有研究报道将这些脱落细胞学检查标本制作成细胞蜡块,可明显提高细胞病理诊断的准确性[8]。固定液的选择对整个细胞蜡块最后的阳性检测率、免疫组化的定量和定性有着重要的作用。因此,本研究采用三种固定液对79例肺腺癌胸水脱落细胞蜡块进行对比染色,观察其效果,现报道如下。
1 资料与方法
1.1 一般资料 收集2021年8月至2022年8月湖州师范学院附属第一医院均诊断为肺腺癌的胸水样本79例,分别采用4%中性甲醛固定(实验组1),95%乙醇固定(实验组2),乙醚-乙醇联合4%中性缓冲甲醛固定(实验组3)制作细胞蜡块,以免疫组化Envision法染色。本研究经医院伦理委员会审批通过。
1.2 方法
1.2.1 细胞蜡块固定方法及固定后处理 3组实验均接受细胞沉渣包埋制块,沉渣包埋方法为:采集胸水200 ml,先静置沉淀,倒去上清液,用胶头滴管吸取3管沉淀物质20 ml,实验组3加入乙醚-乙醇40 ml,作为前固定,静置10 min后摇匀离心,离心速度控制为2 000 r/min,时间为10 min,去除上清液,加入40 ml的4%中性缓冲甲醛于沉淀中进行后固定,时间为24 h。实验组1和实验组2均摇匀离心,离心速度控制为2 000 r/min,时间10 min,分别加入40 ml 4%中性甲醛和95%乙醇于沉淀中,固定24 h。均用滤纸包裹沉淀,常规脱水,并经石蜡包埋、切片。
1.2.2 免疫组织化学染色 采用Envision两步法,将切片于65℃烤箱过夜,先后经二甲苯、梯度乙醇脱蜡。使用Tris/EDTApH9.0直接煮沸法抗原修复:将pH9.0 Tris/EDTA浓缩液用蒸馏水按1∶50稀释,配置适量修复液于不锈钢锅中,置于电磁炉上,大功率加热至沸腾。将电磁炉功率调到最小(保温状态),小火煮沸计时20 min,终止加热,室温放置10 min,自来水冲冷取出切片,将切片浸泡于3%过氧化氢水溶液,室温孵育10 min后,于PBS浸泡1~2 min/缸(6缸)。于切片上滴加适量吐温,室温孵育10~15 min。除去血清(不清洗),切片上分别滴加一抗MC、CK7、Ki-67,室温孵育1 h,于PBS浸泡1~2 min/缸(6缸)。除去PBS,切片上滴加二抗,室温下孵育15~25 min;PBS浸泡1~2 min/缸(6缸)。除去PBS,滴加二抗孵育15 min,二氨基联苯胺显色,Harris苏木素复染,酒精脱水,二甲苯透明,全自动封片机封片。
1.3 免疫组化结果判定 Ki-67表达定位于细胞核内,CK7表达定位于细胞质,MC表达定位于细胞膜,阳性染色均为棕黄色。根据染色强度和表达的完整性评判IHC染色质量:阳性表达强且标志物位置准确,非特异性染色淡或无,核质分明,边界清楚,判定为优良;未达到上述任何一项则判定为不合格。
1.4 统计方法 采用SPSS 26.0统计软件进行分析,计量资料以百分率表示,采用2检验。P<0.05表示差异有统计学意义。
2 结果
采用3种固定液固定的胸水蜡块在相同肿瘤中均呈阳性,仅用单纯的95%乙醇、4%中性甲醛固定液固定的细胞蜡块免疫标记染色效果欠佳,标记稍减弱。采用乙醚-乙醇作前固定、4%中性缓冲甲醛作为后固定的细胞蜡块免疫标记染色效果最好,标记清晰,表达率高,MC、CK7、Ki-67在3组中的表达情况差异均有统计学意义(均P<0.05),见表1。Ki-67在实验组3中呈弥漫、深黄到棕褐色核阳性,见图1a,在其他实验组中呈散在分布的核阳性,核呈浅黄到深黄色,部分抗原甚至表达缺失,见图1b、c。CK7和MC表达定位于细胞膜,在实验组3中呈棕褐色浆阳性,见图2a、3a,但在其他实验组部分细胞中呈浅黄色或阴性表达,见图2b、2c、3b、3c。

图1 Ki-67表达情况(Envision法,×100)

图2 CK7表达情况(Envision法,×100)
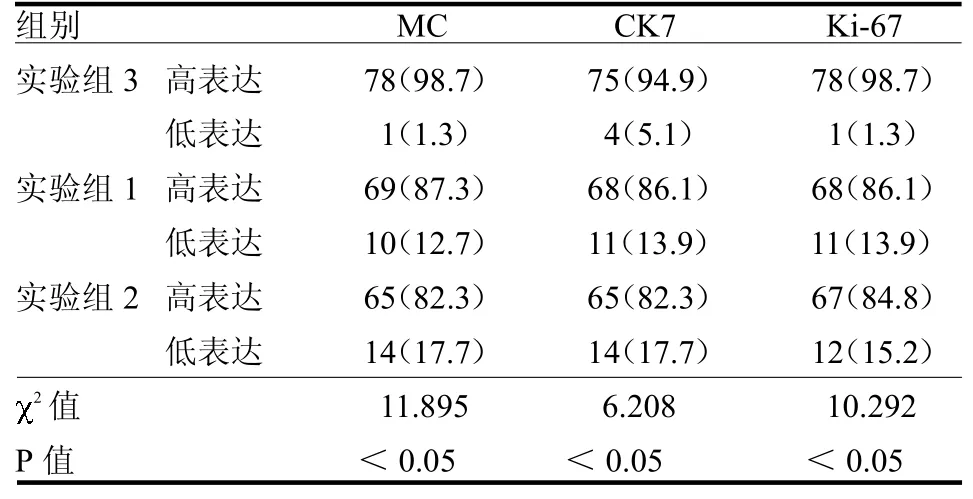
表1 3种抗原标记物在各组中的表达情况(n=79)例(%)
3 讨论
传统细胞学涂片缺陷为细胞离心量少[9],样本需反复多次离心,耗时长,且大量涂片细胞存在厚薄不均的现象,导致细胞结构不清晰、细胞重叠及细胞成团等情况,严重影响病理诊断[10]。细胞蜡块技术的应用较大程度改善了细胞的组织学形态,更好的保存了细胞结构,减少抗原丢失[11]。细胞蜡块利用胸腹水标本制作切片进行免疫组化及基因检测等病理学检查,对于肿瘤晚期无法手术切除的患者进行基因靶向治疗具有较好的参考价值。
固定细胞蜡块是为了固定组织细胞的形态结构,防止其变形或破裂,保存细胞的抗原,提高检测效率[12]。细胞蜡块的固定也是免疫组织化学染色最初的一个关键步骤,可以提高抗原检测的阳性率,弥补组织学上取材的不足,对诊断医生判断细胞的来源、分型及评估患者预后有很大的帮助。细胞蜡块的固定要求细胞核保存好,细胞结构清晰,核质分明,颜色鲜明[13-14]。

图3 MC表达情况(Envision法,×100)
本研究结果显示4%中性甲醛为病理组织良好的固定液,但缺乏脱水能力,导致沉淀物不易凝集,细胞浸于体液中造成细胞肿胀,结构模糊,胞核不清。95%乙醇固定液穿透能力强,凝集较快,但细胞严重收缩,胞浆呈泡沫状,胞核不清,免疫组化标记欠佳。通过乙醚-乙醇的前脱水固定及4%中性缓冲甲醛后固定,细胞结构清晰,核浆分明,免疫组化定位准确,抗原量表达较为完整。前固定中乙醇具有脱水和凝集作用,使细胞核收缩明显;乙醚溶解脂肪从而利于细胞的着色,两者混合同时具有固定和脱水作用。固定液中还含有冰醋酸的成分,如体液中含有大量红细胞,还可对其进行破坏和裂解,防止其造成污染。
综上所述,通过比较3种固定液对细胞蜡块免疫组化染色质量的影响,笔者认为在胸水细胞学的固定过程中,采用乙醚-乙醇作为前固定联合4%中性缓冲甲醛作为后固定的细胞蜡块,可有效保存细胞的良好形态,有效减少抗原丢失,免疫组化染色结果好,为正确高效的病理诊断提供了重要的技术支持。
利益冲突 所有作者声明无利益冲突
