黄芪发酵产物对小鼠急性肺损伤的近红外荧光活体成像研究
2023-03-04刘必旺赵换周文静路荣荣曹越
刘必旺,赵换,周文静,路荣荣,曹越
(1.山西中医药大学傅山学院,山西 榆次 030619; 2.北京中医药大学,北京 100029;3.山西中医药大学附属医院,山西 太原 030024)
急性肺损伤(acute lung injury,ALI)是各种直接和间接致伤因素导致的肺泡上皮细胞及毛细血管内皮细胞损伤,造成弥漫性肺间质及肺泡水肿,造成的急性低氧性呼吸功能不全[1]。依据欧美联席会议的ALI诊断标准,近年来ALI在美国的发病率每年79/10万。据研究,严重感染患者中有25% ~ 50%会发生ALI/ARDS(急性呼吸窘迫综合征)[2]。
黄芪具有补中益气、益卫固表、升阳举陷等功效,其成分或制剂具有改善肺功能、保护肺脏的作用,可以降低脂多糖致急性肺损伤(ALI)模型大鼠呼吸频率、提高PaO2,显著改善ALI导致的ARDS[3-4]。
黄芪发酵产物(HF)是通过酵母菌将黄芪发酵制得。据有关文献报道,通过发酵生物转化技术,可以产生多种酶,使纤维素、半纤维素等构成的细胞壁发生裂解,促进中药有效成分释放,甚至产生新的活性物质,从而可能改善其生物利用度,提高药效[5]。含量检测发现,黄芪发酵产物中黄芪甲苷等化学成分含量增高[6],且黄芪中的许多化学成分有改善肺功能、保护肺脏的功效[7]。
近红外荧光活体小动物成像研究是近年来应用于动物实验探讨炎性的一项新技术。本研究以脂多糖复制ALI小鼠模型,观察HF对ALI模型小鼠TNF-α、IL-1、IL-6及TLR4表达的影响,并采用近红外荧光活体小动物成像技术阐释其保护肺组织免受炎性因子损伤的机制,为其开发利用提供依据。
1 材料与方法
1.1 实验动物
SPF级BALB/c小鼠60只,雌雄各半,4周龄,体质量(20 ± 2)g,由北京维通利华实验动物技术有限公司提供,动物合格证号:SCXK(京)2016-0011。实验单位使用许可证编号:SYXK(晋)2020-0006。饲养于SPF环境。本研究经过山西中医药大学实验动物伦理委员会批准,符合实验动物伦理委员会指导原则。
1.2 药品
黄芪于2018年8月采自山西省应县南泉乡麻峪村(北纬N39°20'59.80″,东经E113°14'46.46″),经应县乾宝黄芪种植专业合作社专家刘仲秀鉴定为豆科植物蒙古黄芪[Astragalus memeranaceus(Fisch) Bge. var.mongholicus (Bge.) Hsiao]的根,3~4年半野生药材。分别用干净的实验刷子刷掉表面泥土至洁净,置50~60 ℃真空干燥箱中干燥120 min,取出,粉碎后过4号筛,备用。舒普深(头孢哌通舒巴坦钠,美国辉瑞制药有限公司,批号:cr5630)。
1.3 试剂
水合氯醛(天津市科密欧化学试剂有限公司,批号:20191010,使用生盐水溶液配制为浓度10%,于常温保存);RDye®800CW 2-DG Optical Probe(C60728-01)(美国LI-COR公司,批号:C60728-01);脂多糖(美国Sigma公司,批号:L2630,使用前量取5 mg脂多糖溶于100 mL生理盐水中,4 ℃保存);PBS缓冲液(批号:03C30C21)、TNF-α(批号:af7108)、IL-6(批号:20201119)、IL-1(批号:20201208)、TLR4检测试剂盒(批号:20210324)、β-actin检测试剂盒(批号:20210203)(武汉博士德生物工程有限公司);牛血清白蛋白(BSA,批号:A8024,华美生物有限责任公司);BCA蛋白定量试剂盒(批号:CW0016s,美国PIERCE公司)。
1.4 仪器
MGC-350 HP人工气候箱(上海一恒科学仪器有限公司);VORTEX-5漩涡混合器(海门其林贝尔仪器制造有限公司);YC-D209E超声波加湿器(北京亚都环保科技有限公司);Pearl Trilogy近红外荧光小动物活体成像系统(美国LI-COR公司);EL204万分之一电子天平(梅特勒-托利多仪器上海有限公司);BCD-206STPQ海尔冰箱(青岛海尔股份有限公司);Option R7纯水系统(英国ELGA科技有限公司)。
1.5 黄芪发酵产物及其混悬液的制备
取安琪酿酒高活性干酵母150 g、蛋白胨100 g、麦芽糖300 g,加入5 000 mL 35~38 ℃的0.2%糖水活化30 min,然后加入5 000 g黄芪药材粉末与15 000 mL 37 ℃的蒸馏水,充分搅拌均匀。保鲜膜封口放置于提前设定好38 ℃的电热恒温培养箱中,经液体深层发酵7 d[8]。将发酵好的药材放置在电热恒温鼓风干燥箱中3 h(温度设定为120 ℃)烘干,杀菌,研磨,即得黄芪发酵产物(HF)。采用HPLC-ELSA法测定发酵后黄芪甲苷的含量为1.337 mg/g。实验时根据实验所需以纯水配成相应浓度的混悬液。
1.6 分组及给药
实验动物依据随机数字表随机分成空白对照组、模型组、舒普深组、HF低剂量组、HF中剂量组和HF高剂量组,每组10只,并标记。空白对照组不造模,蒸馏水灌胃干预。其余各组造模处理后,根据既往研究结果并结合临床剂量,模型组蒸馏水灌胃,舒普深组按0.3 g/kg剂量灌胃,HF低、中、高剂量组分别按黄芪生药量12.5、25、50 g/kg灌胃干预,连续4周。
1.7 模型复制
根据文献[9-11],在实验第1周和第3周,按标记分10次从模型组、舒普深组、HF低剂量组、HF中剂量组和HF高剂量组取不同标记的小鼠各1只,放入自制的密闭舱中。在做好实验者防护措施的前提下,抽取10 mL的脂多糖溶液进行雾化处理,并将低浓度的脂多糖雾化气体通入密闭舱,30 min后将小鼠从密闭舱中取出,进行下一批小鼠的染毒处理,共10批次完成染毒。
1.8 一般状态观察及体质量检测
每日观察并记录小鼠的饮食情况及精神状态等一般状态。实验前及实验中每周称量并记录小鼠体质量。
1.9 近红外荧光小鼠活体成像观察
将近红外荧光分子探针IRDye®800CW 2-DG冻干粉,放入微量迷你离心机中,离心5 min,用1 mL无菌PBS溶解为浓度0.1 nmol/μL水溶液,避光储存在4 ℃冰箱。末次灌胃1 h后,通过尾静脉注射15 nmol的2-DG探针。探针注入24、48、72、96 h后,以10%水合氯醛,按0.04 mL/10 g体质量腹腔注射麻醉,实验动物不反抗后,放入近红外荧光小动物成像系统中,动态监测荧光探针2-DG在小鼠体内的代谢与分布,所得的图像在同一荧光(800 nm)通道下进行显示,并分析其荧光强度[12-13]。
1.10 ELISA法检测小鼠血清TNF-α、IL-6、IL-1水平
近红外荧光活体成像观察后,3 d内,眼球取血,离心血清,使用TNF-α、IL-6、IL-1的酶联免疫吸附实验试剂盒检测血清中TNF-α、IL-6、IL-1的含量。
1.11 Western blot 检测肺组织TLR4的表达
小鼠取血后,取右肺进行组织蛋白的提取。配置SDS-PAGE分离胶,制备凝胶,上样后接通凝胶电泳仪的电源,进行电泳及转膜。将PVDF膜封入塑料袋中,加入BSA稀释的一抗(β-actin,TLR4)。以TBST洗膜,再将PVDF膜封入塑料袋中,加入BSA稀释的碱性磷酸酶标记的二抗,常温摇动1~1.5 h,以TBST洗膜。将化学发光试剂盒ECL中的两种试剂混合,在暗室中滴加到膜上,将所有条带放入普利莱避光片盒中,压紧盖子进行曝光,KODAK曝光系统进行检测。将每个条带的相对强度通过其对应的β-actin进行归一化处理,然后使用图像分析软件进行半定量分析。
1.12 肺病理学观察
小鼠取血后,取左肺浸入10%中性福尔马林溶液中固定。至少48 h后,经水冲洗固定液,酒精梯度脱水后包埋;3~5 μm切片,60 ℃烤片,采用苏木素-伊红(HE)染色;二甲苯Ⅰ、二甲苯Ⅱ透明后树胶封片,对各实验组的肺脏进行光镜检查。
1.13 统计学方法
采用SPSS 21.0和Origin 7.5软件进行分析,计量资料以均数 ± 标准差(±s)表示,多组间比较采用单因素方差分析(One-Way ANOVA)。P< 0.05为差异具有统计学意义。
2 结果
2.1 各组小鼠不同时间点一般状态和体质量的比较
空白对照组小鼠表现正常,呼吸平稳,摄食饮水正常,皮毛光亮,体质量逐渐增加。模型组小鼠造模后活动减少,呼吸急促,反应灵敏度变差,毛发干燥晦暗。第14、21、28天模型组小鼠体质量显著低于空白对照组,第21、28天的模型组与空白对照组比较,小鼠体质量降低,差异有统计学意义(P< 0.05)。第28天舒普深组、HF中剂量组、HF高剂量组与模型组比较,小鼠体质量增高,差异有统计学意义(P< 0.05)。详见表1。结果表明,黄芪发酵产物可以改善脂多糖造模的小鼠体质量的减轻情况,起到增加体质量的作用。
表1 不同时间点各组小鼠体质量比较( ± s,g)
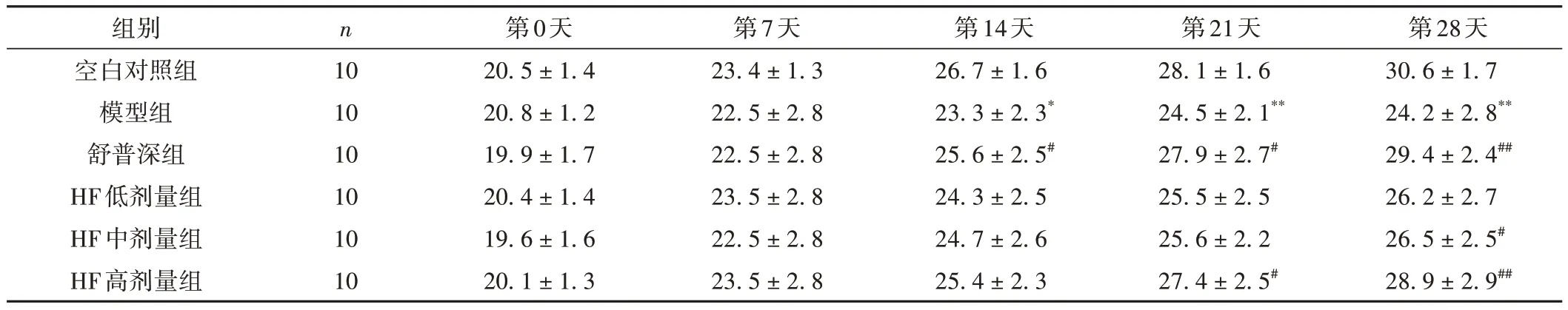
表1 不同时间点各组小鼠体质量比较( ± s,g)
注:与空白对照组比较,*P < 0.05,**P < 0.01;与模型组比较,#P < 0.05,##P < 0.01。
第28天30.6 ± 1.7 24.2 ± 2.8**29.4 ± 2.4##26.2 ± 2.7 26.5 ± 2.5#28.9 ± 2.9##组别空白对照组模型组舒普深组HF低剂量组HF中剂量组HF高剂量组n 10 10 10 10 10 10第0天20.5 ± 1.4 20.8 ± 1.2 19.9 ± 1.7 20.4 ± 1.4 19.6 ± 1.6 20.1 ± 1.3第7天23.4 ± 1.3 22.5 ± 2.8 22.5 ± 2.8 23.5 ± 2.8 22.5 ± 2.8 23.5 ± 2.8第14天26.7 ± 1.6 23.3 ± 2.3*25.6 ± 2.5#24.3 ± 2.5 24.7 ± 2.6 25.4 ± 2.3第21天28.1 ± 1.6 24.5 ± 2.1**27.9 ± 2.7#25.5 ± 2.5 25.6 ± 2.2 27.4 ± 2.5#
2.2 各组小鼠近红外荧光小鼠活体成像的比较
尾静脉注射2-DG荧光探针24 h后,各组可观察到小鼠体内的荧光信号。注射48 h后,2-DG探针对炎症特异性靶向效果良好,达到浓聚高峰,与空白对照组比较,模型组荧光成像非常明显,提示48 h时段可作为观察炎症的最佳成像时段;各组组间比较,模型组小鼠体内的荧光信号最强。注射72 h后,各组荧光信号减弱,说明2-DG探针开始逐渐排出体外。模型组小鼠持续成像96 h,仍可在炎症部位观察到荧光信号。与模型组比较,HF高剂量组小鼠对2-DG探针在不同时刻近红外荧光明显减弱。48 h时段近红外荧光活体成像结果显示,与模型组比较,各给药组荧光信号都减弱。具体见图1、图2。结果表明,黄芪发酵产物可以改善脂多糖小鼠炎性反应,起到抗炎的作用。

图1 小鼠活体成像荧光强度折线图

图2 近红外荧光小鼠活体成像48 h时段观察图
2.3 各组小鼠血清炎性因子水平的比较
与空白对照组比较,模型组小鼠血清中的TNF-α、IL-1、IL-6升高,差异有统计学意义(P< 0.01,P< 0.05)。与模型组比较,HF中剂量组的TNF-α、IL-6的水平降低,差异有统计学意义(P< 0.05);HF高剂量组的TNF-α、IL-1、IL-6的水平降低,差异有统计学意义(P< 0.01,P< 0.05)。见表2。结果表明,黄芪发酵产物在一定程度上能够降低脂多糖诱导的血清炎性因子的水平。
表2 各组小鼠血清促炎细胞因子水平比较( ± s, pg/mL)
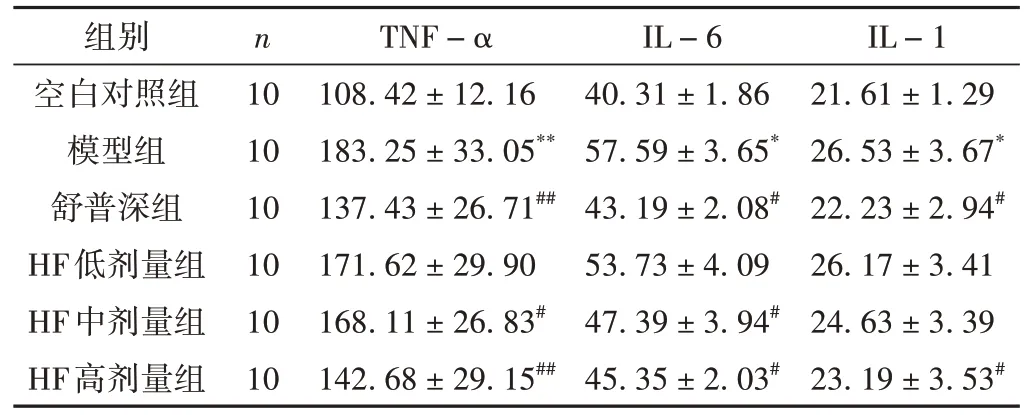
表2 各组小鼠血清促炎细胞因子水平比较( ± s, pg/mL)
注:与空白对照组比较,*P < 0.05,**P < 0.01;与模型组比较,#P <0.05,##P < 0.01。
IL-1 21.61 ± 1.29 26.53 ± 3.67*22.23 ± 2.94#26.17 ± 3.41 24.63 ± 3.39 23.19 ± 3.53#组别空白对照组模型组舒普深组HF低剂量组HF中剂量组HF高剂量组n 10 10 10 10 10 10 TNF-α 108.42 ± 12.16 183.25 ± 33.05**137.43 ± 26.71##171.62 ± 29.90 168.11 ± 26.83#142.68 ± 29.15##IL-6 40.31 ± 1.86 57.59 ± 3.65*43.19 ± 2.08#53.73 ± 4.09 47.39 ± 3.94#45.35 ± 2.03#
2.4 各组小鼠肺病理学的比较
空白对照组小鼠肺组织形态正常,结构清楚,未见明显病变;模型组肺组织上皮细胞不完整、管腔狭窄管壁皱缩、基底膜增厚,肺泡间隔增宽充血,可见大量炎性细胞浸润;HF各剂量组管腔内有渗出物,肺间质增厚且有大量炎性细胞浸润等不同程度病理性改变,其中HF中剂量组炎性细胞浸润及黏液分泌相对较少。见图3。结果表明,黄芪发酵产物能够降低脂多糖小鼠的肺组织损伤程度。

图3 各组小鼠肺组织病理学变化的比较(HE染色,×200)
2.5 各组小鼠对TLR4表达的比较
与空白对照组比较,模型组TLR4蛋白表达水平显著上调,差异有统计学意义(P< 0.01)。与模型组比较,HF高剂量组TLR4表达水平降低,差异有统计学意义(P< 0.05)。见图4。结果表明,黄芪发酵产物能够通过TLR4途径拮抗脂多糖诱发的炎性反应。

图4 各组小鼠对TLR4表达的影响
3 讨论
近年来,近红外荧光成像技术越来越广泛地应用于实验室和临床前研究。该技术一键采集,成像迅速,灵敏度高,具有较强的组织穿透力,更好的信号强度,能够实时、无创地完成在体持续成像监测等工作[12]。荧光探针2-DG是利用GLUT转运蛋白进入细胞的葡萄糖类似物,磷酸化后被有效地捕获在细胞内[13]。许多炎症的特征是代谢率升高,特别是对葡萄糖的摄取增强。2-DG作为葡萄糖的替代物,进入动物机体后,可被炎症组织靶向性摄取,所以可以进行近红外荧光成像系统进行评估分析的研究[14]。本研究结果可见,模型组和各给药组组内比较,48 h时段荧光信号最佳;组间比较,72、96 h时段荧光信号模型组荧光信号最强,各给药组不同程度的荧光信号减弱,说明模型组炎症最重,黄芪发酵产物具有一定的抗炎、保护肺组织的作用。
脂多糖(lipopolysaccharide,LPS)是革兰氏阴性菌细胞壁的主要成分,是引起ALI的主要原因之一,脂多糖诱导法是ALI动物模型的主要方法之一。TLR4是Toll样受体(Toll-like receptors,TLRs)之一,TLR4在肺内多种细胞中均有表达,在肺损伤中起重要作用。有文献报道,黄芪可改善脂多糖所致大鼠ALI,脂多糖通过TLR4系统的信号通路引起ALI[15]。TLR4系统的信号通路主要为TLR4与髓样分化因子(myeloid differentiation factor,MD)形成复合物,激活酪氨酸蛋白激酶(Src),介导NF-κB亚基的核转位,启动TNF-α、IL-6、IL-1等促炎性因子的合成和释放,促进血管内皮细胞黏附分子(intercellular adhesion molecule,ICAM)表达,引发炎症反应。本实验研究了黄芪发酵产物对TLR4、TNF-α、IL-6、IL-1等指标的影响,这些指标都有所改善,说明黄芪发酵产物一定程度上可以抑制脂多糖引起ALI。TLR4系统的信号通路还有其他指标,如Src、NF-κB、ICAM-1及其他促炎性因子等。虽然本实验没有对Src、NF-κB、ICAM-1等进行研究,实验结果仍可以说明黄芪发酵产物可通过TLR4通路拮抗脂多糖炎性反应。见图5。
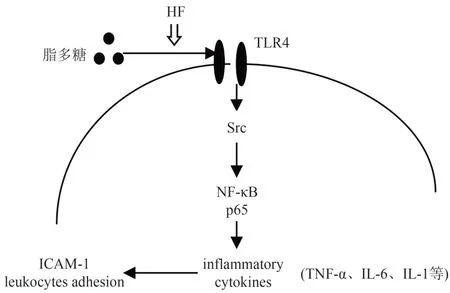
图5 黄芪发酵产物对TLR4通路的影响
黄芪有广泛的生物活性和良好的保健功能,关于黄芪的研究也日益受到国际关注。在美国出版的许多关于植物食品的书籍中,黄芪是位列第一的中药材。中药发酵技术可以将现代生物技术和中医药研究进行完美结合,在中医药研究开发与利用等方面提供了新的思路。中药材的发酵具有2 000多年的历史,但有关黄芪的发酵研究本世纪初才有所报道,目前研究还相对较少。近年来,本研究团队一直致力于黄芪的发酵研究,推动中药发酵技术的发展。中药发酵比一般的物理、化学方法炮制中药更能大幅度地改变药性,为了解中药的功效,开发新药等提供了新的手段。
本实验以黄芪发酵产物为研究对象,建立急性肺损伤(ALI)小鼠模型,通过观察小鼠的一般状态及体质量、ELISA法检测小鼠血清TNF-α、IL-6、IL-1水平,Western blot检测肺组织TLR4的表达情况,及近红外荧光小鼠活体成像观察和肺病理学观察,探讨了黄芪发酵产物对ALI的影响。结果显示,黄芪发酵产物可以改善小鼠体质量的降低的情况,降低脂多糖诱导的血清TNF-α、IL-1、IL-6炎性因子的水平,降低TLR4的表达水平,降低脂多糖小鼠的肺组织损伤程度。综上所述,采用近红外荧光成像系统初步确定黄芪发酵产物对ALI有较好的保护作用,通过TLR4通路,保护肺组织免受炎性因子的损伤,为下一步新药开发及临床应用提供了实验依据。
