聚丙交酯立体寡聚物的合成及微结构分析
2023-03-03孙星宇王霞弟吕小兵
朱 晴, 孙星宇, 王霞弟, 吕小兵
(大连理工大学 精细化工国家重点实验室,辽宁 大连 116024)
随着全球限塑、禁塑法律法规的实施,可生物降解高分子材料作为商品塑料的替代品,越来越多地用于生物医学、食品包装和电子产品等领域。其中,聚丙交酯(聚乳酸)由于良好的生物相容性、原料来源广泛等特点,被认为是最具前途的生物基聚合物材料之一[1-4]。主链立体结构不同的聚丙交酯,具有不同的化学、物理和降解性能。制备聚乳酸的丙交酯单体存在L型、D型和内消旋等异构体。使用不同催化剂、改变丙交酯单体异构体比例,可以得到不同微观结构、不同用途的聚合物[5-6]。因此,精准归属聚合物立体化学信息,对聚合机理理解以及设计高活性和高立构规整性催化体系具有重要意义。
以具有确定分子量和精确立体结构的寡聚物作为模型,是归属聚合物微结构最常见的研究方法之一[7-9]。2013年,本课题组分析了多种聚碳酸苯乙烯酯二聚体的13C NMR信息[10],发现其与先前研究的立构规整聚合物的微结构相匹配[11]。2015年,课题组进一步分析了聚碳酸环戊烯酯二聚体的13C NMR信息,归属δ153.85和 153.78处的核磁信号分别为全同和间同立构序列的羰基碳[12]。采用类似方法,本课题组对聚(碳酸-2,3-丁烯酯)的模型化合物进行了全同和间同序列的微结构归属[13]。最近,本课题组通过分析不同单元数1,4-环己二烯碳酸酯寡聚物的核磁碳谱,发现全同立构序列聚(1,4-环己二烯碳酸酯)的羰基、次甲基和亚甲基区域的碳出峰位置分别在δ154.04、 73.83和29.91处,而间同立构序列出峰位置依次出现在δ153.72、 72.97和28.98处[14]。
2008年,HAWKER课题组利用指数增长合成法,制备了不同单元数的聚丙交酯模型化合物,同时研究了低聚物的热性能和物理性能,并与商用聚丙交酯进行对比,证明了其分子结构和物理性能之间的密切关系[15]。2011年,沈玉梅课题组以聚丙交酯的六聚体为原料,首次制备了羟基封端的分子量可控的聚丙交酯-聚乙二醇化合物[16]。2018年,YOSHIZAWA课题组合成了一系列聚丙交酯寡聚物,发现亲水性聚乳酸寡聚物可以在水中被疏水的多芳香腔捕获[17]。2019年,MEIJER课题组合成了等规聚乳酸寡聚物与低聚二甲基硅氧烷的嵌段共聚物,并系统研究了它们形成立体复合物的结晶行为[18]。同年,DONG课题组利用类似的方法设计合成了具有精确分子量的聚丙交酯模型化合物,并利用这些离散大分子的精确重组,制备了具有不同分子量分布的样品,研究了分子量分布对聚合物结构和性能的影响[19]。
本文以L-丙交酯为原料,采用迭代发散/收敛(IDC)方法[20],选择叔丁基二甲基硅基为羟基保护基,苄基为羧基保护基,设计并合成了丙交酯的八聚体、十聚体和十二聚体化合物(图1)。通过13C NMR光谱分析,期望实现聚丙交酯立体微结构信息的归属。
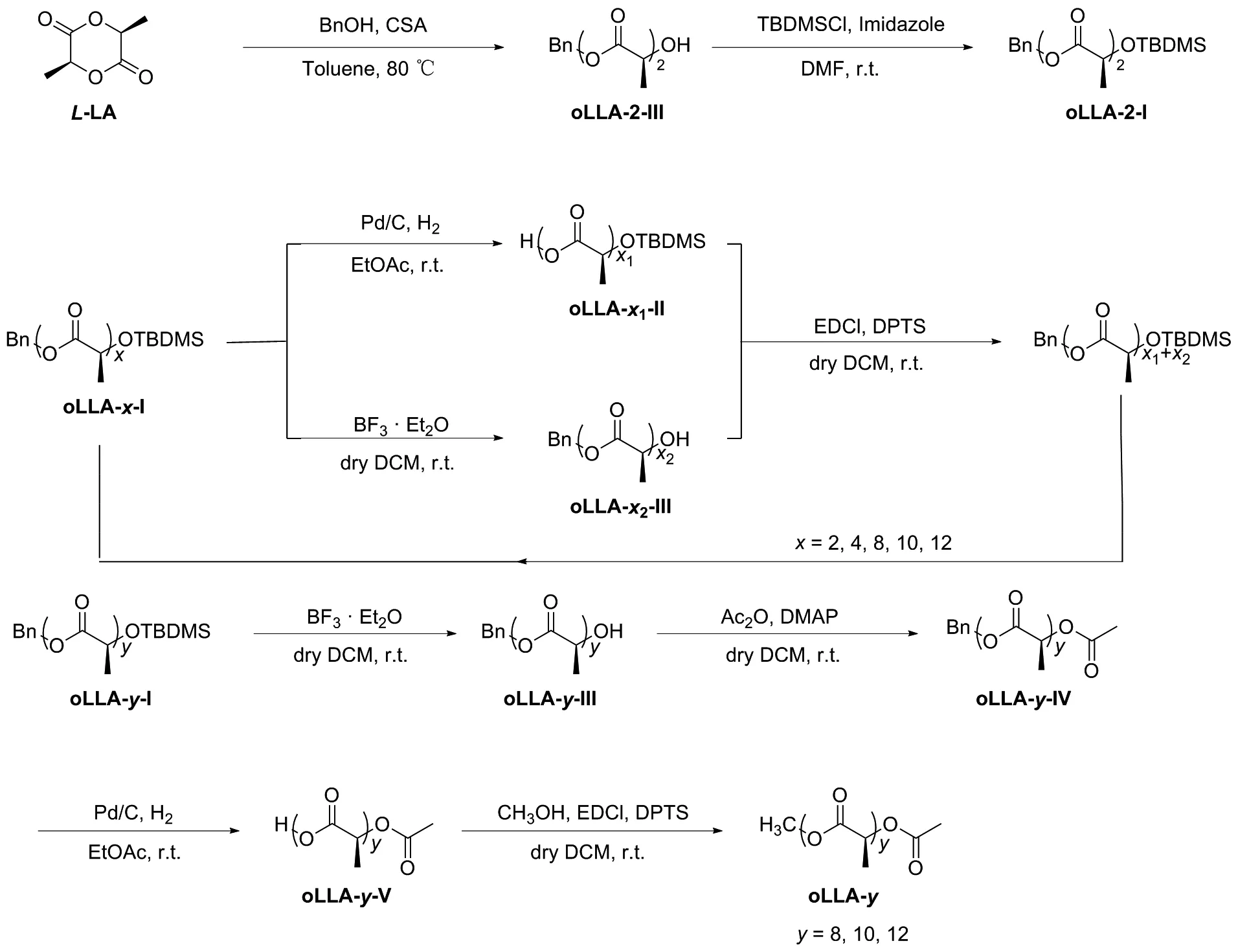
图1 离散型全同乳酸寡聚物的合成路线
1 实验部分
1.1 仪器与试剂
JASCO P1010型旋光仪;Bruker Avance II 400 MHz/Varian DLG 400 MHz型核磁共振仪(CDCl3为溶剂,TMS为内标);Bruker 600 MHz型核磁共振仪(CDCl3为溶剂,TMS为内标);Bruker ultrafleXtreme MALDI-TOF/TOF型质谱仪;Agilent 6230B TOF型液质联用系统。
L-丙交酯(L-LA)、D(+)-10-樟脑磺酸(CSA)、咪唑(Imidazole)、叔丁基二甲基氯硅烷(TBDMSCl)、钯碳催化剂(10%Pd)、 1-(3-二甲氨基丙基)-3-乙基碳二亚胺盐酸盐(EDCl)和三氟化硼乙醚溶液(BF3·Et2O)等购于安耐吉公司;苄醇(BnOH)、 4-二甲氨基吡啶(DMAP)和4-二甲氨基吡啶对甲苯磺酸盐(DPTS)等购于阿达玛斯试剂有限公司。其余所用试剂均为化学纯或分析纯。
1.2 合成
oLLA-2-III的合成:氮气保护下,将L-丙交酯(35.0 g, 242.8 mmol)和苄醇(39.4 g, 364.5 mmol)溶于60.0 mL甲苯,而后加入D(+)-10-樟脑磺酸(0.1 g, 0.5 mmol),搅拌下于80 ℃反应12 h。加入饱和碳酸氢钠溶液停止反应,用乙酸乙酯萃取,有机相依次用饱和氯化钠溶液洗涤,无水硫酸钠干燥。减压蒸除溶剂,残余物经硅胶柱层析(洗脱剂:乙酸乙酯 ∶石油醚=1 ∶15,V∶V)纯化得无色油状液体oLLA-2-III40.4 g,收率65.9%;1H NMR(400 MHz, Chloroform-d)δ: 7.42~7.29(m, 5H), 5.28~5.12(m, 3H), 4.34(qd,J=6.9 Hz, 5.9 Hz, 1H), 2.69(d,J=5.9 Hz, 1H), 1.54(d,J=7.1 Hz, 3H), 1.44(d,J=7.0 Hz, 3H);13C NMR(151 MHz, Chloroform-d)δ: 175.22, 170.13, 135.22, 128.76, 128.67, 128.37, 69.51, 67.38, 66.85, 20.54, 16.95; HR-MS(ESI)m/z: Calcd for C13H16O5{[M+Na]+}275.0890, found 275.0891。
oLLA-2-I的合成:氮气保护下,将oLLA-2-III(22.4 g, 88.8 mmol)和咪唑(27.2 g, 399.5 mmol)溶于75.0 mLN,N-二甲基甲酰胺(DMF),而后加入叔丁基二甲基氯硅烷(33.5 g, 222.3 mmol),搅拌下于室温反应12 h。加入饱和碳酸氢钠溶液停止反应,用乙酸乙酯萃取,有机相依次用饱和氯化钠溶液洗涤,无水硫酸钠干燥。减压蒸除溶剂,残余物经硅胶柱层析(洗脱剂:乙酸乙酯 ∶石油醚=1 ∶30,V∶V)纯化得无色油状液体oLLA-2-I29.7 g,收率91.3%;1H NMR(600 MHz, Chloroform-d)δ: 7.45~7.30(m, 5H), 5.23~5.13(m, 3H), 4.38(q,J=6.8 Hz, 1H), 1.52(s, 3H), 1.41(d,J=6.8 Hz, 3H), 0.90(s, 9H), 0.10(s, 3H), 0.07(s, 3H);13C NMR(151 MHz, Chloroform-d)δ: 173.56, 170.45, 135.41, 128.70, 128.53, 128.32, 68.93, 68.20, 67.14, 25.82, 21.29, 18.39, 17.00, -4.80, -5.18; HR-MS(ESI)m/z: Calcd for C19H30O5Si{[M+Na]+}389.1755, found 389.1759。
oLLA-2-II的合成:氮气保护下,将oLLA-2-I(29.2 g, 79.7 mmol)溶于乙酸乙酯,加入钯碳催化剂(10% Pd, 3.4 g),而后通入H2,搅拌下于室温反应12 h。停止反应,用硅藻土过滤,减压蒸除溶剂,得无色油状液体oLLA-2-II21.4 g,收率97.2%;1H NMR(400 MHz, Chloroform-d)δ: 5.13(q,J=7.1 Hz, 1H), 4.40(q,J=6.8 Hz, 1H), 1.55(d,J=7.2 Hz, 3H), 1.44(d,J=6.7 Hz, 3H), 0.90(s, 9H), 0.11(s, 3H), 0.08(s, 3H);13C NMR(151 MHz, Chloroform-d)δ: 176.14, 173.70, 68.60, 68.23, 25.81, 25.69, 25.60, 21.27, 18.40, 16.87, -4.84, -5.20; HR-MS(ESI)m/z: Calcd for C12H24O5Si{[M+Na]+}299.1285, found 299.1288。
oLLA-4-I的合成:氮气保护下,将oLLA-2-III(16.0 g, 63.4 mmol)和oLLA-2-II(18.6 g, 67.2 mmol)溶于107.0 mL二氯甲烷,而后加入4-二甲氨基吡啶对甲苯磺酸盐(3.7 g, 12.6 mmol),冰浴下缓慢加入1-(3-二甲氨基丙基)-3-乙基碳二亚胺盐酸盐(15.8 g, 82.4 mmol),搅拌下于室温反应12 h。加入饱和碳酸氢钠溶液停止反应,用二氯甲烷萃取,有机相依次用水洗涤,无水硫酸钠干燥。减压蒸除溶剂,残余物经硅胶柱层析(洗脱剂:乙酸乙酯 ∶石油醚=1∶20,V∶V)纯化得无色油状液体oLLA-4-I27.8 g,收率85.8%;1H NMR(600 MHz, Chloroform-d)δ: 7.40~7.29(m, 5H), 5.24~5.10(m, 5H), 4.39(d,J=6.8 Hz, 1H), 1.57(d,J=7.1 Hz, 3H), 1.52(dd,J=7.1 Hz, 2.9 Hz, 6H), 1.44(d,J=6.8 Hz, 3H), 0.90(s, 9H), 0.11(s, 3H), 0.08(s, 3H);13C NMR(151 MHz, Chloroform-d)δ: 173.65, 170.11, 170.08, 169.79, 135.27, 128.76, 128.64, 128.38, 69.39, 68.97, 68.68, 68.15, 67.32, 25.83, 21.34, 18.40, 16.89, 16.87, 16.73, -4.77, -5.16; HR-MS(ESI)m/z: Calcd for C25H38O9Si{[M+Na]+}533.2177, found 533.2183。
oLLA-4-II的合成:以oLLA-4-I(11.5 g, 22.6 mmol)为原料,合成方法同oLLA-2-II,得无色油状液体oLLA-4-II9.5 g,收率99.0%;1H NMR(400 MHz, Chloroform-d)δ: 5.23~5.10(m, 3H), 4.40(q,J=6.8 Hz, 1H), 1.62~1.52(m, 9H), 1.45(d,J=6.8 Hz, 3H), 0.90(s, 9H), 0.11(s, 3H), 0.08(s, 3H);13C NMR(151 MHz, Chloroform-d)δ: 175.39, 173.75, 170.17, 169.82, 68.98, 68.97, 68.73, 68.16, 25.83, 21.34, 18.41, 16.86, 16.79, 16.74, -4.78, -5.16; HR-MS(ESI)m/z: Calcd for C18H32O9Si{[M+Na]+}443.1708, found 443.1710。
oLLA-4-III的合成:氮气保护下,将oLLA-4-I(15.9 g, 31.1 mmol)溶于120.0 mL二氯甲烷,冰浴下缓慢滴加三氟化硼乙醚(22.2 g, 156.1 mmol),搅拌下于室温反应4 h。加入饱和碳酸氢钠溶液停止反应,用二氯甲烷萃取,有机相依次用饱和氯化钠溶液洗涤,无水硫酸钠干燥。减压蒸除溶剂,残余物经硅胶柱层析(洗脱剂:乙酸乙酯 ∶石油醚=1∶6,V∶V)纯化得无色油状液体oLLA-4-III11.0 g,收率89.1%;1H NMR(600 MHz, Chloroform-d)δ: 7.42~7.29(m, 5H), 5.31~5.09(m, 5H), 4.35(p,J=6.8 Hz, 1H), 2.67(d,J=5.9 Hz, 1H), 1.60(d,J=7.2 Hz, 3H), 1.53(dd,J=9.0 Hz, 7.0 Hz, 6H), 1.49(d,J=6.9 Hz, 3H);13C NMR(151 MHz, Chloroform-d)δ: 175.22, 170.02, 169.79, 169.65, 135.21, 128.74, 128.64, 128.36, 69.42, 69.19, 67.34, 66.84, 20.60, 16.86, 16.84, 16.70; HR-MS(ESI)m/z: Calcd for C19H24O9{[M+Na]+}419.1313, found 419.1316。
oLLA-8-I的合成:以oLLA-4-II(8.8 g, 20.9 mmol)和oLLA-4-III(7.8 g, 19.7 mmol)为原料,合成方法同oLLA-4-I,残余物经硅胶柱层析(洗脱剂:乙酸乙酯 ∶石油醚=1 ∶6,V∶V)纯化得无色油状液体oLLA-8-I14.0 g,收率89.1%;1H NMR(600 MHz, Chloroform-d)δ: 7.41~7.30(m, 5H), 5.23~5.10(m, 9H), 4.39(q,J=6.8 Hz, 1H), 1.58(d,J=4.5 Hz, 15H), 1.51(dd,J=7.1 Hz, 2.4 Hz, 6H), 1.44(d,J=6.7 Hz, 3H), 0.90(s, 9H), 0.09(d,J=14.1 Hz, 6H);13C NMR(151 MHz, Chloroform-d)δ: 173.62, 170.10, 170.01, 169.83, 169.75, 169.72, 169.64, 135.23, 128.74, 128.65, 128.37, 69.41, 69.14, 69.11, 68.94, 68.66, 68.14, 67.33, 25.82, 21.33, 18.39, 16.87, 16.79, 16.76, 16.69, -4.78, -5.17; HR-MS(ESI)m/z: Calcd for C37H54O17Si{[M+Na]+}821.3022, found 821.3025。
oLLA-8-II的合成:以oLLA-8-I(5.1 g, 6.4 mmol)为原料,合成方法同oLLA-2-II,得无色油状液体oLLA-8-II4.5 g,收率99.5%;1H NMR(600 MHz, Chloroform-d)δ: 5.15(dq,J=22.8 Hz, 6.6 Hz, 7H), 4.39(q,J=6.6 Hz, 1H), 1.57(t,J=6.8 Hz, 21H), 1.44(d,J=6.7 Hz, 3H), 0.90(s, 9H), 0.09(d,J=13.9 Hz, 6H);13C NMR(151 MHz, Chloroform-d)δ: 173.71, 170.13, 169.87, 169.77, 169.67, 69.15, 69.11, 68.97, 68.70, 68.15, 25.82, 21.33, 18.40, 16.86, 16.79, 16.76, 16.70, -4.79, -5.17; HR-MS(ESI)m/z: Calcd for C30H48O17Si{[M+Na]+}731.2553, found 731.2554。
oLLA-8-III的合成:以oLLA-8-I(8.2 g, 10.3 mmol)为原料,合成方法同oLLA-4-III,残余物经硅胶柱层析(洗脱剂:乙酸乙酯 ∶石油醚=1 ∶2,V∶V)纯化得无色油状液体oLLA-8-III6.4 g,收率91.1%;1H NMR(600 MHz, Chloroform-d)δ: 7.39~7.29(m, 5H), 5.26~5.10(m, 9H), 4.35(p,J=6.8 Hz, 1H), 2.66(d,J=6.0 Hz, 1H), 1.60~1.47(m, 24H);13C NMR(151 MHz, Chloroform-d)δ: 175.20, 170.00, 169.77, 169.69, 169.63, 135.21, 128.73, 128.63, 128.35, 69.40, 69.18, 69.13, 67.32, 66.82, 20.60, 16.84, 16.77, 16.75, 16.67; HR-MS(ESI)m/z: Calcd for C31H40O17{[M+Na]+}707.2158, found 707.2161。
oLLA-8-IV的合成:氮气保护下,将oLLA-8-III(500.0 mg, 0.7 mmol)溶于2.0 mL二氯甲烷,冰浴下加入4-二甲氨基吡啶(9.0 mg, 0.1 mmol),而后加入乙酸酐(0.1 mL, 1.1 mmol),搅拌下于室温反应12 h。加入水停止反应,用二氯甲烷萃取,有机相依次用饱和氯化钠溶液洗涤,无水硫酸钠干燥。减压蒸除溶剂,残余物经硅胶柱层析(洗脱剂:乙酸乙酯 ∶石油醚=1 ∶5,V∶V)纯化得无色油状液体oLLA-8-IV514.0 mg,收率96.9%;1H NMR(600 MHz, Chloroform-d)δ: 7.39~7.30(m, 5H), 5.20~5.08(m, 10H), 2.12(s, 3H), 1.58~1.50(m, 24H);13C NMR(151 MHz, Chloroform-d)δ: 170.56, 170.49, 170.05, 169.91, 169.76, 169.68, 135.21, 128.77, 128.68, 128.40, 69.42, 69.16, 69.14, 69.09, 69.02, 68.46, 67.37, 20.77, 16.92, 16.90, 16.81, 16.79, 16.71; HR-MS(ESI)m/z: Calcd for C33H42O18{[M+Na]+}749.2263, found 749.2279。
oLLA-8-V的合成:以oLLA-8-IV(484.0 mg, 0.7 mmol)为原料,合成方法同oLLA-2-II,得无色油状液体oLLA-8-V408.0 mg,收率96.2%;1H NMR(400 MHz, Chloroform-d)δ: 5.29~5.04(m, 8H), 2.12(s, 3H), 1.72~1.46(m, 24H);13C NMR(151 MHz, Chloroform-d)δ: 175.05, 170.64, 170.50, 169.91, 169.78, 169.68, 69.14, 69.13, 69.09, 69.03, 68.93, 68.47, 20.75, 16.89, 16.79, 16.76, 16.71; HR-MS(ESI)m/z: Calcd for C26H36O18{[M+Na]+}659.1794, found 659.1785。
oLLA-8的合成:以oLLA-8-V(378.0 mg, 0.6 mmol)和甲醇(0.1 mL, 1.5 mmol)为原料,合成方法同oLLA-4-I,残余物经硅胶柱层析(洗脱剂:乙酸乙酯 ∶石油醚=1 ∶4,V∶V)纯化得无色油状液体oLLA-8300.0 mg,收率77.7%; [α]20D=-138.08(c=0.2, CH2Cl2);1H NMR(600 MHz, Chloroform-d)δ: 5.21~5.07(m, 8H), 3.74(s, 3H), 2.12(s, 3H), 1.58~1.50(m, 24H);13C NMR(151 MHz, Chloroform-d)δ: 170.69, 170.55, 170.49, 169.91, 169.78, 169.76, 169.73, 69.35, 69.19, 69.14, 69.09, 69.02, 68.46, 52.58, 20.77, 16.92, 16.81, 16.79, 16.76; HR-MS(ESI)m/z: Calcd for C27H38O18{[M+Na]+}673.1950, found 673.1969。
oLLA-10-I的合成:以oLLA-8-II(1.2 g, 1.7 mmol)和oLLA-2-III(0.4 g, 1.6 mmol)为原料,合成方法同oLLA-4-I,残余物经硅胶柱层析(洗脱剂:乙酸乙酯 ∶石油醚=1 ∶3,V∶V)纯化得白色固体oLLA-10-I1.1 g,收率69.1%;1H NMR(600 MHz, Chloroform-d)δ: 7.40~7.29(m, 5H), 5.23~5.09(m, 11H), 4.39(q,J=6.7 Hz, 1H), 1.61~1.54(m, 21H), 1.52(dd,J=7.1 Hz, 2.2 Hz, 6H), 1.44(d,J=6.7 Hz, 3H), 0.90(s, 9H), 0.09(d,J=14.0 Hz, 6H);13C NMR(151 MHz, Chloroform-d)δ: 173.69, 170.14, 170.06, 169.88, 169.80, 169.76, 169.74, 169.68, 135.21, 128.77, 128.68, 128.40, 69.43, 69.16, 69.11, 68.96, 68.68, 68.15, 67.37, 25.84, 21.36, 18.42, 16.90, 16.82, 16.79, 16.72, -4.77, -5.16; HR-MS(ESI)m/z: Calcd for C43H62O21Si{[M+Na]+}965.3445, found 965.3441。
oLLA-10-III的合成:以oLLA-10-I(1.0 g, 1.1 mmol)为原料,合成方法同oLLA-4-III,残余物经硅胶柱层析(洗脱剂:乙酸乙酯 ∶石油醚=1 ∶2,V∶V)纯化得无色油状液体oLLA-10-III786.0 mg,收率89.4%;1H NMR(600 MHz, Chloroform-d)δ: 7.39~7.30(m, 5H), 5.24~5.12(m, 11H), 4.35(p,J=6.8 Hz, 1H), 2.68(d,J=6.0 Hz, 1H), 1.60~1.57(m, 21H), 1.52(dd,J=7.1 Hz, 2.4 Hz, 6H), 1.49(d,J=6.9 Hz, 3H);13C NMR(151 MHz, Chloroform-d)δ: 175.29, 170.04, 169.79, 169.74, 169.68, 135.21, 128.77, 128.68, 128.39, 69.43, 69.25, 69.19, 69.16, 67.37, 66.85, 20.67, 16.89, 16.82, 16.79, 16.71; HR-MS(ESI)m/z: Calcd for C37H48O21{[M+Na]+}851.2580, found 851.2581。
oLLA-10-IV的合成:以oLLA-10-III(736.0 mg, 0.9 mmol)为原料,合成方法同oLLA-8-IV,残余物经硅胶柱层析(洗脱剂:乙酸乙酯 ∶石油醚=1∶4,V∶V)纯化得无色油状液体oLLA-10-IV738.0 mg,收率95.4%;1H NMR(600 MHz, Chloroform-d)δ: 7.40~7.29(m, 5H), 5.23~5.06(m, 12H), 2.13(s, 3H), 1.57~1.52(m, 30H);13C NMR(151 MHz, Chloroform-d)δ: 170.56, 170.49, 170.05, 169.91, 169.79, 169.76, 169.68, 135.20, 128.77, 128.68, 128.40, 69.43, 69.15, 69.09, 69.02, 68.46, 67.37, 20.77, 16.92, 16.90, 16.81, 16.79, 16.71; HR-MS(ESI)m/z: Calcd for C39H50O22{[M+Na]+}893.2686, found 893.2689。
oLLA-10-V的合成:以oLLA-10-IV(650.0 mg, 0.7 mmol)为原料,合成方法同oLLA-2-II,得无色油状液体oLLA-10-V577.0 mg,收率99.0%;1H NMR(400 MHz, Chloroform-d)δ: 5.25~5.05(m, 10H), 2.12(s, 3H), 1.57(dd,J=10.7 Hz, 7.1 Hz, 30H);13C NMR(151 MHz, Chloroform-d)δ: 174.78, 170.63, 170.50, 169.91, 169.77, 169.67, 69.14, 69.09, 69.02, 68.93, 68.47, 20.76, 16.90, 16.80, 16.78, 16.71; HR-MS(ESI)m/z: Calcd for C32H44O22{[M+Na]+}803.2216, found 803.2202。
oLLA-10的合成:以oLLA-10-V(487.0 mg, 0.6 mmol)和甲醇(0.1 mL, 3.2 mmol)为原料,合成方法同oLLA-4-I,残余物经硅胶柱层析(洗脱剂:乙酸乙酯 ∶石油醚=1 ∶3,V∶V)纯化得无色油状液体oLLA-10310.0 mg,收率62.5%; [α]20D=-142.75(c=0.2, CH2Cl2);1H NMR(400 MHz, Chloroform-d)δ: 5.25~5.02(m, 10H), 3.74(s, 3H), 2.13(s, 3H), 1.59(dd,J=7.2 Hz, 2.9 Hz, 30H);13C NMR(151 MHz, Chloroform-d)δ: 170.68, 170.54, 170.48, 169.90, 169.77, 169.74, 169.71, 69.34, 69.19, 69.14, 69.08, 69.02, 68.45, 52.57, 20.76, 16.91, 16.81, 16.78, 16.76; HR-MS(ESI)m/z: Calcd for C33H46O22{[M+Na]+}817.2373, found 817.2396。
oLLA-12-I的合成:以oLLA-4-II(0.9 g, 2.1 mmol)和oLLA-8-III(1.5 g, 2.2 mmol)为原料,合成方法同oLLA-4-I,残余物经硅胶柱层析(洗脱剂:乙酸乙酯 ∶石油醚=1∶4,V∶V)纯化得白色固体oLLA-12-I1.6 g,收率67.2%;1H NMR(400 MHz, Chloroform-d)δ: 7.42~7.29(m, 5H), 5.23~5.12(m, 13H), 4.39(q,J=6.8 Hz, 1H), 1.61~1.55(m, 27H), 1.52(dd,J=7.1 Hz, 1.5 Hz, 6H), 1.44(d,J=6.7 Hz, 3H), 0.90(s, 9H), 0.09(d,J=9.3 Hz, 6H);13C NMR(151 MHz, Chloroform-d)δ: 173.68, 170.14, 170.05, 169.87, 169.79, 169.75, 169.67, 135.20, 128.77, 128.68, 128.39, 69.42, 69.14, 68.95, 68.67, 68.13, 67.36, 25.83, 21.35, 18.41, 16.89, 16.81, 16.78, 16.71, -4.78, -5.17; HR-MS(ESI)m/z: Calcd for C49H70O25Si{[M+Na]+}1109.3868, found 1109.3834。
oLLA-12-III的合成:以oLLA-12-I(700.0 mg, 0.6 mmol)为原料,合成方法同oLLA-4-III,残余物经硅胶柱层析(洗脱剂:乙酸乙酯 ∶石油醚=1 ∶2,V∶V)纯化得无色油状液体oLLA-12-III521.0 mg,收率83.2%;1H NMR(400 MHz, Chloroform-d)δ: 7.34(q,J=8.3 Hz, 7.7 Hz, 5H), 5.17(td,J=8.5 Hz, 7.7 Hz, 4.9 Hz, 13H), 4.35(q,J=6.7 Hz, 1H), 2.69(d,J=6.0 Hz, 1H), 1.59~1.53(m, 36H);13C NMR(151 MHz, Chloroform-d)δ: 175.30, 170.05, 169.79, 169.75, 169.68, 135.21, 128.77, 128.68, 128.39, 69.43, 69.25, 69.19, 69.16, 67.37, 66.85, 31.07, 20.67, 16.89, 16.82, 16.79, 16.71; HR-MS(ESI)m/z: Calcd for C43H56O25{[M+Na]+}995.3003, found 995.3004。
oLLA-12-IV的合成:以oLLA-12-III(490.0 mg, 0.5 mmol)为原料,合成方法同oLLA-8-IV,残余物经硅胶柱层析(洗脱剂:乙酸乙酯 ∶石油醚=1 ∶2,V∶V)纯化得无色油状液体oLLA-12-IV505.0 mg,收率98.8%;1H NMR(400 MHz, Chloroform-d)δ: 7.39~7.30(m, 5H), 5.26~5.05(m, 14H), 2.12(s, 3H), 1.59~1.52(m, 36H);13C NMR(151 MHz, Chloroform-d)δ: 170.55, 170.49, 170.05, 169.90, 169.78, 169.75, 169.67, 135.20, 128.76, 128.68, 128.39, 69.42, 69.14, 69.08, 69.02, 68.45, 67.36, 20.76, 16.91, 16.89, 16.81, 16.78, 16.71; HR-MS(ESI)m/z: Calcd for C45H58O26{[M+Na]+}1037.3109, found 1037.3109。
oLLA-12-V的合成:以oLLA-12-IV(500.0 mg, 0.5 mmol)为原料,合成方法同oLLA-2-II,得无色油状液体oLLA-12-V450.0 mg,收率98.8%;1H NMR(400 MHz, Chloroform-d)δ: 5.26~5.06(m, 12H), 2.13(s, 3H), 1.61~1.53(m, 36H);13C NMR(151 MHz, Chloroform-d)δ: 174.20, 170.61, 170.50, 169.91, 169.79, 169.77, 169.66, 69.15, 69.09, 69.03, 68.91, 68.47, 20.77, 16.91, 16.81, 16.78, 16.72; HR-MS(ESI)m/z: Calcd for C38H52O26{[M+Na]+}947.2639, found 947.2638。
oLLA-12的合成:以oLLA-12-V(370.0 mg, 0.4 mmol)和甲醇(0.2 mL, 4.2 mmol)为原料,合成方法同oLLA-4-I,残余物经硅胶柱层析(洗脱剂:乙酸乙酯 ∶石油醚=1∶3,V∶V)纯化得白色固体oLLA-12279.0 mg,收率74.3%; [α]20D=-146.91(c=0.2, CH2Cl2);1H NMR(400 MHz, Chloroform-d)δ: 5.25~5.04(m, 12H), 3.74(s, 3H), 2.13(s, 3H), 1.60~1.50(m, 36H);13C NMR(151 MHz, Chloroform-d)δ: 170.68, 170.54, 170.48, 169.90, 169.78, 169.74, 169.71, 69.35, 69.20, 69.15, 69.09, 69.02, 68.46, 52.57, 20.76, 16.92, 16.81, 16.79, 16.76; HR-MS(ESI)m/z: Calcd for C39H54O26{[M+Na]+}961.2796, found 961.2797。
2 结果与讨论
2.1 合成
聚丙交酯的全同立构寡聚物合成方法如图1所示。IDC方法是实现链长快速增长的关键,即分别对不同保护基保护的两个链端进行选择性正交脱保护,并进一步偶联单保护物种,以在每个脱保护-偶联循环中使链长翻倍。同时,长度非2n的序列也可以通过合并平行重复循环来实现。以L-丙交酯为起始原料,通过开环反应得到一端为Bn,另一端为羟基的oLLA-2-III二聚体,随后对羟基端进行TBS保护,得到两端分别为Bn和TBS保护的全同二聚体oLLA-2-I。随后,oLLA-2-I脱去Bn,得到oLLA-2-II。oLLA-2-II的羧基与oLLA-2-III的羟基发生酯化反应,得到全同四聚体oLLA-4-I。将oLLA-4-I分成两部分,分别脱去Bn和TBS,形成oLLA-4-II和oLLA-4-III。oLLA-4-II与oLLA-4-III发生酯化反应,得到全同八聚体oLLA-8-I。同理,oLLA-8-I分成两部分,分别脱去保护基,得到oLLA-8-II与oLLA-8-III。以此类推,oLLA-8-II与oLLA-2-III反应得到十聚体oLLA-10-I;oLLA-8-III与oLLA-4-II反应得到十二聚体oLLA-12-I。将oLLA-8-I先脱去TBS保护基,得到oLLA-8-III,再用乙酸酐对羟基端进行封端,即可得到oLLA-8-IV,随后脱去苄基,得到一端为羧基,另一端为乙酰基的oLLA-8-V。最后,利用甲醇对羧基端封端,得到与聚合物结构相似的模型全同八聚体oLLA-8;十聚体、十二聚体的合成以此类推,最终得到具有精确分子量和聚合度的全同立构聚丙交酯模型化合物oLLA-8/10/12。
2.2 表征
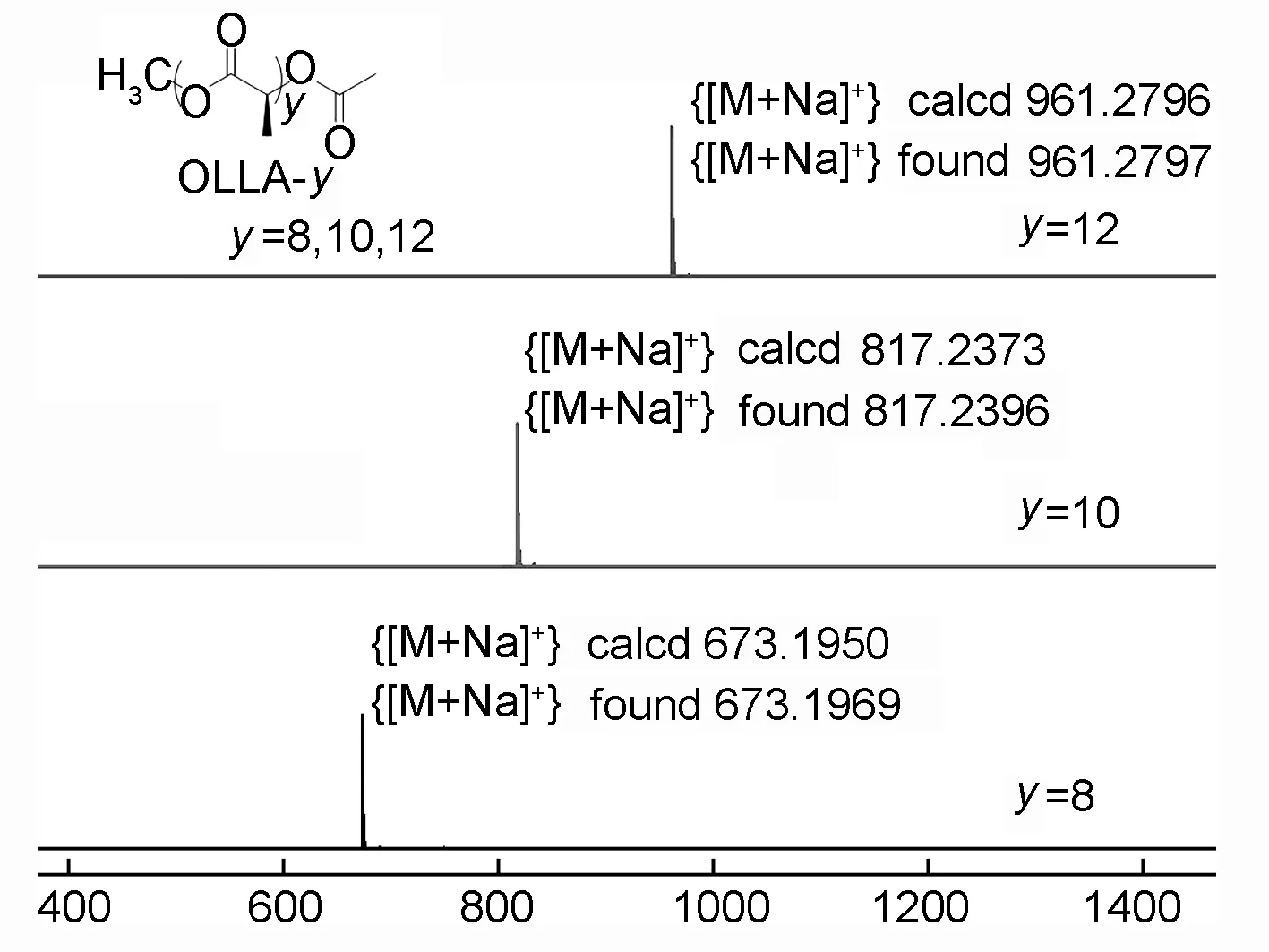
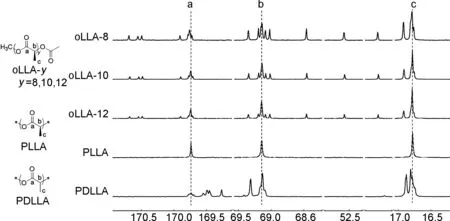
图2为oLLA-8/10/12的质谱图。由图2可知,合成的一系列全同立构聚丙交酯的模型化合物,无论是八聚体、十聚体还是十二聚体,其分子量都是呈单一分布的。图3为全同立构聚丙交酯模型化合物oLLA-8/10/12,以及全同结构的左旋聚丙交酯(PLLA)和外消旋聚丙交酯(PDLLA)的核磁碳谱。由图3可知,oLLA-8/10/12的羰基碳化学位移δ分别为169.76, 169.74和169.74,与全同PLLA的羰基碳出峰位置(δ169.74)基本对应;次甲基碳的化学位移δ分别为 69.15, 69.14和69.15,与全同聚合物的次甲基碳(δ69.15)基本相同;侧链甲基碳在δ16.79, 16.78和16.79处出峰,与全同聚丙交酯的甲基碳出峰位置(δ16.78)也基本匹配。对比oLLA-8/10/12发现,随着重复单元数的增加,端位基团对寡聚物结构的影响逐渐变小,无论是羰基碳、次甲基碳还是侧链甲基碳,其化学位移都向聚合物更加接近。对比oLLA-8/10/12、 PLLA与外消旋聚丙交酯(PDLLA),发现PDLLA的碳谱信号与全同结构的寡聚物和聚合物都有较大的差别。此外,δ170.68~170.48处的信号对应寡聚物端基的羰基碳,δ52.57和δ20.76附近的信号分别对应寡聚物2个不同端基的甲基碳。
m/z
δ
本文以L-丙交酯为原料,合成了全同立构丙交酯八聚体、十聚体和十二聚体模型化合物。采用IDC方法以及选择合适的正交保护基实现了寡聚物快速链增长。通过分析全同立构寡聚物的核磁碳谱,实现了聚丙交酯微结构信息的精确归属。全同立构序列的羰基、次甲基和侧链甲基的碳原子化学位移δ分别位于 169.74、 69.15和16.78处。后续研究将侧重探索相反构型聚丙交酯寡聚物的立体相互作用模式和驱动力。
