脂肪细胞Npy4r促进高脂饮食诱导肥胖
2023-03-03王澜曾帆黄荣凤林树张志辉李旻典
王澜,曾帆,黄荣凤,林树,张志辉,李旻典
研究报告
脂肪细胞促进高脂饮食诱导肥胖
王澜,曾帆,黄荣凤,林树,张志辉,李旻典
陆军军医大学第一附属医院心血管内科,代谢生物钟与心血管病中心,重庆 400038
脂肪组织的神经支配与调节在能量代谢稳态的维持中发挥重要作用。神经肽Y (neuropeptide Y, NPY)及其脂肪细胞受体信号通路促进高脂饮食诱导的肥胖,其中NPY受体1 (NPY receptor Y1, NPY1R)与受体2(NPY2R)是主要的NPY外周受体。NPY受体4 (NPY4R)也在脂肪组织表达,然而尚不清楚其是否参与肥胖的发生发展机制。本研究建立了NPY及其受体的免疫荧光成像技术和脂肪细胞回复性表达小鼠。根据对不同部位脂肪组织的荧光显微术观察,发现NPY在肩胛间棕色脂肪和皮下脂肪的围绕血管区域以点状形式表达,NPY系统的各受体在脂肪组织的空间分布上具有明显的组织特异性:NPY1R在棕色脂肪、主动脉周围脂肪和性腺脂肪较为富集,NPY2R在棕色脂肪和主动脉周围脂肪较为富集,NPY4R在棕色脂肪与性腺脂肪较为富集。继而通过比较脂肪细胞回复性表达小鼠与全身基因静默小鼠在高脂喂食下的体重与糖代谢,发现脂肪细胞促进高脂饮食诱导的肥胖(< 0.0001)。本研究明确了NPY及其受体NPY1R、NPY2R和NPY4R在不同部位脂肪组织的蛋白水平与分布,进而用脂肪细胞特异性地回复表达小鼠模型揭示脂肪细胞具有促进高脂饮食诱导肥胖的作用。
条件性基因回复表达;loxP-STOP-loxP;脂肪细胞;脂肪组织;肥胖
脂肪组织与中枢神经系统的相互作用在能量代谢稳态的维持过程中发挥着重要作用。长期以来,以脂肪组织分泌的脂肪因子(adipokine)为媒介进行从“脂肪到下丘脑”的体液调节机制研究受到了人们的广泛关注[1]。其中,瘦素(leptin)和脂联素(adiponectin, adipoq)是经典的脂肪因子[2],而白脂素(asprosin)与内源大麻素(endocannabinoid)是新近发现的分别调节基础食欲与高脂诱导食欲的脂肪因子[3,4]。同时,脂肪组织还存在神经末梢的交联[5]。脂肪组织的交感神经末梢沿血管分布,与脂肪细胞接触,并且在褐色脂肪、米色脂肪与白色脂肪之间存在明显的交感神经末梢分布密度与细胞间接触点数量的不同[6~8]。相反,感觉神经末梢也与脂肪细胞存在接触,前者与交感神经末梢存在拮抗作用[9]。
神经肽Y (neuropeptide Y,NPY)是已知最有效的促进基础食欲的肽类信号分子[10,11]。与NPY结构相似的肽类信号分子还包括肽YY (peptide YY,PYY)与胰多肽(pancreatic polypeptide,PP)。NPY、PYY、PP及五个主要识别受体(NPY1R、NPY2R、NPY4R、NPY5R、NPY6R)组成NPY受体信号通路,是能量稳态的神经调节机制的重要组成部分[12]。NPY受体与上述肽类信号分子的结合能力不尽相同且存在细胞表达特异性。NPY与PYY具有相似的受体亲和力,即NPY2R>NPY1R>NPY5R>>NPY4R~NPY6R;相反胰多肽的高亲和力受体是NPY4R~NPY6R[12]。脂肪细胞表达多个NPY受体的转录本,如与。脂肪组织与转录本与体重呈正相关,且脂肪细胞特异性敲除促进棕色脂肪和米色脂肪的适应性产热能力,进而抑制高脂诱导肥胖(饮食性肥胖)[13]。敲低脂肪特异性基因可抑制脂肪组织血管的生长、脂质沉积与机体能量代谢,从而减轻饮食性肥胖[14,15]。因此,基于PYY-NPY1/2R信号通路的受体抑制剂在小鼠与非人灵长类的肥胖疾病模型中取得显著的减重效果[13,16]。
相比NPY1R与NPY2R受体信号通路,NPY4R信号通路在脂肪细胞的功能尚不清楚。研究发现全身敲除的小鼠在正常饮食条件下减少体重,抑制脂肪堆积,并伴随着较高的能量代谢率,但没有发生摄食量的改变[12,17]。Npy4r ob/(leptin,瘦素基因)小鼠较/更加肥胖,这表明NPY4R依赖瘦素信号通路发挥体重调节功能[17]。尽管全身敲除不影响小鼠基础摄食行为,但外源胰多肽可通过下丘脑弓状核团NPY4R激活POMC神经元从而抑制食欲[18]。全身敲除或与的双敲除小鼠抵抗高脂诱导肥胖,并且抑制高瘦素血症的发生[19]。上述研究提示NPY4R可能与NPY2R类似也通过脂肪细胞的受体信号通路参与饮食性肥胖的发生机制。鉴于既往研究依赖转录本水平研究脂肪组织的NPY受体信号通路,本研究建立了针对NPY、NPY1R、NPY2R与NPY4R的免疫荧光成像方法,明确NPY及其受体在脂肪组织的蛋白含量与分布。继而用loxP-STOP-loxP条件性转录终止序列构建的条件性基因静默小鼠,通过与脂肪细胞特异性的Adipoq-Cre工具小鼠杂交获得脂肪细胞特异性回复表达小鼠,初步发现脂肪细胞促进高脂诱导的肥胖发生。
1 材料与方法
1.1 实验动物
本研究动物实验方案获得陆军军医大学伦理审查委员会批准。实验小鼠饲养于陆军军医大学高原军事医学系SPF级动物中心,适应 12 h光照/12 h黑暗循环(8:10开灯,20:10分熄灯)1~2周,期间保证自由饮食和自由饮水。6~8周龄C57BL/6J雄性小鼠来自陆军军医大学实验动物中心。在小鼠适应1周后断颈处死取腹股沟皮下脂肪(简称皮下脂肪)、肾周脂肪性腺脂肪、肩胛间棕色脂肪、主动脉周围脂肪、肠系膜脂肪、性腺脂肪用于免疫荧光实验。
基因的条件性静默(loxP-STOP-loxP/+)小鼠采用CRISPR-Cas9基因编辑技术在C57BL/6J小鼠受精卵的基因的第2号外显编码区起始密码子ATG上游7~10碱基位置原位插入“loxP-PGK-Neo-6*SV40 pA-loxP”(loxP-STOP-loxP)序列构建(Cyagen Biosciences Inc,美国)。将基因的gRNA(TGGTAGGTGTGAGAAGATCCAGG)、Cas9 mRNA和loxP-STOP-loxP核酸序列的供体载体共注射到C57BL/6J小鼠受精卵中,筛选获得条件性回复表达的全身性基因静默杂合子(loxP-STOP-loxP/+)C57BL/6J小鼠。
基因静默杂合子小鼠(loxP-STOP-loxP/+)经人工授精自交获得纯合子小鼠。通过F0:成熟脂肪细胞特异性表达的脂联素启动子驱动的Cre重组酶工具小鼠(B6;FVB-Tg(Adipoq-cre)1Evdr/J,Adipoq-Cre)[4,20,21]与条件性静默纯合子小鼠杂交,获得子代F1:Adipoq-CreTg/+;loxP-STOP-loxP/lox-STOP-loxP(雄性6只,雌性6只)与同窝出生的loxP-STOP-loxP/lox-STOP-loxP对照小鼠(雄性7只,雌性6只)。雌性实验小鼠用于检测在脂肪细胞回复表达的DNA分析实验。雄性实验小鼠在12周龄开始称量体重,15周龄开始喂养高脂饲料,每周称量体重至31周龄。其中12周龄(喂食高脂前)、22周龄(高脂7周)和32周龄(高脂17周)分别死亡1只基因静默纯合子小鼠。在高脂进食12周与14周时开展葡萄糖耐受实验;最后,高脂进食19周的34周龄小鼠禁食 6 h (12:00~18:00),收集脂肪组织,并在速冻后储存在–80℃冰箱中用于后续实验。
1.2 实验材料
Co60辐照实验鼠生长繁殖饲料(货号:1010083,江苏协同医药生物工程有限责任公司),高脂饲料(货号:D12492,美国Research Diets公司),蛋白酶K消化液(货号:MK539480,美国Merck公司),2×Taq Master Mix(货号:P222,南京诺唯赞生物科技公司),葡萄糖(货号:G6172,上海麦克林生化科技公司),OCT胶(货号:4583,日本SAKURA公司)。
抗体:NPY (1:100,货号:12833-1-AP,美国Proteintech公司),NPY1R(1:100,货号:bs-1070R,RRID:AB_10856532,北京博奥森生物技术公司),NPY2R(1:100,货号:PA5-77517,RRID:AB_2736253,美国Invitrogen公司),NPY4R(1:150,货号:PA5-77518,RRID:AB_2736254,美国Invitrogen公司),Anti-rabbit IgG (H+L)-F(ab') 2 Fragment (Alexa Fluor 488 Conjugate) (1:500,货号:4412,RRID:AB_ 1904025,美国Cell Signaling Technology公司)。5%牛血清白蛋白封闭液(货号:AR0004,武汉博士德生物工程公司)。
1.3 小鼠基因分型
将待鉴定的小鼠取一侧性腺脂肪组织置于EP管中,每管添加蛋白酶K消化液200 μL,将组织在56℃孵育过夜,然后再98℃孵育15 min,使蛋白酶变性,采用5000 ×离心15 min,取上清液用于PCR(引物序列见表1)。基因分型程序:95℃变性30 s,60℃退火35 s,72℃延伸60 s,循环35次,最后72℃延伸20 min,4℃保温,扩增产物用于DNA凝胶电泳鉴定。
1.4 葡萄糖耐量实验
在9:00更换新垫料后禁食6 h,并测量禁食前初始体重。禁食6 h后,取小鼠尾血检测空腹基础血糖。以对照组平均体重计算葡萄糖注射量,每只实验小鼠按照1.5 g/kg (12周高脂喂食)或1 g/kg (14周高脂喂食)腹腔注射10%葡萄糖溶液,并检测注射葡萄糖后15、30、45、60、90、120 min血糖值(检测血糖期间保持小鼠饮水),检测完后恢复小鼠进食。血糖数据使用曲线面积分析(area of the curve,AOC):即曲线下面积(area under curve,AUC)减去起始葡萄糖基线以下的面积[22]。
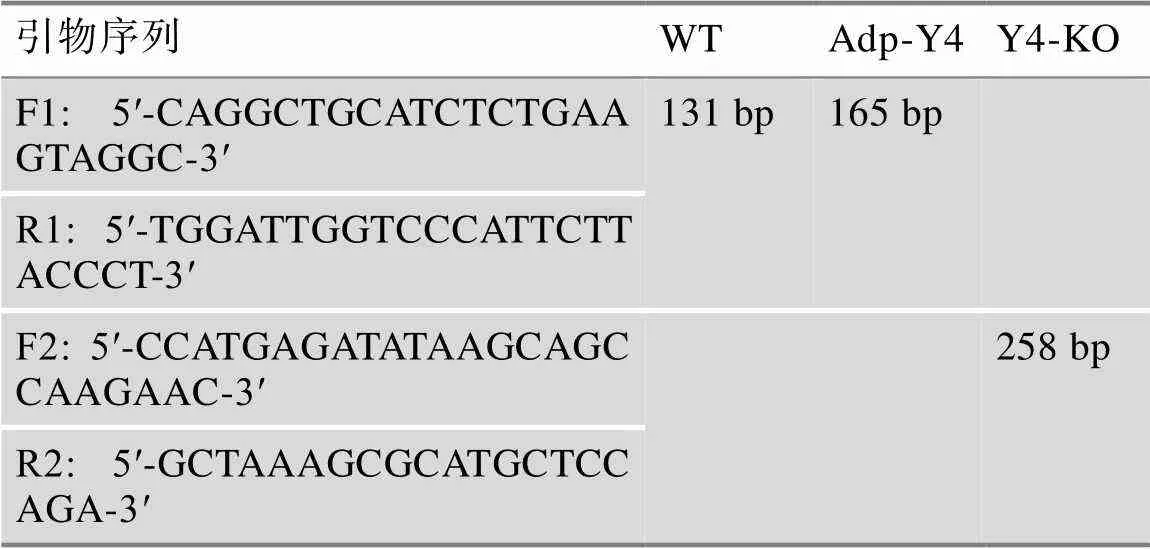
表1 基因分型引物
F:正向引物;R:逆向引物;WT:野生型;Adp-Y4:脂肪细胞回复表达;Y4-KO:全身基因静默。
1.5 免疫荧光成像
将脂肪组织浸泡在4℃的4%多聚甲醛中过夜,过夜后组织在新鲜PBS洗涤3次后,换新鲜PBS在4℃中过夜,取出组织浸泡在PBS-15%蔗糖溶液中4℃过夜。组织预处理后,用滤纸吸干组织表面水分,OCT胶包埋组织,脂肪在–45℃条件下进行切片,切片厚度30 μm。将含有切片组织的玻片放入预冷的50%乙醇中孵育30 min后,用免疫组化笔在组织切片周围做一个疏水屏障;切片在PBS中孵育5 min,用新鲜的PBS重复二次;用1%牛血清白蛋白(BSA)在室温中孵育1 h,阻断非特异性抗体结合;用1%牛血清白蛋白(BSA)稀释一抗,滴加一抗覆盖组织切片,室温孵育2 h;切片在PBS中孵育5 min,用新鲜的PBS重复二次;用1%牛血清白蛋白稀释二抗,滴加二抗覆盖组织切片,室温孵育60 min;切片在PBS中孵育5 min,用新鲜的PBS重复二次;抗荧光淬灭剂封片,最后按300 ms曝光时间进行荧光成像(NI-U,日本Nikon公司)。
1.6 数据处理和统计分析
免疫荧光数据使用Adobe Illustrator CS6作图。计量资料以平均值±标准误差(mean ± SEM)表示,使用GraphPad Prism 8.0.1统计学软件进行数据分析与作图,采用双因素方差分析(2-way ANOVA)或非配对检验进行统计分析,< 0.05时认为差异有统计学意义。
2 结果与分析
2.1 脂肪组织NPY及受体蛋白的免疫荧光成像分析
为了明确NPY受体信号通路在小鼠脂肪组织的表达与分布情况,本研究采用免疫荧光成像技术,观察NPY及其受体1、2和4等蛋白在6个有代表性的小鼠脂肪组织的免疫荧光信号。这些脂肪组织包括3个褐色脂肪组织(肩胛间棕色脂肪interscapular brown adipose tissue、主动脉周围脂肪peri- aortic fat和肾周脂肪peri-renal fat)、2个白色脂肪(肠系膜脂肪mesenteric fat和性腺脂肪perigonadal fat)和1个米色脂肪(皮下脂肪subcutaneous fat)。目前尚不具备可以用来做免疫荧光实验的NPY5R受体,因此没有检测NPY5R蛋白。结果显示NPY在肩胛间棕色脂肪与皮下脂肪的血管区域以点状分布(图 1)。NPY的点状分布可能反映了神经末梢的形态结构,这与外周NPY来源于交感神经末梢有关。继而观察到NPY1R在肩胛间棕色脂肪、主动脉周围脂肪和性腺脂肪表达较强(图2)。NPY1R在肩胛间棕色脂肪与主动脉周围脂肪的信号较为弥散,但阴性对照(未孵育一抗组)的对应组织区域没有信号,表明这些较为弥散的信号与NPY1R抗体识别的肽段相关,不是背景信号。
研究继而观察识别PYY与NPY肽类信号分子的NPY2R蛋白在脂肪组织的分布。结果显示NPY2R在肩胛间棕色脂肪与主动脉周围脂肪表达量最高,其次是肠系膜脂肪与皮下脂肪,在性腺脂肪与肾周脂肪表达量最低(图3)。NPY4R蛋白在肩胛间棕色脂肪表达量最高,其次是性腺脂肪、肠系膜脂肪和主动脉周围脂肪,在皮下脂肪与肾周脂肪的表达量最低(图4)。由此可以看出,NPY系统的各受体在脂肪组织的空间分布上具有解剖学区域特异性:NPY1R在性腺脂肪、肩胛间棕色脂肪和主动脉周围脂肪较为富集,NPY2R在肩胛间棕色脂肪和主动脉周围脂肪较为富集,NPY4R在肩胛间棕色脂肪与性腺脂肪较为富集。
2.2 脂肪细胞Npy4r基因回复表达小鼠模型构建
为了明确脂肪细胞NPY4R在高脂诱导肥胖中的作用,研究采用在基因静默小鼠实现脂肪细胞回复表达的技术策略,可以直接检验脂肪细胞NPY4R对饮食性肥胖作用的充分性。小鼠有2个外显子,编码区完全位于2号外显子内,因此通过CRISPR-Cas9基因编辑技术在小鼠受精卵的基因的2号外显子编码区上游7~10碱基位置原位插入“loxP-PGK-Neo-6*SV40 pA-loxP”(loxP-STOP-loxP)序列,携带loxP-STOP-loxP序列的纯合小鼠将实现基因静默,即Y4-KO (图5A)。Y4-KO与脂肪细胞特异性表达的Adipoq-Cre工具鼠杂交[4,20],获得子代F1:Adipoq-CreTg/+;loxP-STOP-loxP/+,继而F1与loxP-STOP-loxP/loxP-STOP-loxP纯合小鼠杂交,获得F2:Adipoq-CreTg/+;loxP-STOP-loxP/loxP-STOP-loxP(= 6)与loxP-STOP-loxP/loxP-STOP-loxP同窝对照小鼠(= 7),分别标识为Adp-Y4与Y4-KO(图5A)。

图1 NPY在不同部位脂肪组织的免疫荧光图
脂肪组织NPY的免疫荧光信号。EGFP标记显示为绿色;DAPI染细胞核,显示为蓝色;曝光时间300 ms,标尺:100 μm。
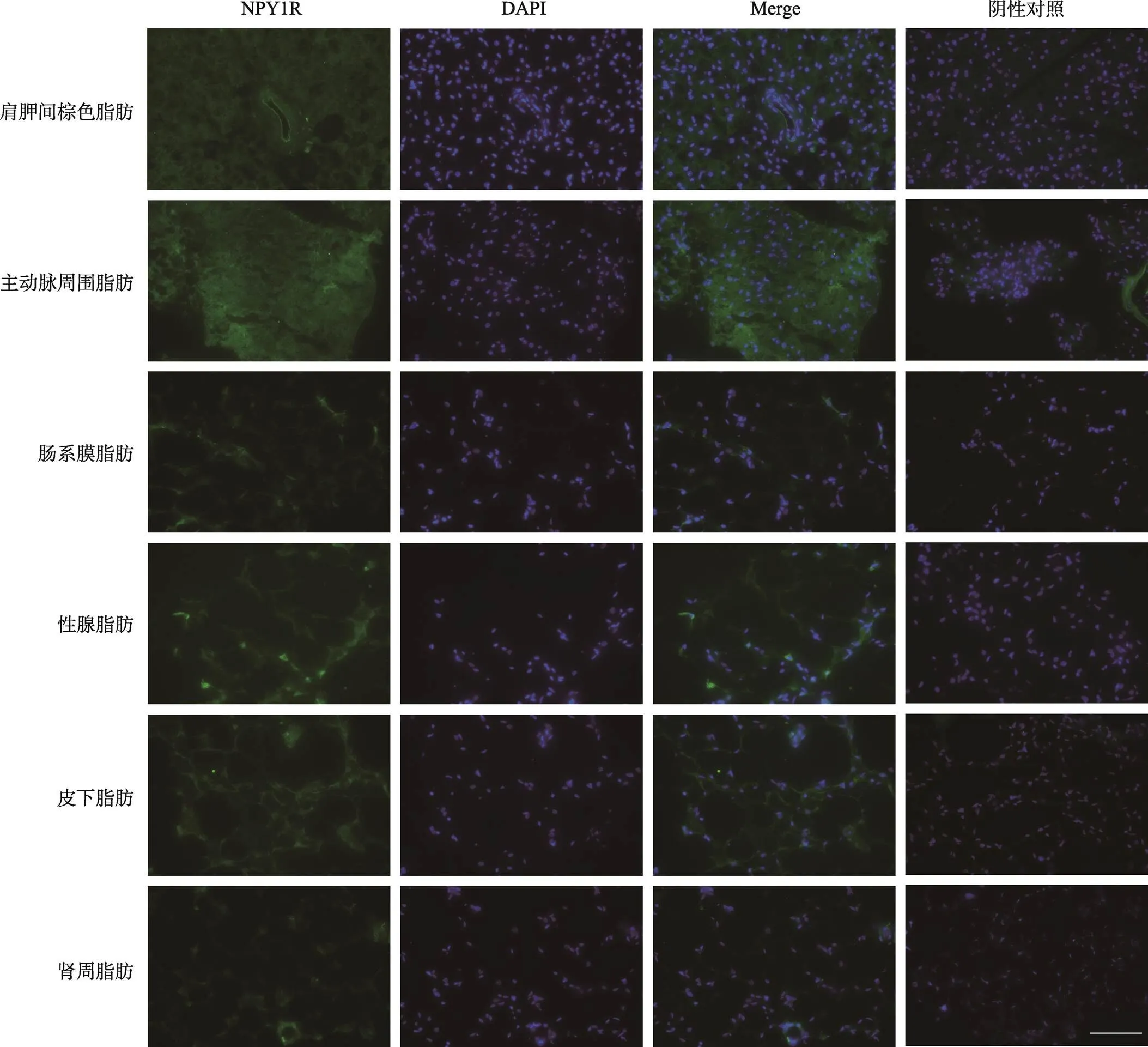
图2 NPY1R受体在不同部位的脂肪组织的免疫荧光图
脂肪组织NPY1R的免疫荧光信号。EGFP标记显示为绿色;DAPI染细胞核,显示为蓝色;曝光时间300 ms,标尺:100 μm。
研究采用基因组DNA的loxP剪接事件来明确Y4-KO与Adp-Y4是否实现。研究组提取了Y4-KO和Adp-Y4以及非同窝野生型雌鼠皮下脂肪组织的基因组DNA,进行PCR基因鉴定(= 6)。如图5A所示,Y4-KO小鼠在258 bp出现携带loxP-STOP- loxP序列的特征条带;Adp-Y4小鼠在258 bp和165 bp均出现了特征条带,165 bp条带表明Adp-Y4小鼠脂肪组织发生了loxP剪接,实现脂肪细胞回复表达Y4;野生型WT组仅在131 bp出现了特征条带,表明其不携带loxP序列,符合预期。
此外,为了进一步明确成熟脂肪细胞的NPY4R蛋白表达情况,本研究设置了三组,即Y4-KO、Adp-Y4小鼠和WT小鼠,检测NPY4R在肩胛间棕色脂肪和性腺脂肪的免疫荧光信号水平及其分布情况。结果表明,Y4-KO小鼠的棕色脂肪(图5B)和性腺脂肪(图5C)的成熟脂肪细胞NPY4R的荧光信号极为微弱,而Adp-Y4小鼠和WT小鼠在上述脂肪组织的成熟脂肪细胞具有相当强度的NPY4R荧光信号。上述结果表明,Adp-Y4小鼠实现脂肪细胞特异的回复性表达。
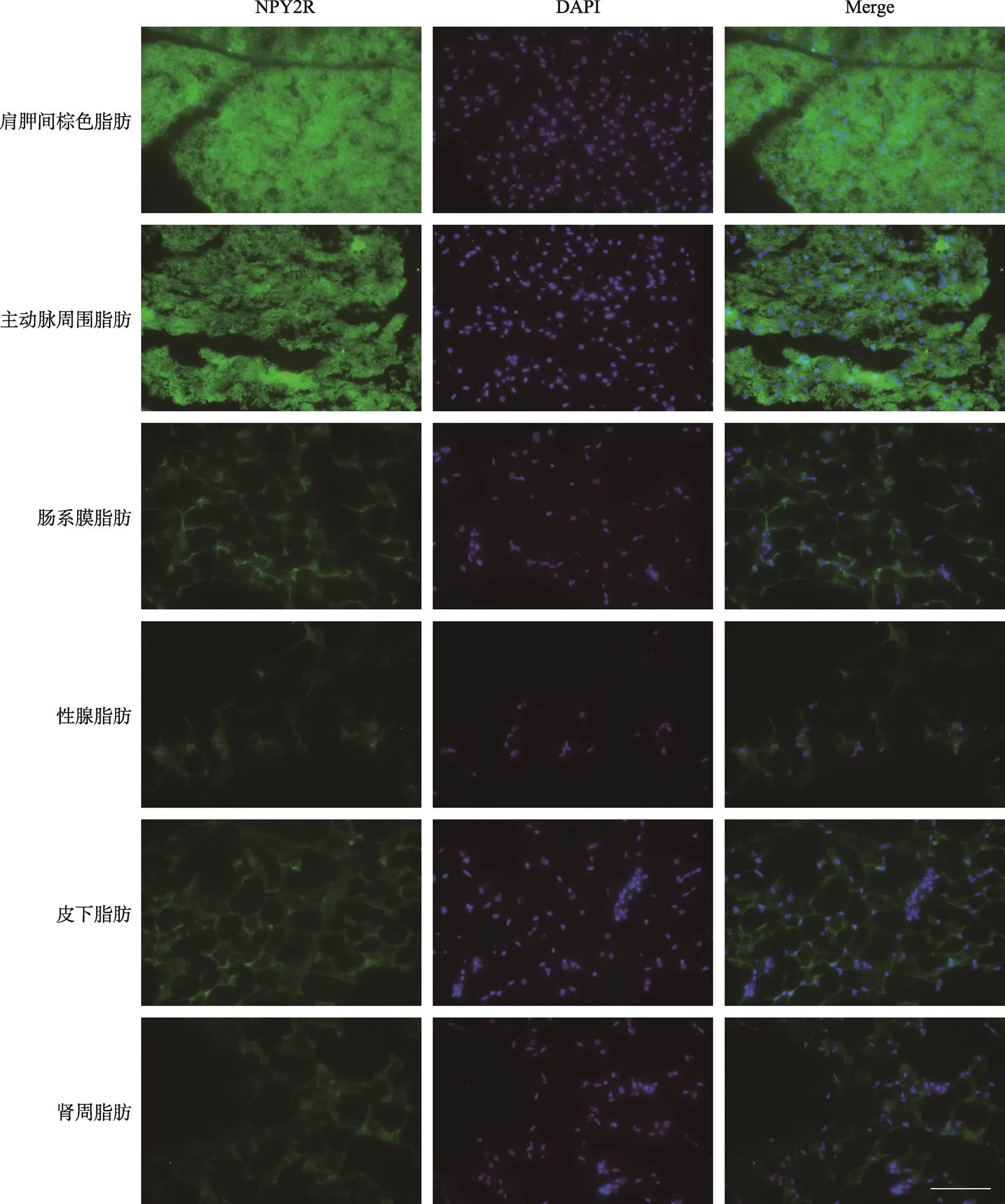
图3 NPY2R受体在不同部位的脂肪组织的免疫荧光图
脂肪组织NPY2R的免疫荧光信号。EGFP标记显示为绿色;DAPI 染细胞核,显示为蓝色;曝光时间300 ms,标尺:100 μm。
2.3 脂肪细胞Npy4r促进高脂诱导肥胖
为了初步探明Adp-Y4对体重稳态与饮食性肥胖的影响,本研究追踪Y4-KO与Adp-Y4小鼠在高脂喂食下的体重变化规律。通过对15周龄小鼠喂食17周高脂饲料,同时每周测量体重,Adp-Y4显著增加体重(图6A)与体重增量(图6B)(2-way ANOVA,体重:< 0.0001,体重增量:< 0.0001)。饮食性肥胖伴随糖耐量受损的发生。研究开展了两次葡萄糖耐受实验。在高脂喂食12周后,用1.5 g/kg剂量进行葡萄糖腹腔注射,采集小鼠尾静脉血检测血糖;发现近一半的小鼠在某些时间点的血糖值超出量程。休息2周即在高脂进食14周后,用较低的1 g/kg剂量行腹腔注射葡萄糖,检测尾静脉血糖;结果表明Adp-Y4与Y4-KO不具有统计学意义上显著的差异,但提示一种趋势,即Adp-Y4较Y4-KO小鼠表现出更大的糖耐量受损(图6C)。
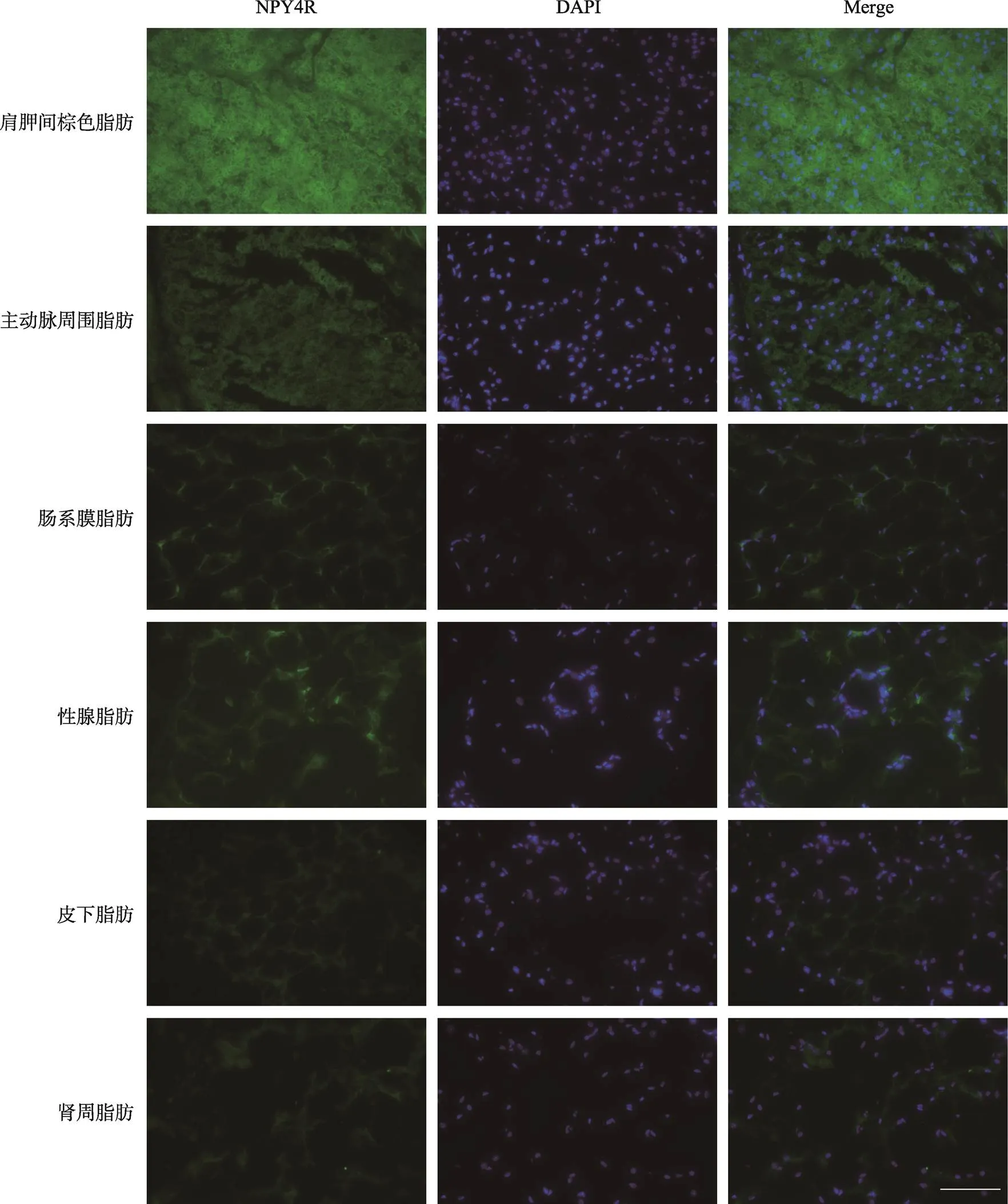
图4 NPY4R受体在不同部位的脂肪组织的免疫荧光图
脂肪组织NPY4R的免疫荧光信号。EGFP标记显示为绿色;DAPI染细胞核,显示为蓝色;曝光时间300 ms,标尺:100 μm。
3 讨论
本研究通过免疫荧光成像分析,首次揭示NPY及其外周主要受体在脂肪组织的蛋白表达水平与分布。NPY在肩胛间棕色脂肪和皮下脂肪的围绕血管区域以点状形式表达,这可能与NPY来自血管附近的神经末梢释放有关。NPY系统的各受体在脂肪组织的空间分布上具有明显的不同:NPY1R在性腺脂肪、肩胛间棕色脂肪和主动脉周围脂肪较为富集,NPY2R在棕色脂肪较为富集,NPY4R在肩胛间棕色脂肪与性腺脂肪较为富集。既往研究表明外周NPY1R与NPY2R分别通过抑制脂肪组织的能量代谢或血管与炎症微环境重构促进饮食性肥胖[13~15]。本研究免疫荧光成像实验的结果在支持既往研究的基础上,提示肩胛间棕色脂肪细胞与主动脉脂肪细胞可能是NPY1R和NPY2R信号通路促进饮食性肥胖的重要靶细胞。本研究免疫荧光实验使用的抗体在免疫荧光、免疫组化和免疫印迹实验得到较多应用,并且除NPY抗体都具有研究资源识别码(research resource identification code,RRID),是目前检测NPY受体信号通路蛋白的主流试剂。免疫荧光实验尽管简洁直观,但属于定性或半定量实验,对这些蛋白受体的精确定量方法仍然有待于继续研究与开发。
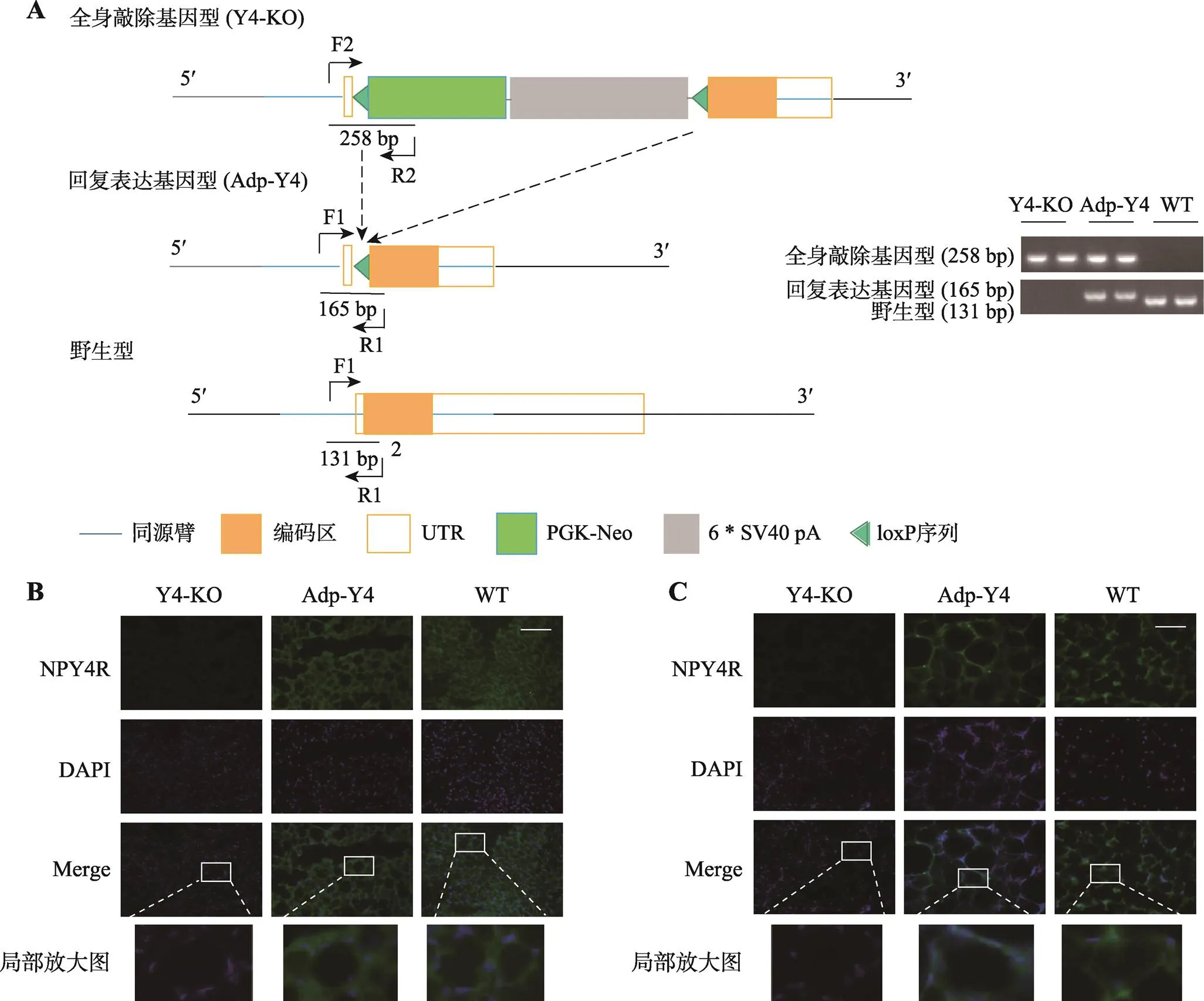
图5 脂肪细胞Npy4r基因回复表达小鼠的构建
A:左图为Y4-KO小鼠以及脂肪细胞回复表达小鼠Adp-Y4构建原理;右图为PCR分析小鼠皮下脂肪组织DNA鉴定Y4-KO小鼠(Y4-KO,258 bp)、脂肪细胞特异性突变小鼠未发生Cre-loxP位点剪接的细胞(Y4-KO,258 bp)和发生Cre-loxP位点剪接的脂肪细胞(Adp-Y4,165 bp)、野生型小鼠(非同窝小鼠,Wild-type,WT,131 bp)。B和C:Y4-KO、Adp-Y4和WT小鼠的脂肪组织NPY4R免疫荧光图。肩胛间棕色脂肪(B)和性腺脂肪(C),WT小鼠为非高脂喂养的非同窝小鼠,EGFP标记显示为绿色;DAPI 染细胞核,显示为蓝色;曝光时间200 ms,标尺:100 μm。
NPY1R与NPY2R是外周组织的主要NPY受体[12],这两种受体蛋白在脂肪组织的差异化表达为NPY系统多样化复杂的时空调节机制提供了重要的分子基础。最近靶向外周NPY1R的研究提示棕色脂肪和米色脂肪的适应性产热功能是阻断外周NPY1R受体信号实现减重的主要机制[13]。值得一提的是白色脂肪的甘油三脂裂解是棕色脂肪适应性产热的直接游离脂肪酸来源,而棕色脂肪本身的甘油三脂裂解不是[23,24]。结合本研究的数据分析:白色脂肪细胞、肩胛间棕色脂肪细胞与主动脉周围脂肪细胞的NPY1R可能是外周NPY1R抑制剂减重的主要靶点,尤其是相比于其他部位的棕色或米色脂肪细胞的NPY1R。外周NPY2R的功能有抑制能量代谢[15]与促进脂肪组织重构[14]两种观点。本研究的数据显示,NPY2R蛋白在经典的肩胛间棕色脂肪和新近发现的主动脉棕色脂肪[1,25]都大量表达,提示棕色脂肪细胞的NPY2R可能比已经报道的白色脂肪细胞的NPY2R发挥更重要的功能,因而在肯定两种观点的同时,支持能量代谢的调节是脂肪细胞NPY2R的主要功能。
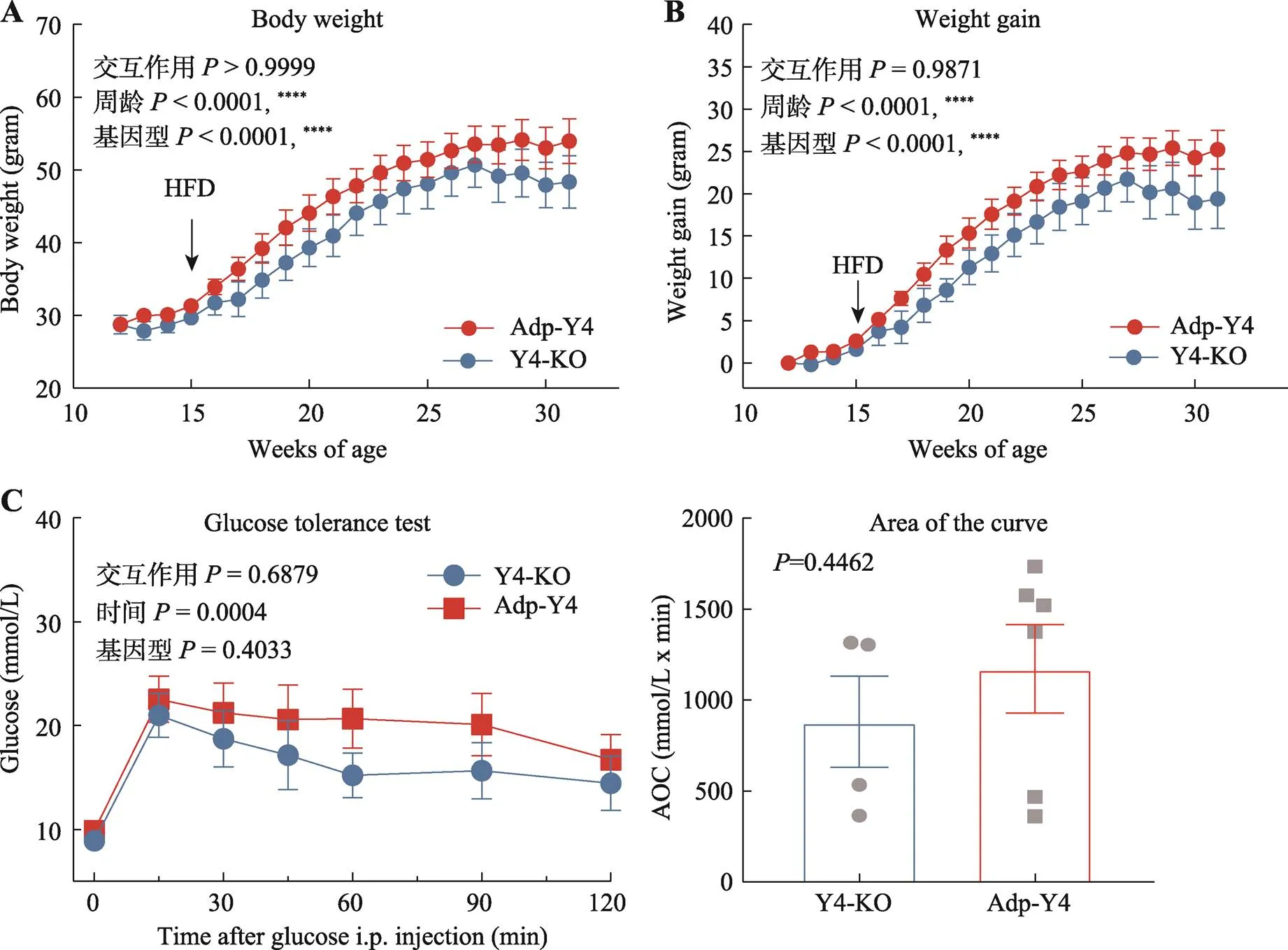
图6 高脂喂养小鼠的体重以及葡萄糖耐量检测
A:小鼠体重-时间曲线(Y4-KO:= 6;Adp-Y4:= 6);B:小鼠体重增量-时间曲线;C:葡萄糖-时间曲线(Y4-KO:= 4;Adp-Y4:= 6)。曲线面积(AOC)分析结果在右侧:测量曲线下面积(AUC)减去起始葡萄糖基线以下的面积。数据表示为平均值±标准误差。统计方法:双因素方差分析或非配对检验(图C右图)。< 0.05时差异显著,****< 0.0001。
NPY4R受体的外周调节功能研究较少,但与脂肪组织功能有一定联系。例如的全身敲除抑制小鼠的饮食性肥胖[19]。通过卵子特异表达的Cre驱动的条件性敲除实现的全身敲除降低了体重与脂肪含量,显著改善了生殖功能,不影响甚至增加瘦素基因()突变引起的肥胖[17]。本研究通过将最近在研究外周生物钟功能中采用的条件性回复表达技术[26,27]应用在脂肪细胞研究中,发现脂肪细胞促进饮食性肥胖。既往研究认为白色脂肪表达基因[12],而本研究发现NPY4R受体蛋白除了在白色脂肪,还在棕色脂肪有较高表达,提示棕色脂肪细胞的NPY4R可能具有代谢调节功能。NPY4R作为Class A/1 G蛋白偶联受体(GPCR),通过结合Gi蛋白,抑制cAMP-PKA信号通路活性[28]。脂肪细胞Gi通过抑制cAMP-PKA信号通路活性,抑制甘油三酯分解,提高胰岛素敏感性[29]。脂肪细胞Gi的敲除小鼠和化学小分子激活小鼠并没有体重表型的差异,不过体重表型有待在长时程的饮食性肥胖模型中进一步明确。因此,NPY4R可能通过Gi抑制cAMP-PKA信号,促进脂肪积累,但不排除存在其他信号通路介导脂肪细胞NPY4R发挥的促进饮食性肥胖的作用,甚至后者是主要的脂肪细胞NPY4R下游通路。
本研究采用一种新的基因改造小鼠模型研究脂肪细胞基因功能。通常采用脂肪细胞特异性敲除或者过表达目的基因研究某基因的生理或病理生理学功能。基因敲除模型能够检验必要性,过表达模型检验充分性。然而过表达模型极可能因为基因表达水平远超出生理范围,而引起系统性误差。化学遗传学或光遗传学方法提供一种替代过表达模型的方案。相比于这些替代模型,通过在目的基因插入条件性转录终止序列(loxP-STOP-loxP),并在脂肪特异性Adipoq-Cre作用下,实现基因静默小鼠的脂肪细胞特异性回复表达目的基因。该策略运用Cre工具小鼠激活靶细胞Cre活性,利用目的基因的内源性启动子实现生理范围的回复表达,并维持其他细胞目的基因的静默状态。这样的脂肪细胞回复性表达动物模型实现与基因敲除动物模型的完全互补,为检验目的基因功能的充分性提供了更好的选择。然而本研究也存在不足,由于生物学重复数随着Y4-KO小鼠的意外死亡减少,本研究观察到糖耐量的差异趋势,但没有得出有统计学意义的结论。这可能与本研究开始高脂喂养的小鼠周龄较大有关(15周龄,相比于通常的6周龄)。深入的研究需要设置野生型对照或全身回复表达的实验组作为严谨的质量控制组,并根据统计效能分析结果增加实验小鼠数量(≥12)。
总之,本研究揭示了NPY及其外周受体在脂肪组织的蛋白水平与分布,构建了脂肪细胞回复表达的全身基因静默小鼠模型,发现脂肪细胞促进饮食性肥胖。组织或细胞特异性回复表达已静默的基因将为代谢生物学研究提供新的研究方法和思路。
感谢澳大利亚Garvan医学研究所石雁川教授的批评与指导;感谢本科室硕士研究生包鑫余同学对原始数据与作图数据的完整性与一致性的核查。
[1] Cypess AM. Reassessing human adipose tissue., 2022, 386(8): 768–779.
[2] Zeng F, Wang L, Wan XQ, Huang RF, Zhang ZH, Li MD. Targeting leptin-positive adipocytes by expressing the Cre recombinase transgene under the endogenous leptin gene., 2022, 44(10): 950–957.
曾帆, 王澜, 万小勤, 黄荣凤, 张志辉, 李旻典. 瘦素基因启动的新型脂肪细胞表达Cre工具小鼠的构建. 遗传, 2022, 44(10): 950–957.
[3] Duerrschmid C, He YL, Wang CM, Li C, Bournat JC, Romere C, Saha PK, Lee ME, Phillips KJ, Jain M, Jia P, Zhao ZM, Farias M, Wu Q, Milewicz DM, Sutton VR, Moore DD, Butte NF, Krashes MJ, Xu Y, Chopra AR. Asprosin is a centrally acting orexigenic hormone., 2017, 23(12): 1444–1453.
[4] Li MD, Vera NB, Yang YF, Zhang BC, Ni WM, Ziso- Qejvanaj E, Ding S, Zhang KS, Yin RN, Wang SM, Zhou X, Fang EX, Xu T, Erion DM, Yang XY. Adipocyte OGT governs diet-induced hyperphagia and obesity., 2018, 9(1): 5103.
[5] Zeng WW, Pirzgalska RM, Pereira MMA, Kubasova N, Barateiro A, Seixas E, Lu YH, Kozlova A, Voss H, Martins GG, Friedman JM, Domingos AI. Sympathetic neuro- adipose connections mediate leptin-driven lipolysis., 2015, 163(1): 84–94.
[6] Chi JY, Wu ZH, Choi CHJ, Nguyen L, Tegegne S, Ackerman SE, Crane A, Marchildon F, Tessier-Lavigne M, Cohen P. Three-Dimensional adipose tissue imaging reveals regional variation in beige fat biogenesis and PRDM16-dependent sympathetic neurite density., 2018, 27(1): 226–236.e3.
[7] Jiang HC, Ding XF, Cao Y, Wang HH, Zeng WW. Dense intra-adipose sympathetic arborizations are essential for cold-induced beiging of mouse white adipose tissue., 2017, 26(4): 686–692.e3.
[8] Zeng X, Ye MC, Resch JM, Jedrychowski MP, Hu B, Lowell BB, Ginty DD, Spiegelman BM. Innervation of thermogenic adipose tissue via a calsyntenin 3beta-S100b axis., 2019, 569(7755): 229–235.
[9] Wang Y, Leung VH, Zhang YX, Nudell VS, Loud M, Servin-Vences MR, Yang D, Wang K, Moya-Garzon MD, Li VL, Long JZ, Patapoutian A, Ye L. The role of somatosensory innervation of adipose tissues., 2022, 609(7927): 569–574.
[10] Myers MG Jr, Affinati AH, Richardson N, Schwartz MW. Central nervous system regulation of organismal energy and glucose homeostasis.,2021, 3(6): 737–750.
[11] Rossi MA, Stuber GD. Overlapping brain circuits for homeostatic and hedonic feeding., 2018, 27(1): 42–56.
[12] Loh K, Herzog H, Shi YC. Regulation of energy homeostasis by the NPY system.,2015, 26(3): 125–135.
[13] Yan CX, Zeng TS, Lee KL, Nobis M, Loh K, Gou LN, Xia ZF, Gao ZM, Bensellam M, Hughes W, Lau J, Zhang L, Ip CK, Enriquez R, Gao H, Wang QP, Wu Q, Haigh JJ, Laybutt DR, Timpson P, Herzog H, Shi YC. Peripheral- specific Y1 receptor antagonism increases thermogenesis and protects against diet-induced obesity., 2021, 12(1): 2622.
[14] Kuo LE, Kitlinska JB, Tilan JU, Li LJ, Baker SB, Johnson MD, Lee EW, Burnett MS, Fricke ST, Kvetnansky R, Herzog H, Zukowska Z. Neuropeptide Y acts directly in the periphery on fat tissue and mediates stress-induced obesity and metabolic syndrome., 2007, 13(7): 803–811.
[15] Shi YC, Lin S, Castillo L, Aljanova A, Enriquez RF, Nguyen AD, Baldock PA, Zhang L, Bijker MS, Macia L, Yulyaningsih E, Zhang H, Lau J, Sainsbury A, Herzog H. Peripheral-specific y2 receptor knockdown protects mice from high-fat diet-induced obesity., 2011, 19(11): 2137–2148.
[16] Rangwala SM, D'Aquino K, Zhang YM, Bader L, Edwards W, Zheng SM, Eckardt A, Lacombe A, Pick R, Moreno V, Kang LJ, Jian WY, Arnoult E, Case M, Jenkinson C, Chi E, Swanson RV, Kievit P, Grove K, Macielag M, Erion MD, SinhaRoy R, Leonard JN. A long-acting PYY(3-36) analog mediates robust anorectic efficacy with minimal emesis in nonhuman primates.,2019, 29(4): 837–843.e5.
[17] Sainsbury A, Schwarzer C, Couzens M, Jenkins A, Oakes SR, Ormandy CJ, Herzog H. Y4 receptor knockout rescues fertility in ob/ob mice.,2002, 16(9): 1077–1088.
[18] Lin S, Shi YC, Yulyaningsih E, Aljanova A, Zhang L, Macia L, Nguyen AD, Lin EJ, During MJ, Herzog H, Sainsbury A. Critical role of arcuate Y4 receptors and the melanocortin system in pancreatic polypeptide-induced reduction in food intake in mice., 2009, 4(12): e8488.
[19] Sainsbury A, Bergen HT, Boey D, Bamming D, Cooney GJ, Lin S, Couzens M, Stroth N, Lee NJ, Lindner D, Singewald N, Karl T, Duffy L, Enriquez R, Slack K, Sperk G, Herzog H. Y2Y4 receptor double knockout protects against obesity due to a high-fat diet or Y1 receptor deficiency in mice.,2006, 55(1): 19–26.
[20] Eguchi J, Wang X, Yu ST, Kershaw EE, Chiu PC, Dushay J, Estall JL, Klein U, Maratos-Flier E, Rosen ED. Transcriptional control of adipose lipid handling by IRF4., 2011, 13(3): 249–259.
[21] Kong XX, Banks A, Liu TM, Kazak L, Rao RR, Cohen P, Wang X, Yu ST, Lo JC, Tseng YH, Cypess AM, Xue RD, Kleiner S, Kang S, Spiegelman BM, Rosen ED. IRF4 is a key thermogenic transcriptional partner of PGC-1alpha., 2014, 158(1): 69–83.
[22] Virtue S, Vidal-Puig A. GTTs and ITTs in mice: simple tests, complex answers., 2021, 3(7): 883–886.
[23] Shin H, Ma YY, Chanturiya T, Cao Q, Wang YL, Kadegowda AKG, Jackson R, Rumore D, Xue BZ, Shi H, Gavrilova O, Yu LQ. Lipolysis in brown adipocytes is not essential for cold-induced thermogenesis in mice., 2017, 26(5): 764–777.e5.
[24] Zhao QW, Pan DN. Progress on the epigenetic regulation of adipose tissue thermogenesis., 2022, 44(10): 867–880.
赵清雯, 潘东宁. 表观遗传修饰对脂肪组织产热的调控进展. 遗传, 2022, 44(10): 867–880.
[25] Tang Y, He Y, Li C, Mu WJ, Zou Y, Liu CH, Qian SW, Zhang FC, Pan JB, Wang YN, Huang HY, Pan DN, Yang PY, Mei J, Zeng R, Tang QQ. RPS3A positively regulates the mitochondrial function of human periaortic adipose tissue and is associated with coronary artery diseases, 2018, 4: 52.
[26] Koronowski KB, Kinouchi K, Welz PS, Smith JG, Zinna VM, Shi JJ, Samad M, Chen SW, Magnan CN, Kinchen JM, Li W, Baldi P, Benitah SA, Sassone-Corsi P. Defining the independence of the liver circadian clock., 2019, 177(6): 1448–1462.e14.
[27] Welz PS, Zinna VM, Symeonidi A, Koronowski KB, Kinouchi K, Smith JG, Guillén IM, Castellanos A, Furrow S, Aragón F, Crainiciuc G, Prats N, Caballero JM, Hidalgo A, Sassone-Corsi P, Benitah SA. BMAL1-driven tissue clocks respond independently to light to maintain homeostasis., 2019, 177(6): 1436–1447.e12.
[28] Tang TT, Tan QX, Han S, Diemar A, Löbner K, Wang HY, Schüß C, Behr V, Mörl K, Wang M, Chu XJ, Yi CY, Keller M, Kofoed J, Reedtz-Runge S, Kaiser A, Beck-Sickinger AG, Zhao Q, Wu B. Receptor-specific recognition of NPY peptides revealed by structures of NPY receptors.,2022, 8(18): eabm1232.
[29] Wang L, Pydi SP, Zhu L, Barella LF, Cui YH, Gavrilova O, Bence KK, Vernochet C, Wess J. Adipocyte G(i) signaling is essential for maintaining whole-body glucose homeostasis and insulin sensitivity., 2020, 11(1): 2995.
Adipocyte reconstitution ofgene insilenced mice promotes diet-induced obesity
Lan Wang, Fan Zeng, Rongfeng Huang, Shu Lin, Zhihui Zhang, Min-Dian Li
,,,,,,
Neural regulation of adipose tissue is crucial in the homeostasis of energy metabolism. Adipose tissue neuropeptide Y (NPY) and its receptors contribute to the development of diet-induced obesity. NPY1R and NPY2R are major receptors for NPY in peripheral tissues including the adipose tissue. NPY receptor 4 () gene is expressed in adipose tissue. However, it is unknown whetheris involved in the development of diet-induced obesity. Here, we established an immunofluorescence microscopy technique and generated an adipocyte-reconstitutedgene knockout mouse. Among six adipose depots, we found that NPY is highly expressed around the vasculature in a dot-like fashion in interscapular brown fat and subcutaneous fat, and NPY receptors are expressed in a depot-specific manner. NPY1R is highly expressed in epidydimal fat, interscapular and peri-aortic brown fat, NPY2R in both interscapular and peri-aortic brown fat, and NPY4R in both brown fat and epidydimal fat. Next, we showed that adipocyte-reconstituted expression ofpromoted diet-induced obesity in mice (< 0.0001). Overall, this study defines the abundance and distribution of NPY and its receptors 1, 2, and 4 in mouse adipose depots, and demonstrates in an adipocyte-reconstituted gene knockout model that adipocyteis sufficient to promote diet-induced obesity.
Conditionally reconstituted gene knockout; loxP-STOP-loxP; adipocyte; adipose tissue; obesity
2022-10-13;
2023-01-30;
2023-02-03
国家自然科学基金青年科学基金项目(编号:81900776)资助 [Supported by the National Natural Science Foundation of China (No. 81900776)]
王澜,硕士,研究实习员,研究方向:代谢生物钟与心血管疾病。E-mail: 770944509@qq.com
李旻典,博士,研究员,科室副主任,研究方向:代谢生物钟与心血管疾病。E-mail: mindianli@tmmu.edu.cn
10.16288/j.yczz.22-302
(责任编委: 孟卓贤)
