基于T1纹理特征的阿尔茨海默病性别差异研究
2023-03-02黄子昂李晓舒朱婉秋高子雯李雨晴周珊珊余永强
黄子昂,李 慧,李晓舒,朱婉秋,高子雯,李雨晴,周珊珊,余永强
阿尔茨海默病(Alzheimer's disease,AD)是一种慢性神经系统的退行性疾病,主要表现为进行性的记忆丧失。aMCI是介于正常衰老和痴呆之间的一种状态,患者存在认知能力下降,但未达到痴呆的诊断标准,是AD的临床前期[1]。
目前诊断AD的方法主要有临床认知评估,磁共振(MRI)结构、结构像纹理分析[2]等。而影像组学作为一种新兴的诊断方法,其基本原理是假设电子医学图像包含视觉感知之外的信息,这些信息可以很好地反映组织特性,也能提高诊断或预后的准确性[3]。而女性的AD患病率约是男性的两倍,在临床表现和疾病进展上也存在诸多不同[4-6],因此探索AD的性别差异是非常重要的临床问题。本研究创新性的关注了AD的性别差异,选取了与AD脑损害关系密切的多个脑区作为感兴趣区域(region of interest,ROI),提取并筛选影像组学特征,旨在得出AD患者影像组学纹理特征的性别差异,及对不同性别AD患者诊断的预测能力,以期为AD的早期诊疗提供帮助。
1 材料与方法
1.1 研究对象收集2017年5月-2022年8月就诊于安徽医科大学第一附属医院神经内科记忆障碍门诊AD患者77例,其中男35例,女42例。入组标准:患者及知情者有记忆障碍主诉;符合美国国立神经病、语言交流障碍和卒中研究所-老年性痴呆及相关疾病学会对AD的诊断标准;简易精神状态检查(Mini-Mental State Examination,MMSE)评分<24分;蒙特利尔认知评估(MoCA)评分<18分;临床痴呆评定量表(Clinical Dementia Rating Scale,CDR)评分>0.5分。排除标准:其他类型痴呆(如路易体痴呆、额颞叶痴呆等);合并其他精神障碍或药物、酒精依赖者;有过脑感染、外伤及手术者;有卒中病史;MR扫描禁忌证(如幽闭恐惧症、金属假牙或支架及高热)等[7]。aMCI患者74例,其中男35例,女39例。入组标准根据Petersen et al[8]在1999年提出的MCI诊断标准及美国国立老化研究所与阿尔茨海默病协会(National Institute on Aging-Alzheimer′s Association,NIA-AA)提出关于AD源性MCI的诊断标准:患者及知情者有记忆减退主诉;存在记忆减退的客观表现(记忆功能评分在匹配组分值1.5标准差以下);保留独立生活的基本能力;日常生活能力量表(Activity of Daily Living Scale,ADL)评分<23 分;MMSE评分≥24分,MoCA评分≥18分;CDR评分=0.5分。排除标准:同AD。正常对照(health control, HC)75例,其中男35例,女40例,正常对照为同期招募的社区志愿者。入组标准:无记忆障碍主诉;MMSE评分≥26分;MoCA评分≥24;CDR评分=0分;无精神疾病家族史;无脑卒中史等。本研究严格遵循赫尔辛基宣言标准,被试均知情同意。
1.2 影像数据采集使用GE Discovery 750w 3.0T MR扫描仪,24通道头颈部联合线圈获取影像数据。扫描前以海绵垫固定头部,嘱患者仰卧静止,闭目清醒,扫描常规T1WI、T2WI、FLAIR序列,以排除脑器质性疾病。
三维高分辨T1结构像采用全脑容积采集(the brain volume sequence,BRAVO)序列,扫描参数:TR 8.5 ms,TE 3.2 ms,TI 450 ms,翻转角12°,矩阵 256 × 256,FOV 25.6 cm× 25.6 cm,层厚1 mm,无层间隔,矢状位扫描188层,扫描时间4 min 56 s。
1.3 图像预处理采用优化的基于体素形态学测量方法,使用 Mricron 软件里的 dcm2nii 插件对原始的DICOM格式图像转换为Nifti格式图像,并对图像质量进行检查。
1.4 影像分析及统计方法
1.4.1人口基线统计学分析 使用SPSS 23.0软件对受试者人口基线信息进行统计学分析。三组之间符合正态分布、方差齐的计量资料采用方差分析,并进行post-hoc事后检验。性别组成使用卡方检验。各组男女之间采用独立样本t检验。
1.4.2脑区的分割及特征提取 选取与AD结构萎缩相关性较高的脑区(海马,丘脑,尾状核,壳核,苍白球,基底节区,岛叶,楔前叶,扣带回,角回,额中回,额下回,顶上小叶及顶下小叶,并进一步分成左右两个区域)作为ROI[9-11],由一名经验丰富的放射科医师使用ITK-SNAP软件动勾画分割相应脑区的所有层面(图1)。得出个体脑区后,使用GE Monogram的AK软件对这些脑区的影像组学特征进行提取,本研究提取的特征包括:① 一阶特征(First Order):体素强度的一阶统计特征值;② 形状特征(Shape):形状特征值;③ 灰度共生矩阵(GLCM):体现纹理变化快慢的高阶纹理特征值;④ 灰度行程矩阵(GLRLM):以描述像素值的分布的高阶纹理特征值;⑤ 灰度区域大小矩阵(GLSZM):以描述图像亮度的高阶纹理特征值。将获得的高维特征通过LASSO算法及小波分析进行降维处理,使受试者的每一个脑区都能得到828个特征。
1.4.3特征处理 将受试者的特征按AD、aMCI、HC设置label,从而分为AD-HC、AD-aMCI、aMCI-HC三组(如将AD和HC的特征设置label为0和1,然后使用IPMs软件对设置label的数据进行逐步分析,即对AD-HC这个分组数据进行分析,以此类推),再使用IPMs软件设置随机种子点为1,separate(训练数据与验证数据比例)为0.7,并对每一组数据进行标准化处理,随后进行特征的筛选,其中包括单因素特征筛选及多因素特征筛选。单因素特征筛选包括:① Correlation_XX(根据自变量与自变量的相关系数筛选);② Variance(根据方差筛选,方差大于选定值的自变量被保留);③ General_Univariate_analysis(采用t检验、秩和检验等方法综合分析,存在统计学差异的自变量被保留); ④ Univariate_Logistic(采用单因素逻辑回归进行分析,存在统计学差异的自变量被保留)。多因素特征筛选包括:① PCA(PCA降维至选定主成分);② Multivariate_Logistic(采用逐步逻辑回归进行分析,存在统计学差异的自变量被保留);③ GBDT(采用GBDT分析,保留对分类贡献大的自变量)。前后进行多种不同特征筛选,后一步筛选在前一步筛选的基础上进行。再按照上述操作分性别进行特征处理。其中P<0.05为差异有统计学意义。
图1 部分脑区3D T1勾画结构图
1.4.4分类分析 支持向量机(support vector machine, SVM)是一种普遍且经典的分类建模方法,旨在通过一个线性判别函数,获得两个类别之间的决策边界(这个决策边界被称为超平面,它的定位是尽可能远离每个分类中最近的数据点,而这些最近的点称为支持向量),从而达到预测和分类的效果。既往研究表明SVM具有较高的性能和泛化能力[12]。本研究将筛选后的特征输入SVM模型中,对ADvsHC、ADvsaMCI、aMCIvsHC分性别进行影像组学分类预测。使用线性核,采用留一法进行交叉验证。计算了分类的灵敏度、特异度、准确度(accuracy,ACC)及曲线下面积(area under curve, AUC)等指标。
2 结果
2.1 人口基线信息各组的年龄、性别组成差异均无统计学意义(P>0.05), AD组及MCI组教育程度及MMSE得分显著低于HC组(P<0.05),见表1、2。
2.2 SVM分类预测结果用支持向量机(SVM)将受试者按性别进行组间分类,ADvsHC的分类能力相较于ADvsaMCI、aMCIvsHC的灵敏度、特异度、AUC及ACC等识别指数均较高,而ADvsaMCI组相较于aMCIvsHC组的灵敏度、特异度、AUC及ACC也相对较高。而女性的ADvsHC、ADvsaMCI、aMCIvsHC的灵敏度、特异度、AUC及ACC普遍高于男性。
在男性的ADvsHC组中,部分ROI拥有较高的识别指数,其中海马、左侧海马、右侧海马、右侧丘脑、楔前叶、左侧楔前叶、右侧楔前叶、左角回、右侧额中回、右侧顶上小叶、顶下小叶、左侧顶下小叶的灵敏度、特异度、AUC能达到80%以上。ADvsaMCI组中,只有少数ROI有较好的灵敏度、特异度、AUC及ACC,其中左侧岛叶、左侧额中回、左侧顶下小叶的灵敏度、特异度、AUC能达到80%以上。而在aMCIvsHC组中,仅有丘脑、右侧额中回、右侧顶上小叶的灵敏度、特异度、AUC能达到70%以上(表3)。
在女性ADvsHC组中,绝大多数ROI具有较高的灵敏度、特异度、AUC及ACC,其中海马、左侧海马、左侧丘脑、右侧尾状核、基底节区、左侧基底节区、右侧基底节区、右侧角回的灵敏度、特异度、AUC能达到90%及以上,明显高于男性组。在ADvsaMCI组中,也有部分ROI有较高的灵敏度、特异度、AUC及ACC,其中右侧扣带回的AUC能够高达94.9%(图2)。而aMCIvsHC组中,只有海马、右侧基底节区、左侧岛叶的灵敏度、特异度、AUC能达到70%以上(表4)。
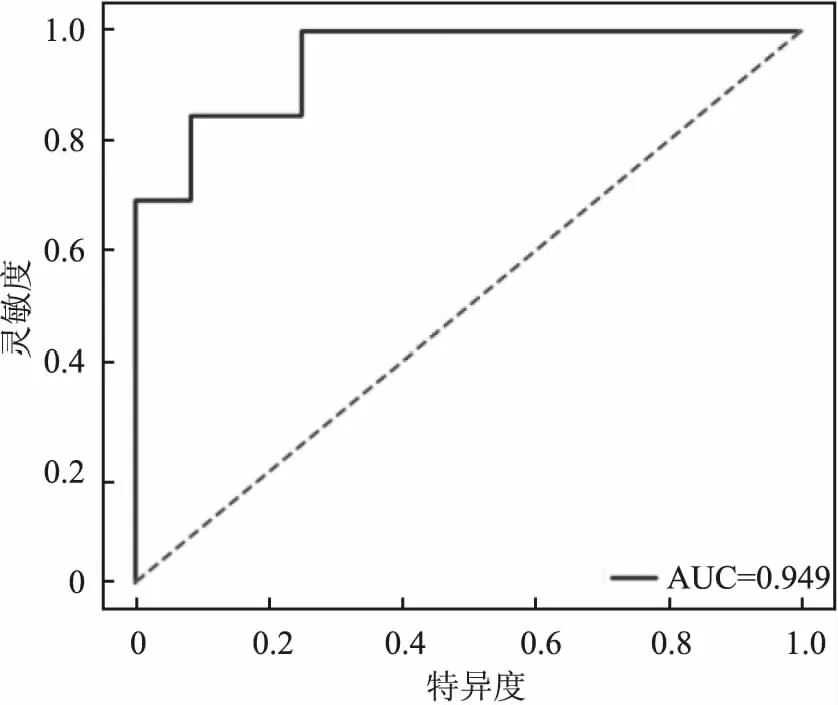
图2 右侧扣带回纹理特征对女性AD vs aMCI的分类能力
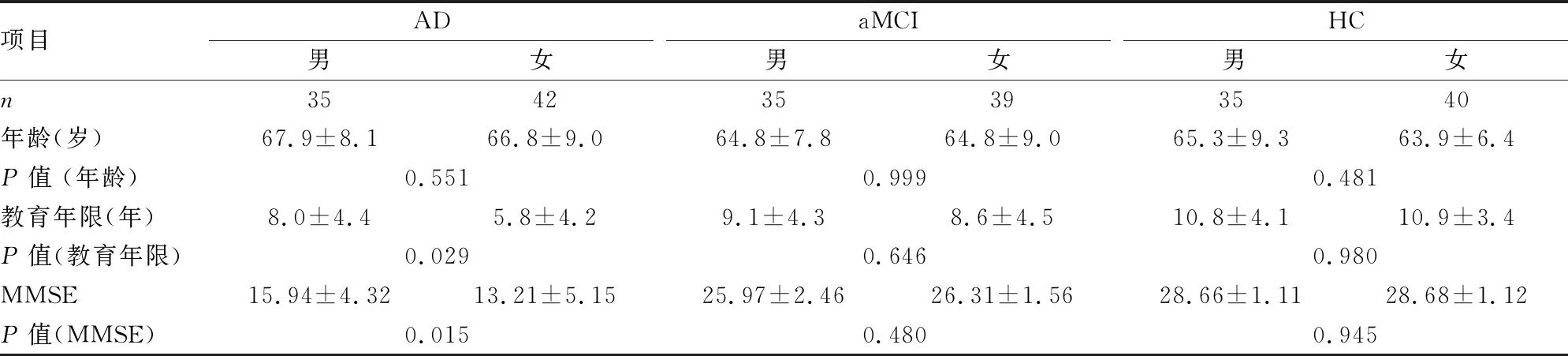
表1 组内按性别基本人口统计学资料

表2 组间按性别基本人口统计学资料
3 讨论
本研究主要从与AD结构变化关系较为密切的多个脑区入手,基于纹理特征的影像组学方法,对AD分性别进行预测。此前,虽有一些单个脑区基于纹理分析的AD影像组学方面的研究,但是多个脑区分性别的相关性研究鲜有报道。关注AD性别间的纹理差异及预测能力,对AD分性别的早期精准诊疗提供一定的借鉴性。
AD的进展存在着大脑结构和功能上的改变,随着成像技术的迅速发展,传统影像已经成为AD疾病管理中的重要模式,为临床提供了全面的视角和丰富的信息,在疾病筛查、早期诊断及治疗等方面起到了至关重要的作用,而影像组学则是在传统影像的基础上,通过深度挖掘数据,寻找出疾病的微环境信息及内涵特征,从而反映出疾病组织及细胞水平的变化,实现更高的精确度和生物信息的提取,并且通过对数据的分析及处理,使用机器学习的方法从中提取关键信息,对疾病进行精准量化评估,并最终用于疾病的辅助诊断及预测治疗。

表3 SVM按性别进行分类预测(男性)

表4 SVM按性别进行分类预测(女性)
本研究显示在不区分性别的情况下,ADvsHC组较ADvsaMCI组有较高的灵敏度、特异度、AUC及ACC,而ADvsaMCI组较aMCIvsHC组也具有较高的灵敏度、特异度、AUC及ACC。随着AD的进程,越来越多的脑区拥有较高的灵敏度、特异度、AUC及ACC,说明越来越多的脑区随着病情的发展参与进来,而在男性和女性的ADvsHC、ADvsaMCI、aMCIvsHC三组分析中,拥有较好灵敏度、特异度、AUC及ACC的脑区并不相同,这可能间接说明了男性与女性与AD损伤相关的脑区也不尽相同,提示了在日后的AD研究中,需要注意区分性别,将更有助于AD的精准诊疗。但是海马、左侧海马、右侧海马区域,在不同分组不同性别中均具有较高的灵敏度、特异度、AUC及ACC。这些区域与既往的一些研究一致[11-13]。AD是一个慢性退行性病变,随着疾病的加重,各个脑区都会呈现不同程度的萎缩。而海马相较于其他脑区结构受累最早,损伤的程度更加的明显,可作为一个稳定的生物标记来对AD进行早期识别及诊疗。而在分性别的研究中,发现女性的各组间灵敏度、特异度、AUC及ACC普遍高于男性的各组间指数。这说明,女性相较与男性,脑区的损害普遍明显,这可能与女性绝经后雌激素水平的显著下降,更容易受到AD病理的影响,教育程度普遍较低,拥有较低的脑储备及认知储备等一些因素关系密切[14]。
本研究还存在一定的局限性,首先,样本量相对较小;其次,本研究是横断面的研究,后期将纳入纵向研究对实验结果进行验证;最后,本研究的受试者虽然都是临床上通过详细的筛查量表及根据临床表现所纳入的,但是依旧缺少AD的病理学生物标志物。在以后的研究中,将继续扩大样本容量,完善多方面生物标志物相关检查,提高对AD的预测效果。
本研究基于纹理特征的影像组学方法,分组间和性别探索了AD进程中纹理特征的差异,以及对不同性别AD患者诊断的预测能力,提示了研究AD性别差异的重要性。本研究还为AD性别特异性的早期识别提供了一些可靠的生物标记,将有助于AD的精准诊疗。
