PRC1在胰腺癌中的细胞生物学功能及临床意义
2023-03-02马丹丹林振宇董庆泰萧正康李中虎张智勇金炜东
马丹丹,张 翌,林振宇,董庆泰,萧正康,李中虎,张智勇,金炜东
胰腺癌是常见的消化道恶性肿瘤之一,发病率和病死率逐年上升,其五年生存率小于8%,80% ~ 85%的患者存在不可切除或转移性疾病[1]。胰腺癌具有起病隐匿、进展迅速、侵袭能力强、总体预后差等特点,因此胰腺癌的诊疗给医务工作者带来巨大挑战。寻找能够早期筛查肿瘤的标志物迫在眉睫[2]。既往研究[3-5]表明胞质分裂调控蛋白1(protein regulating cytokinesis 1,PRC1)参与肝癌、胃癌、肺癌等多种恶性肿瘤的发生发展,均表现出癌基因特性,并与不良预后密切相关。但目前关于PRC1在胰腺癌中功能、临床意义及机制研究的报道甚少,其在胰腺癌中的作用不明确。该研究旨在探索PRC1在胰腺癌中的表达及其与预后的关系、细胞生物学功能及可能的机制,以期为胰腺癌患者早期诊断及预后判断提供新思路。
1 材料与方法
1.1 样本来源收集中部战区总医院普通外科2021年1—12月收治住院接受手术治疗的12例胰腺癌患者的组织标本及。此研究获得本院伦理委员会批准,患者及家属均签署知情同意书。伦理审批文书批号:[2019]002-1。
1.2 试剂和仪器PRC1、GAPDH单克隆抗体及辣根过氧化物酶标记的二抗均购于美国Abcam公司(货号:ab238427、ab245357、ab263962)。细胞凋亡检测试剂盒(货号:C1062M)购自碧云天生物科技有限公司,Matrigel基质胶(货号:356234)购自美国BD公司,Transwell小室(货号:3421)购自美国Corning公司。流式细胞仪(型号:Cyto Flex)购自贝克曼库尔特生命科学公司,显微镜(型号:BX53)购自日本Olympus公司,显影仪(型号:5100R)购自上海天能生物技术公司。人胰腺癌SW1990细胞株保存于本院中心实验室。
1.3 GEPIA数据库分析PRC1在胰腺癌组织及正常胰腺组织中的基因表达差异在GEPIA(http://gepia.cancer-pku.cn/)数据库中设定条件为:“gene: PRC1”、“expression diy:boxplot”、“cancer type:PAAD”,可获得PRC1在胰腺癌组织与正常胰腺组织中的表达差异。
1.4 免疫组织化学染色取出的组织常规甲醛固定包埋。玻片烤片、玻片脱蜡、抗原修复、内源性酶灭活。放于抗原修复盒中在室温条件下1 h封闭,按照1 ∶100比例滴加适量PRC1抗体孵育液到玻片上进行一抗孵育,4 ℃过夜,洗净一抗后加入辣根过氧化物酶标记的二抗(1 ∶1 000)孵育1 h。DAB显色、依次将切片放入70%乙醇溶液、80%乙醇溶液、90%乙醇溶液、95%乙醇溶液、无水乙醇I、无水乙醇II、二甲苯I、二甲苯II中脱水透明,中性树脂封片、每个组织样本中选择5 个视野拍照。
1.5 Western blot检测提取蛋白,测量蛋白浓度,配置分离胶和浓缩胶、蛋白上样、电泳、转膜、室温下封闭2 h,按照1 ∶1 000比例滴加PRC1抗体和GAPDH抗体孵育液进行一抗孵育,次日,加入1 ∶5 000 辣根过氧化物酶标记的二抗进行孵育。按照操作说明书配置显影液等量混合,在显影仪器中显影、保存数据后统计分析。
1.6 细胞培养及转染SW1990细胞培养于含10%胎牛血清(fetal bovine serum,FBS)的DMEM培养基中,37 ℃、5%CO2培养箱中培养。细胞接种于6孔板,待贴壁后,使用阳离子脂质载体Lipofectamine 3000将pcDNA3.1-PRC1质粒转染SW1990细胞作为过表达PRC1组(以PRC1表示),将空载体pcDNA3.1-vector质粒转染SW1990细胞作为其对照组(以Control表示)。靶向PRC1的小干扰RNA(SiRNA-PRC1)则根据NCBI数据库中PRC1基因序列设计原则设计合成,设为沉默PRC1组(以SiRNA-PRC1表示),同时合成随机阴性对照组序列SiRNA-Control(以SiRNA-control表示)。
1.7 CCK-8法检测细胞增殖胰酶消化各组细胞,制成细胞悬液,进行细胞计数。接种于96孔板,每孔加入100 μl含10%FBS的DMEM培养基,分别于培养24、48 h后加入CCK-8试剂 100 μl/孔,37 ℃培养箱孵育3 h后,在酶标仪上(设定波长450 nm)读取吸光度值。
1.8 Transwell实验检测细胞侵袭胰酶消化各组细胞,细胞计数,调整细胞密度为1.0×108个/L。将无血清的DMEM培养基加入带基质胶的Transwell小室上层,加入100 μl/孔细胞悬液。将600 μl含有FBS的培养基加入下室。培养箱中孵育48 h后,在室温下每孔加入4%多聚甲醛1 ml,固定10 min,甲醇对细胞通透处理20 min,0.1%结晶紫染液染色20 min,棉签擦去上室未迁移细胞,将Transwell小室膜切下,注意上下面,用不带二甲苯的封片剂封片。在显微镜下200倍拍照观察,统计结果。
1.9 流式细胞仪检测细胞凋亡用胰酶消化各组细胞,制成细胞悬浮液,细胞计数,调整密度为6.0×105个/ml。培养48 h后,PBS清洗2次,室温避光条件下,加入400 μl结合缓冲液重悬细胞,然后加入10 μl的 AnnexinV-FITC避光孵育15 min,再加入5 μl的碘化丙啶(PI)避光染色5 min。1 h内使用流式细胞仪检测细胞凋亡率。
1.10 PRC1表达量数据获取与分组在TCGA数据库中,同时具有PRC1表达量数据及对应临床病理资料的患者共174例。以胰腺癌患者PRC1 mRNA表达量的中位数为分割点将患者分为PRC1高表达组与PRC1低表达组。
1.11 STRING数据库分析PRC1相互作用蛋白网络在STRING数据库主界面中搜索蛋白名称“PRC1”,选择物种“Homo sapiens”,获得PRC1在人类细胞中的蛋白相互作用网络。STRING数据库的目的是收集和整合表达蛋白之间相互作用的所有功能,将已知和预测的大量生物体的蛋白质-蛋白质关联数据合并起来。综合得分(Combined score)越接近1越能表明蛋白分子间存在相互作用,分数越接近0 则表明蛋白分子间存在相互作用的可能性越低。
1.12 基因集富集分析本研究利用基因集富集分析(gene set enrichment analysis, GSEA)研究PRC1 mRNA表达水平与京都基因和基因组百科全书通路基因集的相关性。设定运行条件为:“Number of permutations”中选择“1 000”,“Phenotype labels”中选择“h_versus_l”, “Permutation type”中选择“phenotype”。
1.13 统计学处理细胞实验数据分析使用SPSS 26.0统计软件,计量资料以均数±标准差表示,两组间均数的比较用独立样本t检验。胰腺癌患者临床病理特征与预后的关系采用Cox回归分析,利用Kaplan-Meier法绘制胰腺癌患者生存曲线。P<0.05为差异有统计学意义。
2 结果
2.1 数据库中PRC1 mRNA基因表达变化GEPIA数据库分析结果显示,胰腺癌组织中的PRC1 mRNA表达量高于其在正常胰腺组织的表达,差异有统计学意义(P<0.05)。见图1。
2.2 免疫组织化学染色结果免疫组织化学染色结果显示,在胰腺癌旁组织中,细胞排列整齐、形态规则,PRC1染色以浅黄色为主。在胰腺癌组织中,癌细胞排列紊乱、核大深染、形态不规则,PRC1染色以棕褐色为主,且定位于细胞质。见图2。
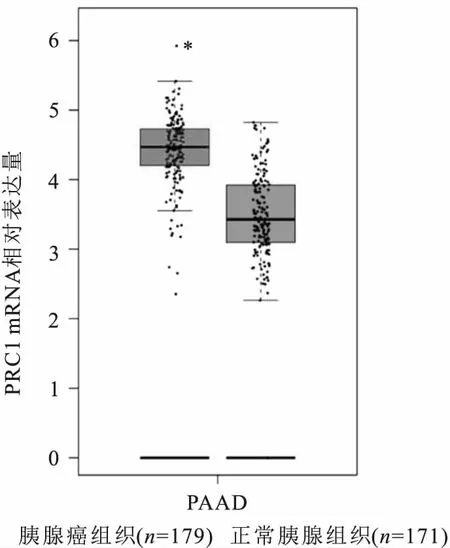
图1 数据库中PRC1 mRNA基因表达变化

图2 免疫组织化学染色结果 ×400
2.3 PRC1蛋白表达变化Western blot法检测结果显示,PRC1在胰腺癌组织中的蛋白表达显著高于胰腺癌旁组织[(1.950 ± 0.151)vs(0.358 ± 0.079),t=32.369,P<0.01]。见图3。
2.4 细胞转染效率的验证针对PRC1的pcDNA3.1-PRC1质粒和SiRNA转染人胰腺癌细胞系SW1990 48 h后,Western blot检测结果显示,PRC1组蛋白表达水平显著高于Control组。SiRNA-PRC1组细胞中PRC1蛋白水平显著低于SiRNA-control组。见图4。因此,本研究设计的pcDNA3.1-PRC1能过表达PRC1,SiRNA-PRC1能沉默PRC1基因的表达,可用于进一步研究PRC1在胰腺癌细胞系SW1990中的细胞生物学功能。
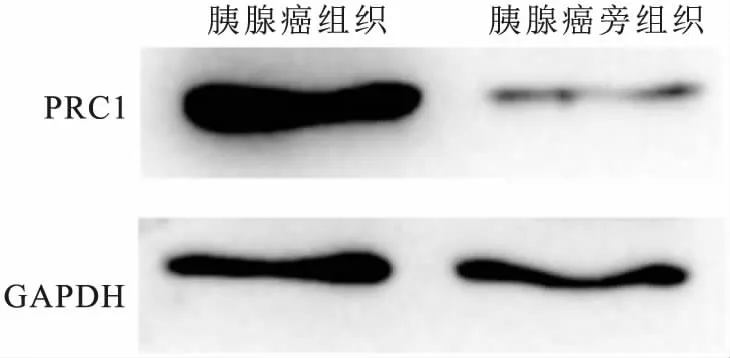
图3 PRC1蛋白表达变化
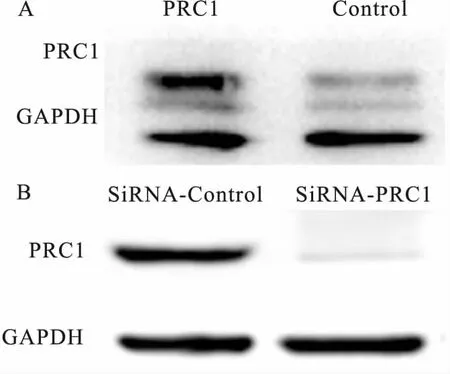
图4 细胞转染效率的验证
2.5 PRC1对细胞增殖能力的影响CCK-8法检测结果显示,与Control组相比, PRC1组的细胞存活率显著增高(t=-9.464、-13.883,P<0.01)。与SiRNA-control组相比,SiRNA-PRC1组的细胞存活率显著降低(t=21.659、16.300,P<0.01)。表明过表达PRC1促进胰腺癌SW1990细胞增殖,而沉默PRC1则抑制胰腺癌SW1990细胞增殖。见图5。

图5 PRC1对细胞增殖能力的影响
2.6 PRC1对细胞凋亡率的影响流式细胞术检测结果显示, 过表达PRC1组细胞凋亡率显著低于Control组(t=9.671,P=0.001)。SiRNA-PRC1组细胞凋亡率显著高于SiRNA-control组(t=-9.515,P=0.001)。结果表明过表达PRC1抑制SW1990细胞凋亡,而沉默PRC1 可诱导SW1990细胞凋亡。见图6。
2.7 PRC1对细胞侵袭能力的影响Transwell细胞侵袭实验结果显示:过表达PRC1组和Control组侵袭细胞数量分别为(47.667 ± 2.517)个、(30.667 ± 2.082)个。与Control组相比,过表达PRC1组侵袭的细胞数量明显增多(t=-9.016,P=0.001)。SiRNA-PRC1组和SiRNA-Control组侵袭细胞数量分别为(23.000 ± 2.000)个、(33.667 ± 3.215)个。与SiRNA-Control组相比,SiRNA-PRC1组侵袭的细胞数量明显减少(t=4.880,P=0.008)。表明过表达PRC1可促进SW1990细胞侵袭能力,沉默PRC1可抑制SW1990细胞侵袭能力。见图7。

图6 PRC1对细胞凋亡率的影响
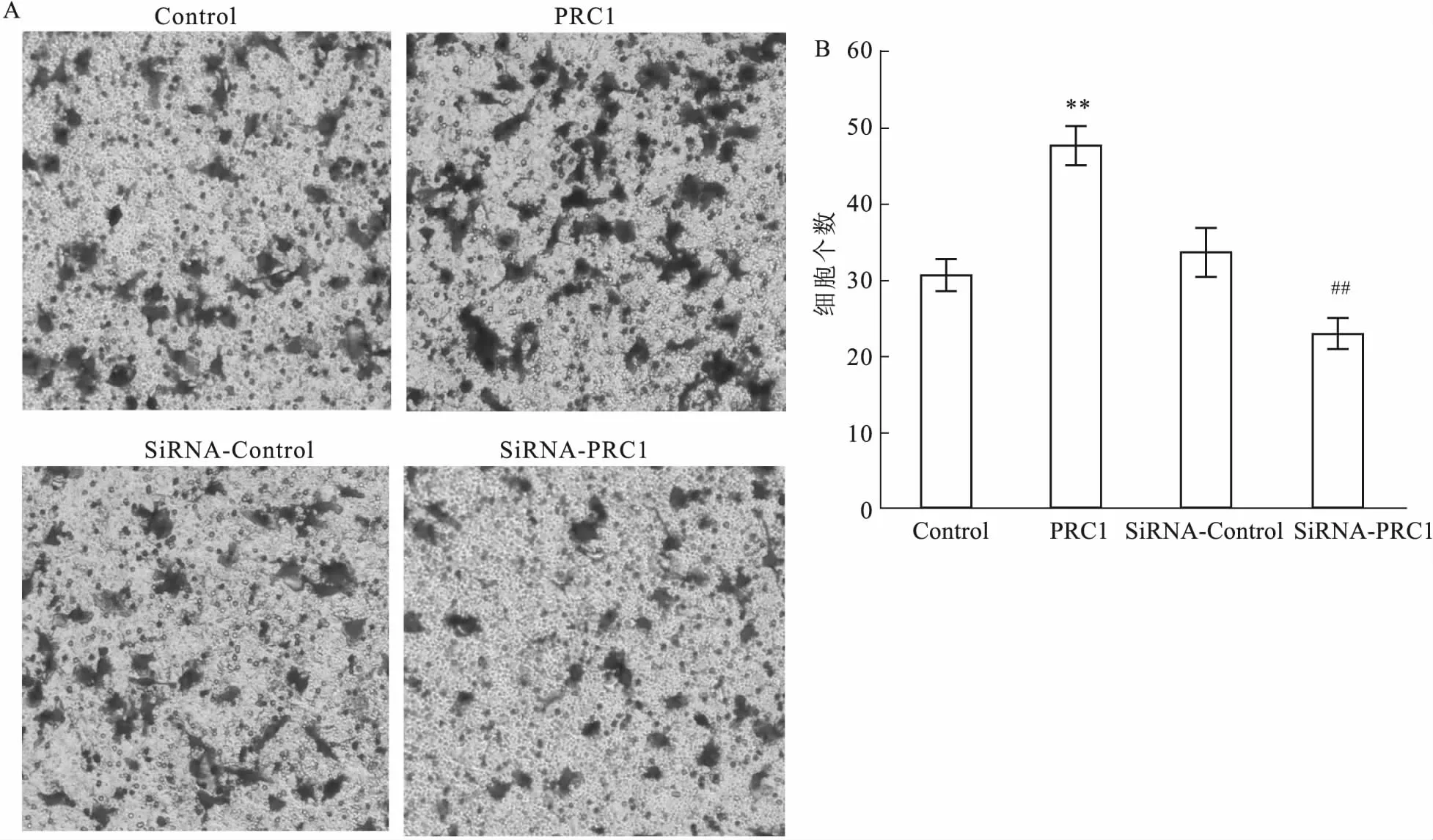
图7 PRC1对细胞侵袭能力的影响 ×200
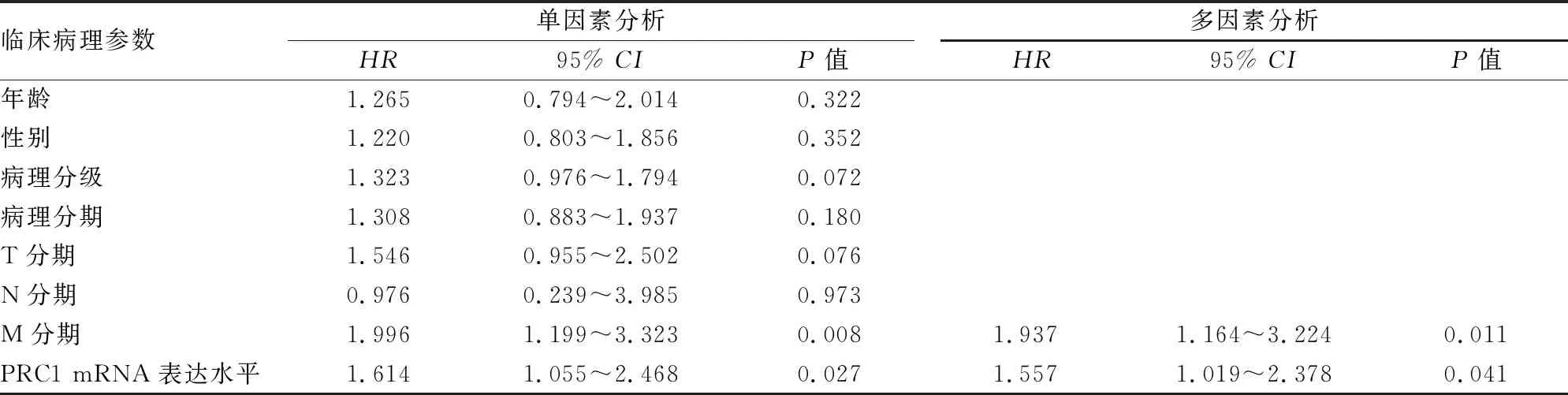
表1 Cox回归分析胰腺癌患者临床病理特征与预后的关系
2.8 胰腺癌患者临床病理特征与预后的关系PRC1基因表达水平与胰腺癌患者预后的相关性采用COX回归分析。单因素COX分析结果显示,PRC1 mRNA表达水平和M分期对胰腺癌患者的预后存在显著影响(P<0.05)。将有统计学差异的临床病理参数进一步纳入多因素Cox分析,结果显示PRC1 mRNA表达水平和M分期是胰腺癌患者预后的独立危险因素(P<0.05)。见表1。
2.9 PRC1表达水平对胰腺癌患者生存率的影响根据PRC1 mRNA表达水平的中位数,将胰腺癌患者分为PRC1高表达组与PRC1低表达组。利用Kaplan-Meier法绘制患者生存曲线。结果表明PRC1高表达组胰腺癌患者的生存时间显著低于PRC1低表达组患者(χ2=4.970,P=0.026,中位生存时间为517 dvs661 d),见图8。

图8 PRC1表达水平对胰腺癌患者生存率间的影响
2.10 PRC1的蛋白相互作用网络利用STRING数据库分析人源PRC1可能存在的蛋白相互作用网络图,结果表明:与PRC1相互作用Score排名前10位的蛋白分别为PLK1(score=0.999)、KIF4A(score=0.997)、KIF20A (score=0.996)、KIF11(score=0.994)、KIF14(score=0.989)、CDK1(score=0.989)、TPX2(score=0.988)、RACGAP1(score=0.988)、CENPE(score=0.987)、NCAPG(score=0.986),见图9。
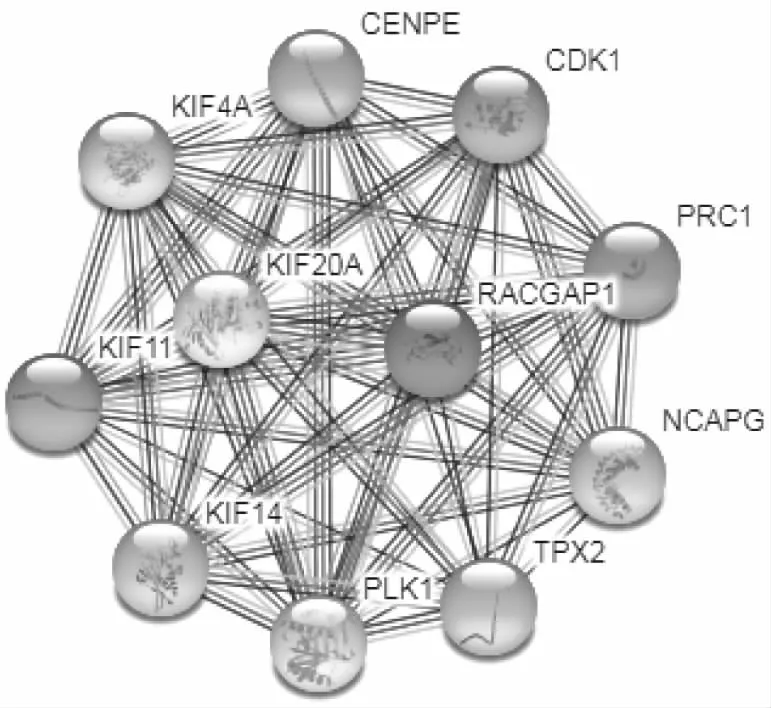
图9 PRC1的蛋白相互作用网络
2.11 PRC1的KEGG信号通路分析GSEA研究结果显示:PRC1 mRNA高表达样本富集到P53信号通路、Wnt信号通路、Notch信号通路等相关基因集(P<0.05)。见表2。
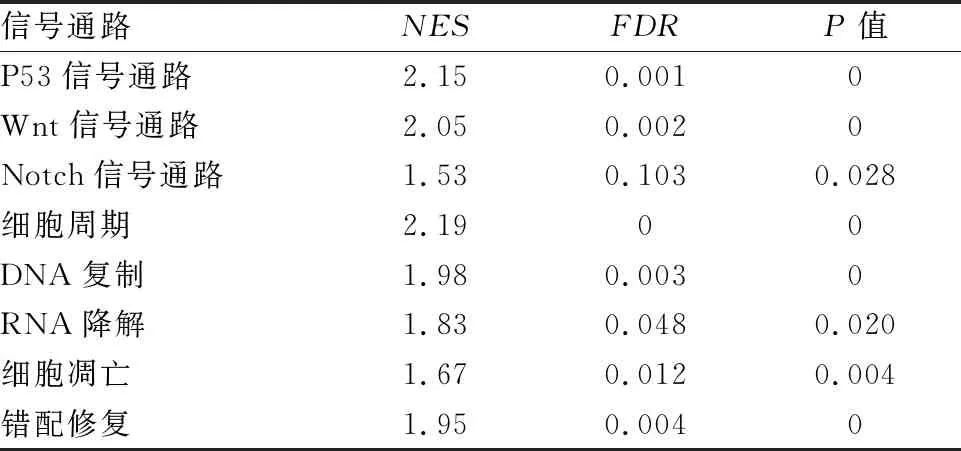
表2 PRC1的KEGG信号通路分析
3 讨论
本研究利用生物信息学技术系统分析PRC1在胰腺癌中的表达差异及其对胰腺癌预后的诊断价值。结果显示PRC1基因水平在胰腺癌中高表达,且PRC1高表达与胰腺癌的不良预后密切相关。同时Western blot检测结果提示PRC1蛋白水平在胰腺癌中亦高表达,免疫组织化学染色结果显示PRC1定位于细胞质。研究[5]表明PRC1在肺癌细胞系中过表达,PRC1的高表达与肺癌患者的预后不良有关,有望成为肺癌治疗的潜在靶点。Chen et al[6]报道PRC1在肝癌中发挥致癌作用,PRC1高表达与早期肝癌复发和患者预后不良相关。Wang et al[7]进一步观察到PRC1可使肝癌患者产生化疗耐药并预测术后不良预后。研究[8]结果提示PRC1的过表达预示着乳腺癌患者预后的无病生存率较低。Bu et al[9]研究结果证实在卵巢癌中PRC1蛋白及mRNA表达均上调,PRC1过表达导致耐药、肿瘤复发和预后不良。本研究结果与国内外文献[5-9]报道一致,均有力地证实PRC1可能在恶性肿瘤发生发展中发挥关键作用,扮演重要角色。因此进一步探讨PRC1在胰腺癌发生发展中的生物学功能及机制具有一定的临床意义。
本研究体外细胞实验结果显示,PRC1促进胰腺癌细胞增殖、侵袭及转移,并抑制其凋亡。梁志刚[10]报道过表达PRC1可促进非小细胞肺癌细胞的增殖和迁移,并促进细胞周期进入分裂期,沉默PRC1则抑制非小细胞肺癌细胞的增殖和迁移。Chen et al[6]研究结果表明PRC1基因敲除显著抑制肝癌细胞的增殖、迁移和侵袭能力。本研究结果与国内外文献[6,10]报道基本一致,均证实PRC1在胰腺癌发生发展中发挥促癌作用,为进一步的机制研究提供实验理论基础。
研究[11]结果表明Polo样激酶1(Polo-like kinase 1,PLK1)是一种高度保守的丝氨酸/苏氨酸蛋白激酶,与PRC1共同作用调控有丝分裂细胞周期,在肿瘤细胞的形成中发挥作用,并在多种肿瘤细胞中高表达。本研究利用STING数据库预测PRC1通过与PLK1、KIF4A相互作用发挥功能,与文献[11]报道一致。除此以外,还预测到与PRC1相互作用的蛋白有KIF20A、KIF11、KIF14、CDK1、TPX2、RACGAP1、CENPE、NCAPG。可为PRC1的功能研究提供新思路。
研究[12]表明抑癌基因P53是一种转录因子,由DNA损伤、癌基因激活和营养缺乏等多种应激信号诱导产生。具有调控细胞周期与细胞凋亡、维持基因组稳定性等多种功能,在预防肿瘤的发生中发挥关键作用,在功能上是“基因组的主要守护者”。Ye et al[3]报道壳聚糖包被阿霉素纳米粒给药系统通过P53/PRC1途径促进细胞凋亡,使细胞周期停滞于G2/M期,从而抑制肝癌细胞生长。Zhang et al[4]研究结果证实PRC1直接受P53的负调控,在胃癌细胞中P53表达缺失时,PRC1则高表达。高表达的PRC1在胃癌中发挥致癌作用。研究[13]表明胰腺癌相关的基因突变多集中于Wnt信号通路、TGF-β信号通路等。Tang et al[14]研究结果表明在肝细胞癌中,microRNA-194通过PRC1介导的Wnt/β-catenin 信号通路抑制肝癌细胞侵袭和迁移。Cai et al[15]研究结果表明microRNA-194通过抑制PRC1介导的Wnt/β-catenin 信号通路来预防食道癌的发生。本研究GSEA预测PRC1在胰腺癌中发挥功能的可能信号通路有P53信号通路、Wnt信号通路等,与文献[3-4,12-15]报道基本一致。除此以外,还预测到Notch信号通路、细胞周期、DNA复制、RNA降解、细胞凋亡、错配修复等,可为PRC1在胰腺癌中的进一步机制研究提供更多线索和思路。
综上所述,PRC1在胰腺癌中高表达是胰腺癌患者预后的独立危险因素,并促进胰腺癌细胞增殖及侵袭,具有癌基因的特性,有望成为胰腺癌早期诊断和预后判断的潜在生物学标志物。
