Prdx1过表达通过Nrf2/HO-1信号通路抑制氧化应激减轻自发性高血压大鼠心肌肥厚和纤维化
2023-03-02纪新博顾申红麦华德符碧薇
纪新博,顾申红,麦华德,符碧薇
自发性高血压(spontaneously hypertensive,SHR)是常见的心血管疾病之一,可对机体重要器官产生损害,是全球人口死亡的重要风险因素。心脏作为长期高血压主要损伤的靶器官之一,主要损伤表现为左心室结构改变和重构,最终引起心力衰竭的发生[1]。研究[2]报道,心肌肥厚和纤维化是心脏重构的重要病理变化,减轻心肌肥厚和纤维化对于治疗SHR所致心脏病以及降低SHR诱导心力衰竭患者死亡率具有积极的意义。过氧化物氧化还原酶蛋白(peroxiredoxin,Prdx)是一个由六种硫醇依赖性过氧化物酶组成的家族,在对抗活性氧簇、抗氧化过程中发挥关键作用[3]。既往研究[4-6]表明,Prdx是生理和病理性心血管事件的重要调节剂。Prdx1作为Prdx家族的一员,可通过清除活性氧调节氧化剂敏感性并发挥抗氧化作用[7]。然而,Prdx1是否在SHR所致心血管疾病中起作用尚不清楚。该研究旨在探索Prdx1在SHR所致心肌肥厚和心肌纤维化中的作用,并分析其相关分子机制。
1 材料与方法
1.1 实验材料
1.1.1实验动物及腺病毒 SPF级雄性SHR大鼠45只,SPF级雄性Wistar Kyoto(WKY)健康大鼠15只,9周龄,体质量190~200 g。室温18~24 ℃,相对湿度50%~70%,标准饲料喂养,自由饮水、进食。所有大鼠均购自海南药物研究所有限责任公司,生产许可证:SCXK(琼)2020-0007。Prdx1过表达腺病毒(AAV9-Prdx1)及AAV9阴性对照(AAV9-NC)购自上海基因化工有限公司。
1.1.2主要试剂及仪器 苏木精-伊红染色(HE)试剂盒、Masson三色染色试剂盒均购自优博奥生物科技有限公司;RNA提取试剂盒购自天根生化科技有限公司;qRT-PCR试剂盒、反转录试剂盒购自日本Takara公司;二喹啉甲酸(BCA)蛋白定量试剂盒购自碧云天生物研究所;超氧化物歧化酶(superoxide dismutase,SOD)、谷胱甘肽过氧化物酶(glutathione peroxidase,GSH-Px)、丙二醛(malondialdehyde,MDA)ELISA检测试剂盒购自上海通蔚实业有限公司;兔抗Prdx1、核因子E2相关因子2(nuclear factor E2-related factor 2,Nrf2)、血红素氧合酶-1(heme oxygenase-1,HO-1)、醌氧化还原酶1[NAD(P)H:quinone acceptor oxidoreductase 1,NQO1]抗体,鼠抗甘油醛-3-磷酸脱氢酶(glyceraldehyde-3-phosphate dehydrogenase,GAPDH)抗体购自美国Abcam公司;辣根过氧化物酶(HRP)标记的山羊抗兔IgG、山羊抗鼠IgG购自美国Jackson Immuno Resrarch公司;增强化学发光试剂(ECL)购自美国GEN-VIEW公司。BP-2010A型动物智能无创血压仪购自日本 Softron 株式会社;Vev770型小动物超声检测仪购自 Visualsonics公司;ELx808酶标仪购自美国Biotek公司;ECLIPSE CI光学显微镜、DS-U3成像系统购自日本尼康公司;qRT-PCR仪购自美国Roche公司。
1.2 实验方法
1.2.1实验分组及给药 45只SHR大鼠适应性喂养1周后,连续7 d测量血压,待大鼠血压稳定后,随机分为模型组(SHR组)、AAV9-NC组、AAV9-Prdx1组,每组15只。另取15只WKY大鼠设为对照组(Control组)。其中AAV9-NC组大鼠尾静脉注射AAV9-NC 1×1011viral particles/(L·d);AAV9-Prdx1组大鼠尾静脉注射AAV9-Prdx1 1×1011viral particles/(L·d);SHR组和Control组大鼠均尾静脉注射同等剂量的生理盐水。连续给药8周。
1.2.2超声心动图检测大鼠心功能指标 各组大鼠麻醉后,采用Vevo 2100超高分辨率小动物彩色超声多普勒成像细胞实时监测大鼠心功能变化,记录大鼠左心室射血分数(ejection fraction,EF)和左心室缩短率(fractional shortening,FS)。
1.2.3大鼠血压测定 每2周采用智能无创血压计测定各组大鼠清醒状态下的尾动脉血压。将大鼠置于37 ℃恒温室内适应1 h,随后将大鼠固定于血压计配套的保温套中,待大鼠安静下来,血压监测界面的脉搏波稳定时开始测定血压,连续检测3次,计算大鼠平均血压。
1.2.4大鼠心肌肥厚指标检测及样本采集 末次给药后,准确称量大鼠体质量,大鼠禁食不禁水12 h,腹腔注射10%水合氯醛(0.3 ml/kg)麻醉大鼠,经腹主动脉取血,3 000 r/min离心10 min后收集上清液,置于-80 ℃冰箱保存。采血结束后,迅速取出大鼠心脏,用生理盐水冲洗后,用滤纸吸去多余水分,称量大鼠心脏质量,计算心脏质量指数(heart mass index,HMI)和左心室质量指数(left ventricular mass index,LVMI),HMI(mg/g)=心脏质量/大鼠体质量,LVMI(mg/g)=左心室体重/大鼠体质量。随后将一部分心肌组织放入4%多聚甲醛溶液中固定,一部分心肌组织置于-80 ℃冰箱保存待测。
1.2.5大鼠心肌组织形态学观察 取固定于4%多聚甲醛中的心肌组织,经石蜡包埋制成5 μm厚度的石蜡切片,切片常规脱蜡水化后,分别进行HE染色和Masson染色,中性树胶封片,光学显微镜下观察大鼠心肌组织形态学变化和大鼠心肌纤维化,其中胶原纤维呈蓝色,心肌组织呈红色。
1.2.6大鼠血清中氧化应激指标检测 取各组大鼠血清,严格根据检测试剂盒说明书检测SOD、GSH-Px、MDA水平。
1.2.7qRT-PCR法检测大鼠心肌组织中Prdx1 mRNA表达水平 取大鼠心肌组织,使用TRIzol试剂从心肌组织中提取总RNA,以紫外分光光度计检测RNA纯度和浓度。按照反转录试剂盒说明书合成cDNA,使用SYBR Green Master Mix试剂盒进行qRT-PCR试验。Prdx1上游引物序列:5′-TTTGTGTGTCCCACGGAGAT-3′,下游引物序列:5′-TAATGGTGCGCTTGGGATCTG-3′;GAPDH上游引物序列:5′-GACATGCCGCCTGGAGAAAC-3′,下游引物序列:5′-AGCCCAGGATGCCCTTTAGT-3′。反应条件为:95 ℃ 30 s,95 ℃ 10 s,61 ℃ 30 s,72 ℃ 15 s,共进行40个循环。以GAPDH基因作为内参,采用2-△△Ct法计算Prdx1 mRNA相对表达量。
1.2.8Western blot法检测大鼠心肌组织中Prdx1蛋白和Nrf2/HO-1信号通路相关蛋白表达 取大鼠心肌组织,加入RIPA裂解缓冲液提取总蛋白,通过BCA试剂盒测定蛋白浓度。将蛋白煮沸变性后,取定量蛋白在SDS-PAGE凝胶上分离,转移到PVDF膜,室温下用5%脱脂奶粉封闭膜2 h。洗膜后,将膜与Prdx1(1 ∶800)、Nrf2(1 ∶500)、HO-1(1 ∶500)、NQO1(1 ∶500)、GAPDH(1 ∶1 000)一抗在4 ℃条件下孵育过夜,洗膜,加入二抗(1 ∶2 000),室温下孵育1 h。采用ECL发光显色液显影,凝胶成像分析仪分析蛋白条带,以GAPDH作为内源性参照,计算目的蛋白相对表达量。
2 结果
2.1 各组大鼠心肌组织中Prdx1表达变化与Control组比较,SHR组和AAV9-NC组大鼠心肌组织中Prdx1 mRNA和蛋白表达量均降低(F=39.571、46.230,P<0.05);与SHR组比较,AAV9-Prdx1组大鼠心肌组织中Prdx1 mRNA和蛋白表达量均升高(F=21.975、25.783,P<0.05)。见图1。
2.2 Prdx1过表达对SHR大鼠平均血压的影响给药2周后,与Control组比较,SHR组和AAV9-NC组大鼠平均血压升高(P<0.05);AAV9-Prdx1组大鼠平均血压与SHR组比较差异无统计学意义。给药4~8周后,与Control组比较,SHR组和AAV9-NC组大鼠平均血压升高(P<0.05);与SHR组比较,AAV9-Prdx1组大鼠平均血压呈稳定降低趋势(P<0.05)。见表1。
2.3 Prdx1过表达对SHR大鼠心功能指标及心肌肥厚指标的影响与Control组比较,SHR组和AAV9-NC组大鼠心功能指标EF和FS均降低,心肌肥厚指标HMI和LVMI均升高(P<0.05);与SHR组比较,AAV9-Prdx1组大鼠心功能指标EF和FS均升高,心肌肥厚指标HMI和LVMI均降低(P<0.05)。见表2。
2.4 Prdx1过表达对SHR大鼠心肌组织形态学的影响Control组大鼠心肌细胞排列整齐,细胞形态清晰。SHR组和AAV9-NC组大鼠心肌细胞形态不规则,排列紊乱,炎性细胞浸润明显。AAV9-Prdx1组大鼠心肌细胞病理损伤较SHR组明显改善,炎性细胞浸润减少。见图2。
2.5 Prdx1过表达对SHR大鼠心肌纤维化的影响Control组大鼠心肌纤维排列规则且密集,心肌间质中存在少量胶原纤维;SHR组和AAV9-NC组大鼠心肌纤维化加重;AAV9-Prdx1组大鼠心肌纤维化较SHR组减少。见图3。
2.6 Prdx1过表达对SHR大鼠血清氧化应激指标的影响与Control组比较,SHR组和AAV9-NC组大鼠血清中SOD和GSH-Px活性降低,MDA含量升高(P<0.05);与SHR组比较,AAV9-Prdx1组大鼠血清中SOD和GSH活性升高,MDA含量降低(P<0.05)。见表3。

图1 各组大鼠心肌组织中Prdx1表达变化

表1 Prdx1过表达对SHR大鼠平均血压的影响

表2 Prdx1过表达对SHR大鼠心功能指标及心肌肥厚指标的影响

图2 Prdx1过表达对SHR大鼠心肌组织形态学的影响 HE×200

图3 Prdx1过表达对SHR大鼠心肌纤维化的影响 Masson×400

表3 Prdx1过表达对SHR大鼠血清氧化应激指标的影响
2.7 Prdx1过表达对SHR大鼠心肌组织中Nrf2/HO-1信号通路相关蛋白表达的影响与Control组比较,SHR组和AAV9-NC组大鼠心肌组织中Nrf2、HO-1、NQO1蛋白表达量均降低(F=15.731、17.862、14.921,P<0.05);与SHR组比较,AAV9-Prdx1组大鼠心肌组织中Nrf2、HO-1、NQO1蛋白表达量均升高(F=13.985、11.749、10.770,P<0.05)。见图4。
3 讨论
Prdx1广泛存在于原核生物和真核生物中,其作为一个过氧化物酶分子,可通过调节活性氧相关的多种信号通路在许多疾病如衰老、急性组织损伤、神经退行性疾病和癌症中发挥保护作用[8]。Lv et al[9]报道,Prdx1基因敲除可通过激活 P38/JNK 信号通路增加活性氧水平加重氧化应激和肺损伤,提示Prdx1的抗氧化作用可以减轻脂多糖诱导的急性肺损伤。Yang et al[10]报道,Prdx1通过靶向炎症和凋亡相关 mRNA 的稳定性来减轻脑出血引起的脑损伤。Prdx1可能是减轻脑出血所致脑损伤的潜在治疗靶点。Mei et al[11]研究发现,Prdx1过度表达抑制肾小管间质纤维化中的氧化应激和细胞凋亡。Jiang et al[12]报道,Prdx1过表达通过抑制氧化应激和心肌细胞凋亡减轻阿霉素诱导的心脏毒性。本研究检测Prdx1在SHR大鼠心肌肥厚和心肌纤维化中的作用,结果显示Prdx1过表达稳定降低SHR大鼠血压,升高SHR大鼠心功能指标EF、FS水平,降低心肌肥厚指标HMI、LVMI水平,减轻大鼠心肌组织病理损伤和纤维化程度,对SHR大鼠心肌肥厚和纤维化具有保护作用,并改善了大鼠心功能不全。提示Prdx1在SHR心脏病发生发展中起重要作用。
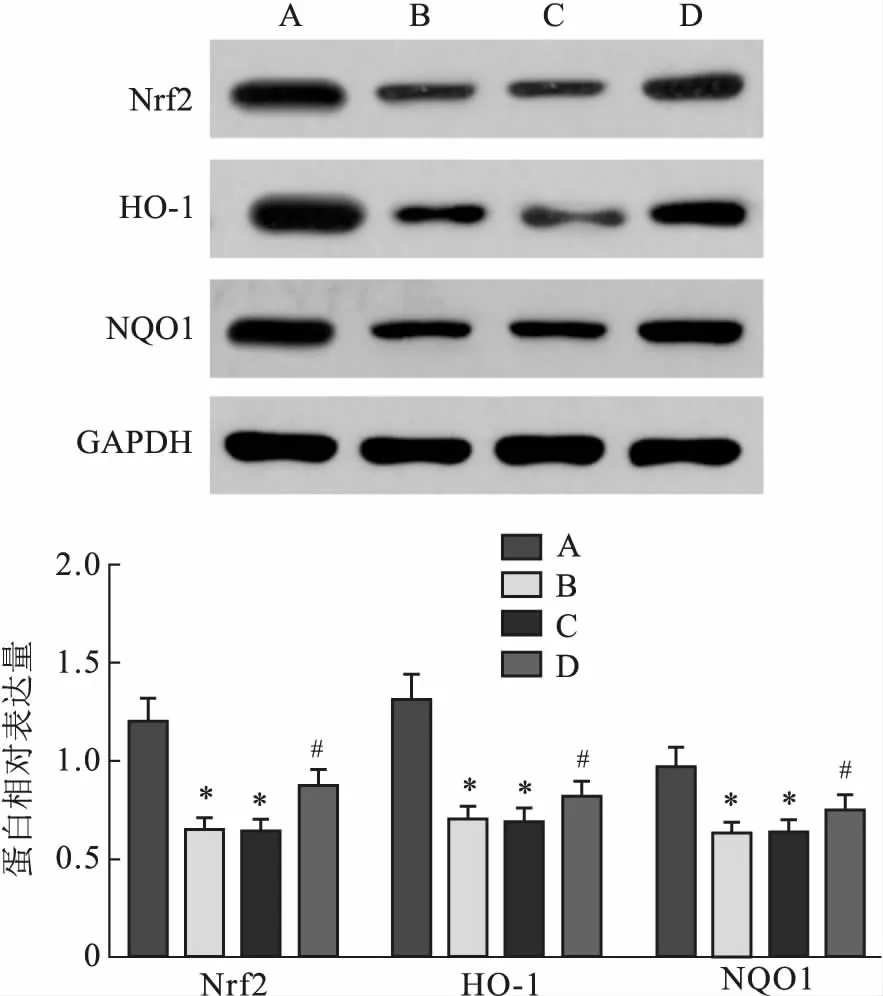
图4 Prdx1过表达对SHR大鼠心肌组织中Nrf2/HO-1信号通路相关蛋白表达的影响
SHR的发病机制与氧化应激密切相关,在SHR患者体内,氧化和抗氧化水平失衡,大量自由基产生引起血管内皮损伤和血管功能障碍,加重高血压病情,促使SHR引起机体器质性损伤。研究[13]报道,抑制氧化应激能够恢复血管功能、减轻SHR诱导的心肌肥厚和心功能不全,从而阻止SHR引起的心脏重构。SOD、GSH-Px、MDA是衡量氧化应激反应的主要相关指标,SOD、GSH-Px是机体重要的过氧化物分解酶,可以有效消除氧自由基,保持细胞氧化还原的动态平衡,进而保持血管正常的舒缩活性,减轻血管内皮功能和靶器官氧化损伤。MDA作为氧自由基作用于脂质发生氧化反应的最终产物,其含量升高可加剧细胞膜损伤,同时提示机体抗氧化能力的降低[14]。本研究检测上述氧化应激指标,结果显示SHR大鼠血清中SOD和GSH-Px活性均降低,而MDA含量升高。经过外源性Prdx1干预后,SHR大鼠血清中SOD和GSH-Px活性升高,MDA含量降低。提示Prdx1可能通过改善SHR大鼠体内氧化应激反应降低血压,进而减轻SHR引起的心肌损伤。
Nrf2是氧化应激反应中抗氧化防御系统调节的关键转录因子,静息状态下,Nrf2与Keap1结合处于无活性状态。氧化应激发生时,无活性的Nrf2与Keap1解离进入活化状态,由细胞质进入细胞核,通过调节一系列抗氧化酶如HO-1、NQO1等相关基因表达保护机体免受氧化应激损害。Nrf2/HO-1信号通路在保护机体免受内源性或外源性应激方面起着重要作用。已有研究[15]表明,抑制Nrf2/HO-1信号通路活性,能够加重SHR大鼠心脏重构。而增强Nrf2信号通路活性可有效抑制心肌梗死后心脏重塑[16]。Prdx1被证明能够通过激活Nrf2,上调HO-1表达,减轻压力超负荷引起的心肌肥厚和心力衰竭[17]。本研究显示,Prdx1过表达能够上调SHR大鼠心肌组织中Nrf2、HO-1和NQO1蛋白表达。提示Prdx1可能通过激活Nrf2/HO-1信号通路抑制氧化应激,上调心肌组织抗氧化能力,进而减轻SHR大鼠心肌肥厚和心肌纤维化。
综上所述,Prdx1过表达通过激活Nrf2/HO-1抗氧化信号通路,抑制SHR心肌组织氧化应激反应,从而抑制SHR导致的心肌肥厚和纤维化,保护心功能。
