腹腔注射同种异体粪便滤液建立大鼠脓毒症模型
2023-03-02刘军超王伟宝杜会博李福龙牛春雨赵自刚
刘 辉,刘军超,王伟宝,杜会博,李福龙,牛春雨,赵自刚,5
严重感染以及由创伤、烧伤等严重致病因素引起肠道菌群移位,导致细菌入血并快速繁殖,造成机体免疫功能失衡,从而引发脓毒症[1]。脓毒症病情急骤,病死率极高,研究其病理生理机制以探寻有效的治疗措施,是当前研究的热点,因此建立稳定、可靠、符合临床实际的脓毒症动物模型就显得尤为重要。目前,建立动物模型的方法主要以静脉输入脂多糖(lipopolysaccharides,LPS)或菌液、腹腔注射LPS或菌液、盲肠结扎穿孔(cecal ligation and puncture,CLP)、结肠支架植入腹膜炎(colon ascendens stent peritonitis,CASP)等最为常见[2],但这模型均在不同程度上存在一些优缺点。临床研究[3]显示脓毒症第二大致病因素为腹腔感染,因此,该研究结合文献[4]报道并进行改良后,采取向大鼠腹腔内注射同种异体粪便滤液的方法建立模型,用以反映腹腔感染引起脓毒症的临床病程,旨在探索一种更简便、稳定、重复性好的脓毒症模型。
1 材料与方法
1.1 实验动物SPF级健康雄性Wistar大鼠48只,购自斯贝福(北京)生物技术有限公司(许可证号:SCXK(京)2019-0010),260~300 g。大鼠在清洁环境中适应性饲养1周后用于本实验,环境温度(23±2)℃,湿度40%~60%,12 h昼夜交替,自由饮食。所有动物管理与实验流程均依据河北北方学院实验动物管理条例进行,并得到河北北方学院实验动物伦理委员会批准,伦理批准编号:2021-1-9-10。
1.2 主要试剂及仪器戊巴比妥钠(P11011)购自德国默克公司;肿瘤坏死因子-α(tumor necrosis factor-α, TNF-α)、白介素-6(interleukin-6, IL-6)、D-乳酸(D-lactic acid, D-LA)、血清肠型脂肪酸结合蛋白(serum intestinal fatty acid binding protein, I-FABP)试剂盒(批号分别为CD31063、CD30219、CD30088、CD30257)购自武汉纯度生物科技有限公司;血清天门冬氨酸氨基转移酶(aspartate aminotransferase, AST)、丙氨酸氨基转移酶(alanine aminotransferase, ALT)试剂盒(批号分别为101370、102370)购自北京艾威德医疗科技有限公司;BUN、Cr试剂盒[批号分别为3030-717(S)、3020-717(S)]购自宁波瑞源生物科技有限公司。小动物肺功能检测系统(Buxco)购自美国Data Sciences International (DSI)公司;无创血压监测仪(BP-2010A)购自北京软隆生物科技有限公司;全自动生化检测仪(7600-010型)购自日立公司;自动脱水机(ASP200S型)购自德国Leica公司;光学显微镜(CKX31型)购自日本Olympus公司。
1.3 同种异体大鼠粪便滤液的制备参照文献[4]以腹腔注射自体粪便制备大鼠脓毒症模型的方法,本研究经过改良创新后采取注射粪便滤液的方式实施。收集正常大鼠粪便,在(23±2)℃、湿度30%~50%的清洁环境中自然晾晒3 d,使其充分干燥;然后,将干燥粪便充分研磨后,采用规格为0.5 mm的尼龙网过滤器去除颗粒物,制备粪便粉末;取粪便粉末,按照1 g/10 ml的浓度加入5%葡萄糖,室温静置1 h,放入摇床充分混匀后,用网眼大小0.5 mm×0.5 mm的尼龙布过滤,留取滤液,用于腹腔注射。
1.4 大鼠脓毒症模型的建立与生存率观察分别按照0.5、1、2 g/kg的剂量给大鼠进行腹腔注射(分别为SP1、SP2、SP3组,每组6只。为了保证腹腔注射滤液的体积一致,0.5 g/kg组所用滤液加3倍生理盐水,1 g/kg组所得滤液加等量生理盐水,然后以20 ml/kg的剂量依次进行腹腔注射,对照组(n=6)腹腔注射等体积的生理盐水。腹腔注射粪便滤液后,将每只大鼠置于独立的饲养笼中,观察大鼠一般情况,通过视频监控系统记录大鼠生存率。腹腔注射粪便滤液24 h后,测量存活大鼠的体温、心率,并应用无创血压监测仪测量大鼠的平均动脉血压(mean arterial pressure, MAP)。超过72 h存活的大鼠视为长期存活,腹腔注射过量戊巴比妥钠麻药实施安乐死。
结合严重腹腔感染诱发脓毒症患者未实施治疗的死亡率在70%~80%之间[5],根据各组大鼠的存活时间,后续实验选择1 g/kg剂量建立模型。实验过程中,参照脓毒症严重程度评价,统计以1 g/kg剂量建立脓毒症模型的造模成功率,并观察造模成功与失败大鼠腹腔肠管病变情况。同时,将12只大鼠均分为对照组、脓毒症组,观察肺、肝、肾功能与组织结构、血清炎症因子等指标。
1.5 大鼠脓毒症严重程度评价随机选取以1 g/kg 剂量建立脓毒症模型的18只大鼠,参照动物脓毒症严重程度评价表[6],评估变量包括外观表现、意识状态、活动量、对触觉和听觉刺激的反应、眼睛闭合程度、呼吸频率和性质(劳力性呼吸困难)。每个变量评分在0~4之间,总分值大于10分为中重度脓毒症。在评分基础上,统计造模成功率,并观察造模成功与失败大鼠腹腔肠管病变情况。
1.6 大鼠肺功能检测大鼠在腹腔注射粪便滤液后24 h或对照组大鼠在相应时间点,应用Buxco小动物肺功能检测系统检测肺功能。方法如下:1%戊巴比妥钠(5 ml/kg)腹腔注射麻醉大鼠,10 min后将大鼠固定于小动物手术台,充分暴露颈部皮肤并备皮,采用颈部正中切口依次分离皮下组织、颈部肌肉,暴露气管,于气管第3~4软骨环做切口,用内径3 mm的气管导管插管并用手术缝线结扎固定,稳定5 min后将大鼠放入体积描记舱内,待大鼠适应舱内环境后将气管导管连接在呼吸阀上,关闭舱体,依次检测功能残气量(functional residual capacity,FRC)、气道阻力(airway resistance,RI)、前100毫秒用力呼气容积(forced breath volume at the 100th millisecond,FEV100)、呼气峰流量(peak expiratory flow,PEF)、动态肺顺应性(dynamic lung compliance,Cdyn)、深吸气量(inspiratory capacity,IC)。
1.7 血清炎性因子及生化指标检测活体肺功能检测结束后,做腹部正中切口,逐层分离腹部肌肉,探查暴露腹主动脉后,用一次性采血针穿刺取血2 ml,3 000 r/min离心15 min,取上清液,采用ELISA法检测TNF-α、IL-6、D-LA、I-FABP浓度。采用7600-010型全自动生化检测仪检测血清AST、ALT、尿素氮(blood urea nitrogen,BUN)、肌酐(creatinine,Cr)水平反应肝、肾功能变化。
1.8 肺、肝、肾组织结构观察取固定位置肺、肝、肾组织于4%多聚甲醛固定24 h后,修块,使用自动脱水机脱水后,常规石蜡包埋、切片,苏木精-伊红(HE)染色,光学显微镜观察各组织结构变化。采用等级评分对肺组织损伤程度进行评价[7]:0分为无任何病理改变;1分为病变范围<25%;2分为病变范围 25%~50%;3分为病变范围 51%~75%;4分为病变范围>75%。依据文献[8]对肝肾组织损伤程度进行评价。肝组织:0分为未见异常;1分为满足以下条件中的三项且必须包含①:① 汇管区有中性粒细胞浸润,② 肝细胞肿胀,③ 肝细胞嗜酸性变,④ 肝细胞灶性坏死,⑤ 肝细胞可见双核现象,⑥ 库普弗细胞增殖、肥大;2分为在满足评分1分的前提下有散在肝细胞点状坏死;3分为在评分2分的基础上有肝细胞大片坏死。肾脏组织:0分为未见异常;1分为肾小球未见明显异常,肾小管上皮肿胀,管腔狭窄,蛋白管型,肾间质水肿;2分为肾小球毛细血管充血,肾小管上皮坏死,间质水肿,炎性细胞浸润;3分为在评分2分基础上可见肾小管上皮片状坏死。
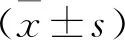
2 结果
2.1 大鼠生存率的观察观察注射不同剂量粪便滤液大鼠的生存情况并记录死亡时间,如图2所示,建模24 h内,SP1组100%(6/6)存活,SP2组83.3%(5/6)存活,SP3组全部死亡;建模48 h内,SP1组83.3%(5/6)存活,SP2组16.7%(1/6)存活;建模72 h内,SP1组66.7%(4/6)存活,SP2组16.7%(1/6)存活;对照组全部存活,见图1。

图1 腹腔注射同种异体粪便滤液后大鼠生存状况
2.2 大鼠的一般状况腹腔注射同种异体粪便滤液24 h后,大鼠表现为精神倦怠,行动迟缓,毛发无光泽,背部竖毛,寒战,喘息样呼吸,口周有血性分泌物,眼角带血丝、病变严重者伴随拉恶臭稀便等情况,见图2。
2.3 大鼠体温、心率、MAP的变化腹腔注射同种异体粪便滤液后24 h,SP1组大鼠体温、心率、MAP与对照组差异无统计学意义(P>0.05);SP2组大鼠体温、心率明显高于对照组、SP1组(P<0.01,P<0.05),MAP明显低于对照组、SP1组(P<0.01,P<0.05)。由于SP3组大鼠在24 h内全部死亡,故未观察这些指标。

图2 大鼠一般状况观察

表1 腹腔注射同种异体粪便滤液24 h后体温、心率、MAP的变化
2.4 大鼠脓毒症严重程度评价以及造模成功率的观察本研究采用1 g/kg质量粪便制备滤液建立脓毒症模型的大鼠共18只,建模24 h后对模型情况进行评价,依据脓毒症严重程度评分量表,有14只大鼠评分大于10分,结合生命体征的变化和剖腹后肺、肝、肾脏充血水肿,肠管肿胀坏死,脓性或血性恶臭腹腔积液,即判定大鼠出现了中重度脓毒症表现,造模成功率为77.8%(14/18)。对建模失败的大鼠麻醉后剖腹探查发现,大网膜的包裹使炎症局限,腹腔炎性病变较轻,见图3。
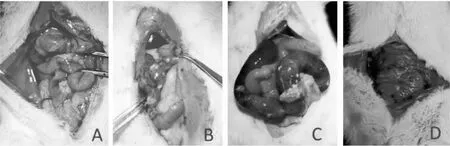
图3 不同转归大鼠腹部解剖外观
2.5 脓毒症大鼠肺功能及形态学的变化与对照组比较,脓毒症组大鼠FRC、Cdyn、FEV100、PEF明显下降,RI、IC明显增高(P<0.05),见图4。脓毒症组大鼠肺脏外观可见充血水肿,组织湿干比值高于对照组(P<0.05);组织学观察显示,脓毒症组大鼠肺泡间隔增宽、大量炎性细胞浸润,肺泡壁增厚、肺泡腔变小,对照组大鼠肺组织结构基本正常;脓毒症组大鼠肺组织损伤评分高于对照组(P<0.05),见图5。
2.6 脓毒症大鼠肝、肾功能与形态学的变化图6所示,与对照组相比,脓毒症组大鼠肾小球结构紊乱,球-囊间隙扩大,肾小管细胞水肿;肝细胞出现轻度水肿,汇管区有炎性细胞浸润。脓毒症组大鼠肝脏和肾脏的病理学评分以及血清ALT、AST、BUN、Cr浓度均高于对照组(P<0.05)。
2.7 脓毒症大鼠血清炎性因子的变化与对照组相比,脓毒症组大鼠TNF-α、IL-6浓度明显增高(P<0.05),见图7。

图4 脓毒症大鼠肺功能变化
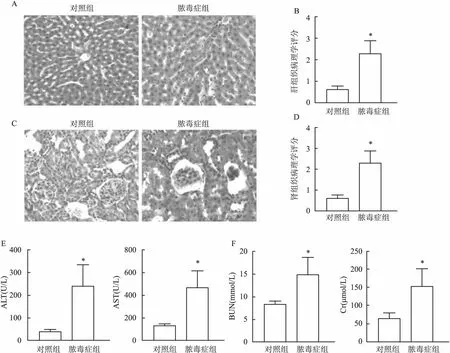
图6 脓毒症大鼠肝肾功能及组织形态学变化

图7 脓毒症大鼠血清炎性因子变化
2.8 脓毒症大鼠血清D-LA、I-FABP的变化与对照组相比,脓毒症组大鼠血清D-LA、I-FABP的浓度明显增高(P<0.05),见图8。
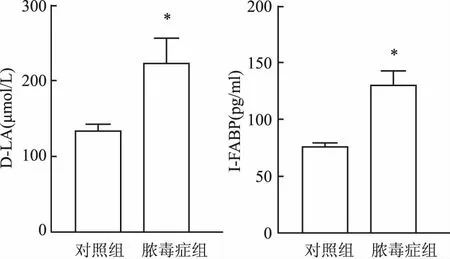
图8 脓毒症大鼠血清D-LA、I-FABP的变化
3 讨论
动物模型的可信性、重复性、相似性是评价模型应用价值的主要指标。脓毒症的病理生理机制极其复杂,病死率仍居高不下,因此建立脓毒症动物模型并深入研究其病理生理机制,对于降低脓毒症病死率、致残率具有非常重要的意义。
目前人类脓毒症诊断主要是依据SOFA评分标准,通过对意识状态、心血管、呼吸、肾、肝和血小板功能的综合判断来确诊,但这一评分标准并不适用于动物模型。故本研究对动物模型的评价主要依据目前较常用的大鼠脓毒症评分表,并结合大鼠一般状态和生命体征参数、自然死亡率、炎症反应、受累靶器官组织学改变等方面指标,以及传统动物模型全身炎症反应综合征(systemic inflammatory response syndrome,SIRS)诊断标准中的体温与心率变化进行判断,进一步观察肺、肝、肾功能与组织结构变化,多方面验证本模型的可信性。
本研究显示,注射粪便滤液后大鼠出现不同程度精神状态、活动量的改变,同时体温升高、心率增快、呼吸增快、血压降低、腹腔存在严重感染,这些指征均支持脓毒症的诊断。研究[9]显示血清TNF-α、IL-6在造模后24 h明显升高,提示发生了早期炎症反应。肺脏是脓毒症最易累及的靶器官之一,SIRS发生后免疫细胞激活并释放大量的炎症因子,从而造成肺微血管内皮细胞活化、白细胞迁移、毛细血管渗漏、肺间质水肿、肺不张等病理变化[10],本研究建模后24h大鼠肺功能出现明显异常,气道阻力增加,功能残气量降低,肺顺应性下降,这些指标均表明脓毒症后出现肺功能障碍,结合肺组织结构以及反映水肿的湿干比指标的变化,证明了肺损伤的存在。D-LA是胃肠道微生物糖酵解后的产物,肠屏障损伤后,肠黏膜通透性增加,D-LA释放入血[11]。I-FABP由肠黏膜顶端成熟的肠细胞释放,生理条件下,外周血中I-FABP含量很少,肠损伤后血清I-FABP水平明显增高[12],本研究结果显示血清D-LA和I-FABP水平明显增高,表明脓毒症后出现了肠组织损伤。肾脏、肝脏也存在不同程度的细胞水肿和炎性细胞浸润,并伴有肝肾功能血清生化指标的增高。以上这些器官的病理变化支持“机体对感染的反应失调而导致危及生命的器官功能障碍”这一最新脓毒症的定义[13]。对模型剖腹观察发现,脓毒症大鼠腹腔广泛粘连、肠管水肿坏死、大量恶臭腹水渗出,进一步佐证了该模型的成功建立。本研究注射不同剂量粪便滤液后,通过观察大鼠注药后一般状态、生命体征和生存率筛选出适合后期研究的药物剂量,参考脓毒症严重程度评价量[6]对造模成功率进行统计,成功率在77.8%,满足建模要求。
内源性粪便污染造成的脓毒症模型,很好地模拟了临床上腹膜炎导致脓毒症的发病过程。CLP是目前常用的脓毒症模型制备方法[14],病变通常在术后48 h显著,但是盲肠结扎的长度、穿刺针大小、术者技术都直接影响模型的成功率,建模过程需要反复探索,耗费时间,重复性差。CASP模型需要较高难度的技术。与CLP或CASP相比,本研究所用的腹腔注射粪便滤液方法,动物不需要接受麻醉与外科手术,没有麻醉与手术对动物的影响,只需要简单的腹腔注射即可。因此,从方法学上来说,本模型操作更为简便。
静脉或腹腔注射LPS、菌液的模型,具有损伤小、易于操作的优点,通过调节LPS的数量及其生物活性模拟革兰阴性杆菌引起的脓毒症。然而,其不能诱导多重微生物感染的脓毒症,另外有研究[15]显示,LPS敏感性存在种内和种间差异,大鼠LPS的半数致死量剂量大约比人类引起严重疾病和低血压所需的剂量大1 000到10 000倍,这可能与大鼠血清中的一种与铁结合的急性期蛋白血凝素有关,其可以抑制外周血单核细胞在内毒素等刺激时产生促炎因子。同时,LPS或菌液的制备方法复杂,价格也比较昂贵。因此,与LPS相比,通过注射粪便滤液诱导多重微生物引发的腹腔感染,最大限度模拟了临床上急性腹膜炎、肠源性感染造成的脓毒症状态,更接近临床,同时粪便滤液的制备方法简单,获取容易,不需要经费。
对于应用注射粪便滤液而言,国内外学者也曾经进行了一些探讨。Carrara et al[4]应用同种同体粪便滤液建立了猪脓毒症模型,消除了种属不同的不足,但由于粪便滤液来自湿的粪便,不能很好地进行标准化,这就增加了不同个体间的差异。为此,本研究对上述方法进行了改良,首先,用同种粪便消除了种属不同的不足;其次,将粪便自然干燥,一次性制备大量的粪便滤液,保证了粪便滤液的同质化,最大限度减少了粪便来源对动物个体的影响。粪便自然干燥的方法相比其他脱水方法(如低、高温烘干或微波干燥)而言,病原体的变化不大,但本研究并没有应用肠道菌群及其代谢组学分析粪便滤液与肠道“原生态”病原微生物谱及毒素的差异,这也是今后需要进一步关注的问题。
