蟾毒灵通过激活内质网应激通路诱导HCT116细胞凋亡
2023-03-02李宗恒唐东豪袁泽婷殷佩浩1
尚 靖,李宗恒,夏 琪,唐东豪,陈 佳,袁泽婷,殷佩浩1,
结直肠癌(colorectal cancer,CRC)是全球最普遍的一种恶性肿瘤,有调查显示,2020年全球有 940 000 人死于CRC,死亡人数仍在增加[1]。在一定程度上,传统的术后放疗和化疗能改善疗效,但放疗耐受和化疗耐药常常导致治疗失败。抗凋亡是大多数癌症产生放疗耐药和化疗耐药的主要原因,因此促进肿瘤细胞凋亡是改善癌症治疗的关键目标之一[2]。
蟾毒灵是从中药蟾酥中提取的中药单体,研究[3-8]表明蟾毒灵具有广泛的抗肿瘤作用,包括抑制细胞增殖、诱导肿瘤细胞凋亡,抑制肿瘤细胞的耐药,防止侵袭和转移。研究[9]指出,诱导细胞凋亡是蟾毒灵最重要的抗肿瘤方式之一。而持续的内质网应激(endoplasmic reticulum stress,ERS)与细胞凋亡密不可分[10]。因此该研究观察蟾毒灵对结直肠癌HCT116细胞凋亡和增殖的作用,并探讨ERS在HCT116细胞凋亡中的作用。
1 材料与方法
1.1 主要试剂RPMI-1640培养基、双抗(青霉素-链霉素溶液)和胰酶购自美国Gibco公司;胎牛血清(fetal bovine serum,FBS)购自以色列BI公司;蟾毒灵购自成都瑞芬思生物科技有限公司;4-苯基丁酸购自美国MedChemExpress公司;Cell Counting Kit-8(CCK-8)细胞增殖毒性检测试剂盒和Annexin V-FITC/PI细胞凋亡检测试剂盒购自日本DOJINDO公司;RIPA裂解液、苯甲基磺酰氟(fhenylmethanesulfonylfluoride,PMSF)、SDS-PAGE蛋白上样缓冲液、BCA蛋白浓度测定试剂盒和SDS-PAGE电泳相关试剂购自上海碧云天生物技术有限公司;兔源B淋巴细胞瘤-2(B cell lymphoma-2,Bcl-2)抗体(ab32124)和鼠源β-actin抗体(ab6276)购自英国Abcam公司;兔源葡萄糖调节蛋白78(glucose regulated protein 78,GRP78)抗体(3177S)、兔源Bcl-2关联X蛋白(Bcl-2-associated X protein,Bax)抗体(2772S)、兔源真核翻译起始因子2α(eukaryotic translation initiation factor 2α,eIF2α)抗体(5324S)、兔源磷酸化真核翻译起始因子2α(phosphorylated eukaryotic translation initiation factor 2α,p-eIF2α)抗体(3398S)和鼠源C/EBP同源蛋白(C/EBP homologous protein,CHOP)抗体(2895P)购自美国Cell Signaling Technology公司;兔源磷酸化蛋白激酶R样内质网激酶(phosphorylated protein kinase R like endoplasmic reticulum kinase,p-PERK)抗体(abs137056)购自爱必信(上海)生物科技有限公司;ECL显影液和PVDF膜购自美国Miliipore公司。
1.2 细胞培养用含有1%双抗和10% FBS的RPMI-1640培养基培养HCT116细胞,在5% CO2、37 ℃的培养箱中培养,取对数生长期细胞进行实验。
1.3 CCK-8法检测细胞活力取HCT116细胞接种至96孔板(1.5×104个/孔)。第2天用含不同浓度蟾毒灵(0、2.5、5、10、20、40 nmol/L)的培养基或含不同浓度4-苯基丁酸(0、1、2、4、8、16 mmol/L)的培养基替换原来的培养基,并孵育48 h,然后根据制造商的说明书加入CCK-8工作液,培养箱中孵育1h后,然后根据制造商的说明书用酶标仪检测在450 nm处的吸光度,并计算细胞存活率。
1.4 AnnexinV/PI流式细胞术检测细胞凋亡取HCT116细胞接种至6孔板(1×105个/孔)。待贴壁后弃去原有的培养基,用含有不同浓度蟾毒灵(0、2.5、5、10 nmol/L)的新鲜培养基孵育48 h。收集细胞至离心管,用PBS洗涤后,用1×Annexin V Binding Solution重悬,将细胞浓度调整至1×106个/ml。取100 μl细胞悬液至流式管,加入Annexin V-FITC和PI各5 μl,室温下避光孵育15 min,加入500 μl PBS混匀后用流式细胞仪检测细胞凋亡率。
1.5 Western blot检测蛋白表达取HCT116细胞接种至6孔板(3×105个/孔)。待贴壁后弃去原有的培养基,根据实验分组分别处理48 h后,用PBS洗3次后,加入RIPA裂解液(含PMSF),在冰上裂解10 min,将裂解物转移至EP管后,在4 ℃条件下12 000 r/min离心25 min,取上清液,用BCA法测定蛋白浓度,加入SDS-PAGE蛋白上样缓冲液后在金属浴(100 ℃)中煮10 min;取15 μg细胞总蛋白进行SDS-PAGE电泳,结束后将其转移至PVDF膜,并用5%脱脂牛奶封闭1 h,按目标蛋白的分子量裁剪PVDF膜,将目标条带与对应的一抗孵育过夜(4 ℃),一抗包括GRP78(1 ∶1 000)、Bax(1 ∶1 000)、eIF2α(1 ∶1 000)、p-eIF2α(1 ∶1 000)、CHOP(1 ∶1 000)、Bcl-2(1 ∶1 000)和β-actin(1 ∶5 000);洗涤3次后与对应的二抗(兔二抗1 ∶2 000,鼠二抗1 ∶2 000)在常温下孵育1h,洗膜3次后,用ECL显影液进行显色。
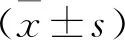
2 结果
2.1 蟾毒灵对HCT116细胞增殖活性的影响如图1所示,不同浓度的蟾毒灵(0、2.5、5、10、20、40 nmol/L)作用HCT116细胞48 h之后,用CCK-8法检测细胞增殖活性,蟾毒灵抑制了HCT116细胞的增殖活力,测得半数抑制浓度为(19.86±1.49) nmol/L,且随蟾毒灵浓度增大,抑制作用逐渐增强,与0 nmol/L相比,差异有统计学意义(F=301.9,P<0.001),同时确定选用10 nmol/L作为后续实验的最大干预浓度。结果表明蟾毒灵抑制HCT116细胞的增殖活性。

图1 蟾毒灵对HCT116细胞增殖的影响
2.2 蟾毒灵可以促进HCT116细胞凋亡将HCT116细胞用不同浓度的蟾毒灵(0、2.5、5、10 nmol/L)干预48 h后,用流式细胞术检测细胞凋亡,结果如图2所示,与对照组(0nmol/L蟾毒灵)相比,随蟾毒灵浓度升高,HCT116细胞的细胞凋亡率依次升高(F=85.27,P<0.001),提示蟾毒灵可以促进HCT116细胞凋亡。
2.3 蟾毒灵对HCT116细胞凋亡蛋白的影响为了进一步验证蟾毒灵可以促进HCT116细胞的凋亡,将HCT116细胞用不同浓度的蟾毒灵(0、2.5、5、10 nmol/L)干预48 h后,用Western blot法检测HCT116细胞内凋亡相关蛋白的变化,结果如图3显示,与对照组(0 nml/L蟾毒灵)相比,随着蟾毒灵浓度增加,Bax蛋白相对表达量逐渐升高(F=8.062,P<0.01),Bcl-2蛋白相对表达量逐渐下降(F=68.94,P<0.001)。以上数据表明,蟾毒灵可以提高Bax的水平,并使Bcl-2表达降低,从而诱导HCT116的凋亡。

图2 蟾毒灵对HCT116细胞凋亡的影响
2.4 蟾毒灵对HCT116细胞ERS通路蛋白表达的影响为了进一步验证蟾毒灵能否诱导HCT116细胞发生ERS,将HCT116细胞用不同浓度的蟾毒灵(0、2.5、5、10 nmol/L)干预48 h后,用Western blot法检测ERS相关蛋白GRP78、p-PERK、eIF2α、p-eIF2α和CHOP的表达情况。结果如图4所示,与对照组(0 nml/L蟾毒灵)相比,随着蟾毒灵浓度增加,GRP78、p-PERK、p-eIF2α和CHOP蛋白相对表达量逐渐升高(FGRP78=26.18,Fp-PERK=42.35,Fp-eIF2α=23.83,FCHOP=132.9,P<0.001),而eIF2α蛋白相对表达量逐渐下降(F=31.74,P<0.001)。表明蟾毒灵上调了GRP78蛋白的表达,说明蟾毒灵能诱导HCT116细胞ERS;同时,蟾毒灵对p-PERK、p-eIF2α和CHOP蛋白表达起到了上调作用,对eIF2α的蛋白表达起到下调作用,对PERK/eIF2α/CHOP信号通路起到激活作用。
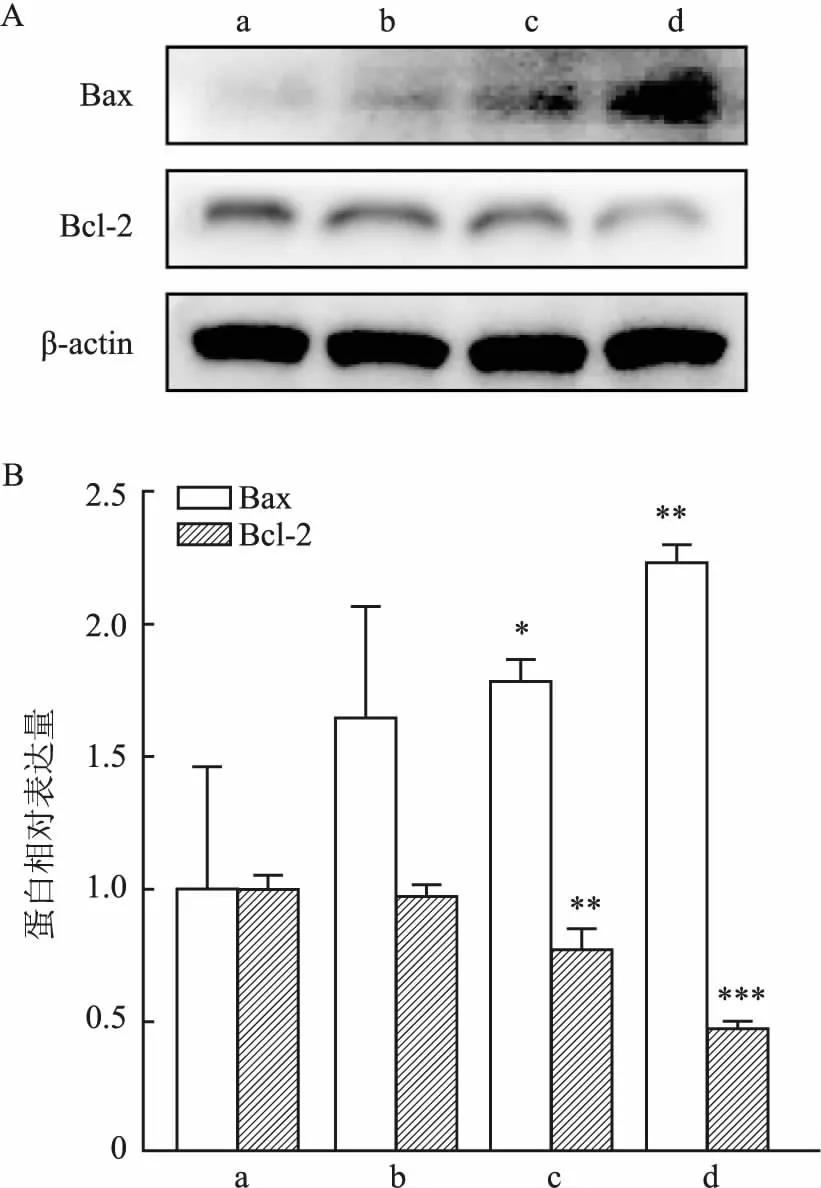
图3 蟾毒灵对Bax和Bcl-2蛋白表达的影响
2.5 蟾毒灵联合ERS抑制剂对HCT116细胞凋亡蛋白的影响用ERS抑制剂4-苯基丁酸处理HCT116细胞48 h,选用非杀伤浓度2 mmol/L(图5A)作为联合用药的浓度。设置对照组、蟾毒灵组(10 nmol/L蟾毒灵)和联合组(10 nmol/L蟾毒灵+2 mmol/L 4-苯基丁酸)分别处理HCT116细胞48 h,随后用Western blot对HCT116细胞中Bax和Bcl-2的变化进行检测,图5B和5C可以看出,蟾毒灵组Bax蛋白的相对蛋白表达量高于对照组,而在联合4-苯基丁酸后,表达量下降(F=68.18,P<0.001);蟾毒灵组Bcl-2蛋白的相对表达量低于对照组,而在联合4-苯基丁酸后,表达量上升(F=47.82,P<0.001)。以上结果进一步验证蟾毒灵可通过诱导ERS来促进细胞凋亡。

图4 蟾毒灵对内质网应激相关蛋白表达的影响
3 讨论
内质网在缺氧、营养缺乏、突变蛋白过多、药物作用及氧化还原状态的改变等不利条件下,蛋白质的折叠功能受损,错误折叠的蛋白质积累在内质网会触发ERS,对此,细胞为了保持细胞内环境稳态而发生一系列反应,称为未折叠蛋白反应(unfolded protein response,UPR)[11]。UPR三种主要的应力传感器为三种跨膜蛋白(位于内质网中),分别为蛋白激酶R样内质网激酶(protein kinase R-like ER kinase, PERK)、肌醇需求酶1(inositol-requiring protein 1, IRE1)和激活转录因子6(activating transcription factor 6, ATF6)[12]。当内质网相对动态平衡时,应力传感器在内质网管腔中的GRP78结合,使其处于灭活状态;在ERS条件下,GRP78对错误折叠蛋白质中暴露的疏水多肽结构域具有更高的亲和力,从而导致GRP78与三种跨膜蛋白解离,UPR信号通路被激活[11]。UPR的主要目的是恢复内质网的动态平衡,以确保细胞存活,而持续且严重的ERS会引起细胞凋亡[13]。例如,在ERS被激活时,PERK的磷酸化使多种PERK底物(其中包含eIF2α)磷酸化,进而阻断了eIF2-GTP-Met-tRNA的形成,减少蛋白质翻译,从而缓解内质网中的蛋白质折叠负担[11, 14]。然而,如果ERS仍未缓解,持续的PERK激活将导致CHOP上调,增加促凋亡的Bcl-2家族蛋白的表达,以促进细胞凋亡[11, 15]。
图5 蟾毒灵联合4-苯基丁酸对Bax和Bcl-2蛋白表达的影响
本研究结果显示,蟾毒灵可呈浓度依赖性地抑制HCT116细胞增殖活性;蟾毒灵可以诱导HCT116细胞凋亡,Western blot检测结果显示蟾毒灵可以下调Bcl-2并上调Bax表达,表明蟾毒灵能诱导HCT116细胞发生凋亡。为了确定蟾毒灵是否诱导了HCT116细胞的ERS,首先分析了ERS的标志蛋白GRP78的表达情况,结果显示GRP78表达上调,表明蟾毒灵诱导了ERS;紧接着对于ERS通路PERK/eIF2α/CHOP上的蛋白的表达情况进行检测,结果显示在蟾毒灵的刺激下,p-PERK、p-eIF2α和CHOP表达会随浓度上升而上升,而eIF2α表达会随浓度上升而下降,说明蟾毒灵激活了该通路。为了探讨ERS与HCT116细胞凋亡的关系,使用了4-苯基丁酸(ERS抑制剂),联合用药组(蟾毒灵+4-苯基丁酸)与蟾毒灵组相比,Bcl-2的表达显著上调,Bax的表达下调,表明在4-苯基丁酸抑制ERS之后,细胞凋亡也被抑制了,表明在蟾毒灵诱导HCT116细胞凋亡中,ERS起到了重要作用。
综上所述,本研究证实,蟾毒灵能有效地抑制HCT116细胞增殖的活性,并能诱发HCT116的凋亡,而该作用在一定程度上是通过激活ERS来实现的。这说明蟾毒灵有可能成为一种直接靶向凋亡途径来治疗CRC的潜在药物,并为蟾毒灵的临床转化提供了理论依据。
