硝酸异山梨酯联合丹参酮注射液治疗AHF的临床疗效
2023-03-02吴玉珍康孟杰邢文珂
吴玉珍 康孟杰 邢文珂
急性心力衰竭(Acute heart failure,AHF)属于心脑血管疾病,受急性心脏负荷加重与心肌损害的影响,AHF 能够导致急性肺循环压力升高、心排血量骤降、周围循环阻力增加,造成肺循环充血而引起急性肺水肿与肺淤血,并可以伴发器官、组织灌注不足与心源性休克综合征[1]。医学上认为,AHF也是众多心血管疾病发展的最终归宿,具有高发病率、高病死率、预后不佳的特点,据统计其发病率正在不断上升[2]。早期临床使用β 受体阻滞剂、血管紧张素Ⅱ受体拮抗剂和血管紧张素转换酶抑制剂治疗心力衰竭取得了一定的效果,但仍有部分患者效果不佳[3]。单硝酸异山梨酯缓释片、丹参酮注射液是治疗心脑血管疾病常用药物[4]。对此,本研究对硝酸异山梨酯联合丹参酮注射液治疗对AHF 患者的影响进行研究,现报道如下。
1 资料与方法
1.1 一般资料
选取2018年1月至2021年8月于首都医科大学附属北京世纪坛医院治疗的138 例AHF 患者,根据治疗药物的不同分为研究组(n=73,硝酸异山梨酯联合丹参酮注射液)和对照组(n=65,硝酸异山梨酯)。其中研究组男39 例,女性34 例;年龄43~78岁,平均年龄(63.94±4.56)岁。美国纽约心脏病学会心功能分级标准(New York Heart Association,NYHA)[5]分级:Ⅱ级26 例、Ⅲ级30 例、Ⅳ级17例。对照组男36 例,女29 例;年龄45~80 岁,平均年龄(64.18±4.36)岁;NYHA 分级:Ⅱ级22 例、Ⅲ级28 例、Ⅳ级15 例。纳入指标:符合AHF 诊断标准[6];在本院治疗且临床资料完整者;无手术相关禁忌症。排除标准:对本次治疗药物过敏者;合并其他恶性肿瘤或其他脏器衰竭者;有精神障碍,无法配合治疗的患者。本研究经院医学伦理委员会批准通过,受试者家属已签署知情同意书。
1.2 方法
两组患者入院后均给予常规治疗,包括卧床休息、戒烟酒、纠正电解质紊乱、控制感染等,同时给予吸氧、β-受体阻滞剂及血管紧张素转换酶抑制剂等常规药物治疗。
对照组口服单硝酸异山梨酯(生产厂家:鲁南贝特制药有限公司;批准文号:国药准字H20052095;规格:20 mg)进行治疗。用法:40 mg/次,1 次/d。研究组在对照组基础上联合丹参酮注射液(生产厂家:上海上药第一生化药业有限公司;批准文号:国药准字H31022558;规格:2 mL:10 mg)进行治疗。用法:取60 mg 丹参酮注射液与250 mL 0.9 氯化钠注射液混合稀释静脉滴注,1次/d。两组均连续治疗2周。
1.3 观察指标
1.3.1 血流动力学
两组患者均在治疗前及治疗2 周后经右颈内静脉置入漂浮导管及压力传感器、鞘管等,使用床旁监护仪监测患者血流动力学指标,包括中心静脉压(Central venous pressure,CVP)、肺循环阻力(Pulmonary circulation resistance,PVR)、平均肺动脉压(Mean pulmonary arterial pressure,MPAP)。
1.3.2 心功能
两组患者均在治疗前及治疗2 周后采用超声经颅多普勒血流分析仪(深圳市德力凯电子有限公司)检测患者左心室射血分数(left ventricular ejection fraction,LVEF)、左心室舒张末期内径(left ventricular end diastolic dimension,LVEDD)、左心室收缩末期内径(left ventricular end systolic dimension,LVESD)。
1.3.3 炎性因子
两组患者均在治疗前及治疗2 周后收集所有参与研究者早晨空腹静脉血5 mL,静置30 min后,使用离心机(离心半径10.0 cm)3 000 r/min 分离血清,10 min 后取出低温保存。使用酶联免疫吸附法(Enzyme Linked Immune Sorbent Assay,ELISA)检测肿瘤坏死因子-α(Tumor necrosis factor α,TNF-α)、白介素-6(Interleukin-6,IL-6)、超敏C 反应蛋白(highsensitivity C-reactive protein,hs-CRP)。试剂盒购自上海研域有限公司,严格按照使用说明书进行操作检测。
1.3.4 不良反应
比较两组患者治疗期间头晕、心悸、皮疹等不良反应的发生情况。
1.4 统计学方法
采用SPSS 22.0 统计软件进行统计分析,计量资料采用()描述,两组间比较采用t检验;计数资料采用通过n(%)表示,并采用χ2检验;以P<0.05 为差异有统计学意义。
2 结果
2.1 两组血流动力学比较
治疗前两组CVP、PVR、MPAP 比较差异无统计学意义(P>0.05),治疗后两组患者CVP、PVR、MPAP 均出现下降,其中以研究组变化更为明显,差异有统计学意义(P<0.05)。见表1。
表1 两组治疗前后血流动力学比较(±s)Table 1 Comparison of hemodynamics between the two groups before and after treatment(±s)
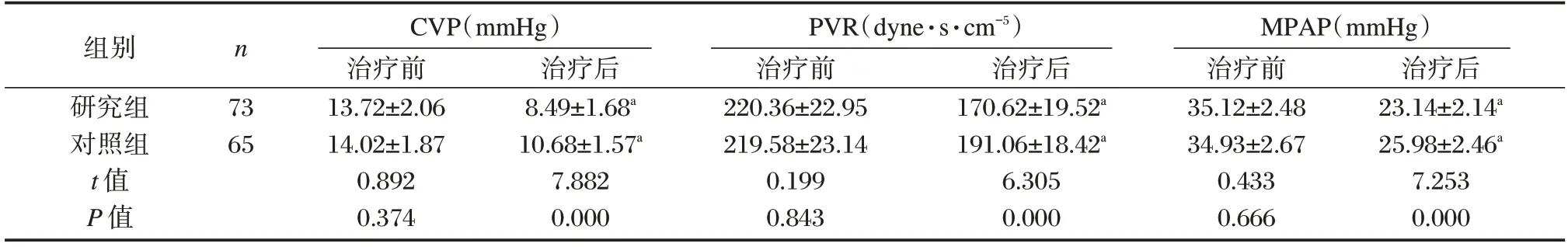
表1 两组治疗前后血流动力学比较(±s)Table 1 Comparison of hemodynamics between the two groups before and after treatment(±s)
注:与同组治疗前比较,aP<0.05。
组别研究组对照组t 值P 值n 73 65 CVP(mmHg)治疗前13.72±2.06 14.02±1.87 0.892 0.374治疗后8.49±1.68a 10.68±1.57a 7.882 0.000 PVR(dyne·s·cm-5)治疗前220.36±22.95 219.58±23.14 0.199 0.843治疗后170.62±19.52a 191.06±18.42a 6.305 0.000 MPAP(mmHg)治疗前35.12±2.48 34.93±2.67 0.433 0.666治疗后23.14±2.14a 25.98±2.46a 7.253 0.000
2.2 两组心功能指标比较
治疗前两组LVEDD、LVESD、LVEF 比较差异无统计学意义(P>0.05),治疗后两组患者LVEDD、LVESD 均出现下降,而LVEF 出现上升,其中以研究组变化更为明显,差异均有统计学意义(P<0.05)。见表2。
表2 两组治疗前后心功能指标比较(±s)Table 2 Comparison of cardiac function indexes between the two groups before and after treatment(±s)

表2 两组治疗前后心功能指标比较(±s)Table 2 Comparison of cardiac function indexes between the two groups before and after treatment(±s)
注:与同组治疗前比较,aP<0.05。
组别研究组对照组t 值P 值n 73 65 LVEF(%)治疗前31.51±3.04 30.94±2.84 1.134 0.259治疗后38.16±2.98a 35.17±2.67a 6.177 0.000 LVEDD(mm)治疗前63.95±3.58 64.24±3.76 0.464 0.644治疗后55.35±2.41a 59.16±3.04a 8.200 0.000 LVESD(mm)治疗前51.04±3.07 50.86±3.58 0.318 0.751治疗后42.65±2.51a 45.68±2.84a 6.653 0.000
2.3 两组炎性因子比较
治疗前两组TNF-α、IL-6、hs-CRP 比较差异无统计学意义(P>0.05),治疗后两组患者TNF-α、IL-6、hs-CRP 水平均出现下降,其中以研究组变化更为明显,差异均有统计学意义(P<0.05)。见表3。
表3 两组治疗前后炎性因子比较(±s)Table 3 Comparison of inflammatory factors before and after treatment between the two groups(±s)
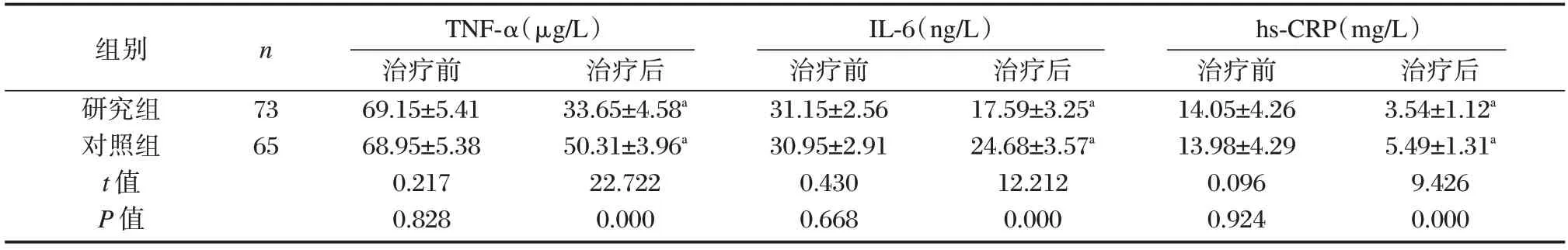
表3 两组治疗前后炎性因子比较(±s)Table 3 Comparison of inflammatory factors before and after treatment between the two groups(±s)
注:与同组治疗前比较,aP<0.05。
组别研究组对照组t 值P 值n 73 65 TNF-α(μg/L)治疗前69.15±5.41 68.95±5.38 0.217 0.828治疗后33.65±4.58a 50.31±3.96a 22.722 0.000 IL-6(ng/L)治疗前31.15±2.56 30.95±2.91 0.430 0.668治疗后17.59±3.25a 24.68±3.57a 12.212 0.000 hs-CRP(mg/L)治疗前14.05±4.26 13.98±4.29 0.096 0.924治疗后3.54±1.12a 5.49±1.31a 9.426 0.000
2.4 两组不良反应比较
研究组不良反应发生率为19.18%,稍高于对照组的12.31%,但两组比较差异无统计学意义(P>0.05)。见表4。

表4 两组不良反应发生情况比较[n(%)]Table 4 Comparison of the occurrence of adverse reactions between the two groups[n(%)]
3 讨论
AHF 是一种临床综合征,临床表现为疲劳乏力、呼吸困难、急性肺水肿、咯痰或咯血等症状[6]。目前,醛固酮受体拮抗剂、β-受体阻滞剂等药物已用于心力衰竭治疗,临床研究表明上述药物可降低死亡率、改善预后,但仍有部分患者存在治疗后临床症状没有明显改善,甚至恶化[6]。
单硝酸异山梨酯缓释片属长效硝酸酯类药物,是一种血管扩张剂,其作用机制是通过亚硝基团直接扩张血管,放松动静脉平滑肌,扩张外周静脉,减少血液回流心脏,从而减低右心房压力、减低心室前负荷及室壁张力,并最终增加心输出量,从而达到临床治疗的效果[7]。现代药理研究表明,丹参酮是丹参的主要脂溶性成分之一,其活性作用可以加速体内的新陈代谢和各种生化反应[8]。本研究结果显示,治疗后研究组血流动力学下降更为明显,与既往研究结果相似[9]。分析原因为:单硝酸异山梨酯是一种温和的动脉扩张剂和强大的静脉扩张剂,它能有效地降低心室充盈压力,减少心肌耗氧量和心室壁应力,并通过抑制血小板聚集,降低血液粘度,改善患者血流动力学[10]。丹参酮具有钙通道阻滞剂样作用,如改善冠状动脉血液循环、抗心律失常、减少心肌梗塞面积、抗急性缺血缺氧、抗血栓形成和改善平滑肌状态[11]。故单硝酸异山梨酯联合丹参酮注射液联合使用能更好地提高AHF 患者血流动力学改善程度[12]。另一方面,本组数据分析得:治疗后研究组患者心功能改善更为明显,与既往文献报道[13]类似,提示单硝酸异山梨酯与丹参酮注射液两者联合使用在改善AHF 患者心功能上优势更佳。究其原因为:单硝酸异山梨酯可通过扩张肺血管来缓解肺部充血,改善肺毛细血管压力,进一步扩张外周小动脉,降低全身阻力,纠正心力衰竭的状态,改善心功能[14]。而丹参酮具有扩张冠状动脉及其分支的功能,可改善心肌的供血,进而改善心功能[15]。炎性介质水平的高低与心力衰竭的发生、病情进展具有密切联系,TNF-α 是一种促炎因子,能促进炎症细胞的活化和聚集。IL-6、hs-CRP 可有效促进心肌细胞表达粘附,其水平升高可加重心肌细胞损伤[16]。本研究患者经硝酸异山梨酯联合丹参酮治疗后,研究组TNF-α、IL-6、hs-CRP 水平下降最为明显,说明硝酸异山梨酯联合丹参酮治疗可有效地促进细胞因子水平的改善和减少炎症反应。同时本研究针对药物安全性进一步分析得:单硝酸异山梨酯联合丹参酮注射液与单硝酸异山梨酯单用治疗AHF 患者不良反应发生率比较差异无统计学意义,提示单硝酸异山梨酯联合丹参酮注射液治疗AHF 具有一定安全性。
综上所述,硝酸异山梨酯联合丹参酮可有效改善AHF 患者血流动力学、心功能、炎性因子,且安全性较高,临床可考虑将其推广应用。
