PSMD14在胰腺癌中的表达分析及对胰腺癌细胞增殖的影响*
2023-03-01徐恩君杨玉萍王中新
王 悦,徐恩君,杨玉萍,王中新
安徽医科大学第一附属医院检验科,安徽合肥 230000
胰腺癌是一种具有高度侵袭性的肿瘤,严重威胁人类生命健康[1]。胰腺癌发病隐匿,早期诊断困难,仅15%~25%的患者确诊时有机会接受手术治疗[2]。绝大多数胰腺癌患者确诊时已处于中晚期,5年生存率低至9%,预后极差[3]。缺乏早期检测手段、肿瘤转移及化疗抵抗等多方面因素是患者预后不良的原因[1]。研究表明,胰腺癌中存在广泛的基因和表观遗传学改变,导致肿瘤驱动基因异常激活[4-5]。因此,挖掘潜在的肿瘤驱动基因并探索其与胰腺癌的关系将有助于人们认识胰腺癌的进展机制,改善患者预后。泛素化是常见的转录后修饰方式,即泛素分子与底物蛋白赖氨酸残基连接的过程。泛素化的蛋白通常被蛋白酶体识别并降解,而去泛素化则是将泛素分子从底物蛋白移除,从而维持蛋白的稳定性[6]。由于作用底物的多样性,去泛素化酶在多种生物学进程中发挥重要调控作用,与肿瘤的发生密切相关[7-8]。蛋白酶体26S亚基非ATP酶14(PSMD14)是去泛素化酶中JAB1/MPN/Mov34金属酶(JAMM)结构域蛋白酶家族的一员,在卵巢癌、肝癌和头颈癌等多种肿瘤中表达上调[9-11]。其表达上调与病理高分期、血管侵袭和肿瘤增殖等多种预后不良因素有关[10-12],而下调PSMD14表达则能诱导细胞凋亡、抑制细胞增殖和上皮间质转化过程[9,13]。在结直肠癌中,PSMD14通过促进致癌基因ALK2的去泛素化而维持其蛋白稳定性,从而促进结直肠癌细胞增殖和化疗抵抗[14]。在头颈癌中,PSMD14则介导了SNAIL的去泛素化和蛋白的稳定性,从而促进肿瘤的侵袭转移[15]。由此可见PSMD14通过作用于多种不同的底物在多种肿瘤中扮演了“促癌”的角色,而其在胰腺癌中的作用及机制尚不清楚。本研究旨在分析PSMD14在胰腺癌中的表达情况及与患者预后的关系,并初步探讨其作用于胰腺癌细胞的分子机制。
1 资料与方法
1.1一般资料 6对胰腺癌组织和癌旁正常组织(距离肿瘤边缘2 cm以上)来源于2020年4月至2020年12月于本院进行手术切除治疗并经病理检查确诊为胰腺癌的患者。本研究经安徽医科大学第一附属医院医学伦理委员会批准。标本来源的患者均对本研究知情同意并签署知情同意书。
1.2细胞与试剂 胰腺癌PANC-1和BxPC-3细胞购自中国科学院上海生命科学研究院细胞资源中心。DMEM培养基、胰酶及胎牛血清、Opti-MEM培养基为Gibco公司产品,链霉素-青霉素双抗为Hyclone公司产品。Lip3000转染试剂购自Invitrogen公司,PSMD14小干扰RNA(siRNA)和阴性对照siRNA购自Thermo Fisher Scientific公司。葡萄糖摄取试验试剂盒、乳酸生成试验试剂盒为Abcam公司产品。CCK-8试剂盒、组织总蛋白提取试剂盒、RIPA裂解液、BCA蛋白定量试剂盒、5×蛋白上样缓冲液购自碧云生物技术公司。PSMD14、肝脏磷酸果糖激酶(PFKL)抗体购自Abcam公司,己糖激酶2(HK2)抗体、丙酮酸激酶2(PKM2)抗体、β-actin抗体购自Proteintech公司。PVDF膜、增强化学发光液购自Millipore公司。Trizol试剂购自Life technologies公司。PrimeScript反转录试剂盒、SYBR Premix Ex TaqTMⅡ试剂盒购自Takara公司。
1.3方法
1.3.1PSMD14 mRNA表达分析 通过基因表达谱交互分析工具(GEPIA2,http://gepia2.cancer-pku.cn/#index)分析TCGA数据库中PSMD14 mRNA在胰腺癌患者癌组织和正常组织中的表达差异,同时分析PSMD14 mRNA表达水平与患者总生存率和无病生存率的关系。对PSMD14表达可能参与调控的生物学过程进行基因富集分析,即GO功能注释和KEGG通路富集分析。
1.3.2Western blot(WB)检测蛋白表达水平 将组织进行充分研磨后,使用RIPA试剂在4 ℃条件下充分裂解细胞,按照组织蛋白提取试剂盒说明书中的步骤提取总蛋白。用BCA法测定蛋白浓度,取适量蛋白加入5×上样缓冲液后于100 ℃水浴10 min使蛋白变性。将处理好的蛋白在10%SDS聚丙烯酰胺凝胶上电泳,然后电转至PVDF膜,用含5%牛奶的缓冲液将膜封闭2 h,将PVDF膜与一抗(PSMD14 1∶1 000稀释,HK2 1∶1 000稀释,PFKL 1∶1 000稀释,PKM2 1∶1 000稀释,β-actin 1∶2 000稀释)4 ℃孵育过夜。洗膜(10 min×3次)后,将膜与二抗(1∶3 000)室温孵育1 h,再洗膜(10 min×3次),最后用化学发光液显影并用凝胶成像仪拍照。
1.3.3细胞培养和细胞转染 人胰腺癌细胞PANC-1和BxPC-3用含1%双抗、10%胎牛血清的DMEM培养基,在37 ℃、5%CO2条件下培养。取对数生长期的细胞计数,按2×105个细胞/孔接种于6孔板,待细胞融合度达50%~70%时进行转染。按照Lip 3000转染试剂说明书,将2.5 μg siRNA用125 μL无血清培养基稀释,5 μL Lip3000用125 μL无血清培养基稀释,两者混合后加入细胞中,8 h后换液继续培养至48 h。PSMD14 siRNA的序列如下,F:5′- GCCAUCUACCACUUGCAAUTT-3′,R:5′- AUU GCA AGUGGUAGAUGGCTT-3′。
1.3.4CCK-8试验 细胞转染48 h后按3 000个/孔接种于96孔板,每组设置5孔,分别培养0、24、48、72 h,每孔加入10 μL CCK-8试剂,孵育1 h,酶标仪测定450 nm处吸光度(A)值。
1.3.5葡萄糖摄取试验、乳酸生成试验及相关性分析 肿瘤细胞常通过增强糖酵解来保证细胞的快速增殖[16],因此本研究对PSMD14是否通过调控胰腺癌细胞的糖酵解来促进细胞增殖进行研究。葡萄糖摄取试验:将转染的细胞以3 000个/孔接种于96孔板中,待细胞贴壁后,更换为无血清培养基使细胞饥饿过夜。PBS洗3次,加入2-脱氧葡萄糖。按照葡萄糖摄取检测试剂盒说明书处理细胞,酶标仪测定412 nm处A值(可反映葡萄糖摄取量)。乳酸生成试验:将转染的细胞以3 000个/孔接种于96孔板中,待细胞贴壁后,更换为无血清培养基,于24 h收集细胞培养上清,离心去除细胞碎片,按照乳酸生成检测试剂盒说明书加入试剂,酶标仪测定450 nm处A值(可反映乳酸生成量)。为了进一步探讨PSMD14调控细胞糖酵解的机制,通过GEPIA2分析PSMD14 mRNA与糖酵解限速酶HK2、PFKL、PKM mRNA表达水平的相关性。
1.3.6RNA提取及反转录实时荧光定量聚合酶链反应(RT-qPCR) 按照试剂说明用Trizol提取细胞总RNA,并用核酸仪检测RNA浓度。用PrimeScript RT kit将RNA反转录为cDNA,再用SYBR Premix Ex TaqTMⅡ Kit及相应引物对cDNA进行PCR扩增。反转录及qPCR在Bio-rad CFX96型PCR仪上进行。引物序列如下,PKM2正向为5′-TCGCATGCAGVACCTGATT-3′,反向为5′-CCTCGAATAGCTGCAAGTGGTA-3′;β-actin正向为5′-GGACTTCGAGCAAGAGATGG-3′,反向为5′-AGCACTGTGTTGGCGTACAG-3′。

2 结 果
2.1PSMD14在胰腺癌和癌旁正常组织中的表达情况及与患者预后的关系 TCGA数据分析显示:PSMD14 mRNA在胰腺癌组织中的表达水平显著高于癌旁正常组织(P<0.05)。WB显示:PSMD14蛋白在胰腺癌组织中的表达水平高于癌旁正常组织(P<0.05)。以PSMD14 mRNA表达水平中位数为界,将胰腺癌患者分为PSMD14高表达组和低表达组,PSMD14高表达组的总生存率和无病生存率均明显低于PSMD14低表达组(P<0.05)。见图1。
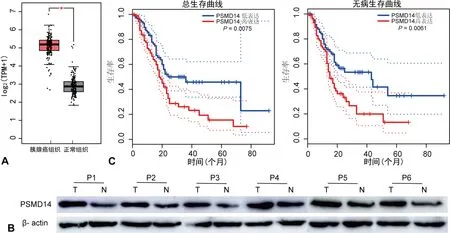
注:A为TCGA数据中PSMD14 mRNA在胰腺癌组织和癌旁正常组织中的表达水平比较,胰腺癌组织179例,癌旁正常组织171例,*表示两组间比较P<0.05,以TPM表示mRNA的表达水平,纵轴数值为将TPM进行对数处理后的数值;B为WB检测PSMD14蛋白在胰腺癌组织和癌旁正常组织中的表达水平,P1~P6为标本编号,T表示胰腺癌组织,N表示癌旁正常组织;C为PSMD14高、低表达组的总生存曲线和无病生存曲线。
2.2基因富集分析 GO功能注释和KEGG通路富集分析显示:PSMD14表达与细胞增殖的相关功能和通路有关,如DNA重组、细胞周期的正向调控等,提示PSMD14可能影响胰腺癌细胞的增殖。
2.3PSMD14对胰腺癌细胞增殖的作用 WB检测显示:转染PSMD14 siRNA的细胞与转染阴性对照siRNA的细胞相比,PSMD14蛋白表达水平明显降低(P<0.05)。CCK-8试验显示:与转染阴性对照siRNA的细胞相比,转染PSMD14 siRNA的细胞增殖被明显抑制(P<0.05),说明PSMD14可以促进胰腺癌细胞的增殖。见图2。

注:A为WB检测各组细胞中PSMD14蛋白的表达水平及PSMD14蛋白表达水平的比较;B为CCK-8试验检测细胞的增殖能力;阴性对照表示转染阴性对照siRNA,siRNA表示转染PSMD14 siRNA。
2.4PSMD14促进细胞糖酵解 干扰PSMD14表达能显著抑制细胞的葡萄糖摄取和乳酸生成(P<0.05),见图3。
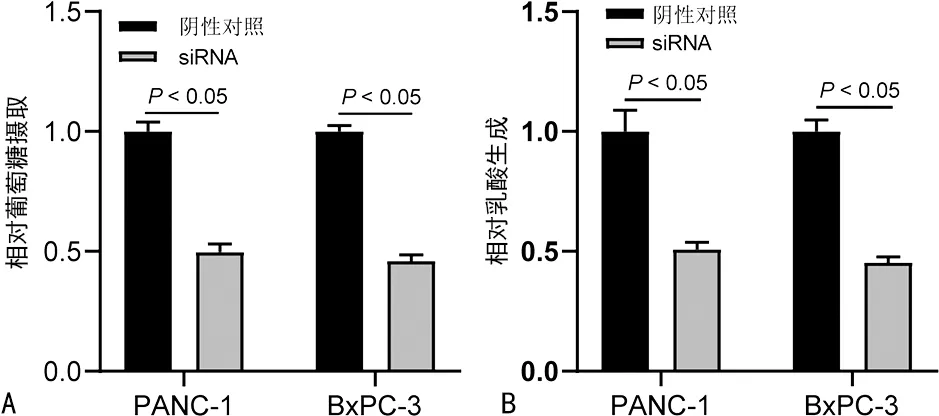
注:A为葡萄糖摄取试验;B为乳酸生成试验;阴性对照表示转染阴性对照siRNA,siRNA表示转染PSMD14 siRNA;葡萄糖摄取量和乳酸生成量分别由相应的A值表示。
2.5PSMD14对糖酵解限速酶表达的影响 通过GEPIA2分析发现PSMD14 mRNA与糖酵解限速酶HK2、PFKL、PKM mRNA的表达水平呈正相关(r=0.30、0.25、0.41,P<0.05)。WB检测显示:干扰PSMD14表达能抑制PKM2蛋白的表达(P<0.05),而对HK2和PFKL蛋白的表达无明显影响(P>0.05),说明PSMD14可能通过调控PKM2蛋白的表达影响胰腺癌细胞的糖酵解。RT-qPCR结果显示:干扰PSMD14表达对PKM2 mRNA表达无明显影响(P>0.05),提示PSMD14可能通过转录后修饰的方式调控PKM2蛋白的表达。见图4。

注:A为通过GEPIA2分析胰腺癌中PSMD14与HK2、PFKL和PKM2 mRNA表达水平的相关性,以TPM表示mRNA的表达水平,横纵轴数值为将TPM进行对数处理后的数值;B为WB检测各组细胞中HK2、PFKL和PKM2蛋白的表达水平及PKM2蛋白相对表达水平的组间比较;C为RT-qPCR检测各组细胞中PKM2 mRNA的表达水平;阴性对照表示转染阴性对照siRNA,siRNA表示转染PSMD14 siRNA。
3 讨 论
蛋白的泛素化和去泛素化是常见的转录后修饰过程,近年来越来越多的研究证实了其在肿瘤进展中发挥重要的调控作用[8]。PSMD14是去泛素化酶中JAMM家族成员之一,其在肝癌、肺癌、结直肠癌等多种肿瘤中表达上调,而且是影响预后的因素[10,12,14]。本研究首次探讨了PSMD14在胰腺癌调控中的分子机制,发现PSMD14在胰腺癌组织中表达异常上调,其高表达与患者预后不良有关,这与其在其他多种肿瘤中的促癌作用一致[10,12,14]。
既往的研究表明,PSMD14可通过促进细胞增殖、促进上皮间质转化、介导侵袭转移过程、促进血管侵袭等多种方式促进肿瘤进展[12,17-18],而PSMD14导致胰腺癌患者预后不良的分子机制尚不清楚。本研究通过基因富集分析挖掘了PSMD14在胰腺癌中可能参与的生物学过程,发现其富集的功能和通路与细胞增殖有关,提示PSMD14可能参与调控胰腺癌细胞增殖。进一步的实验验证发现,干扰PSMD14表达可抑制胰腺癌细胞增殖。在其他多种肿瘤中,靶向抑制PSMD14表达也能明显抑制肿瘤进展。在黑色素瘤中,靶向抑制PSMD14可导致SMAD3的聚集和锌指转录因子(SLUG)的减少,从而抑制肿瘤细胞的增殖和迁移[19]。JING等[11]研究发现,PSMD14抑制剂可拮抗E2F1/Akt/SOX2信号介导的肿瘤干性,从而逆转化疗抵抗现象。以上研究说明PSMD14可能作为肿瘤治疗的潜在靶点。然而,在胰腺癌中PSMD14调控细胞增殖的机制尚不清楚,进一步阐明其机制将有助于评估其作为胰腺癌精准治疗靶点的潜力。
无氧糖酵解,也称为“Warburg效应”,是肿瘤的重要代谢重塑方式之一,肿瘤细胞因此可快速获得能量供给并产生有利于肿瘤生长的微环境[20]。有研究表明,泛素化和去泛素化可调控肿瘤细胞的无氧糖酵解,并导致细胞增殖、迁移和侵袭能力等生物学行为的改变[21]。泛素化酶TRIM47通过增加果糖-1,6-二磷酸酶1(FBP1)的泛素化降解而促进细胞糖酵解,导致胰腺癌进展[22],去泛素化酶OTUB2通过调控U2AF2的去泛素化维持其稳定性,从而促进肺癌细胞的糖酵解[23]。本研究结果显示:干扰PSMD14表达能抑制胰腺癌细胞的葡萄糖摄取和乳酸生成,提示PSMD14可抑制细胞糖酵解。SUN等[9]研究发现PSMD14可促进卵巢癌细胞糖酵解进而加速肿瘤进展,使用PSMD14抑制剂可抑制肿瘤生长,与本研究结果一致。本研究发现,干扰PSMD14可抑制胰腺癌细胞增殖,但其对胰腺癌细胞侵袭能力的影响及在体内的效应仍需进一步地研究。
研究证实PSMD14可催化多种底物的去泛素化过程[10,14-15],通过相关性分析,本课题组发现PSMD14与糖酵解关键酶HK2、PFKL和PKM存在共表达,提示PSMD14可能参与调控这3种酶的表达。进一步地发现,干扰PSMD14表达可降低PKM2蛋白表达水平,而对HK2和PFKL蛋白表达水平无影响,说明PKM2是PSMD14的调控靶点,此结果与在卵巢癌中的研究结果一致[9]。PKM2是糖酵解限速酶之一,参与调控包括胰腺癌在内的多种肿瘤细胞的糖酵解过程,能显著影响肿瘤进展[24-25]。多种泛素化酶,如LHPP、Parkin、TRIM58等[26-28],以及多种去泛素化酶,如OTUB2和USP20,可调控PKM2的泛素化和去泛素化过程[26-30]。LHPP、TRIM58和OTUB2调控PKM2的泛素化及蛋白的稳定性[26,28-29]。CHEN等[31]研究发现,Parkin调控PKM2的泛素化及降解过程,而LIU等[27]研究表明Parkin促进PKM2的泛素化并抑制酶活性,但不影响蛋白稳定性。USP20促进PKM2的去泛素化但不影响蛋白稳定性[30]。本研究结果发现干扰PSMD14表达能抑制PKM2蛋白的表达,但不影响PKM2 mRNA表达。因此,笔者推测PSMD14可能通过促进PKM2的去泛素化而增加其蛋白稳定性,但仍有待进一步的实验研究来证实。鉴于泛素化和去泛素化对PKM2的蛋白稳定性和活性的调控机制复杂多变,结合本研究结果,下一步仍需要继续研究PSMD14调控PKM2蛋白表达的具体机制,如明确PSMD14对PKM2的泛素化调控位点以及这种调控是否影响PKM2进入细胞核,是否影响PKM2的聚合形式等。
综上所述,本研究证实了PSMD14在胰腺癌组织中高表达,PSMD14高表达与患者预后不良有关。PSMD14促进胰腺癌细胞糖酵解和增殖,这可能与其上调PKM2蛋白表达有关,而这也可能是其导致患者预后不良的原因之一。
