Chemerin、VEGF与缺血低灌注区面积间的关系及对短期预后的预测价值*
2023-03-01闫志荣王锦梅
闫志荣,王 帅,王锦梅
河北省唐山市开滦总医院:1.药剂科;2.康复科,河北唐山 063000
急性脑梗死(ACI)具有高发病率、高致残率、高病死率及高复发率的特点,在全球人群致残原因中居首位[1]。ACI的早期诊治是改善患者预后的关键环节[2]。因此,快速识别高危患者,及时进行针对性治疗对拯救患者生命,改善预后至关重要。血管内皮生长因子(VEGF)是最有效的促血管形成因子,也是公认的神经营养因子,多项研究证实脑组织缺血缺氧后,VEGF表达上调[3-4]。Chemerin是新型脂肪细胞因子,与脂质代谢及炎症密切相关,参与动脉粥样硬化(AS)发生与发展[5-6]。脂肪因子Chemerin与AS关系的研究多在心血管疾病中进行,在脑血管疾病中进行的研究相对较少。基于此,本研究旨在探讨Chemerin、VEGF与ACI患者缺血低灌注区面积间的关系,以及上述指标对患者短期预后预测价值,以期为临床ACI防治提供理论依据,现报道如下。
1 资料与方法
1.1一般资料 将2018年5月至2021年10月于本院治疗的87例ACI患者纳入研究作为观察组,纳入标准:符合ACI诊断标准[7];为首次ACI发作并在发病3 d内就诊;存在相应神经系统症状和体征。另外,选取同期于本院进行体检的健康者87例作为对照组,纳入标准:全身体检结果正常;无脑血管疾病史。排除标准:有短暂性脑缺血发作(TIA);有卒中病史的后遗症;有3个月内的手术或外伤史;有恶性肿瘤;有严重心、肺、肝、肾疾病。本研究经本院伦理委员会批准。纳入研究者均对本研究知情同意,并签署知情同意书。
1.2方法 (1)基本资料收集:自制《基本资料调查表》收集患者性别、年龄、体质量指数、吸烟史、饮酒史、卒中家族史、高血压、糖尿病、高血脂等资料。(2)缺血低灌注区面积测定:采用西门子Somatom sensation 16层螺旋CT机,以梗死区域行CT灌注成像(CTPI),测量缺血低灌注区面积。(3)血清Chemerin、VEGF测定:采集静脉血3 mL,以3 500 r/min转速、8 cm半径离心5 min,分离血清,采用酶联免疫吸附法检测Chemerin、VEGF水平,试剂盒购自北京百奥莱博科技有限公司。(4)出院时采用mRS评分评估短期预后情况:mRS评分0~<3分为预后良好;mRS评分3~6分为预后不良。
1.3观察指标 (1)两组基本资料及血清Chemerin、VEGF水平。(2)ACI影响因素。(3)ACI患者血清Chemerin、VEGF水平与缺血低灌注区面积的相关性。(4)不同预后ACI患者基本资料及血清Chemerin、VEGF水平。(5)ACI患者短期预后的影响因素。(6)血清Chemerin、VEGF水平对ACI患者短期预后预测价值。

2 结 果
2.1两组基本资料及血清Chemerin、VEGF水平比较 两组吸烟史、饮酒史、卒中家族史、高血压、糖尿病、高血脂比例及血清Chemerin、VEGF水平比较,差异均有统计学意义(P<0.05)。见表1。

表1 两组基本资料及血清Chemerin、VEGF水平[n(%)或

续表1 两组基本资料及血清Chemerin、VEGF水平[n(%)或
2.2ACI影响因素 以ACI发生情况为因变量(否=0,是=1),以表1中差异有统计学意义的指标为自变量进行Logistic回归分析。结果显示:在控制吸烟史、饮酒史、卒中家族史、高血压、糖尿病、高血脂等因素后,血清Chemerin、VEGF高表达为ACI的独立危险因素(P<0.05)。见表2。
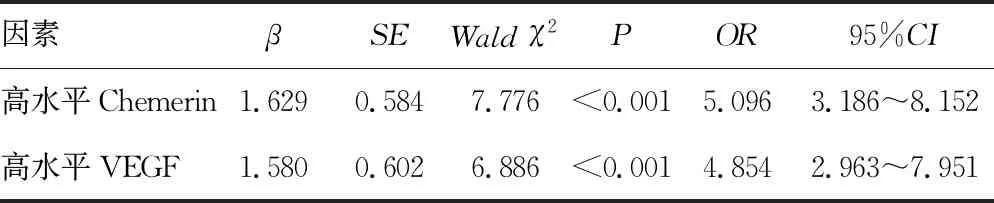
表2 ACI的影响因素分析
2.3ACI患者血清Chemerin、VEGF水平与缺血低灌注区面积的相关性 血清Chemerin、VEGF水平与缺血低灌注区面积均呈正相关(r=0.810、0.979,P<0.001),见图1、2。

图1 血清Chemerin水平与缺血低灌注区面积的相关性分析
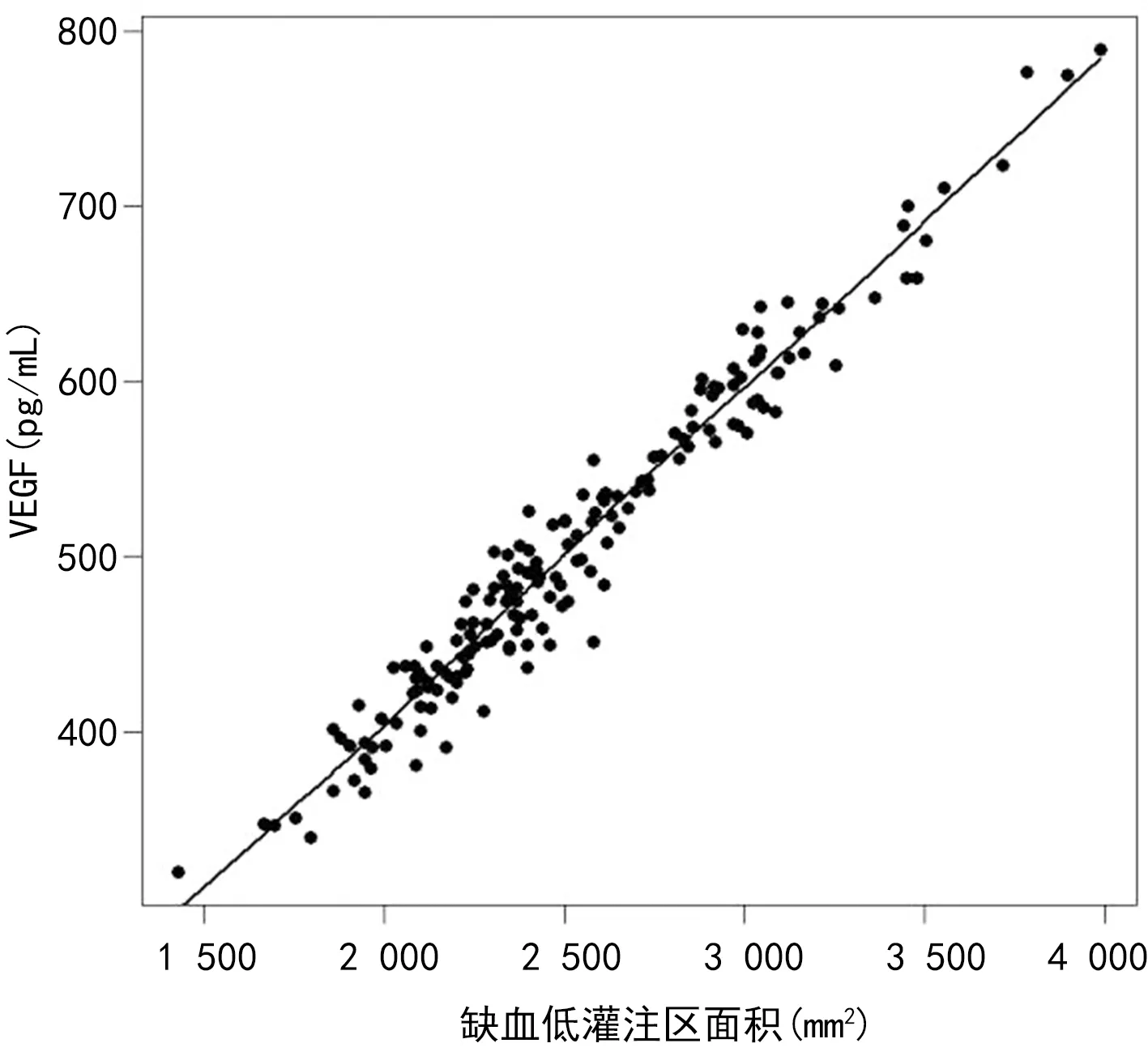
图2 血清VEGF水平与缺血低灌注区面积的相关性分析
2.4不同预后ACI患者基本资料及血清Chemerin、VEGF水平比较 预后良好58例,预后不良29例,预后不良患者缺血低灌注区面积及血清Chemerin、VEGF水平均大于或高于预后良好患者(P<0.05)。见表3。

表3 不同预后ACI患者基本资料及血清Chemerin、VEGF水平比较[n(%)或

续表3 不同预后ACI患者基本资料及血清Chemerin、VEGF水平比较[n(%)或
2.5ACI患者短期预后影响因素 以短期预后为因变量(预后良好=1,预后不良=2),以表4中差异有统计学意义的指标为自变量,进行Logistic回归分析,结果显示:缺血低灌注区面积大及高水平Chemerin、VEGF为ACI的独立危险因素(P<0.05)。见表4。
2.6血清Chemerin、VEGF对ACI患者短期预后预测价值 以预后不良为阳性,预后良好为阴性,绘制各指标预测短期预后的ROC曲线,结果显示:Chemerin、VEGF用于预测短期预后的AUC分别为0.765、0.815,两项指标联合使用的AUC最大,为0.877。见图3、表5。

表4 ACI患者短期预后影响因素
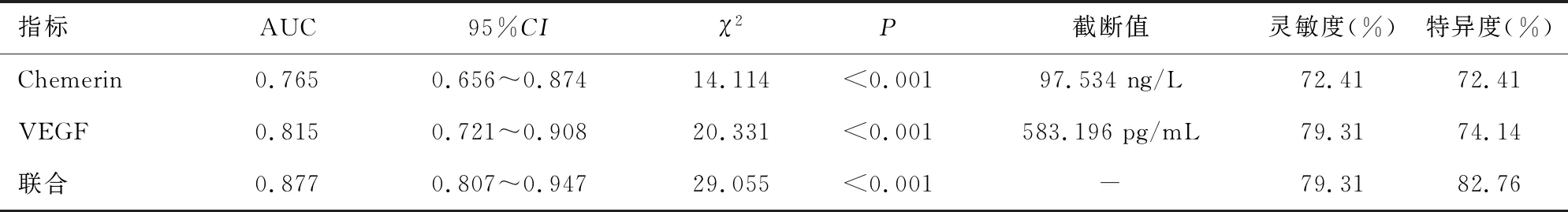
表5 血清Chemerin、VEGF对ACI患者短期预后预测价值
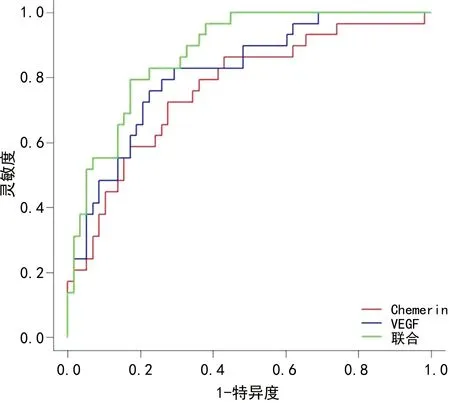
图3 血清Chemerin、VEGF预测ACI患者短期预后的ROC曲线
3 讨 论
ACI急性期神经损伤是涉及多环节、多机制的级联过程,与炎症反应、兴奋性氨基酸毒性、离子失衡、氧自由基损伤等有关,急性期的有效治疗对患者预后至关重要[8]。现阶段,经循证医学证实的,能有效治疗ACI的方法有限[9]。为进一步改善ACI患者预后,学者们在努力研究神经损伤机制、探索新的治疗方案的同时,也在积极寻找可预测患者病情程度及转归的生化指标,以期为个体化治疗提供依据。
AS是引起ACI的主要原因之一[10]。目前,AS发病机制仍未完全明确,脂肪细胞因子是AS及相关疾病研究的新兴靶点。其发挥作用的主要机制:改变血管内皮细胞屏障功能;参与血管平滑肌细胞增殖及凋亡;参与脂质紊乱;影响AS斑块稳定性等。Chemerin是新型脂肪细胞因子,大量表达于白色脂肪组织中[11-12]。越来越多研究证实,Chemerin通过调控炎症反应及糖脂代谢等活动参与AS及其相关疾病的发生[13-14]。目前,脂肪因子Chemerin在心血管疾病中的研究较多,在脑血管疾病中的研究相对较少。本研究显示,血清Chemerin高表达为ACI独立危险因素,提示Chemerin可能参与ACI发生、发展过程,与徐品丽等[15]研究一致。Chemerin在炎症反应早期,通过作用于表达Chemerin受体(ChemR23)的免疫细胞,趋化免疫活性细胞(巨噬细胞等),上调细胞黏附分子表达,促进白细胞介素-6(IL-6)、肿瘤坏死因子(TNF-α)等炎症因子释放,并上调细胞黏附分子表达,发挥促炎作用[16]。作为重要脂肪细胞因子,Chemerin通过调节脂肪细胞分化、诱导胰岛素抵抗、促进成熟脂肪细胞脂解等作用,广泛参与糖、脂代谢过程[17]。白细胞与血管内皮黏附是AS病理改变的前提,而黏附因子是介导白细胞与血管内皮细胞黏附的关键因素[18]。Chemerin参与机体免疫趋化反应,在招募单核细胞参与局部炎症的过程中发挥重要作用,可上调单核巨噬细胞表面黏附分子表达,介导单核巨噬细胞对血管内皮黏附,促进AS进展及ACI发生[19]。另外,Chemerin广泛参与糖脂代谢紊乱,而血脂异常、肥胖是ACI发生的重要危险因素[20]。因此,推测Chemerin可能通过糖脂代谢而加速ACI发生及发展。ACI患者缺血低灌注区面积可直接反映脑组织及神经功能损伤程度,与神经功能恢复情况密切相关。进一步分析发现,ACI患者血清Chemerin水平与缺血低灌注区面积呈正相关,提示血清Chemerin可在一定程度反映患者病情严重程度,通过监测Chemerin水平,可为ACI治疗的有效性评价及疾病防控提供参考依据。
VEGF是调节血管发生的关键因子,在炎症、AS、创伤愈合、肿瘤生成等与有关的诸多病理过程中发挥重要作用[21]。有研究表明,VEGF具有独立于血管生成的神经保护作用,参与神经重塑过程[22]。VEGF在ACI中可促进侧支循环建立、改善缺血区血供。本研究显示,高水平VEGF为ACI的独立危险因素,与缺血低灌注区面积有关,提示VEGF参与ACI发生及发展。研究证实,缺氧、缺血是VEGF及其受体表达上调的最强诱发因素[23]。ACI缺血、缺氧环境中,细胞内VEGF mRNA表达上调,进而引起血清VEGF水平升高,刺激内皮细胞分裂、增殖,促进毛细血管网形成和缺血再灌注,以挽救缺血脑组织,而且随着患者病情加重,机体刺激VEGF生成的作用增强,VEGF水平进一步升高[24]。
ACI的临床实验中,神经功能评估量表较多,其中mRS被广泛用于评价神经功能恢复情况,即预后评估[25]。本研究也采用mRS对ACI患者短期预后情况进行评价,并分析血清Chemerin、VEGF对短期预后的预测价值。ROC曲线分析显示,血清Chemerin、VEGF在ACI短期预后预测方面均有一定价值,二者联合预测的AUC更高,可为ACI预后评估提供更准确的方法。Chemerin、VEGF在ACI发生中的作用机制不同,二者联合可为病情及预后评价提供更全面信息。
综上所述,ACI患者血清Chemerin、VEGF水平与缺血低灌注区面积呈正相关,而且二者联合可有效预测患者短期预后情况,为临床干预治疗提供依据。Chemerin、VEGF与ACI发生、发展的关系尚需进一步研究。
