CD155表达水平对非小细胞肺癌PD1免疫疗法反应性的影响
2023-03-01肖龙敏韩文健
肖龙敏,韩文健,吴 洪
恩施土家族苗族自治州民族医院外三科,湖北恩施 445000
免疫检查点抑制剂(ICIs)的使用已成为癌症治疗领域最有前途的方法之一[1-3]。在已确定的多种免疫调节剂中,程序性细胞死亡蛋白1(PD1)/程序性细胞死亡蛋白配体1(PDL1)轴导致慢性感染和肿瘤中T细胞免疫耗竭已被广泛研究[4]。因此,针对PD1或PDL1的阻断抗体已被开发并批准用于治疗各种晚期癌症,包括非小细胞肺癌,使其成为最成功的ICI[5-6]。然而,进一步的临床应用面临广泛的挑战,例如一小部分受益人群、原发性和获得性耐药、缺乏预测和预后生物标志物以及治疗相关的不良反应[7]。一种新的ICI靶标是黏附分子CD155,它还充当由肿瘤细胞和肿瘤相关骨髓细胞表达的免疫检查点配体[8-9]。CD155在多种实体癌类型(包括非小细胞肺癌)的肿瘤细胞上被上调,并且已被证明有利于肿瘤生长和肿瘤存活[10]。目前尚不清楚非小细胞肺癌CD155对免疫浸润环境的影响程度,或者CD155在非小细胞肺癌中的表达是否会影响对PD1免疫疗法的反应性。基于此,本研究旨在探讨CD155表达水平对非小细胞肺癌PD1免疫疗法反应性的影响。
1 资料与方法
1.1一般资料 纳入本院2014-2018年收治的非小细胞肺癌患者111例,其中男69例,女42例。诊断标准:根据《中国表皮生长因子受体基因敏感突变和间变淋巴瘤激酶融合基因阳性非小细胞肺癌诊断治疗指南(2014版)》[11]的诊断标准诊断为非小细胞肺癌。纳入标准:(1)患者同意且积极配合PD1免疫疗法者;(2)临床资料完整。排除标准:(1)患有其他肿瘤者;(3)标本采集前接受任何治疗者;(3)患有精神疾病者;(4)合并高血压、心脏病者。所有患者均由本院病理科确诊并签署知情同意书。所有患者标本采集前未接受任何治疗,标本采集后被快速冷冻在液氮中,保存在-80 ℃。通过电话、门诊、或查阅病例途径开展随访,中位随访时间达28个月。对所有入组患者均进行了有效随访,随访时间结束后仍未出现疾病进展的患者将按照截止时间记录。
1.2试剂 CD155、PDL1、CD8、PD1抗体购自Abcam公司。DAB Chromogen Kit购自北京华夏远洋科技有限公司。
1.3方法
1.3.1治疗方法和疗效评价 使用2 mg/kg的pembrolizumab进行PD1免疫疗法。21 d为一个治疗周期,2个周期后评估患者的治疗效果。将治疗前4周内所有入组患者的影像学数据作为基线,并pembrolizumab治疗后每2个周期检查一次CT或MRI,以评估疗效。通过复查胸腹部CT、骨扫描、颅脑MⅪ等检查,与治疗前影像进行对比,根据iRECIST的患者的疗效展开评估,存在完全缓解(CR)、部分缓解(PR)、疾病稳定(SD)与疾病进展(PD)之分。无进展生存期(PFS)定义为入组的患者开始使用PD1免疫疗法至肿瘤出现(任一方面)进展或(由任一原因)死亡之间的时间,也可为没有出现进展的随访截止时间。
1.3.2免疫组织化学染色(IHC) 使用CD155、 PDL1抗体和 Chromogen Kit观察染色,并用稀释的苏木精复染。对两个具有代表性的高倍视野进行IHC评估,评估阳性肿瘤细胞的百分比和IHC信号的最大强度(0+到3+)。CD155 评分使用盲法H评分法,分类如下:0+(无阳性细胞)、1+(0~99个阳性细胞)、2+(100~199个阳性细胞)或3+(200~300个阳性细胞)。PDL1阴性定义为与用阴性IgG抗体染色相同的组织,PDL1阳性定义为PDL1抗体染色为棕色的组织。
1.3.3多重免疫组织荧光分析 非小细胞肺癌组织标本在载玻片上以 3 mm切片,并用PD1抗体、CD8抗体、相应荧光二抗、DAPI进行染色。载玻片用 DAPI 复染并盖上盖玻片。使用 InForm 分析软件对多光谱图像进行光谱分离,然后进行组织和细胞分割。对来自 InForm 的合并数据文件进行预处理,并使用 Spotfire 图像映射工具为每个标记(PD1+、CD8+)设置荧光阈值,然后使用Microsoft Excel中的表格进行分段细胞计数。
1.4统计学处理 本研究使用PRISM软件进行的统计学分析。使用χ2检验分析CF155不同分类与治疗反应的相关性。使用Spearman相关分析通过多重免疫荧光进行检测的CD155表达水平与免疫细胞计数的相关性。P<0.05认为差异具有统计学意义。
2 结 果
2.1CD155限制了非小细胞肺癌患者对抗PD1联合治疗的反应 使用IHC 对接受 PD1免疫疗法的非小细胞肺癌患者治疗前组织标本中的CD155蛋白水平进行了表征。根据IHC染色水平,17.12%(19/111)的非小细胞肺癌组织标本为 CD155 阴性(评分 0+),27.03% (30/111) 分类为评分1+,25.23% (28/111) 评分为2+,30.63% (34/111) 得分为3+,见图1A。与 CD155 低表达的肿瘤患者相比 (评分为0+、1+),治疗前为CD155 高表达的患者(评分为2+、3+)的 PD1免疫疗法治疗后表现出较高的SD或PD率,而CR或PR率较低,见图1B。此外,观察到PD1免疫疗法治疗后6 个月内的疾病进展与的非小细胞肺癌患者的高 CD155肿瘤水平之间存在明显关联,见图1C。使用PFS 和Kaplan-Meier 和 Cox 比例风险模型进一步评估 CD155 与治疗反应之间的关联。与 CD155低表达肿瘤相比,CD155高表达肿瘤患者的中位 PFS较短(P<0.05),见图1D。
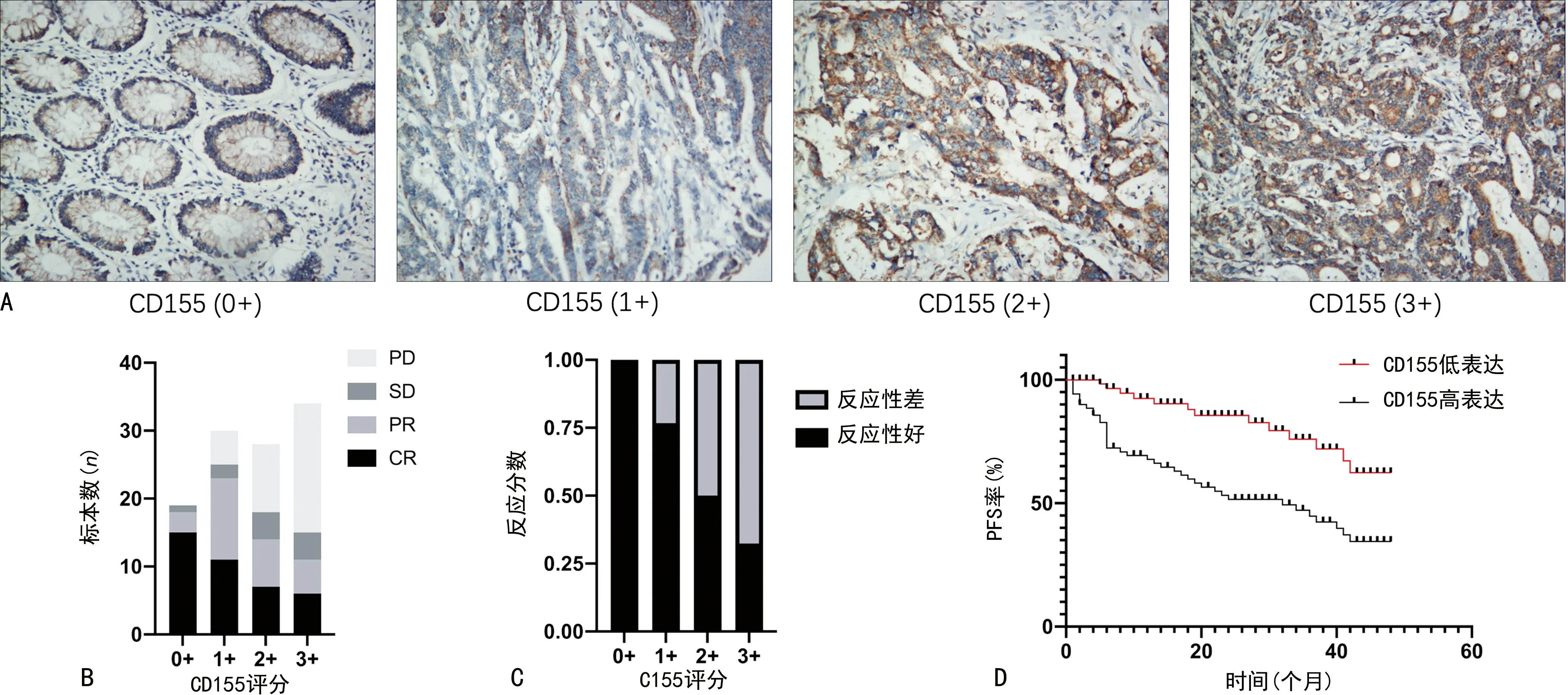
注:A为不同评分的CD155免疫染色评分;B为不同CD155评分患者的治疗后表现;C为CD155评分与治疗反应性的关系;D为CD155表达水平与存活概率的关系。
2.2CD155高表达/PDL1阴性非小细胞肺癌对抗PD1治疗的反应很差 接下来比较了肿瘤CD155与PDL1阴性和PDL1阳性非小细胞肺癌的PD1免疫治疗结果。肿瘤为PDL1阴性和CD155高表达的患者的 RECIST反应较差,见图2A。接受PD1免疫疗法治疗且肿瘤为PDL1阴性和 CD155高表达的患者的6个月PFS率也更差(P<0.05),中位PFS更短(P<0.05)。相比之下,CD155低表达的PDL1阳性肿瘤患者具有更好的PFS结果,见图2。

注:A为不同CD155和PDL1表达情况患者治疗后的表现;B为不同CD155和PDL1表达情况患者对于治疗的反应性;C为不同CD155和PDL1表达情况患者对患者存活概率的影响;CD155high表示CD155高表达;CD155low表示CD155低表达;PDL1negative表示PDL1阴性表达;PDL1positive表示PDL1阳性表达。
2.3CD155与肿瘤浸润性CD8+T细胞上PD1表达增加相关 使用多重免疫组织荧光来检查关键抑制性受体PD1在CD8+T 细胞上的表达,发现CD8+T细胞的数量在CD155不同表达水平非小细胞肺癌组织中无显著差异(P>0.05),见图3A。相反,PD1+CD8+T 细胞的数量与增加的CD155评分显著相关(P<0.05),见图3B。
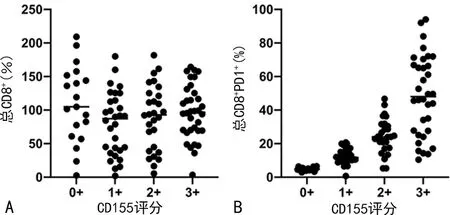
图3 CD155与肿瘤浸润性CD8+ T细胞上PD1表达增加相关
3 讨 论
针对细胞毒性T淋巴细胞抗原-4(CTLA-4)、PD1或PDL1的ICI药物的开发在免疫肿瘤学领域获得了巨大的兴趣。虽然CTLA-4是1987年发现的第一个免疫检查点分子,但PD1/PDL1轴在CD8+T细胞衰竭中的作用已被广泛研究[12]。免疫肿瘤学家将这一概念扩展到抗肿瘤免疫,使PD1/PDL1成为药物开发最有希望的靶点[13]。本研究发现在非小细胞肺癌中,CD155的表达表达水平与PD1免疫疗法疗效存在相关性。与 CD155低表达肿瘤相比,CD155高表达肿瘤患者的中位 PFS较短(P<0.05)。肿瘤为PDL1阴性和 CD155高表达的患者的RECIST 反应较差。
与CD155低表达的肿瘤患者相比 (评分为0+、1+),治疗前为CD155 高表达的患者(评分为2+、3+)的 PD1免疫疗法治疗后表现出较高的SD或PD率,而CR或PR率较低。CD155介导NK细胞黏附,触发NK细胞效应因子功能[14]。结合两种不同的NK细胞受体:CD96和CD226。这些相互作用在细胞-细胞接触部位积累,导致NK细胞和靶细胞之间形成成熟的免疫突触。这会引起溶解颗粒和IFN-γ的黏附和分泌,激活NK细胞的细胞毒性。这种转移在一些表达大量CD155的肿瘤细胞中更为重要,并可能触发杀伤型NK细胞的激活,为肿瘤提供一种免疫逃避机制。并且在介导肿瘤细胞侵袭和迁移中发挥作用。
CD155表达水平影响PD1免疫疗法的疗效,这表明靶向CD155通路的治疗可能对非小细胞肺癌患者有益。肿瘤CD155信号通过免疫检查点受体CD96和TIGIT来促进CD8+T细胞抑制[15]。本研究发现PD1+CD8+T 细胞的数量与增加的CD155评分显着相关,并且这种增加与 非小细胞肺癌患者的早期进展时间相关。鉴于这些数据,共同靶向CD155 通路联合PD1免疫疗法治疗可能会提高对非小细胞肺癌患者的反应性。
综上所述,CD155的表达水平与非小细胞肺癌组织中免疫浸润的PD1+CD8+T细胞数量具有相关性。此外,靶向CD155途径的治疗可能会改变非小细胞肺癌患者对PD1免疫疗法的反应。
