慢性牙周炎患者血清STAT6 mRNA、HMGB1、MMP-13水平分析及临床意义探讨*
2023-03-01边百川
司 玲,崔 蕾,边百川,韩 雪,赵 欢
河北省直属机关第二门诊部口腔科,河北石家庄 050000
慢性牙周炎是发生在牙周组织的慢性炎症性疾病,由牙周细菌感染与宿主免疫功能失调引起,不及时治疗可导致牙槽骨、牙骨质、牙龈和牙周韧带等组织发生炎症变化,甚至引起牙齿脱落[1],为控制牙周炎进展应及早进行诊治。宿主免疫反应失调、过度炎症反应可引起组织损伤并影响细菌的有效清除,是慢性牙周炎组织损伤和疾病进展的主要原因[2]。信号转导和转录激活因子6(STAT6)是炎症反应的关键转录因子,STAT6信号传导诱导巨噬细胞的表型转化,调控炎症反应[3]。高迁移率族蛋白B1(HMGB1)是一种重要的晚期炎症反应介质,研究发现HMGB1可激活炎症反应下游信号通路中的核因子-κB(NF-κB)导致炎症级联反应[4]。基质金属蛋白酶-13(MMP-13)是基质金属蛋白酶家族重要成员,通过切割Ⅱ型胶原参与软骨降解过程,与骨关节炎发生密切相关[5]。STAT6 mRNA、HMGB1、MMP-13在慢性牙周炎中的报道并不多见,其临床意义和价值尚不清楚,本研究拟检测慢性牙周炎患者血清STAT6 mRNA、HMGB1、MMP-13,分析其与病情严重程度、炎症反应和牙周临床指标的相关性,为临床诊治提供参考。
1 资料与方法
1.1一般资料 将2019年2月至2022年2月本院收治的156例慢性牙周炎患者纳入研究作为牙周炎组,男81、女75例,年龄41~69岁、平均(53.02±6.49)岁。纳入标准:(1)符合第4版《牙周病学》中慢性牙周炎诊断标准[6];(2)至少存留20颗牙齿;(3)年龄18周岁以上,对本研究知情同意。排除标准:(1)有种植牙、佩戴义齿;(2)近1周接受过去腐治疗、根管治疗、正畸治疗及抗菌药物和免疫抑制剂治疗;(3)颌面创伤;(4)合并恶性肿瘤、自身免疫疾病。另外,选取72例于本院进行体检的无口腔疾病的健康者作为对照组,男41例、女31例,年龄40~67岁、平均(52.95±6.01)岁。牙周炎组、对照组年龄、性别比较差异无统计学意义(P>0.05)。本研究已经获得本院伦理会批准。
1.2仪器与试剂 Trizol试剂购自美国Invitrogen公司;Superscript Ⅲ cDNA扩增系统购自美国Invitrogen公司;Prism 9700 PCR仪购自美国Applied公司;FK-SY96S全自动酶标仪购自山东方科仪器有限公司;酶联免疫吸附法(ELISA)检测试剂盒购自上海酶联生物科技有限公司。
1.3方法
1.3.1标本采集 所有受试者入组后后于次日清晨采集空腹静脉血3 mL于无抗凝剂的试管,待血液凝固后取上层液体于离心管,以2 500~3 000 r/min的速度离心,取试管最上层液体(血清)作为待测标本,于-20 ℃保存。
1.3.2STAT6 mRNA的检测 采用实时荧光定量聚合酶链反应(qPCR)检测STAT6 mRNA水平。Trizol法提取总RNA,Superscript Ⅲ cDNA扩增系统将RNA反转录为cDNA。采用PCR仪进行检测,反应条件:95 ℃ 30 s,然后95 ℃ 15 s、55 ℃ 30 s、72 ℃ 30 s共45个循环。反应体系:Power SYBR®Green PCR Master Mix 2.5 μL,2 μL cDNA(12.5 ng)特异引物,RNase-Free ddH2O 21 μL。STAT6引物序列,正向:5′-TTCTGCCAAAGACCTGTCCAT-3′,反向:5′-CTGTCCTCTACCATAGTCACA-3′;GAPDH引物序列,正向:5′-CCACTCACGGCA AATTCAAC-3′,反向:5′-GGAGAAGGCGTTTGC TTAGTT-3′。采用2-ΔΔCt法,以GAPDH为内参,计算STAT6 mRNA的相对表达水平。
1.3.3炎症因子的检测 取血清标本,采用ELISA检测血清HMGB1、MMP-13、肿瘤坏死因子-α(TNF-α)、白细胞介素(IL)-1α、IL-1β、IL-6水平。检测步骤严格按照试剂盒说明书进行。
1.3.4牙周临床指标评估 对牙周炎患者进行牙周临床指标的评估。牙周临床指标包括出血指数(BI)、探诊深度(PD)和附着丧失(AL)。采用牙周探针(购自广州市福星旺贸易有限公司)进行操作。探针与牙长轴平行,探针尖端紧贴牙面,探入牙袋底后记录从袋底到龈缘的距离,即PD。AL指的是釉牙骨质界至袋底的距离,能客观反映出牙周组织的破坏程度。参考文献[7]评估BI,BI分为1~5级;1级:龈沟无出血;2级:轻探龈沟后出血;3级:探诊后明显出血,未溢出龈沟;4级:探诊出血溢出龈沟;5级:龈沟自发性出血。1级赋值1分,以此类推。
1.3.5病情评估和分组 轻度牙周炎:牙龈有炎症,BI<2,PD3~≤4 mm,AL 1~2 mm,X线片提示牙槽骨吸收<根长的1/3;中重度牙周炎:BI≥2,PD≥5 mm,AL≥3 mm,X线片提示牙槽骨吸收超过根长的1/3[6]。根据牙周炎病情严重程度将患者分为轻度组(80例)和中重度组(76例)。

2 结 果
2.1牙周炎组和对照组血清STAT6 mRNA、HMGB1、MMP-13及炎症因子水平比较 牙周炎组血清STAT6 mRNA、HMGB1、MMP-13、TNF-α、IL-1α、IL-1β、IL-6水平均高于对照组(P<0.05),见表1。
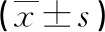
表1 两组血清STAT6 mRNA、HMGB1、MMP-13及炎症因子水平比较
2.2不同病情牙周炎患者血清STAT6 mRNA、HMGB1、MMP-13、炎症因子及牙周临床指标比较 中重度组血清STAT6 mRNA、HMGB1、MMP-13、TNF-α、IL-1α、IL-1β、IL-6水平及PD、BI、AL均高于轻度组(P<0.05),见表2。
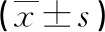
表2 不同病情牙周炎患者血清STAT6 mRNA、HMGB1、MMP-13、炎症因子水平及牙周临床指标比较

组别nIL-1β(pg/mL)IL-6(pg/mL)PD(mm)BI(分)AL(mm)轻度组80100.99±6.85123.86±10.124.01±0.631.52±0.262.02±0.37中重度组76116.24±10.05147.26±12.396.02±0.983.02±0.654.52±0.63t11.12312.94815.31519.09830.403P<0.001<0.001<0.001<0.001<0.001
2.3牙周炎组STAT6 mRNA、HMGB1、MMP-13和炎症因子、牙周临床指标的相关性 牙周炎组STAT6 mRNA、HMGB1、MMP-13与TNF-α、IL-1α、IL-1β、IL-6水平及PD、BI、AL均呈正相关(P<0.05),见表3。

表3 STAT6 mRNA、HMGB1、MMP-13和炎症因子、牙周临床指标的相关性分析
2.4STAT6 mRNA、HMGB1、MMP-13诊断慢性牙周炎的价值 STAT6 mRNA、HMGB1、MMP-13诊断慢性牙周炎的临界值分别为2.31、76.09 ng/mL、201.41 pg/mL,ROC曲线的AUC分别为0.739、0.687、0.684,STAT6 mRNA、HMGB1和MMP-13联合用于诊断慢性牙周炎的AUC为0.911,大于STAT6 mRNA、HMGB1和MMP-13单项检测(Z=4.830、5.257、6.009,P<0.05),见表4、图1。

表4 STAT6 mRNA、HMGB1、MMP-13用于慢性牙周炎诊断的价值分析
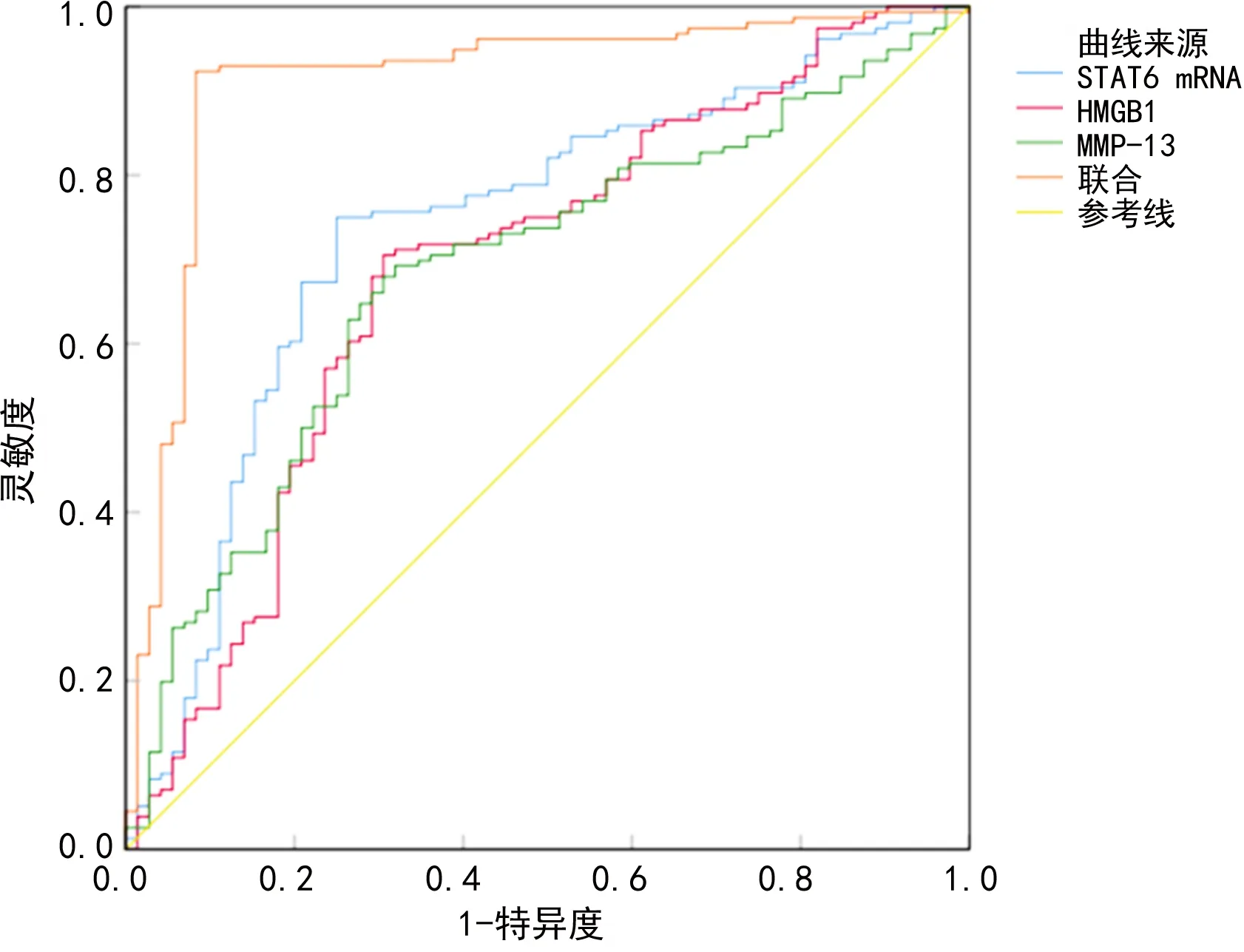
图1 STAT6 mRNA、HMGB1、MMP-13单项及联合用于诊断慢性牙周炎的ROC曲线
3 讨 论
慢性牙周炎是人类最常见的口腔疾病,也是导致牙齿脱落的主要原因,影响着全球约20%~50%的人口,已知吸烟、口腔卫生差、糖尿病、药物、年龄、遗传和心理压力等是慢性牙周炎发病的高危因素,慢性牙周炎不仅可导致牙周组织炎性损伤,还可引起心血管疾病、糖尿病、癌症、阿尔兹海默症等全身性疾病[8-9]。慢性牙周炎发病机制复杂,目前认为是口腔菌群失调及先天和适应性免疫功能障碍介导的炎症反应导致,牙周组织慢性炎症由多种促炎细胞因子参与,包括IL-1α、IL-1β、TNF-α、IL-6和IL-17等大量炎症因子释放,炎症反应失控导致牙周组织的慢性炎症性损伤,最终引起骨吸收和牙齿的脱落[10]。
STAT是Janus激酶(JAK)下游信号传递细胞因子,JAK激活后细胞溶质STAT会发生酪氨酸磷酸化并二聚化,以响应各种外部刺激发生丝氨酸磷酸化,增强转录反应,JAK-STAT通路响应细胞内细胞因子和生长激素的信号传导,启动典型的信号级联反应,参与造血、细胞生长、组织修复、免疫调控等生理过程,JAK-STAT信号传导通路异常可引起癌症、炎症以及自身免疫性疾病[11]。STAT6是STAT家族成员之一,可被多种细胞因子以及JAK激活,参与免疫反应调控过程,研究显示STAT6基因多态性与嗜酸性粒细胞增多、总免疫球蛋白E水平增高以及哮喘发病有关[12]。本研究发现,牙周炎患者血清STAT6 mRNA表达增高与牙周炎病情严重程度、炎症因子、牙周炎指标有关,表明STAT6表达上调可能诱导牙周组织炎症,加剧病情进展。分析原因:在牙周病原菌刺激下,JAK激活,诱导STAT6表达上调,STAT6二聚化并在细胞核内易位,刺激细胞凋亡、免疫调节和基因转录,激活单核细胞、中性粒细胞和T淋巴细胞,促使促炎细胞因子和趋化因子大量释放,诱导炎症反应发生[13],加剧牙周炎病情进展。
HMGB1是一种高度保守的DNA结合蛋白,可通过与免疫细胞表面受体结合实现免疫调节,从而调控炎症反应过程,在炎症反应过程中HMGB1可通过激活其内源性配体——Toll样受体4,激活NF-κB,进而诱导IL-1β、TNF-α、IL-6和IL-8等炎症因子释放和级联反应,导致过度炎症损伤[14-15]。本研究发现,HMGB1与慢性牙周炎也存在密切关系,表现牙周炎组血清HMGB1水平高于对照组(P<0.05),且HMGB1水平随着牙周炎病情的加重而增高,HMGB1与TNF-α、IL-1α、IL-1β、IL-6水平,PD、BI、AL呈正相关,说明HMGB1可能参与牙周局部炎症损伤过程。推测其机制如下,首先,HMGB1通过与Toll样受体相互作用促使炎性细胞因子的产生增加,诱导牙周炎症反应和组织损伤[15];其次,HMGB1通过与其配体-晚期糖基化终末产物受体结合会激活转录因子NF-κB,促使促炎因子TNF-α、IL-6等释放,引起牙周组织炎症[16],继而导致慢性牙周炎及病情的进展。
MMP-13也称为胶原酶3,是Ⅱ型胶原蛋白裂解的关键酶,主要通过特定信号通路直接或间接启动下游基质和胶原蛋白降解,MMP-13过度表达可导致上皮间质转化,在癌症侵袭、转移、生长调节、免疫逃避、细胞凋亡和血管生成中具有重要作用[17],MMP-13表达上调还可导致细胞外基质过度降解,诱导骨关节炎的发生[18]。本研究结果显示:MMP-13过表达与慢性牙周炎发病有关,MMP-13表达越高牙周炎病情越重,牙周损伤越明显,相关性分析结果显示MMP-13与TNF-α、IL-1α、IL-1β、IL-6呈正相关,表明MMP-13可能调控炎症反应参与慢性牙周炎发病过程,MMP-13过表达可能导致炎症反应和牙周组织破坏。相关报道也指出:炎症环境下NF-κB信号通路激活可诱导MMP-13表达上调,导致细胞外基质降解和骨代谢异常,进一步加剧炎症反应[19]。抑制MMP-13表达可减轻脂多糖诱导的牙周炎小鼠模型中炎症介质释放和骨吸收[20]。
ROC曲线分析显示:STAT6 mRNA、HMGB1、MMP-13在慢性牙周炎诊断方面具有一定价值, STAT6 mRNA、HMGB1、MMP-13联合诊断的效能明显提高,表明STAT6 mRNA、HMGB1、MMP-13可作为慢性牙周炎临床诊断的辅助指标。
综上所述,慢性牙周炎患者血清STAT6 mRNA表达上调,HMGB1、MMP-13水平增高,且中重度组血清STAT6 mRNA表达和HMGB1、MMP-13水平高于轻度组。STAT6 mRNA、HMGB1、MMP-13与血清炎症细胞因子、PD、BI、AL呈正相关,提示STAT6、HMGB1、MMP-13可能通过调节牙周局部炎症反应参与牙周组织破坏过程,STAT6 mRNA、HMGB1、MMP-13是慢性牙周炎诊断中颇具应用前景的指标。本研究局限之处在于样本例数偏少,未观察STAT6 mRNA、HMGB1、MMP-13与慢性牙周炎治疗疗效和预后的关系,尚待进一步扩大样本量,增加观测时间点加以证实。
