SKAP1通过调控ICAM-1对宫颈癌模型小鼠肿瘤生长、转移及免疫调节机制研究
2023-02-27郑再宏闫锡钊丁珍珍
郑再宏,闫锡钊,李 博,丁珍珍
(沧州市人民医院妇产科,河北 沧州 061000)
宫颈癌是常见的女性恶性肿瘤疾病,具有较高的发病率和病死率,患者五年存活率仅为20%~30%[1]。肿瘤细胞的迁移是人类癌变过程中的关键步骤,因为它构成了转移的病理生理基础,该过程包括恶性细胞与血管内皮粘连,以便侵入周围组织,其中黏附分子在这一过程中起主要作用[2]。细胞间黏附分子-1(intercellular adhesion moleclar-1,ICAM-1)是属于β2-整合素家族,有研究显示其在宫颈癌肿瘤细胞中的过度表达与通过粘附内皮细胞的血管侵入有一定相关性,这意味着该分子在转移灶的产生中可能发挥作用[3]。SKAP1是一种免疫细胞接头蛋白,能通过安排和组装多分子信号复合体来协调淋巴细胞的激活和分化,且SKAP1二聚体形成可稳定SLP-76微簇并促进粘附[4-5]。所以ICAM-1和SKAP1的表达在可能免疫调控机制中发挥重要作用,但是其在宫颈癌中的调控机制至今还未见报道。本研究旨在探索宫颈癌中SKAP1与ICAM-1介导的免疫调控机制,为开发针对该靶点的免疫抑制剂提供理论基础。
1 材料与方法
1.1 实验动物与细胞
人宫颈癌细胞株HeLa,购自北京大学人民医院妇产科实验室。雌性BLAB/c裸鼠30只,5~6周龄,体质量18~20 g,购自上海市计划生育科学研究所实验动物经营部,动物生产许可:SCXK(沪)2018-0006,在沧州医学高等专科学校动物实验中心饲养,动物使用许可证号SYXK(冀)2019-006。恒温18~22℃,湿度50%~80%,密闭无菌环境。本研究参照中国医学科学院医学实验动物物研究所实验动物使用与管理委员会执行标准。
1.2 试剂与仪器
干扰质粒,购自美国Invitrogen公司;DMEM高糖培养基,购自美国Gibco公司;0.25%胰蛋白酶-EDTA消化液,购自北京索莱宝公司;胎牛血清,购自杭州四季青公司;TrizolTM RNA Isolation Reagent购自美国GIBCO公司;M-MLV reverse transcriptase,购自上海泽叶生物科技有限公司;质粒抽提试剂盒,购自美国Genomed公司;二喹啉甲酸(bicinchoninic acid,BCA)蛋白定量试剂盒、免疫组化试剂盒均购自上海雅酶生物医药科技有限公司;DAB显色试剂盒,购自北京中山生物技术有限公司;鼠抗人SKAP1单克隆抗体、鼠抗人ICAM-1单克隆抗体、鼠抗人GAPDH单克隆抗体及辣根过氧化酶标记二抗均购自美国Abcam公司;Western blot化学发光工作液,购自意大利Cyanagen公司。
OLYMPUS-IX70倒置相差荧光显微镜(日本OLYMPUS公司);Image Station In-Vivo FX多功能活体成像系统(美国KODAK公司);Light Cycler Nano实时荧光定量PCR仪(瑞士罗氏公司);全波长扫描酶标仪(美国Thermo Fisher Scientific公司);Image Quant LAS4000mini成像仪(美国GE公司);BIO-RAD Mini Trans-Blot垂直电泳/电转系统(美国BIO-RAD公司);BD Calibur流式细胞仪(美国BD公司)。
1.3 细胞培养及感染
宫颈癌HeLa细胞贴壁生长于DMEM培养基(含有10 %胎牛血清、青霉素10×104U·L-1、链霉素100 mg·L-1),于37℃、5% CO2、饱和湿度的培养箱中孵育,2~3 d换液1次。当细胞达到90%融合度时用质量分数0.25%胰酶消化并计数,以5×105/孔接种于6孔培养板,培养24 h,以利于转染。将干扰SKAP1的stealth RNA转变成miRNA并构建到pcDNA6.2TM-GW/EmGFP-miR载体中,形成针对SKAP1的miRNA的干扰载体-SKAP1-miRNA,同时设计合成阴性对照质粒(Neg-miRNA),以上均由江苏齐氏生物科技有限公司设计并合成。按照慢病毒说明书进行细胞感染,通过Lipofectamine 2000介导,将SKAP1-miRNA、Neg-miRNA每孔2 μg转入HeLa细胞中,同时,以仅加脂质体及未加任何干扰措施的细胞作为对照,转染4~5 h后更换DMEM完全培养基,继续培养72 h后将细胞消化,制成单细胞悬液,以每孔1个细胞的量接种于96孔板,加入1 μg·mL-1的嘌呤霉素,得到具有嘌呤霉素抗性的单克隆细胞,即为稳定表达细胞。在慢病毒感染细胞72 h后,于荧光显微镜下观察细胞的感染效率和细胞状态,选取感染效率80%左右且状态良好的细胞进入后续实验。
1.4 宫颈癌模型小鼠的构建及分组
将BALB/c裸鼠随机分为对照组(细胞未做处理)、空质粒组(Neg-miRNA组)和SKAP1基因沉默组(SKAP1-miRNA组),每组10只。取稳定表达的各组HeLa细胞,用PBS重悬,配制成每毫升1×107的细胞悬液,分装至无菌EP管中,每管0.2 mL。用微量进样器抽取0.2 mL混匀的HeLa细胞悬液接种于右前腋窝中部外侧皮下,接种时尽量保证与接种点的距离不超过针头长度,并避免刺破皮肤或者刺破肌肉层,当针头到达接种位点时注射,退出针头,压迫进针处,避免漏液。
1.5 评价指标及检测方法
1.5.1 观察各组肿瘤生长情况 接种后继续饲养30 d,期间每隔3 d用直尺测量1次瘤体的长轴(a)、短轴(b),根据体积近似公式V=(a×b)2÷2(mm3)计算肿瘤体积。
1.5.2 活体荧光成像技术检测裸鼠肿瘤转移情况 在接种第30 d后采用活体荧光成像技术检测小鼠肿瘤转移情况。观察前1 d每只裸鼠腹腔注射荧光素底物(1.5 mg·10 g-1),饱和三溴乙醇(0.18 mL·10 g-1)麻醉后放入活体荧光影像系统摄像,应用Slide Book 4.0软件进行分析。
1.5.3 Real-Time PCR法检测肿瘤组织SKAP1、ICAM-1 mRNA相对表达量 断颈脱臼处死小鼠,迅速取出肿瘤组织分成两部分。一部分迅速置入液氮中保存,另一部分放入福尔马林中固定。取液氮冷冻的肿瘤组织,碾磨。按照TrizolTMRNA Isolation Reagent说明书提取总RNA,然后用M-MLV reverse transcriptase将总RNA反转录成cDNA。反应体系:cDNA模板5 μL,上下游引物各0.8 μL,SYBR Premix Ex Taq TM 10 μL,ROX Reference Dye II 0.4 μL,dd H2O 3 μL。使用 RT-PCR 仪进行扩增,PCR循环条件:95℃预变性10 S,95℃变性15 S,60℃退火30 S,60℃延伸60 S,共40个循环。相对表达水平以GAPDH为内参。记录各孔Ct值(扩增动力曲线拐点),目的基因的相对表达水平=2-ΔΔCt。PCR引物序列由北京赛百盛基因技术有限公司合成(引物序列见表1)。

表1 引物序列
1.5.4 免疫组化法检测肿瘤组织SKAP1、ICAM-1蛋白表达情况 肿瘤组织经福尔马林溶液固定48 h后,按照常规操作步骤依次进行石蜡包埋、脱蜡水化、内源性过氧化物酶灭火、抗原修复、滴加一抗、二抗,DAB显色,然后复染、封片,于显微镜下观察。
1.5.5 Western blot法检测肿瘤组织SKAP1、ICAM蛋白相对表达量 取冻存的裸鼠肿瘤组织,PBS冲洗3次,加入蛋白裂解液,匀浆后在4℃条件下2 500 r·min-1离心10 min,弃上清液,BCA蛋白定量试剂盒进行蛋白定量。加入上样缓冲液,煮沸5 min,-80℃保存。SDS-PACE电泳分离目的蛋白,恒定电流转移至PVDF膜,5%脱脂牛奶于室温封闭2 h,加入用TBS稀释的SKAP1、ICAM-1、GAPDH一抗,4℃孵育过夜,TBS洗涤液洗膜后加入用TBS按1: 5 000稀释的辣根过氧化物酶标记的二抗,室温孵育90 min,TBS洗涤液漂洗3次,碱性磷酸酶化学发光显色并拍照,凝胶成像系统分析灰度值。目的蛋白条带灰度值与内参GAPDH条带灰度值比值为目的蛋白相对表达量。
1.5.6 流式细胞术检测肿瘤组织免疫细胞CD3+、CD4+、CD8+水平 取冻存的裸鼠肿瘤组织研磨,收集组织悬液,离心弃上清,加入3倍体积红细胞裂解液,冰上裂解5 min,离心弃上清,RPMI-1640重悬,调整细胞浓度为每毫升l×107个。加入流式管,每管100 μL,加入荧光标记的CD3、CD4、CD8单抗,混匀,室温避光孵育20 min,加入2 mL PBS缓冲液,离心弃上清,加入0.5 mL PBS缓冲液重悬,流式细胞仪检测CD3+、CD4+、CD8+水平。
1.5.7 ELISA法检测肿瘤组织Th1和Th2细胞因子水平 取冻存的裸鼠肿瘤组织研磨,收集组织悬液,离心收集上清,按照小鼠白细胞介素-2(interleukin,IL-2)、干扰素(interferon-gamma,IFN-γ)、IL-4和IL-10 ELISA试剂盒操作步骤,测定OD 450 nm值,根据标准品浓度及OD值建立标准曲线,计算各组肿瘤组织中IL-2、IFN-γ、IL-4和IL-10含量。
1.6 统计学方法
采用SPSS 26.0统计软件对数据进行分析和处理,计量资料以均数±标准差(±s)表示,多组间比较采用单因素方差分析,组间两两比较采用LSD-t检验,以P<0.05为差异有统计学意义。
2 结果
2.1 各组肿瘤生长情况比较
细胞接种后饲养期间,对照组和空质粒组裸鼠各死亡1只,SKAP1基因沉默组死亡2只。各组瘤体体积均随时间延长而增大(P<0.05)。见表2。
表2 各组肿瘤体积变化比较(±s ) mm3
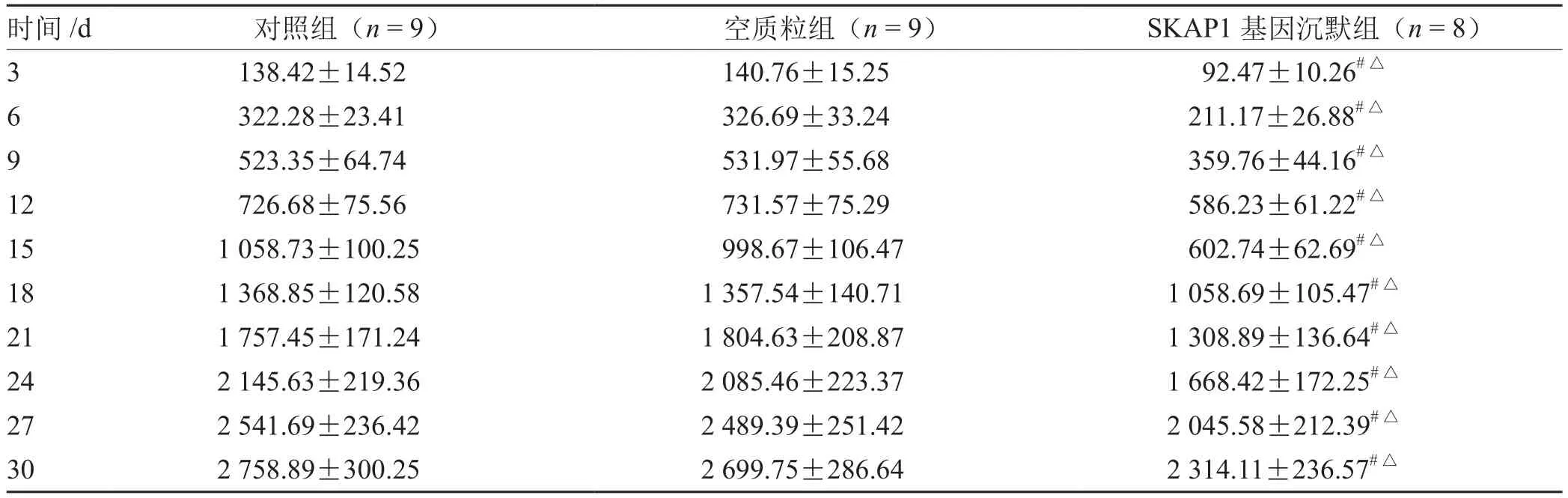
表2 各组肿瘤体积变化比较(±s ) mm3
注:与对照组比较,# P<0.05;与空质粒组比较,△P<0.05
时间/d 对照组(n = 9) 空质粒组(n = 9) SKAP1基因沉默组(n = 8)3 138.42±14.52 140.76±15.25 92.47±10.26#△6 322.28±23.41 326.69±33.24 211.17±26.88#△9 523.35±64.74 531.97±55.68 359.76±44.16#△12 726.68±75.56 731.57±75.29 586.23±61.22#△15 1 058.73±100.25 998.67±106.47 602.74±62.69#△18 1 368.85±120.58 1 357.54±140.71 1 058.69±105.47#△21 1 757.45±171.24 1 804.63±208.87 1 308.89±136.64#△24 2 145.63±219.36 2 085.46±223.37 1 668.42±172.25#△27 2 541.69±236.42 2 489.39±251.42 2 045.58±212.39#△30 2 758.89±300.25 2 699.75±286.64 2 314.11±236.57#△
2.2 各组肿瘤转移情况比较
活体荧光成像检测各组裸鼠肿瘤组织转移情况结果显示,对照组和空质粒组的肿瘤细胞转移面积较大,且荧光信号较强,而SKAP1基因沉默组肿瘤细胞转移面积较小,荧光信号强度较弱。见表3、图1。
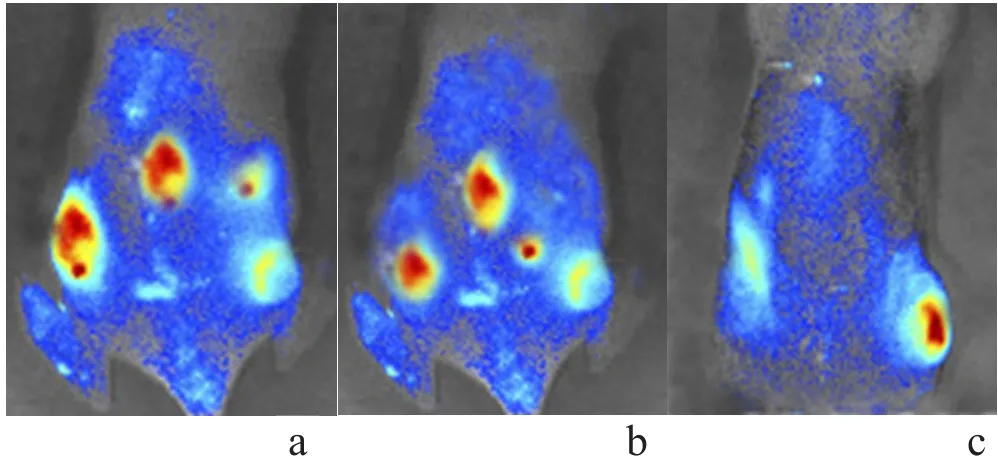
图1 活体荧光成像检测肿瘤组织的转移
表3 各组平均荧光信号强度比较(±s ) a.u.

表3 各组平均荧光信号强度比较(±s ) a.u.
注:与对照组比较,# P<0.05;与空质粒组比较,△P<0.05
组别 例数 平均荧光强度对照组 9 301.15±69.65空质粒组 9 296.64±32.27 SKAP1基因沉默组 8 105.49±11.23#△
2.3 各组肿瘤组织SKAP1、ICAM-1 mRNA相对表达量比较
见表4。
表4 各组肿瘤组织SKAP1、ICAM-1 mRNA相对表达量比较(±s )

表4 各组肿瘤组织SKAP1、ICAM-1 mRNA相对表达量比较(±s )
注:与对照组比较,# P<0.05;与空质粒组比较,△P<0.05
组别 例数 SKAP1 mRNA ICAM-1 mRNA对照组 9 1.15±0.12 0.98±0.10空质粒组 9 1.03±0.11 0.92±0.09 SKAP1基因沉默组 8 0.45±0.05#△ 0.43±0.04#△
2.4 各组肿瘤组织SKAP1、ICAM-1蛋白表达情况比较
免疫组化结果显示,SKAP1基因沉默组肿瘤组织SKAP1、ICAM-1蛋白阳性表达量较高,而对照组和空质粒组蛋白阳性表达量较低。见图2。

图2 免疫组化检测肿瘤组织中SKAP1、ICAM-1蛋白表达
注:A为免疫组化检测SKAP1蛋白;B为免疫组化检测ICAM-1蛋白(×200);a为对照组;b为空质粒组;c为SKAP1基因沉默组
2.5 各组肿瘤组织SKAP1、ICAM蛋白相对表达量比较
见图3、表5。
表5 各组肿瘤组织SKAP1、ICAM-1相对表达量比较(±s )

表5 各组肿瘤组织SKAP1、ICAM-1相对表达量比较(±s )
注:与对照组比较,# P<0.05;与空质粒组比较,△P<0.05
组别 例数 SKAP1 ICAM-1对照组 9 0.99±0.11 0.88±0.09空质粒组 9 0.94±0.10 0.85±0.09 SKAP1基因沉默组 8 0.39±0.04#△ 0.35±0.04#△
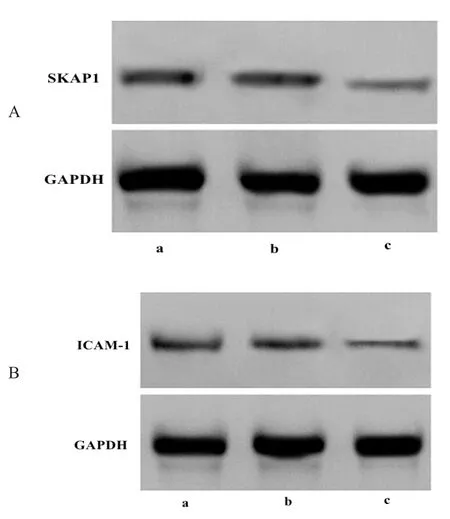
图3 Western blot条带图
2.6 各组肿瘤组织免疫细胞CD3+、CD4+、CD8+水平比较
见表6。
表6 各组肿瘤组织免疫细胞CD3+、CD4+、CD8+水平比较(±s )

表6 各组肿瘤组织免疫细胞CD3+、CD4+、CD8+水平比较(±s )
注:与对照组比较,# P<0.05;与空质粒组比较,△P<0.05
组别 例数 CD3+/% CD4+/% CD8+/% CD4+/CD8+对照组 9 28.85±2.96 15.53±1.62 15.85±2.03 0.98±0.12空质粒组 9 29.14±3.02 15.98±1.56 16.04±1.84 1.00±0.11 SKAP1基因沉默组 8 36.63±4.01#△ 19.96±2.21#△ 11.17±1.29#△ 1.79±0.18#△
2.7 各组肿瘤组织Th1和Th2细胞因子水平比较
见表7。
表7 各组肿瘤组织Th1和Th2细胞因子水平比较(±s ) ng·L-1

表7 各组肿瘤组织Th1和Th2细胞因子水平比较(±s ) ng·L-1
注:与对照组比较,# P<0.05;与空质粒组比较,△P<0.05
组别 例数 IL-2 IFN-γ IL-4 IL-10对照组 9 198.52±20.36 401.15±41.56 130.25±14.53 352.29±36.63空质粒组 9 201.18±21.24 399.85±40.57 129.84±13.81 349.84±35.49 SKAP1基因沉默组 8 314.42±32.65#△ 598.85±62.18#△ 75.54±7.86#△ 202.52±21.14#△
3 讨论
SKAP1在多种实体瘤中高表达,其表达越高,患者生存率越低[6]。在前期研究中,宫颈癌患者肿瘤组织中SKAP1呈现高表达,且与TNM分期、淋巴结转移等临床特征及患者预后有一定关系。在本次研究中,沉默SKAP1基因后,裸鼠瘤体体积增加幅度以及肿瘤转移程度均小于对照组和空质粒组,而对照组和空质粒组并无明显差异,这说明抑制SKAP1表达可在一定程度上抑制肿瘤生长及其转移。SKAP1基因位于人类的第十七对常染色体,主要以蛋白的形式存在于T细胞中,作为免疫细胞特有的接头蛋白,其具有SH2或SH3接头蛋白活性,主要功能为结合含SH2或SH3结构域的蛋白,能与蛋白、蛋白复合物、蛋白激酶和蛋白磷酸酶结合[7]。本研究结果显示,SKAP1基因沉默组肿瘤组织免疫细胞CD3+、CD4+、CD4+/CD8+及 Th1细 胞 因 子 IL-2、IFN-γ水平均高于对照组和空质粒组,CD8+和Th2细胞因子IL-4、IL-10水平均低于对照组和空质粒组,说明沉默SKAP1基因可在一定程度上逆转Th1/Th2漂移,恢复Th1细胞因子优势,改善裸鼠免疫功能。SKAP1的表达在免疫调控机制中发挥重要作用,可能是自身免疫性和难治性疾病治疗干预的一个有吸引力的靶点。
SKAP1是TCR诱导的RapL-Rap1复合物形成和ICAM1活化所需的上游调节因子[8]。SKAP1是RapL以一种依赖于SKAP1的PH结构域和PI3K通路的方式与膜结合所必需的,SKAP1 PH结构域失活突变(即R131M)显著损害RapL向Rap1和ICAM1结合膜的转位以及ICAM1结合的上调[9]。对于SKAP1能够介导免疫浸润T细胞,而ICAM-1在调控肿瘤免疫细胞中不可或缺的作用。本研究结果显示,SKAP1基因沉默组肿瘤组织SKAP1、ICAM-1 mRNA及其蛋白相对表达量均低于对照组和空质粒组,而对照组与空质粒组肿瘤组织并无明显差异,提示沉默SKAP1基因可能在一定程度上下调ICAM-1表达。原因可能是T细胞受到刺激后,TCR/CD3转导的早期第一信号引起淋巴细胞功能相关抗原-1对ICAM-1的亲和力及亲合力瞬时上调,SKAP1进一步促进淋巴细胞功能相关抗原-1和ICAM-1在T细胞与抗原呈递细胞接触区域的相互作用,进而影响T细胞的活化[10]。
