水凝胶在人造细胞体系中的应用研究进展
2023-02-26李书彬董明东韩晓军
李书彬 董明东 韩晓军*
1(哈尔滨工业大学化工与化学学院,城市水资源与水环境国家重点实验室,哈尔滨 150001)
2(奥胡斯大学纳米科学交叉研究中心,丹麦DK-8000)
生命起源的过程纷繁复杂,人类至今尚未完全理解细胞的产生、结构的变化以及功能的形成。合成生物学提供了认识生命的起源及运行机制的方法[1-4]。通过构建人造细胞能够简化生命系统中的复杂结构,更好地模拟细胞的行为[5-10]。构建的人造细胞通常需要具备区室化、分裂和代谢等部分或全部生命特征,人造细胞的构建基元包括磷脂[11-16]、聚合物[17]和聚电解质[18]等。通过外加刺激或在人造细胞中封装具有特定功能的酶,这些人造细胞表现出简单的细胞行为。为了使人造细胞能够执行更复杂的功能,在体系中引入其它功能性材料尤为重要。
水凝胶是一种具有多种官能团的高度含水的三维网络结构,能够通过改变官能团的种类和数量调节水凝胶的特性和含水量[19-22]。这种特性和结构可赋予人造细胞特定的功能。水凝胶的组成成分可以分为天然成分和合成成分,虽然天然成分更具生物相容性,但合成成分能对官能团种类和数量进行精确定制,因而在人造细胞领域的应用更为突出。将水凝胶应用于人造细胞领域不仅能使人造细胞更具真实细胞的结构和功能,在药物控释和组织工程方面也显现出极大的应用潜力。目前,关于水凝胶的综述主要集中于水凝胶结构的设计及制备方法等方面,有关水凝胶在人造细胞领域的应用的综述较少。随着人造细胞领域研究的快速发展和对多功能构件的需求,对水凝胶在人造细胞领域的应用进行总结归纳尤为重要,可为今后的研究提供理论参考。本文综述了近十年来应用于人造细胞研究和应用中的水凝胶组成及水凝胶的加工方法,重点阐述了其在细胞结构模拟、药物控释和组织工程方面的应用,并探讨了该领域目前存在的问题及未来的研究方向。
1 用于人造细胞领域的水凝胶成分
1.1 天然成分
用于人造细胞领域的水凝胶的天然成分主要为天然聚合物(藻酸盐、葡聚糖和琼脂糖)。天然聚合物具有高生物相容性、环境友好性、可降解性和可持续性等优点,然而其中所含有的活性官能团较少,无法满足对水凝胶功能的调节。对天然聚合物进行修饰和改性能够使其在保留自身优势的同时,可以满足制备功能多样的水凝胶的要求。
1.1.1 海藻酸
海藻酸是从褐藻类的海带或马尾藻中提取碘和甘露醇后的副产物,其分子由β-D-甘露糖醛酸和α-L-古洛糖醛酸按(1→4)键连接而成[23]。海藻酸在水溶液中表现出聚阴离子行为,因而可在其溶液中加入Ca2+等阳离子促使水凝胶生成[24]。
海藻酸水凝胶通常被封装在人造细胞内部模拟细胞结构,或将人造细胞包裹在水凝胶内作为细胞外基质[25-27]。1995 年,Monshipouri 等[25]首次利用脂质体挤出法将海藻酸钠溶液包封到人造细胞中,外部溶液中的Ca2+进入人造细胞内部进行交联,最终形成包封海藻酸水凝胶的人造细胞,开拓了海藻酸水凝胶在人造细胞领域中的应用。此后的研究多集中于对包封海藻酸溶液方法的改进和对Ca2+进入人造细胞方式的调控[28-30]。
海藻酸水凝胶具有交联速度快和性能优异等诸多优点,但其水溶液粘度较高,给封装造成一定困难;并且海藻酸含有的活性官能团较少,无法赋予水凝胶更多的智能性。对海藻酸进行修饰改性,引入更多种类的活性官能团,能使海藻酸水凝胶功能更加丰富。
1.1.2 葡聚糖
葡聚糖是以葡萄糖为单糖组成的同型多糖,具有良好的生物相容性,常用于水凝胶的制备[31-33]。根据交联方式的不同,水凝胶分为由氢键、静电作用、亲疏水作用和主-客体相互作用等非共价键方式进行交联的物理交联和通过自由基聚合和点击化学反应等形成的共价键交联的化学交联。葡聚糖具有良好的水溶性,但单独的天然葡聚糖很难形成水凝胶,需要加入其它聚合物形成氢键进行物理交联,或对葡聚糖进行改性,利用改性官能团的特性实现化学交联[34-36]。葡聚糖水凝胶多利用人造细胞作为模板,以实现由宏观尺度的水凝胶向微观尺度微凝胶颗粒的转变。乳液法是最常用的将葡聚糖衍生物溶液包封到人造细胞中的方法,Franssen 等[37]利用乳液法实现了对葡聚糖水凝胶的包封,之后利用Triton X 100等表面活性剂破坏人造细胞的膜结构,获得人造细胞大小的微凝胶颗粒,对模型蛋白表现出良好的控释能力。此外,具备各种响应能力的葡聚糖衍生物的合成也使葡聚糖水凝胶的交联方式更加丰富多样。葡聚糖基水凝胶通常具有稳定性和高生物相容性,但需要对葡聚糖进行修饰改性,以满足不同的用途需要。这种修饰或改性会增加操作的复杂性,并且引入的化学成分对生物相容性的影响还有待考察。
1.1.3 琼脂糖
琼脂糖是一种电中性聚合物,温度达到90 ℃以上即可溶解,温度下降到35~40 ℃时形成凝胶,这是其具有多用途的基础。琼脂糖水凝胶因具有良好的稳定性、生物相容性和成胶性已广泛应用于食品、纺织、化工和生物分离等领域。然而,琼脂糖在人造细胞领域的应用仍处于探索的初级阶段。2017 年,Bayoumi 等[38]利用模具构建了琼脂糖凝胶,并将人造细胞封装到凝胶内部。水凝胶不仅为人造细胞提供了温和的外界环境,还有助于人造细胞之间的信号传递,因而成为构建人造细胞外基质的理想材料。由于琼脂糖特殊的成胶模式,对包封在内的人造细胞的稳定性提出了更高的要求。
1.2 合成成分
制备水凝胶的材料主要为经过化学聚合反应得到的高分子聚合物。用于人造细胞领域的合成高分子聚合物主要包括聚(N-异丙基丙烯酰胺)、聚乙二醇衍生物、聚丙烯酸和聚缩水甘油等。在制备过程中能够通过修饰调节聚合物的官能团种类,实现对水凝胶性能的调控。然而,水凝胶合成过程中通常需要加入对人体有害的催化剂,并且制得的聚合物生物相容性和降解性较差,极易损害环境,不利于生态的可持续发展。因此,需要对水凝胶的合成过程进行改进,或选择更高生物相容性和环境友好性的聚合物。
1.2.1 聚(N-异丙基丙烯酰胺)(PNIPAM)
PNIPAM 是典型的温度响应聚合物,当环境温度低于临界相转变温度(LCST)时,PNIPAM 链处于伸展构象[39]。当温度高于其LCST 时,PNIPAM 链转变为卷曲状态。这种构象的转变使PNIPAM 水凝胶可在温度的调控下展现出孔隙率、尺寸和折光率等性质的变化,在生物医学、传感器制备和人造细胞领域引起了广泛关注[40-41]。
2002 年,Kazakov 等[40]首先将N-异丙基丙烯酰胺(NIPAM)单体及光引发剂包封到人造细胞中,外加紫外光使聚合物单体在人造细胞内聚合形成水凝胶[42]。获得的水凝胶在温度调控下表现出尺寸变化对内容物的有效控释,为人造细胞作为智能药物载体提供了参考。
PNIPAM 基水凝胶对智能人造细胞的构建提供了思路,然而交联过程加入的小分子交联剂或引发剂具有一定的毒性且不易被去除,使其生物相容性不佳。另外,紫外光的照射可能影响负载在水凝胶中的酶的活性,降低了反应效率。因此,需要对PNIPAM 基水凝胶聚合过程进行改进或选用对紫外光不敏感的酶进行研究。
1.2.2 聚乙二醇(PEG)衍生物
PEG 具有良好的生物相容性和亲水性,通过对PEG 进行改性修饰可使获得的PEG 衍生物具有更多优异性能[43]。基于PEG 衍生物制备的水凝胶能够通过简单改变PEG 的分子量实现对水凝胶机械性能的调控。目前,已有多种基于PEG 衍生物构建的水凝胶的研究报道。以乙二醇二甲基丙烯酸酯为例,2009 年,An 等[44]利用脂质体挤出法制备了包封聚乙二醇二甲基丙烯酸酯水凝胶的人造细胞。其中,水凝胶中负载了β-半乳糖苷酶,在溶液中加入底物β-D-吡喃半乳糖苷后,底物能够在酶的催化下产生红色荧光产物。PEG 衍生物基水凝胶价格低廉且易于制备,常被用于人造细胞或生物医学领域。但是,改性导致的生物相容性变化通常被忽略,容易产生生物毒性或造成环境污染。因此,需要对衍生物的生物相容性和环境友好性进行探究。
1.2.3 聚丙烯酸(PAA)
PAA 单体因其分子结构优势,易与多种合成高分子、天然高分子和无机纳米材料交联制备水凝胶。由单体聚合形成的PAA 水凝胶具有良好的吸附/溶胀性能。因此,PAA 水凝胶通常被包封在人造细胞内部,依赖其良好的吸附性能实现对疏水药物的负载。2009 年,Tiwari 等[45]利用反相蒸发法制备了封装PAA 水凝胶的人造细胞,该水凝胶能够在不同pH 值下表现出对疟疾抗原Pfs25 的不同释放行为,为药物递送载体的构建提供了新的方法。
封装于人造细胞中的PAA 水凝胶具有结构可控、性能稳定和寿命长等诸多优点。但是,单纯的PAA 水凝胶功能单一,无法满足水凝胶智能化的要求。因此,需要在水凝胶中引入具备其它功能的结构模块,以赋予PAA 水凝胶更多的响应性和智能性。
1.2.4 聚缩水甘油(PGL)
PGL 具有良好的水溶性和生物相容性。聚合物链上的重复单元中含有反应性羟基,有利于对其进行修饰和改性。目前,已经获得了包括线性[46]、树枝状[47]和超支化[48]等多种PGL 衍生结构。相较于传统的线性聚合物结构,树枝状和超支化的PGL 聚合物水凝胶在人造细胞内表现出对负载物更精确的控释能力,这可能由于其具有相较传统水凝胶更致密的网络结构[49]。最近,Lockhart 等[49]制备了包封PGL 水凝胶的人造细胞,并在生理条件下研究了模型药物的释放行为,研究表明,PGL 水凝胶的存在对药物的控释起到了决定性作用。
虽然目前已制备出许多具有优异响应性和智能性的PGL 水凝胶,然而其应用于人造细胞领域的研究尚处于起步阶段,赋予PGL 水凝胶更多性能或利用PGL 水凝胶增强人造细胞的智能性显得尤为重要。用于人造细胞体系的多种水凝胶成胶组分及其优缺点见表1。

表1 用于人造细胞体系的各水凝胶成胶组分Table 1 Comparison of gelling components of various hydrogels used in artificial cell system
2 水凝胶材料加工方法
运用不同的加工方法可制备出性能各异的水凝胶材料。常见的水凝胶材料加工方法包括静电纺丝、3D 打印、冷冻铸造和微流控技术等。
2.1 静电纺丝
自1902 年Cooley[55]提出静电纺丝技术以来,由于其制备的水凝胶材料具有高孔隙率、优越的孔隙互连性及稳定性,已成为研究热点。静电纺丝装置通常由注射泵、注射器、注射针头和金属收集器组成。在电场作用下,注射针头处的溶液由球形变为圆锥形,并逐渐延展得到纤维细丝,进而获得水凝胶材料。该方法具有操作简便、可控性强等优点,目前已广泛用于骨骼肌、皮肤和血管等组织工程支架的制备。然而,由于注射针头孔径微小,极易导致静电纺丝过程中针头堵塞;同时,静电纺丝形成的纤维细丝很难控制取向,不利于大规模的产业化应用。因此,需通过改良针头或相关设备进行方法优化。
2.2 3D打印
1986 年,Charles[56]开发了3D 打印技术,主要通过计算机控制打印机对材料进行逐层加工,通过更换打印的原料能够制备出性能各异的水凝胶材料。基于计算机构建的模型,采用3D 打印可构建许多精密的结构,特别在组织工程方面,目前已构建出肝脏、心脏和手掌等多种组织或器官,对生物医学领域的研究起到了极大的推动作用。这些材料通常对原料的生物相容性提出了极高的要求,通过在前体溶液中加入活细胞能够实现活细胞在水凝胶材料中的直接封装,极大地简化了实验过程。但是,3D 打印技术通常需要昂贵的设备,成本很高,这在很大程度上限制了该技术的应用及推广。
2.3 冷冻铸造
冷冻铸造也称冰模板,自2006 年被提出后,目前已成为水凝胶材料加工的一种有效方法[57]。冷冻铸造加工过程通常先将凝胶固化,再减压使溶剂升华而形成多孔的凝胶结构。该方法十分简便,并且形成的水凝胶具有较大的孔隙率,这种大孔隙的互通结构更有利于细胞的迁移和营养物质的交换,因而在组织工程领域得到了极大的关注。然而,由于在加工过程中需要冷冻加压等操作,因此不利于生物活性成分的包封,并且对凝胶原料的稳定性也提出了很高的要求。
2.4 微流控技术
微流控技术是一种利用微结构对微量液体进行操作的手段。利用结构精密的微流控芯片可实现对水凝胶尺寸结构的精确控制。水凝胶形成的一般过程为先将前体溶液在微流控芯片中形成微液滴,然后通过物理或化学交联使其固化形成水凝胶微球。通过该方法形成的水凝胶尺寸很小,能够很好地充当微反应器或模拟微小的组织结构的功能,对于生物医学和组织工程领域具有重要的意义[58]。但是,微流控芯片制备过程复杂,设备昂贵,不利于该技术的普及。
3 水凝胶在人造细胞领域的应用
3.1 细胞结构模拟
水凝胶亲水的网络结构能够使人造细胞更接近真实的生物细胞结构。对于细胞结构的模拟,主要是将水凝胶封装在人造细胞内以实现对细胞质基质、细胞骨架和细胞器等结构的模拟。
3.1.1 细胞质基质模拟
细胞质基质是细胞质中均质而半透明的胶体部分,区别于单纯的水溶液,基质具有一定粘度并包含细胞生命活动所需的反应底物以执行必要的生化反应[59-61]。将水凝胶封装到人造细胞中极好地模拟了基质的物理状态,特别是处于溶胶状态的水凝胶,既能使人造细胞中维持一定粘度,也能负载多种酶及反应物[62-63]。
对于细胞质基质的模拟,通常选用具有环境响应能力的水凝胶以实现水凝胶在人造细胞内部溶胶-凝胶态的可控转变。琼脂糖和PNIPAM 作为典型的温度响应水凝胶组分被广泛用于细胞基质模拟。这些研究通常通过显微注射法将前体溶液包封在人造细胞中。显微注射法是一种十分精密的技术,常用于转基因领域,能将外源基因片段通过微量注射针直接注射到细胞中使外源基因嵌入宿主的染色体内。由于显微注射法能够实现对注射溶液组分的精确控制,因而在人造细胞领域也引起了广泛关注。包封在人造细胞中的前体溶液能够通过改变温度实现对人造细胞内粘度的控制[64]。2005 年,Jesorka 等[65]利用显微注射法将PNIPAM 溶液注射到人造细胞内部,通过改变环境的温度,人造细胞内部表现出不同的粘度变化。当环境温度为20 ℃时呈流动态(图1A 左图),当温度上升至27 ℃时为凝胶态(图1A 右图)。人造细胞内的粘度的变化能够直观地通过人造细胞内包封微粒的运动轨迹显示,在人造细胞内部处于流动态时,包封微粒的运动范围很大(图1B 蓝线);凝胶态时,包封微粒的的运动范围极小(图1B 红线)[66]。

图1 凝胶对细胞溶胶的模拟:(A)环境温度为20 ℃和27 ℃时囊泡内溶胶-凝胶转变图像[65];(B)溶胶状态下500 s 内人造细胞内粒子运动轨迹(蓝线)以及凝胶状态下500 s 内人造细胞内粒子运动轨迹(红线)[66]Fig.1 Simulation of gel on cytosol:(A)Image of sol-gel transition in the vesicle at 20 ℃and 27 ℃[65];(B)The trajectory of particles in the artificial cell within 500 s in the sol state(blue line),and the trajectory of particles in the artificial cell within 500 s in the gel state (red line)[66]
3.1.2 细胞骨架
细胞骨架是细胞维持形态的重要结构,在承受外力、保持细胞内部结构有序性方面起到了不可或缺的作用[67-68]。区别于肌动蛋白构建的细胞骨架系统,水凝胶构建的人造细胞骨架无需复杂的蛋白提取流程,被广泛应用于合成生物学领域[69]。
水凝胶模拟细胞骨架主要特点在于其能够使人造细胞抵抗外部机械应力。2009 年,Gaspard 等[70]将NIPAM 单体和交联剂封装到人造细胞中,外加紫外光照射形成水凝胶。形成的水凝胶能够模拟细胞骨架,使人造细胞在机械应力下表现出高度的稳定性[71]。通过改变水凝胶的交联密度还能够调控人造细胞的机械敏感性。
3.1.3 细胞器
细胞器是细胞质中具有特定形态和功能的结构,构建空间分隔的微区室是实现细胞器模拟的基础。负载酶或反应物的水凝胶微粒常被用于人造细胞中细胞器的模拟[72-74]。
微凝胶构建人造细胞器的基本过程为:首先制备功能化微凝胶,再将微凝胶封装到人造细胞内部作为人造细胞器,模拟细胞器之间或细胞器与细胞质之间的通讯过程。这些通讯过程通常基于无细胞表达系统[75]。Thiele 等[76]利用PEG 衍生物水凝胶实现了细胞器与细胞质之间的通讯过程模拟。将负载DNA的微凝胶封装到油包水液滴中,构建含有水凝胶细胞器的人造细胞结构(图2A)。微凝胶能够与液滴中包封的无细胞表达系统实现信号传递并进行转录翻译,实现绿色荧光蛋白的表达。类似地,Aufinger 等[77]将含有不同DNA 的琼脂糖微凝胶封装在人造细胞中,利用同时包封的无细胞表达系统实现了转录和翻译过程在不同微凝胶细胞器中的空间分离。如图2B 所示,青色和黄色的微凝胶类细胞器中含有不同的转录系统,其转录产生的RNA 分别被含有不同互补链的红色和绿色微凝胶的类细胞器捕获,表现为微凝胶内部荧光随时间的推移而增强,为之后的翻译过程做准备。
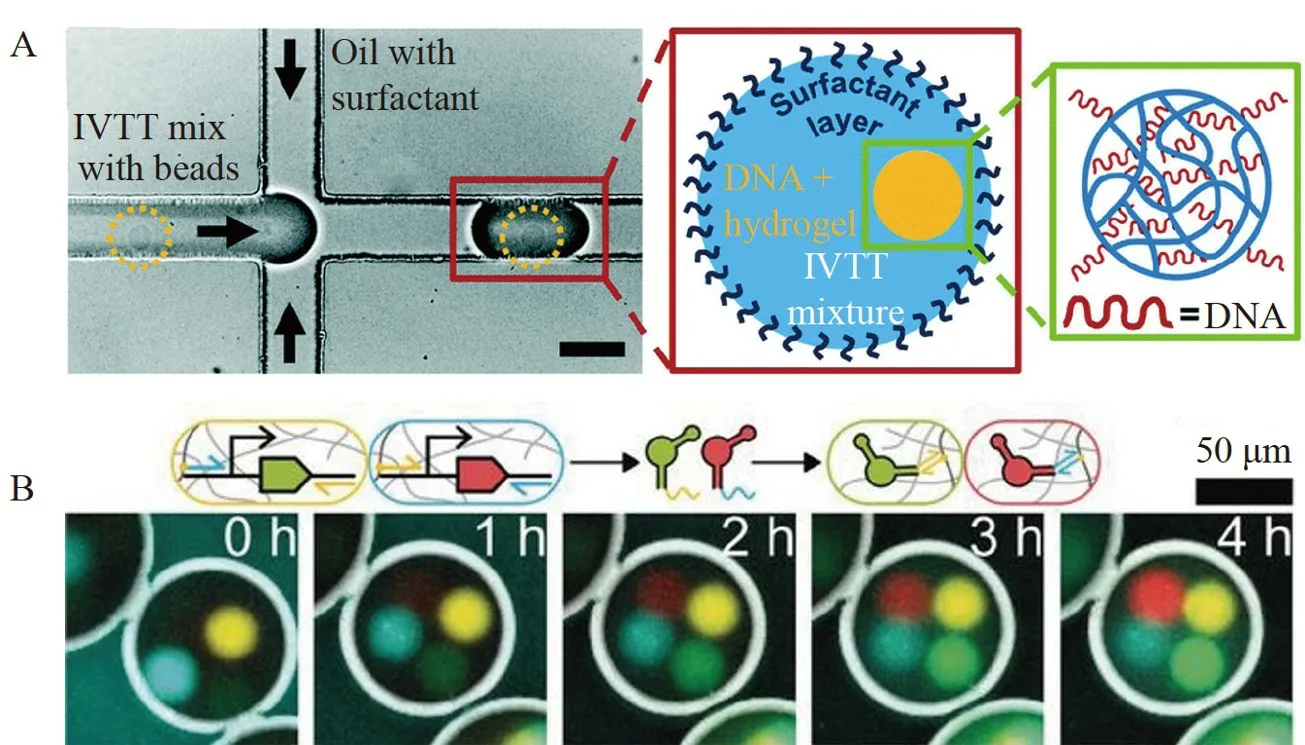
图2 凝胶对细胞器的模拟:(A)乳液法制备含有水凝胶细胞器的人造细胞结构[76];(B)人造细胞中凝胶细胞器间的信号传递导致的荧光随时间的变化[77]Fig.2 Preparation of gel artificial organelles in artificial cells:(A) Artificial cell structure containing hydrogel organelles prepared by emulsion method[76];(B) Time dependent fluorescence caused by signal transduction between gel organelles in artificial cells[77]
3.2 药物控释
水凝胶的环境响应能力是其用于药物缓释的基础。依据成胶因子的性质可使水凝胶对pH、生物分子、温度、光和磁场等变化响应,促进或阻碍水凝胶中负载药物的释放,因而在生物医学以及癌症治疗等领域引起了极大的关注。
3.2.1 pH响应的药物控释
在药物控释方面最常见的是基于pH 响应水凝胶构建的人造细胞。环境酸碱度的改变引起凝胶内部的网络结构的变化,表现为凝胶网络的膨胀或收缩从而引起药物的控释。pH 响应的水凝胶通常为聚电解质水凝胶[78]。2006 年,Tan 等[79]制备了由PEG 衍生物包被的聚电解质水凝胶,此水凝胶由聚甲基丙烯酸(PMAA)和聚(2-(二乙氨基)乙基甲基丙烯酸酯)(PDEA)组成。DEA 片段可以在低pH 值下质子化,赋予该片段正电荷,而MAA 单元在高pH 值下带负电荷。因此,凝胶在高pH 值和低pH 值下都表现出明显的溶胀,使水凝胶能够通过响应pH 值实现对药物的控释。
3.2.2 温度响应
温度响应水凝胶常用于磷脂构建的人造细胞,使其具备有效的药物缓释能力。因为磷脂构建的人造细胞通过调节磷脂组分也能响应温度变化。一方面,可将负载药物的人造细胞置于温敏水凝胶网络内部,实现人造细胞与水凝胶对药物的协同缓释[80];另外,还可将人造细胞附着于微凝胶表面。2010 年,Mackinnon 等[81]制备了PNIPAM 和丙烯酸(AA)交联的微凝胶,其中,PNIPAM 多分布在凝胶的核心位置,而AA 分布在水凝胶外部,外部的AA 促进了磷脂囊泡在微凝胶表面的结合。当环境温度高于32 ℃时,温敏性微凝胶收缩,使结合在表面的磷脂囊泡发生形变破裂,从而释放囊泡的内容物(图3A)。

图3 (A)温度改变导致的温度响应水凝胶系统中药物释放[81];(B)包封温敏水凝胶的人造细胞响应近红外光的药物释放机理[82];(C)分子响应水凝胶响应葡聚糖/H2O2 分子并释放负载的分子[83]Fig.3 (A)Drug release in temperature responsive hydrogel system caused by temperature change [81];(B)Drug release mechanism of artificial cells encapsulated with thermosensitive hydrogels in response to near-infrared light[82];(C) Molecular response hydrogel responds to dextran/H2O2 molecule and releases encapsulated molecules[83]
3.2.3 光响应
红外光刺激在生物医学领域十分普遍。对于水凝胶构建的人造细胞系统而言,通常利用水凝胶中包封的光热剂将光响应和温度响应结合使用。光热剂能够吸收近红外光,并以热能的形式传递给水凝胶材料,引发温敏水凝胶中药物的释放。Yu 等[82]制备了由PEG 修饰的磷脂囊泡封装的P(NIPAM-co-AAM)温敏微凝胶,水凝胶中负载了光热剂吲哚菁绿(ICG)和药物盐酸阿霉素(DOX)。ICG 能够响应近红外光刺激,使微凝胶溶胀,导致磷脂囊泡破裂,促进了负载的DOX 的释放(图3B)。
3.2.4 分子响应
分子响应水凝胶已逐渐引起关注,特别是生物分子响应水凝胶,能够识别生物体内特定的分子,使载体对于生理环境的感知能力显著提高。葡萄糖是常见的生物模型分子,针对葡萄糖已设计并制备了包括针对糖尿病治疗的多种水凝胶材料。2019 年,Li 等[83]制备了由PEG 为外壳的双响应的水凝胶药物载体。水凝胶以四硫醇官能季戊四醇四(3-巯基丙酸酯)为交联剂,双官能单体丙烯酰基(4-(5-(羟甲基)-5-甲基-1,3,2-二氧杂硼-2-基)苯基)甲醇(AHMDM)为双响应基团。一方面,HMDM 的环状苯硼酸酯可与葡萄糖反应,导致交联断裂;另一方面,HMDM 的环状苯硼酸酯也可与H2O2反应。因此,当环境中葡萄糖和H2O2量增多时,将引起水凝胶负载的胰岛素释放(图3C)。
3.3 组织工程
水凝胶在结构和生物学特性方面类似细胞外基质,不仅能够维持细胞的生命活动,还具有很好的负载能力,因而成为组织工程支架的理想模型。目前,水凝胶支架多用于负载活细胞,然而负载活细胞的水凝胶支架为防止细胞死亡和活性下降,对实验及存放提出了十分严苛的条件,利用水凝胶作为支架负载人造细胞无需严苛的实验条件,并且人造细胞的引入能够显著提高水凝胶的功能性,因而成为研究热点。人造细胞的引入使水凝胶支架具有可注射性、增强的机械性能、表面润滑性和信号传递性等优势。
3.3.1 可注射性
可注射性水凝胶是一种可在体外注射、体内成胶的水凝胶材料。由于具有原位成胶的特性,注射水凝胶能够填充各种不规则的创口,支架中负载的药物或生物活性分子能促进伤口的快速愈合。注射水凝胶的凝胶化可以通过各种刺激诱导,包括光、温度以及pH 值变化。
由于生理环境pH 值的稳定性和光在体内的穿透深度极为有限,为解决此问题,研究者制备了温度响应的可注射水凝胶支架。2015 年,Ren 等[84]开发了一种用于组织工程的热响应性可注射水凝胶支架,将包封辣根过氧化物酶(HRP)的热响应脂质体悬浮在透明质酸-酪胺(HA-Tyr)缀合物和H2O2溶液中。在室温下,HRP 通过脂质膜与HA-Tyr 缀合物分离,因此前体溶液保持为液体并可注射。注射后,脂质经历相变,显著增加了膜渗透性,并导致HRP 的释放和Tyr 部分与H2O2的氧化偶联,进而形成水凝胶支架。
3.3.2 机械性能增强
机械性能是水凝胶支架的重要评价指标。优良的机械性能对于延长支架的使用寿命,减轻患者反复手术的痛苦十分重要。水凝胶的机械性能能够通过调节水凝胶内部的成胶组分、相互作用力和网络结构等进行调节。在水凝胶成胶溶液中混合人造细胞也可起到很好的增强机械性能的效果。
Cheng 等[85]在明胶衍生物溶液中混入磷脂囊泡,利用囊泡和水凝胶网络之间的氢键交联制备了机械增强型水凝胶,对复合水凝胶进行了压缩、拉伸、扭转和弹性等测试,结果表明,相较于单纯的水凝胶,含有磷脂囊泡的水凝胶压缩和拉伸百分比更高,显示出十分优越的机械性能(图4A)。
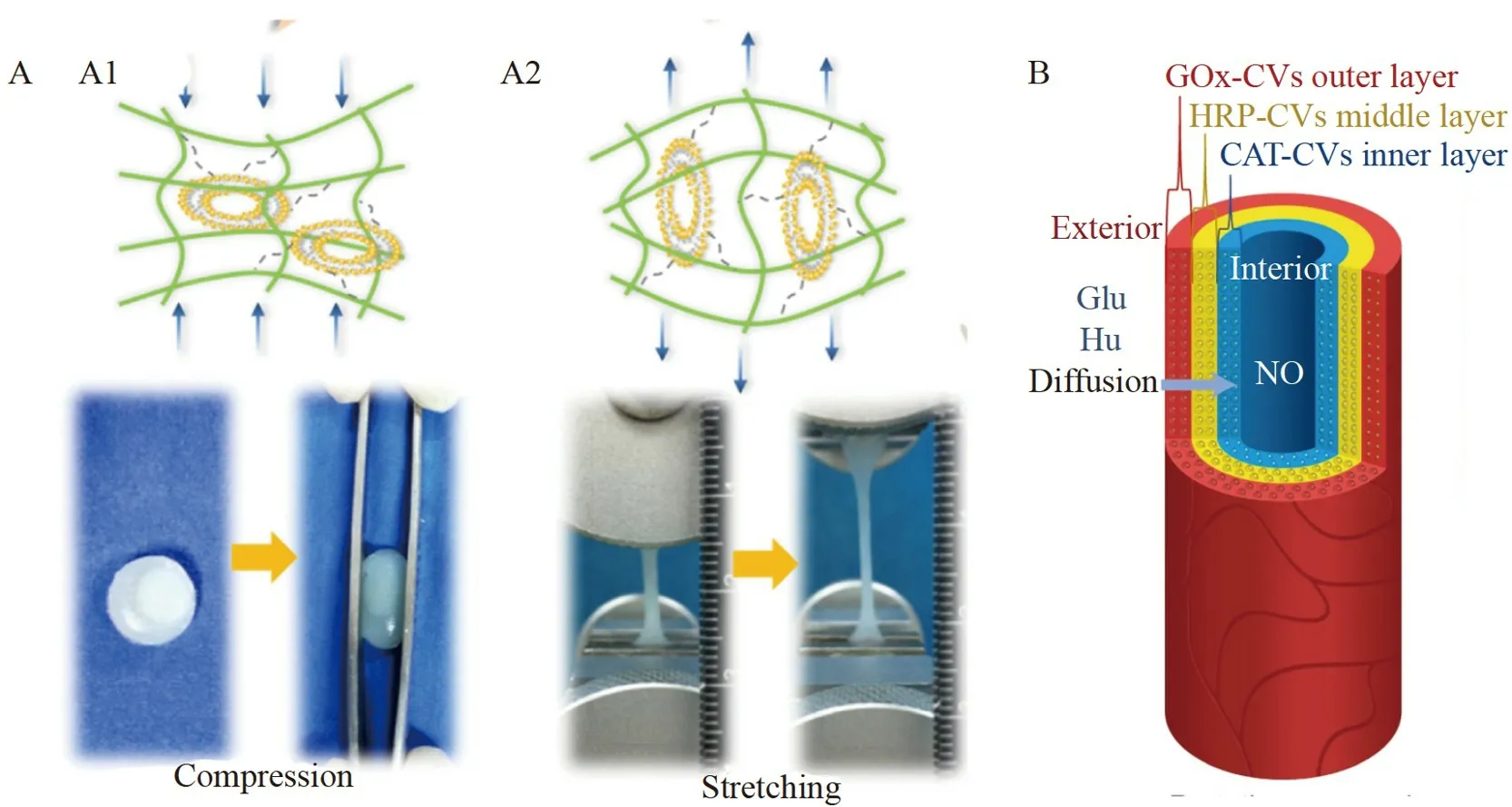
图4 (A)水凝胶与人造细胞间的氢键相互作用使材料压缩(A1)和拉伸(A2)能力增强[85];(B)人工血管结构示意图[87]Fig.4 (A) Hydrogen bond interaction between the hydrogel and the artificial cell enhances the compression(A1) and stretching (A2) abilities of the material[85];(B) Bionic structure diagram of artificial blood vessel[87]
3.3.3 表面润滑性
表面润滑性在组织工程领域极为重要。在生物体中,健康的关节软骨覆盖主要关节的骨骼末端,是自然界中已知的最有效润滑的表面。这种低摩擦对生物体健康至关重要,能够最大限度地减少磨损,并通过减少机械转导软骨的剪切应力维持体内平衡。
受软骨结构启发,2020 年,Lin 等[86]设计了含有磷脂囊泡的水凝胶,在施压条件下脂质不断向表面渗出,形成光滑层。水凝胶的摩擦和磨损减少了100 倍,即使在水凝胶干燥和再水化后也获得了良好的效果。该研究提供了一种维持水凝胶界面润滑的通用方法。
3.3.4 信号传递性
组织内细胞之间的信号传递对于组织功能的执行十分重要。以胰岛组织为例,按染色和形态学特点,人类的胰岛细胞主要分为胰岛A 细胞、B 细胞、D 细胞及PP 细胞。这4 种细胞按特定的空间顺序排列为胰岛组织,利用不同细胞之间的信号传递所分泌的胰岛素和胰高血糖素,能够使人体内的葡萄糖浓度保持在一定范围内,对于维持人体健康起到了重要作用。人造细胞常用于模拟细胞之间的信号传递,将酶或底物分别封装到不同的人造细胞中,可通过扩散实现人造细胞间的物质传递,发生级联反应,模拟组织内细胞之间的信号传递。
最近,Liu 等[87]将人造细胞负载到琼脂糖凝胶基质中,采用凝胶灌注的方法制备了人工血管(图4B)。在葡萄糖和羟基脲双输入情况下,底物进入人工血管激活人造细胞内的葡萄糖氧化酶/辣根过氧化物酶的级联反应,产生过氧化氢和一氧化氮,从而实现了人工血管内的信号传递。
4 总结与展望
水凝胶优越的性能使其广泛应用在人造细胞领域,由水凝胶组建的人造细胞系统在细胞结构模拟、药物控释和组织工程等方面展现出极大的优势。天然水凝胶生物相容性高,但性能欠佳,合成水凝胶性能多样,但其生物毒性及可降解性有待改善。进行细胞模拟的水凝胶功能单一,欠缺多重响应性。用于药物控释的水凝胶虽具有良好的刺激响应能力,但生物相容性和可降解性较差。用于组织工程的水凝胶系统多为水凝胶与人造细胞的单纯混合,有关人造细胞与水凝胶的结合方式对材料的性能探究较少。因此,未来用于人造细胞体系的水凝胶研究的发展方向应主要集中于以下方面:(1)结合天然成分与合成成分制备既具有高生物相容性又具备多种活性官能团的水凝胶;(2)利用修饰的活性官能团设计具有多重响应性的智能水凝胶;(3)在人造细胞体系中运用多种具备不同功能的水凝胶以及它们之间的相互协助,实现人造细胞体系更加复杂的功能。智能水凝胶在人造细胞体系中的应用有助于模拟复杂的细胞功能,提供新型药物控释载体和组织工程材料。
