心肌细胞膜修饰的新型阳离子脂质纳米颗粒介导心肌肥厚的高效治疗研究
2023-02-26矫莉萍李玮孙枝红刘杰孙成铭
矫莉萍 李玮 孙枝红 刘杰 孙成铭*,
1(青岛大学医学部,青岛266071)2(青岛大学附属烟台毓璜顶医院医学检验科,烟台 264000)
心肌肥厚是在血压升高或后负荷增加时为了维持心脏正常的收缩功能而发生的生理适应性反应[1]。病理性心肌肥厚常与收缩功能障碍、间质纤维化、心脏结构重塑和胎儿心脏基因的重新表达相关联,是诱发心力衰竭和猝死的重要原因之一[2-3]。目前,心肌肥厚的主要治疗策略是药物治疗,即通过使用降低血压或者能够阻断肾上腺素能受体的药物[4],但患者的临床响应率低,治疗效果并不理想。因此,亟需寻找一种能有效预防或者逆转心肌肥厚的新型治疗方式[5]。
MicroRNAs(miRNAs)是一类非编码的小RNA,以碱基互补配对的形式与靶基因3′非编码区(3′UTR)识别和结合,通过对靶基因的切割或翻译抑制而调控靶基因的表达[6]。miR-133a 是心肌组织中含量最丰富的miRNA 之一,在心血管疾病进程中具有重要作用[7]。研究发现,miR-133a 与心肌肥厚呈负相关[8],主要通过抑制GDP-GTP 交换蛋白(RhoA)的表达来调控心肌肥厚的病理过程[8-10]。因此,miR-133a 具有治疗心肌肥厚的应用潜力。
基于RNA 技术的基因治疗(如mRNA、siRNA 和miRNA 等)通过调控相关基因的表达实现治疗包括心血管病、肿瘤、遗传病和免疫性疾病等多种疾病的目的[11]。为了实现有效治疗,RNA 疗法需将治疗性的RNA 输送至靶细胞中[12-13]。然而,RNA 在递送的过程中面临着多重阻碍,如RNA 表面负电荷和亲水性阻碍了RNA 在跨质膜之间的被动扩散,并且易与血清蛋白结合而被吞噬细胞吞噬,体内血液循环中极易被RNA 酶降解等,均导致其难进入细胞中发挥功能[14]。为了克服上述阻碍,多种病毒类和非病毒递送系统被开发用于RNA 的递送。相较于病毒递送系统,非病毒递送系统可绕过病毒载体的限制,在不引起免疫反应的前提下将目标RNA 运送至靶细胞中发挥作用。
阳离子脂质纳米颗粒(Lipid nanoparticles,LNPs)是目前应用最广的非病毒类RNA 药物递送载体,通常由阳离子脂质、磷脂、胆固醇和聚乙二醇(Polyethylene glycol,PEG)构成[15]。其中,阳离子脂质是通过与带负电荷的核酸相互作用促进核酸包裹和介导内体破裂使核酸释放到细胞质中,主要起到保护核酸免受核酸酶降解的作用。PEG 通常在LNPs 中占比最小,影响LNPs 的粒径和电荷,在增强颗粒稳定性的同时阻止LNPs 聚集,在循环和生物分布过程中具有关键作用。此外,辅助性脂质(如磷脂和胆固醇)主要作用是支持颗粒结构,并在储存和循环过程中增强稳定性[16-17]。
基于LNPs 的递送载体在RNA 治疗领域具有很好的应用前景,但其在体内的有效靶向输送问题值得重视[18]。本研究基于“模仿自然”的观念,利用天然细胞膜伪装纳米载体制备了HR-133a@F1-5LNPs 仿生纳米运载系统,此系统具有类天然细胞的生物性能,因此兼具良好的生物相容性、同源靶向性、更低的毒副作用以及更长的体内循环时间[19]。Hu 等[20]将纳米级的红细胞膜包裹聚乳酸-羟基乙酸共聚物(Poly(lactic-co-glycolic acid),PLGA),开发了一种新药物递送平台。此平台将红细胞膜和聚合物载体的特点相融合,利用红细胞膜表面的CD47 将药物纳米载体伪装成“自我”而躲过了巨噬细胞的摄取和免疫系统的清除,有效延长了体内循环的循环时间,并靶向至病变部分。Wang 等[21]通过从血液中分离出血小板膜并将其修饰于聚合物表面,构建了一种全新的仿生载体。此载体表面修饰的血小板膜所保留的膜蛋白成分,可以有效地结合人类的胶原蛋白,并靶向孤立血管的损伤区域。Chen 等[22]报道了一种将癌细胞膜包覆于吲哚菁绿(ICG)聚合物核表面而组成的核-壳纳米结构(ICNPs)。此ICNPs 具有源癌细胞相似的细胞粘附分子,有利于源癌细胞摄取膜结合的肿瘤抗原进行有效的呈递和下游免疫的激活,而且可以通过同型结合机制,将ICNPs 精准地靶向至源癌细胞,进而实现更有效的治疗效果。这种集天然细胞膜功能和纳米载体功能于一体的纳米载体在生物医学领域中具有巨大的应用潜力和发展前景[23-24]。
在前期仿生研究的基础上,本研究将心肌细胞膜(采用H 表示)修饰在搭载miR-133a 的脂质体(F1-5)纳米颗粒R-133aF1-5LNPs(即F1阳离子载体在氮磷比(N/P)为5∶1 时吸附miR-133a 形成的纳米颗粒)表面,构建了兼具高递送效率和低细胞毒性的仿生基因载体HR-133a@F1-5LNPs。通过仿生基因载体HR-133a@F1-5LNPs 将miR-133a 递送至肥厚性心肌细胞中,靶向结合RhoA 3′UTR 抑制RhoA/ROCK 信号通路,抑制了细胞周期重启和细胞骨架的重新排列,调控了心肌肥厚的病理过程,达到抑制心肌肥厚和发挥基因治疗的目的[9-10,14],为心肌肥厚治疗提供了一种新思路。
1 实验部分
1.1 仪器与试剂
ZS90 型纳米粒度电位仪(英国Malvern 公司);Tecnai G2 F20 S-TWIN 型透射电子显微镜(工作电压200 kV,美国FEI 公司);UH-100B 型超声波细胞破碎仪(天津奥特赛恩斯仪器有限公司);Axio Observer 7全自动倒置荧光显微镜(德国ZEISS 公司);Beckman Moflo-XDP 流式细胞仪(上海贝克曼库尔特商贸有限公司);TC-XP-D 博日基因扩增仪(杭州博日科技有限公司);ABI 7500 实时荧光定量PCR 仪、NanoDroplite 分光光度计和EVOS M7000 型智能成像分析系统(美国Thermo Fisher 公司);Multiskan FC型酶标仪、蛋白电泳转膜系统和GeldocXR+凝胶成像系统(美国BioRad 公司);Chemi Scope6200Touch化学发光成像分析系统(上海勤翔科学仪器有限公司)。
MiR-133a(安徽通用生物系统有限公司);GAPDH、BNP 和RhoA 引物(生工生物工程(上海)有限公司);1,2-二硬脂酰-sn-甘油-3-磷酸胆碱(1,2-Dioctadecanoyl-sn-glycero-3-phophocholine,DSPC)和胆固醇(Cholesterol,CHO)(艾伟拓(上海)医药科技有限公司);1,2-二肉豆蔻酰-rac-甘油-3-甲氧基聚乙二醇2000(1,2-Dimyristoyl-rac-glycero-3-methoxypolyethylene glycol-2000,DMG-PEG(2000))和鬼笔环肽(美国Avanit 公司);血管紧张素Ⅱ(Angiotensin Ⅱ,AngⅡ,美国MCE 公司);聚乙酰亚胺(Polyethyleneimine,PEI,上海阿拉丁生化科技股份有限公司);磷酸盐缓冲溶液(PBS,美国Corning 公司);DAPI 溶液(即用型,北京索莱宝科技有限公司)。细胞膜蛋白与细胞浆蛋白提取试剂盒(碧云天生物技术有限公司);M5 Hiper Universal RNA Mini Kit 组织/细胞RNA 快速提取试剂盒和M5 Super plus qPCR RT kit with gDNA remover、2×M5 HiPer Realtime PCR Super mix with High Rox、M5 Hiper Cell Counting Kit(CCK)CCK-8 细胞增殖与活性检测试剂盒(北京聚合美生物科技有限公司);One-Step PAGE Gel Fast Preparation Kit(12%)试剂盒(南京诺唯赞生物科技股份有限公司)。
1.2 实验方法
1.2.1 脂质纳米粒(R-133a@FLNPs)的合成和筛选
分别称取2 mg 阳离子脂质分子F1、F2和F3(结构见图1)溶于1 mL 无水乙醇中(2 mg/mL),并按照推荐摩尔比[25](阳离子脂质∶DSPC∶胆固醇∶DMG-PEG(2000)=50∶10∶38.5∶1.5)加入DSPC、胆固醇和DMG-PEG,分别制备F1-LNPs、F2-LNPs 和F3-LNPs;随后,用200 μL PBS 溶液溶解1 OD(1 OD=40 μg)miR-133a(200 ng/μL)。F-LNPs 与miR-133a 的合成比例用氮磷比(N/P)表示,按照N/P 比为2.5∶1、5∶1 和10∶1,将乙醇相中F1-LNPs、F2-LNPs 和F3-LNPs 分别快速注入miR-133a PBS 相中,反复吹打混匀后,室温孵育30 min,制备成3 种不同N/P 比的基因载体R-133a@F1LNPs、R-133a@F2LNPs 和R-133a@F3LNPs,再采用PBS 溶液分别稀释至终体积为1 mL,通过纳米粒度电位仪检测纳米复合物的粒径大小和表面电荷。

图1 阳离子脂质F1、F2 和F3 的结构示意图Fig.1 Structure diagram of cationic lipids F1,F2 and F3
为了评估R-133a@FLNPs 对核酸的浓缩能力,以阳离子载体的“金标准”PEI 作为对照。将按照不同N/P 比制备的一系列基因载体R-133a@FLNPs 稀释至终体积为10 μL,室温孵育30 min 后进行琼脂糖凝胶阻滞实验。在电压为100 V 条件下电泳30 min 后,在凝胶成像仪下观察,比较不同N/P 比载体与miR-133a 的结合能力,筛选出3 种纳米颗粒结合miR-133a 的最佳比例。
将对数生长期的HL1 心肌细胞以8×103/孔的密度接种于8 孔共聚焦小室中,置于37 ℃、5%CO2恒温培养箱中培养过夜。待细胞生长至60%~80%时,分别加入R-133a@F1LNPs、R-133a@F2LNPs 和R-133a@F3LNPs,继续在培养箱中孵育12 h 后,弃去培养基,用预冷PBS 洗涤2 次,去除多余载体,再向其中加入DAPI 染液,避光处理10 min,预冷PBS 洗涤3 次(每次5 min)。通过激光共聚焦显微镜观察心肌细胞对不同组基因载体的摄取情况。Cy5 标记的miR-133a 的吸收波长为650 nm,发射波长为670 nm。DAPI 的吸收波长为358 nm,发射波长为461 nm。
王树林出了电梯,手机已然开启。并没有再次出现短信。他快步地朝小区大门而去,雨未停,空气清凉。一路上思磨着那两个问号的意义,犹豫着是否要回拨一个电话。他和伍亦苒有过设定,他们的交往过程追寻的就是快乐。花堪折时直须折,莫待花落空折枝。任何一方没有任何消息的时候一定有诸多不便,换句话说,另一方无须抱怨和勉强,他们都以不破坏现实状态为最高出发点。
将HL1 心肌细胞接种于12 孔板中,置于37 ℃、5%CO2培养箱中培养过夜。待细胞生长至60%~80%时,分别向其中加入R-133a@F1LNPs、R-133a@F2LNPs 和R-133a@F3LNPs,培养箱中孵育12 h 后,弃去培养基,经胰酶消化处理并收集细胞悬液(2000 r/min,5 min);用预冷PBS 洗涤2 次(1000 r/min,5 min)后,将其转移至流式管中,进行流式细胞术分析;以未处理细胞为阴性对照,检测Cy5 阳性细胞比例和荧光强度。
1.2.2 仿生基因载体(HR-133a@F1-5LNPs)的制备和表征
将处于对数生长期的HL1 心肌细胞接种于10 cm 细胞培养皿中,过夜培养后收集细胞,并按照细胞膜提取试剂盒(碧云天生物技术有限公司)说明书的要求提取HL1 心肌细胞膜。首先用预冷PBS 洗涤3 次,将细胞用细胞刮分离后收集于15 mL 离心管中,2000 r/min 离心5 min,留取细胞沉淀。向细胞沉淀中加入PMSF 终浓度为1 mmol/L 的膜蛋白抽提试剂A,并轻轻混匀,置于冰上裂解15 min。将细胞悬液转移至预冷的玻璃研磨器,研磨30~50 次,收集裂解液;在4 ℃以2000 r/min 离心10 min,去除细胞核和未破碎的细胞。收集上清液,在4 ℃以14000 r/min 离心30 min,获得的沉淀即为HL1 心肌细胞膜,于–80 ℃保存备用。
将HL1 心肌细胞膜重悬于去离子水中,超声破碎混匀。将上述悬液在0.22 μm 过滤器上重复过滤10 次,使细胞膜均匀覆盖于滤器的滤网上;将筛选出的最佳基因载体R-133a@F1-5LNPs 在同一滤器上过膜挤压10 次,使细胞膜均匀覆盖在基因载体表面,获得仿生纳米载体HR-133a@F1-5LNPs。采用透射电子显微镜(TEM)和粒径分析仪对HR-133a@F1-5LNPs 的粒径和基本形貌进行表征,并通过考马斯亮蓝染色评估HR-133a@F1-5LNPs 的膜包裹情况。
1.2.3 HR-133a@F1-5LNPs的生物安全性测定
将HL1 心肌细胞以5×103/孔的密度接种于96 孔板中,置于37 ℃、5% CO2培养箱中培养过夜。更换培养基后,加入不同浓度(0~100 μg/mL)的R-133a@F1-5LNPs、HR-133a@F1-5LNPs 和PEI,继续恒温培养24 h。更换新鲜培养基后,加入CCK-8 试剂,于37 ℃避光孵育30 min,采用酶标仪读取450 nm 处的吸光度,通过公式(1)计算细胞存活率(Cell viability,CV)。其中,As为加入阳离子基因载体的实验组吸光度,Ac为未加入阳离子基因载体的对照组吸光度,Ab为不含细胞的培养基空白对照组的吸光度。
体外溶血实验也是评估基因载体的生物相容性的重要指标之一。取2 mL C57BL/6J 小鼠外周血于EDTA 抗凝管中,分离血细胞重悬于PBS 中,加入浓度为25 μg/mL、N/P 比为5∶1 的R-133a@F1-5LNPs、HR-133a@F1-5LNPs 和PEI 重悬血红细胞,在细胞培养箱中分别孵育12 和24 h。以PBS 处理为阴性对照,去离子水处理为阳性对照,采用分光光度计测定不同实验组样品在545 nm 处的吸光度,通过公式(2)计算红细胞的溶血率(Hemolysis ratio,%)。将处理后的红细胞分散在载玻片上,在显微镜下直接观察红细胞的形态,评估红细胞的结构完整性。
1.2.4 体外心肌肥厚模型的建立及HR-133a@F1-5LNPs体外靶向性分析
通过AngⅡ刺激HL1 心肌细胞,模拟长期高血压引起的心脏超负荷导致的心脏代偿性肥厚,建立心肌肥厚的细胞模型[26]。采用体外评估心肌细胞相关肥厚基因(B-Type natriuretic peptide,BNP)和HL1心肌细胞体积变化情况验证建模是否成功。将处于对数期的HL1 心肌细胞以2×105/孔的密度接种于6 孔板中,于37 ℃、5% CO2培养箱过夜培养。更换无血清的MEM 培养基后,分别向其中加入不同浓度(1×10–5mol/L、1×10–6mol/L、1×10–7mol/L 和1×10–8mol/L)的AngⅡ培养液刺激处理48 h,测定诱导心肌细胞肥大的最佳药物处理浓度。
采用M5 Universal RNA Mini Kit 试剂盒提取不同浓度组HL1 心肌细胞的总RNA,采用NanoDroplite紫外分光光度计测定RNA 的浓度。参照HiScriptIII RT SuperMix for qPCR(+gDNA wiper)逆转录试剂盒说明书,配制逆转录反应体系,逆转录后将cDNA 置于–20 ℃保存备用。qPCR 反应扩增体系根据ChamQ Universal SYBR qPCR Master Mix 说明书在冰上进行配制。qPCR 数据分析时,选择GAPDH 作为内参基因,采用2–ΔΔCt法计算不同浓度AngⅡ刺激的HL1 心肌细胞的BNP 相对表达量。引物序列:GAPDH Forward primer(5′-3′)∶GGTTGTCTCCTGCGACTTCA;GAPDH Reverse primer(3′-5′)∶TGGTCCAGGGTTTCTTACTCC;BNP Forward primer(5′-3′)∶AAGAGAAAAGTCGGAGGAAATGG;BNP Reverse primer(3′-5′)∶TACAACAACTTCAGTGCGTTACAGC。
将处于对数生长期的HL1 心肌细胞接种于共聚焦小皿中,AngⅡ(1×10–7mol/L)刺激处理48 h,建立心肌肥厚的细胞模型。待心肌肥厚模型建立后,向每孔加入500 μL 4%多聚甲醛溶液固定细胞10 min,PBS 洗涤3 次,弃去溶液。向每孔加入200 μL 37 ℃预热的鬼笔环肽染液,置于37 ℃恒温培养箱中避光培养30 min。弃去染液后,以PBS 溶液洗涤3 次,加入DAPI 溶液(即用型)染色5 min,再经PBS溶液洗涤后,以激光共聚焦显微镜观察心肌细胞HL1 细胞形态,随机选取5 个视野进行拍照,每个视野随机选取10 个细胞,采用Image J 软件计算心肌细胞表面积,取平均值,每组重复测量3 次。
将HL1 心肌细胞接种于共聚焦小皿中,AngⅡ(1×10–7mol/L)刺激处理48 h,建立心肌肥厚的细胞模型。分别加入R-133a@F1-5LNPs、HR-133a@F1-5LNPs 和PEI/miR-133a 溶液处理12 h,弃去培养基,PBS 溶液清洗2 次,加入DAPI 染色5 min,PBS 洗涤3 次,每次5 min,在共聚焦显微镜下观察肥厚性心肌细胞对HR-133a@F1-5LNPs 的摄取情况。
1.2.5 HR-133a@F1-5LNPs体外对心肌肥厚治疗效果评价
为了验证HR-133a@F1-5LNPs 是否将miR-133a 递送至细胞中,将HL1 心肌细胞接种于6 孔板中,AngⅡ(1×10–7mol/L)刺激处理48 h,建立心肌肥厚的细胞模型。更换培养基,以PBS 处理组为对照,分别加入R-133a@F1-5LNPs 和HR-133a@F1-5LNPs,继续培养12 和24 h。采用qPCR 测定HL1 心肌细胞中RhoA 基因的表达水平。引物序列:RhoA Forward primer(5′-3′)∶GTTGGTGATGGAGCTTGTGG;RhoA Reverse primer(3′-5′)∶CAGCTGTGTCCCATAAAGCC
将处于对数生长期的HL1 心肌细胞接种于6 孔板内,AngⅡ刺激HL1 心肌细胞,建立心肌的细胞肥厚模型。向其中分别加入PBS、R-133a@F1-5LNPs、HR-133a@F1-5LNPs 和PEI 继续培养48 h。提取各处理组细胞中的蛋白质,并通过BCA 蛋白定量试剂盒测定各样本的蛋白浓度。采用One-Step PAGE Gel Fast Preparation Kit(12%)试剂盒制备12%蛋白电泳胶,电泳槽中加入Running buffer 电泳缓冲液,每孔按相同蛋白量上样,80 V 恒压电泳25 min,随后调整电压为150 V 电泳1 h。随后进行转膜、封闭、孵育一抗、洗涤、孵育二抗和洗涤,加入发光液后,置于化学发光成像分析仪进行成像,检测HL1 心肌细胞中的RhoA 的蛋白水平表达。
1.2.6 统计学分析
实验数据以均数±标准差表示,采用Graphpad Prism 软件对其分析,组间两两比较采用Student′s t检验,当p<0.05 时,认为差异有统计学意义。
2 结果与讨论
2.1 脂质纳米粒(R-133a@FLNPs)的合成和筛选
如图2A 所示,N/P 比分别为2.5∶1、5∶1 和10∶1 的R-133a@F1LNPs、R-133a@F2LNPs 和R-133a@F3LNPs 纳米复合物的粒径随着N/P 比增大而逐渐减小,主要分布于70~300 nm 范围内。相较于其它组别,N/P 比为10∶1 时各组的粒径最小。表面Zeta 电位大约在25~40 mV 之间,随着N/P 比值增加,电荷增大(图2B)。这是由于阳离子表面带正电荷,可以通过静电作用将核酸缩合成尺寸更小的纳米颗粒[27]。通过琼脂糖凝胶阻滞实验检测阳离子载体F-LNPs 结合miR-133a 的能力(图2C),合成的R-133a@F1LNPs、R-133a@F2LNPs 和R-133a@F3LNPs 由于分子量变大而被阻滞在泳道口,而未被结合的miR-133a 会随着电泳向正极移动,当miR-133a 完全结合时,相应的下端条带消失。R-133a@F1LNPs 在N/P 比为5∶1 时可完全结合miR-133a,而PEI、R-133a@F2LNPs 和R-133a@F3LNPs 在N/P 比为10∶1 时才可完全结合miR-133a。
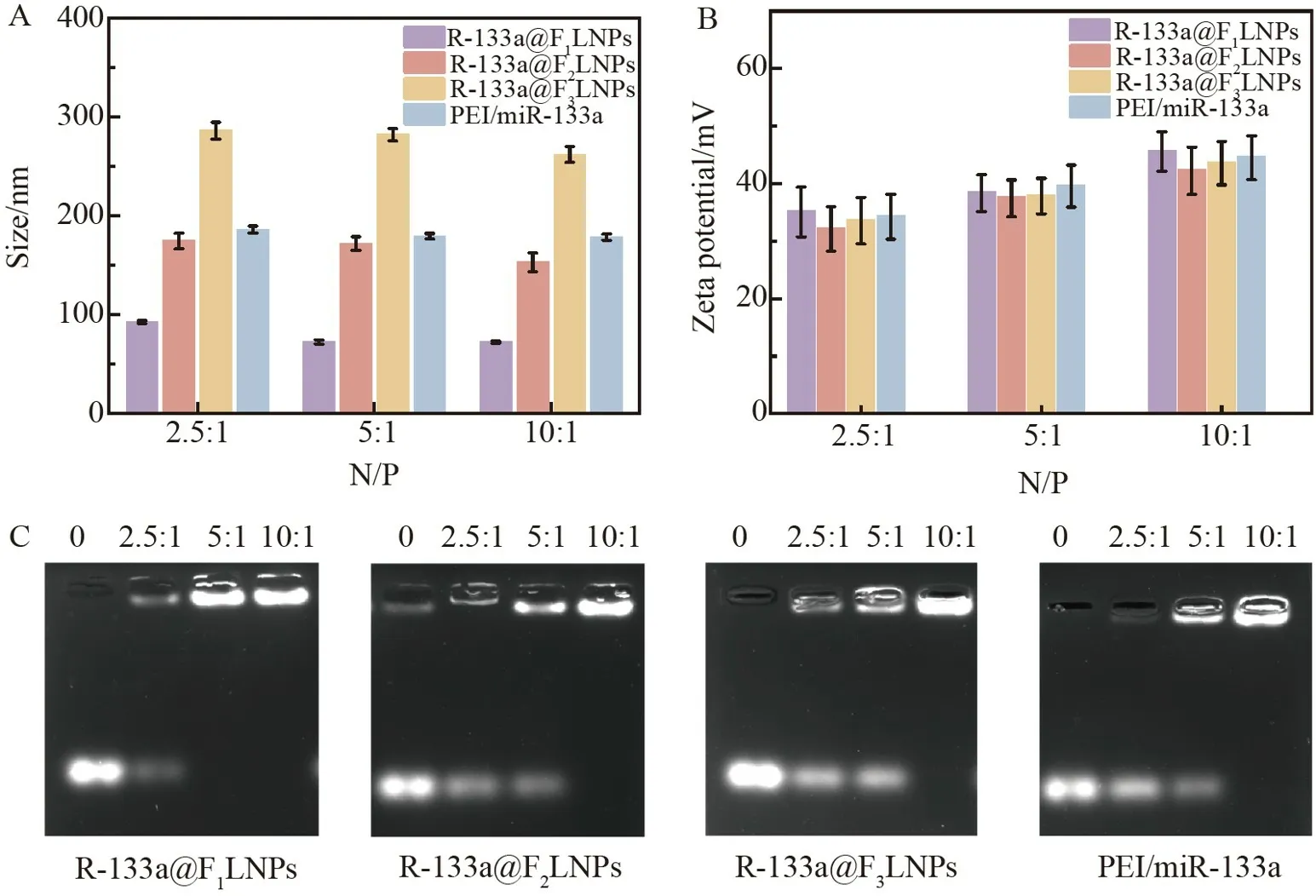
图2 (A)不同氮磷(N/P)比的R-133a@F1LNPs、R-133a@F2LNPs、R-133a@F3LNPs 和PEI/miR-133a 的粒径变化图;(B)不同N/P 比的R-133a@F1LNPs、R-133a@F2LNPs、R-133a@F3LNPs 和PEI/miR-133a的电荷变化图;(C)凝胶阻滞分析不同N/P 比的F1-LNPS、F2-LNPS、F3-LNPS 以及PEI 对miR-133a 的结合能力Fig.2 (A) Particle size variation of R-133a@F1LNPs,R-133a@F2LNPs,R-133a@F3LNPs,and PEI/miR-133a at different ratios of nitrogen to phosphorus (N/P);(B) Variations in charges of R-133a@F1LNPs,R-133a@F2 LNPs,R-133a@F3LNPs,and PEI/miR-133a at different N/P ratios;(C) Gel retardation analysis of the binding ability of F1-LNPS,F2-LNPS,F3-LNPS and PEI with miR-133a at different N/P ratios
为了筛选出递送miR-133a 进入HL1 心肌细胞的最佳阳离子载体,以流式细胞术和共聚焦显微镜进行体外测定。流式细胞术结果(图3A)显示,采用R-133a@F1LNPs、R-133a@F2LNPs、R-133a@F3LNPs 和PEI/miR-133a 分别处理HL1 心肌细胞后,随着N/P 比增加,Cy5(Cy5 标记miR-133a)阳性细胞比例呈现先增高后降低的趋势,这可能是因为在N/P 比为2.5∶1 条件下制备的3 种聚阳离子载体对核酸的结合能力较差,形成的纳米颗粒尺寸较大,不利于细胞的内吞;当N/P 比为10∶1 时,虽然纳米颗粒对核酸的浓缩能力变强,但在较高N/P 比下,基因载体的表面电荷增高,导致细胞毒性增加。如图3B 和3C 所示,在N/P 比为5∶1 时,R-133a@F1-5LNPs 处理组的荧光强度和Cy5 阳性细胞比例(92.3%)远高于其它处理组,而对照PEI 处理组的荧光强度和Cy5 阳性细胞比例最低,仅为20.9%。共聚焦荧光显微镜的检测结果(图3D)显示,相较于其它处理组,R-133a@F1-5LNPS处理组的Cy5 红色荧光信号最强,PEI 处理组的荧光信号最弱。

图3 (A)不同N/P 比的R-133a@F1LNPs、R-133a@F2LNPs、R-133a@F3LNPs 和PEI/miR-133a 在HL1心肌细胞中的内化情况;(B)N/P 比为5∶1 时,HL1 心肌细胞对R-133a@F1-5LNPs、R-133a@F2-5LNPs、R-133a@F3-5LNPs 和PEI/miR-133a 摄取的平均荧光强度;(C)N/P 比为5∶1 时,R-133a@F1-5LNPs、R-133a@F2-5LNPs、R-133a@F3-5LNPs、PEI/miR-133a 在HL1 心肌细胞中的转染效率;(D)在荧光显微镜下观察HL1 细胞对R-133a@F1-5LNPs、R-133a@F2-5LNPs、R-133a@F3-5LNPs 和PEI/miR-133a 的摄入情况Fig.3 (A) Internalization of different N/P ratios of R-133a@F1LNPs,R-133a@F2LNPs,R-133a@F3LNPs and PEI/miR-133a in HL1 cardiomyocytes;(B) Average fluorescence intensity of R-133a@F1-5LNPs,R-133a@F2-5 LNPs,R-133a@F3-5LNPS and PEI/miR-133a uptake by HL1 cardiomyocytes at N/P ratio of 5∶1;(C)Transfection efficiency of R-133a@F1-5LNPs,R-133a@F2-5LNPs,R-133a@F3-5LNPs and PEI/miR-133a in HL1 cardiomyocytes at N/P ratio of 5∶1;(D)Observation of uptake of R-133a@F1-5LNPs,R-133a@F2-5LNPs,R-133a@F3-5LNPs and PEI/miR-133a by HL1 cells under fluorescent microscopy
综上,在N/P 比为5∶1 时,R-133a@F1-5LNPs 纳米复合物细胞递送性能最佳,可作为心肌肥厚基因治疗的最佳基因递送载体。
2.2 仿生基因载体(HR-133a@F1-5LNPs)的制备和表征
采用心肌细胞膜包裹筛选出的最佳聚阳离子载体R-133a@F1-5LNPs 并制备成仿生纳米载体HR-133a@F1-5LNPs。透射电子显微镜结果表明,R-133a@F1-5LNPs 呈球形,粒径约为70 nm,水合粒径结果显示其分布较集中,平均粒径为(71±1)nm;外层修饰HL1 心肌细胞膜的HR-133a@F1-5LNPs 纳米颗粒也呈球形,并可观测到一层膜结构包覆于表面,其粒径约为90 nm;水合粒径结果表明,HR-133a@F1-5LNPs 粒径分布较集中,平均粒径为(90±1)nm(图4A)。为了进一步验证HL1 心肌细胞膜已包覆于基因载体表面,通过考马斯亮蓝实验测定HR-133a@F1-5LNPs 表面细胞膜蛋白水平。由图4B 可见,HR-133a@F1-5LNPs 与HL1 心肌细胞膜的膜蛋白表达基本一致,而R-133a@F1-5LNPs 组未检出蛋白。上述结果表明,HL1 心肌细胞膜已修饰在R-133a@F1-5LNPs 载体表面,即制备得到了仿生纳米载体HR-133a@F1-5LNPs。
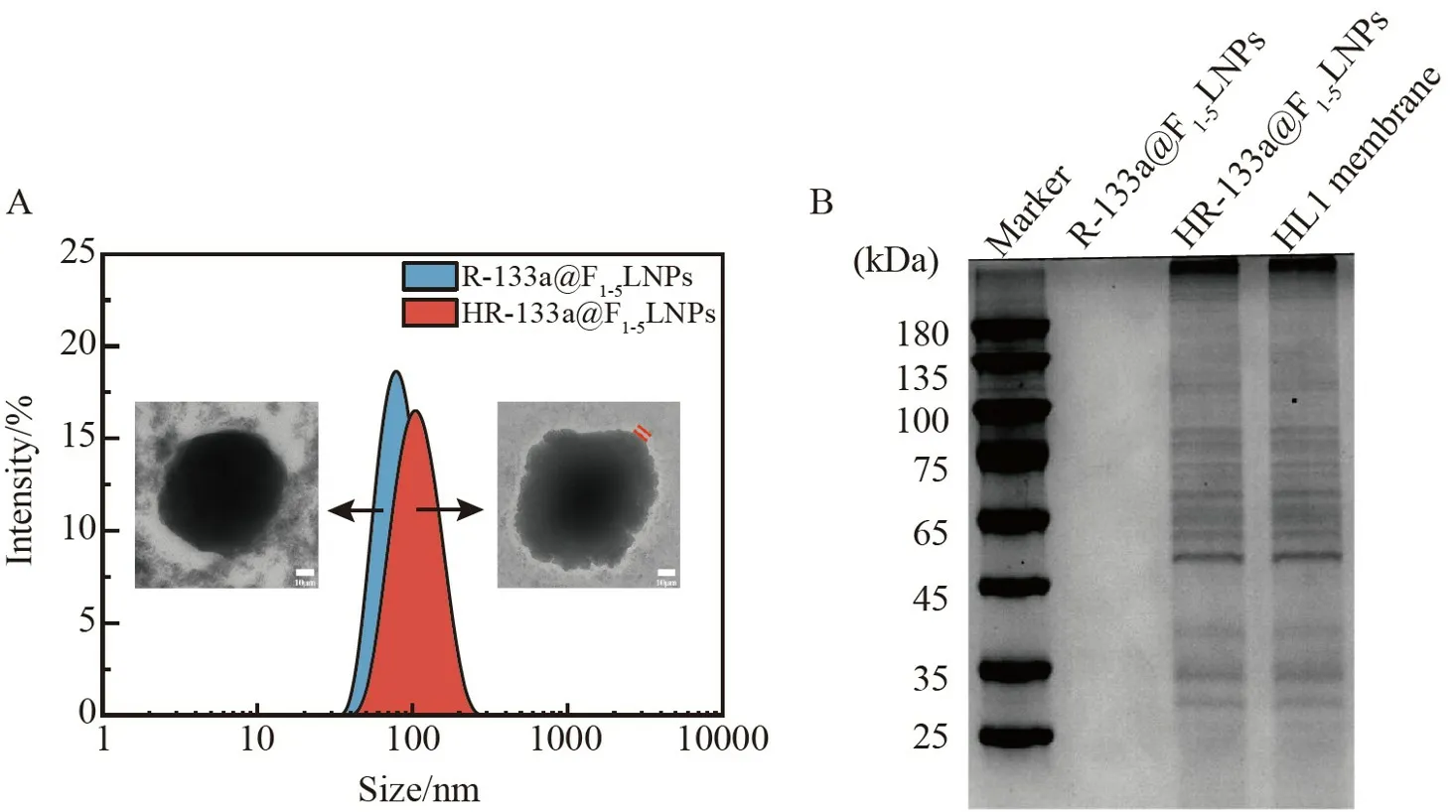
图4 (A)R-133a@F1-5LNPs 和HR-133a@F1-5LNPs 的粒径分布和透射电镜形貌图;(B)R-133a@F1-5 LNPs、HR-133a@F1-5LNPs 和HL1 心肌细胞膜考马斯亮蓝染色结果Fig.4 (A) Particle size distribution and transmission electron microscopy (TEM) morphology images of R-133a@F1-5LNPs and HR-133a@F1-5LNPs;(B) Results of Coomassie Brilliant Blue staining of R-133a@F1-5 LNPs,HR-133a@F1-5LNPs and HL1 cardiomyocytes membrane
2.3 HR-133a@F1-5LNPs的生物安全性测定
采用CCK-8 实验评估不同浓度(0~100 μg/mL)HR-133a@F1-5LNPs 体外细胞水平的生物安全性。如图5A 所示,随着浓度增高,R-133a@F1-5LNPs 和HR-133a@F1-5LNPs 处理组的HL1 心肌细胞的存活率略有下降,但仍大于90%。修饰HL1 心肌细胞膜的仿生载体HR-133a@F1-5LNPs 处理组细胞的存活率略高于R-133a@F1-5LNPs,并且两组均显著高于PEI/miR-133a 处理组的HL1 心肌细胞的存活率。采用25 μg/mL 的R-133a@F1-5LNPs、R-133a@HF1-5LNPs 和PEI/miR-133a 评估溶血率(图5B),PEI/miR-133a处理红细胞12 h 后,溶血率为25.4%;处理24 h 后,溶血现象更明显,溶血率可达52.3%,远高于生物材料允许的最大溶血率(5%)[28]。R-133a@F1-5LNPs 和HR-133a@F1-5LNPs 对红细胞产生的影响很小,处理24 h 后溶血率仍较低。同时,红细胞的形态也可被用于评估纳米颗粒溶血的发生情况。与PBS 处理组相比,PEI/miR-133a 处理组红细胞的形态发生了明显改变,而R-133a@F1-5LNPs 和HR-133a@F1-5LNPs 处理组红细胞的形态与PBS 处理组几乎没有差异(图5C),因此,相比于PEI 组,R-133a@F1-5LNPs 组细胞毒性低,尤其是细胞膜修饰后,基因载体的生物安全性明显提高。
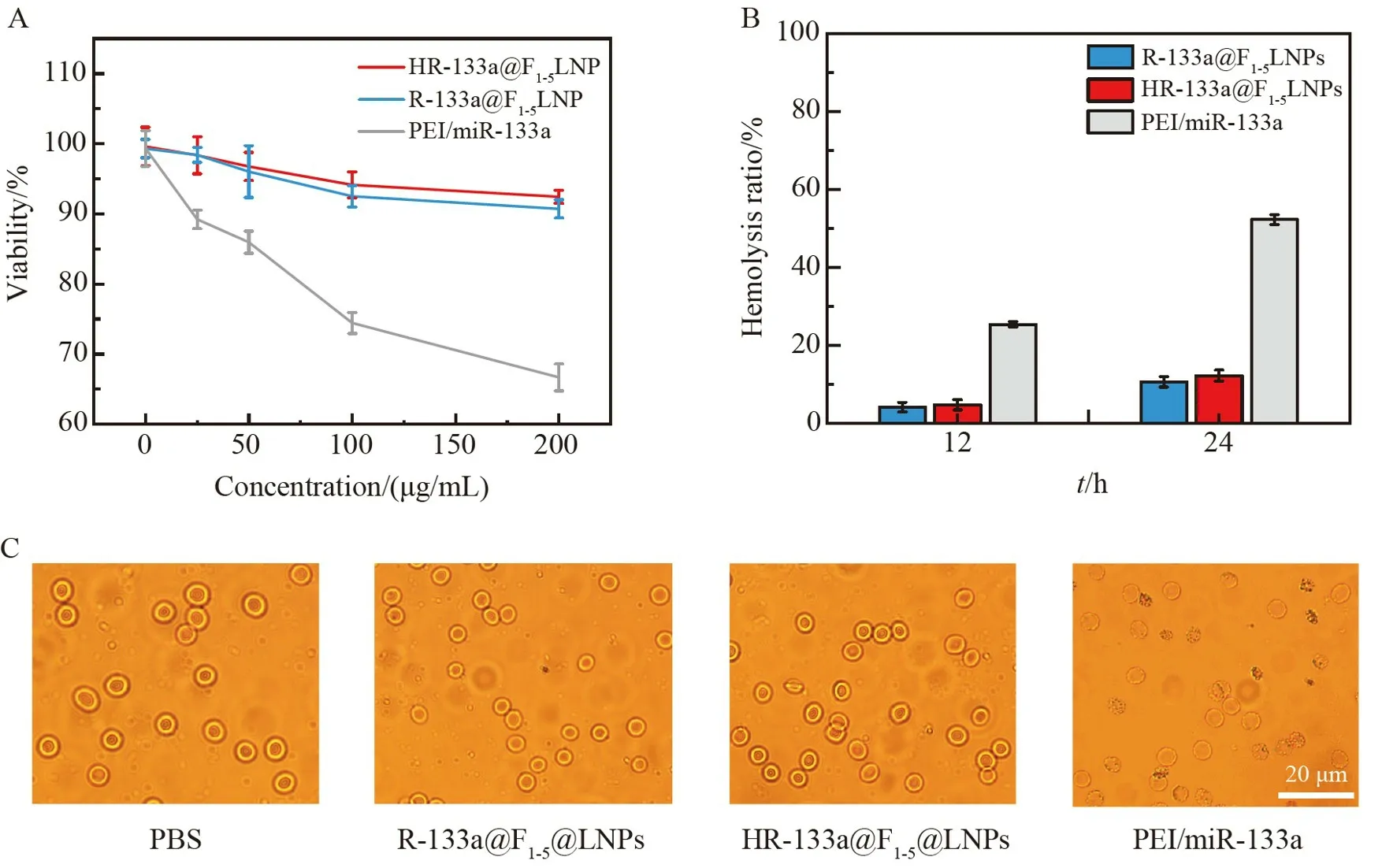
图5 (A)不同浓度的R-133a@F1-5LNPs、HR-133a@F1-5LNPs 和PEI/miR-133a 对HL1 心肌细胞的毒性作用;(B)25 μg/mL R-133a@F1-5LNPs、HR-133a@F1-5LNPs 和PEI/miR-133a 分别处理红细胞12 和24 h后,红细胞的溶血率变化;(C)25 μg/mL R-133a@F1-5LNPs、HR-133a@F1-5LNPs 和PEI/miR-133a 处理红细胞24 h 后红细胞形态Fig.5 (A)Cytotoxic effects of different concentrations of R-133a@F1-5LNPs,HR-133a@F1-5LNPs and PEI/miR-133a on HL1 cardiomyocytes;(B) Changes in hemolysis rate of red blood cells after treatment with 25 μg/mL R-133a@F1-5LNPs,HR-133a@F1-5LNPs and PEI/miR-133a for 12 h and 24 h,respectively;(C) Morphology of red blood cells after treatment with 25 μg/mL R-133a@F1-5LNPs,HR-133a@F1-5LNPs,PEI/miR-133a for 24 h,respectively
2.4 HR-133a@F1-5LNPs体外靶向性分析
采用不同浓度(1×10–5mol/L、1×10–6mol/L、1×10–7mol/L、1×10–8mol/L)的AngⅡ刺激HL1 心肌细胞48 h,探索诱导心肌细胞肥大的最佳药物浓度。qPCR 结果(图6A)显示,与对照组相比,不同浓度的AngⅡ刺激HL1 心肌细胞内的BNP 相对表达量均上调,其中,1×10–7mol/L AngⅡ组BNP 表达水平最高,差距具有统计学意义(p<0.01),表明1×10–7mol/L 可能是诱导心肌细胞肥大模型的AngⅡ最佳浓度。通过鬼笔环肽染色HL1 心肌细胞骨架观察其形态改变(图6B),与对照组相比,AngⅡ诱导HL1 心肌细胞的细胞面积显著增大,进一步通过软件Image J 测量细胞面积(图6C),也显示两者之间有显著差异(p<0.05)。

图6 (A)使用不同浓度AngⅡ刺激HL1 48 h 肥厚基因B 型利钠肽(BNP)的表达情况;(B)鬼笔环肽染色观察细胞形态改变;(C)使用Image J 软件对细胞面积进行统计分析结果,n=3,**p<0.01 vs Control;(D)肥厚性HL1 心肌细胞对R-133a@F1-5LNPs 和HR-133a@F1-5LNPs 的摄取情况Fig.6 (A)Expression of hypertrophy gene(B-Type natriuretic peptide,BNP)in HL1 cardiomyocytes after 48-h stimulation with different concentrations of AngⅡ;(B) Observation of cell morphology changes by Griffonia simplicifolia lectin staining;(C)Statistical analysis of cell area using Image J software,n=3,**p<0.01 vs Control;(D) Uptake of R-133a@F1-5LNPs and HR-133a@F1-5LNPs by hypertrophic HL1 cardiomyocytes
通过观察肥厚性HL1 心肌细胞中的荧光信号,评估细胞对R-133a@F1-5LNPs 和HR-133a@F1-5LNPs的摄取。miR-133a 携带Cy5 荧光,在646 nm 左右的激发光下可以发出红色荧光,包裹了心肌细胞膜的纳米颗粒HR-133a@F1-5LNPs 处理组中的红色荧光显著高于未包膜材料组(图6D),说明包裹HL1 心肌细胞膜后提高了HR-133a@F1-5LNPs 的靶向能力,体外实验验证了HR-133a@F1-5LNPs 具有更好的转染能力,可以更好地协助纳米颗粒进入细胞中。
2.5 HR-133a@F1-5LNPs的体外心肌肥厚治疗效果评价
为了验证HR-133a@F1-5LNPs 能否将miR-133a 递送至心肌细胞中并发挥作用,采用qPCR 测定心肌肥厚相关基因的mRNA 的表达水平。结果如图7A 所示,与PBS 对照组相比,HR-133a@F1-5LNPs 和R-133a@F1-5LNPs 处理组的RhoA mRNA 水平明显降低,相较于R-133a@F1-5LNPs 处理组,HR-133a@F1-5LNPs处理组表达水平更低。这表明HR-1 33a@F1-5LNPs 可将miR-133a 递送至心肌细胞中,并抑制了RhoA 的表达。

图7 (A)qPCR 检测HL1 心肌细胞经R-133a@F1-5LNPs 和HR-133a@F1-5LNPs 处理12 h 和24 h 后RhoA mRNA 的表达水平;(B)Western blot 检测HL1 心肌细胞经R-133a@F1-5LNPs、HR-133a@F1-5LNPs 和PEI/miR-133a 处理24 h 后RhoA 和蛋白表达水平(1:PBS,2:AngⅡ,3:AngⅡ+R-133a@F1-5LNPs,4: AngⅡ+HR-133a@F1-5LNPs,5:AngⅡ+PEI/miR-133a)Fig.7 (A)Detection of RhoA mRNA expression in HL1 cardiomyocytes after treatment with R-133a@F1-5LNPs and HR-133a@F1-5LNPs for 12 h and 24 h by qPCR;(B) Detection of RhoA protein expression levels in HL1 cardiomyocytes after treatment with R-133a@F1-5LNPs and HR-133a@F1-5LNPs for 24 h by Western blot
采用Western blot 方法检测了心肌肥厚细胞模型HL1 心肌细胞分别经R-133a@F1-5LNPs、HR-133a@F1-5LNPs 和PEI/miR133a 处理后RhoA 的蛋白表达水平(图7B)。与正常HL1 心肌细胞相比,在肥厚性的HL1 心肌细胞中RhoA 蛋白的表达明显增高,而R-133a@F1-5LNPs 和HR-133a@F1-5LNPs 处理组的心肌细胞中RhoA 蛋白的表达显著下降,基本恢复至正常水平;PEI/miR133a 处理组的RhoA 蛋白表达水平相较肥厚组细胞有所降低,但仍显著高于对照组。此结果表明,HR-133a@F1-5LNPs 可将miR-133a递送至HL1 心肌细胞内,抑制RhoA 蛋白的表达,具有诱导细胞结构重排的潜力,从而实现治疗心肌肥厚的目的。
3 结论
基于“模仿自然”和阳离子载体递送的优势,本研究采用心肌细胞膜修饰的方法制备了一种新型仿生阳离子基因递送载体HR-133a@F1-5LNPs,既保留了心肌细胞膜的同源靶向特性,又具备阳离子载体充分包裹miR-133a 和促进细胞内化的双重效应。在体外实验中,此载体能够特异性地将miR-133a 靶向递送至心肌细胞,表现出优异的递送效率,通过靶向结合RhoA 3′UTR 抑制RhoA/ROCK 信号通路,从而抑制了心肌细胞的重排和纤维化。此新型仿生递送系统改善了由压力超负荷而引起的心肌肥厚,为心肌肥厚的治疗提供了一种新的思路。
