铁调素敲除对雄性小鼠铁代谢及骨代谢影响的实验研究
2023-02-26刘禄林江小伟廖直斌赖长君张福生曹子厚刘午阳姬广林徐又佳
刘禄林 江小伟 廖直斌 赖长君 张福生 曹子厚 刘午阳 姬广林 徐又佳*
1. 赣南医学院第一附属医院骨科,江西 赣州 341000 2. 宁都县人民医院骨科,江西 赣州 3428003 3. 苏州大学附属第二医院骨科,江苏 苏州 215000
由于人口老龄化程度的不断加剧,骨质疏松症及其并发症已成为公共健康领域新的挑战[1]。骨质疏松症的原因很多,近年来研究[2-3]发现铁蓄积是骨质疏松症的一个独立危险因素。绝经后女性雌激素下降90 %,伴随血清铁蛋白提高2~3倍,升高的血清铁蛋白可能是I型骨质疏松症的重要致病因素[4]。一项针对1 729名健康绝经后女性和中年男性(年龄≥40岁)为期3年的队列研究[5]结果提示,血清铁蛋白水平与骨量丢失速率呈正相关。铁蓄积不仅对成骨细胞增殖、分化有抑制作用[6-7],还可促进破骨细胞分化和骨吸收[8],骨转换失衡最终导致骨质疏松。铁蓄积与骨质疏松发生的相关性被发现后,有报道表明降低铁水平可以改善代谢和骨微结构[9-10]。铁调素是调节机体铁吸收和利用的关键分子[11]。本团队对小鼠进行铁调素基因敲除,发现7月龄时小鼠出现明显铁蓄积和骨量下降,主要表现为成骨细胞活性受抑制[12]。然而,慢性和持续性铁蓄积对骨代谢的影响尚不清楚,尤其是在老年状态下。因此,本研究利用铁调素基因敲除小鼠构建内源性铁蓄积小鼠模型(KO组),将其与野生型(WT组)小鼠比较,观察两组小鼠7、12、18月龄时铁代谢指标和骨量变化,探究骨转换指标和氧化应激水平的变化,初步探讨慢性持续性铁蓄积对骨代谢的动态影响。
1 材料和方法
1.1 材料
1.1.1研究材料:铁调素基因敲除小鼠购自苏州大学-剑桥基因组资源中心;微型计算机断层(Micro-CT,SKY-SCAN公司,比利时);多功能酶标仪(Biotek公司,美国);Elisa试剂盒:血清铁调素 (武汉伊莱瑞特公司)、血清铁蛋白(英国ABCam公司)、OCN(美国Cloud-Clone 公司)、CTX(美国Cloud-Clone 公司)水平;血清MDA(中国南京建成公司),SOD(中国南京建成公司)。
1.1.2研究对象:参照文献[12]将铁调素基因敲除杂合子小鼠进行杂交,产生敲除型(KO组)和野生型(WT组)后代,选取雄性小鼠作为研究对象,经基因鉴定后进行分笼饲养。在7、12、18月龄时每组选10只小鼠,麻醉后收集小鼠血清、肝脏、股骨及胫骨标本。
1.2 研究方法
1.2.1骨铁浓度:采用原子吸收光谱法测定胫骨铁含量。将胫骨样品用盐水冲洗几次,然后在110 ℃的烤箱中过夜干燥。准确测量干重后将干燥的样品在马弗炉中550 ℃下灰化,然后溶解在王水酸中,根据原子吸收法测定铁浓度。
1.2.2普鲁士蓝肝脏铁染色:将肝组织用含10 %甲醛缓冲液固定,经乙醇梯度脱水后包埋制成石蜡切片,用普鲁士蓝染色液(核固红法)对肝铁进行染色。
1.2.3Micro-CT扫描检测小鼠股骨微结构:取小鼠左侧股骨,剔除骨周围肌肉等软组织。将股骨标本及时置于Micro-CT样品检测板中进行适当固定,并行精准扫描。股骨远端感兴趣区(ROI)扫描条件和参数参照文献[8]。
1.2.4血清中铁调素、铁蛋白、氧化应激和骨转换标志物的测定:将两组小鼠完全麻醉后,经小鼠内眦静脉取适量血液,室温静置2 h后,4 ℃,3 000 r/min,离心20 min,取上清即为血清标本。采用酶联免疫吸附法(ELISA)检测小鼠血清铁调素、铁蛋白、OCN、CTX。采用组织化学反应法检测SOD、MDA水平。按照各种试剂盒说明书步骤进行操作。
1.3 统计学方法
所有数据均采用SPSS 21.0统计软件进行统计学处理,数据以均数±标准差表示,组间比较采用t检验。检验水准α值取双侧0.05。经处理后的数据使用GraphPad Prism5软件进行图像编辑。
2 结果
2.1 小鼠体重、铁代谢指标相关结果
与WT组小鼠相比,KO组小鼠发育正常,且小鼠的饮食、睡眠、活动、毛发色泽等无异常迹象。如图1A所示,在7、12、18个月各时间观察点,同一观察节点时间比较两组小鼠的体重无显著差异。为验证Hepc1基因敲除的效果,采用ELISA检测血清铁调素水平,KO组小鼠各时间点铁调素均显著低于同期的WT组小鼠(图1B)。反映机体铁存储水平的血清铁蛋白在KO组小鼠则明显高于同期的WT组小鼠(图1C)。此外,在本研究中也观察到骨组织铁含量在KO组小鼠均显著高于WT组小鼠(图1 D)。铁调素敲除后铁调素水平下降,血清铁和组织铁含量明显升高,结果提示内源性铁蓄积小鼠模型成功构建。

图1 小鼠体重和铁代谢指标结果Fig.1 Results of body weight and iron metabolism related indices in mice注:A:体重;B:血清铁调素;C.:血清铁蛋白;D:骨铁浓度。与WT小鼠相比,*P<0. 05。
2.2 小鼠普鲁士蓝肝铁染色
肝脏普鲁士蓝染色提示KO组小鼠肝脏切片铁沉积在3个时间点均明显增高(图2),提示铁调素基因敲除后,小鼠肝脏逐渐出现铁蓄积,该结果进一步说明内源性铁蓄积模型的成功构建。

图2 肝脏普鲁士蓝铁染色图 (×40)Fig.2 Prussian blue staining of iron in liver (×40)
2.3 股骨Micro-CT扫描检测结果
为了评估铁超载对骨微结构的影响,对骨小梁和皮质骨进行了显微CT分析。从三维立体图可以看出随着年龄增大,WT组小鼠松质骨骨小梁逐渐疏松,而KO组小鼠较同期WT组小鼠骨小梁数量更少、骨小梁间隙更大(图3A、3B)。进一步三维CT数据分析表明,较同期WT组小鼠,KO组小鼠BMD明显降低,BV/TV、Tb.N、Tb.Th、ConnD减小,Tb.Sp、SMI增大;皮质骨三维数据分析提示和同期WT组小鼠相比,KO组小鼠皮质外径周长没有明显区别,而内径周长增大,皮质骨面积明显减小(表1)。
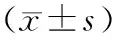
表1 小鼠股骨远端微结构参数三维分析Table 1 Three-dimensional analysis of microstructural parameters of distal femur in

图3 股骨远端松质骨和皮质骨Micro-CT三维重建Fig.3 Three-dimensional reconstruction of cancellous and cortical bone of the distal femur by Micro-CT注:A:松质骨;B:皮质骨。
2.4 血清骨转换指标和氧化应激指标
KO组小鼠在7、12、18个月三个时间点的OCN水平均显著低于WT组小鼠(图4A);而两组小鼠的CTX水平在7月龄时无明显区别,在12、18月龄时KO组小鼠均显著高于WT组小鼠(图4B),提示内源性铁积累同时合并骨吸收活性增强、骨形成水平抑制。本研究同时检测了氧化应激水平,KO组小鼠三个时间点的氧化指标MDA明显高于WT组小鼠(图4C),而抗氧化指标SOD则呈相反趋势(图4D)。
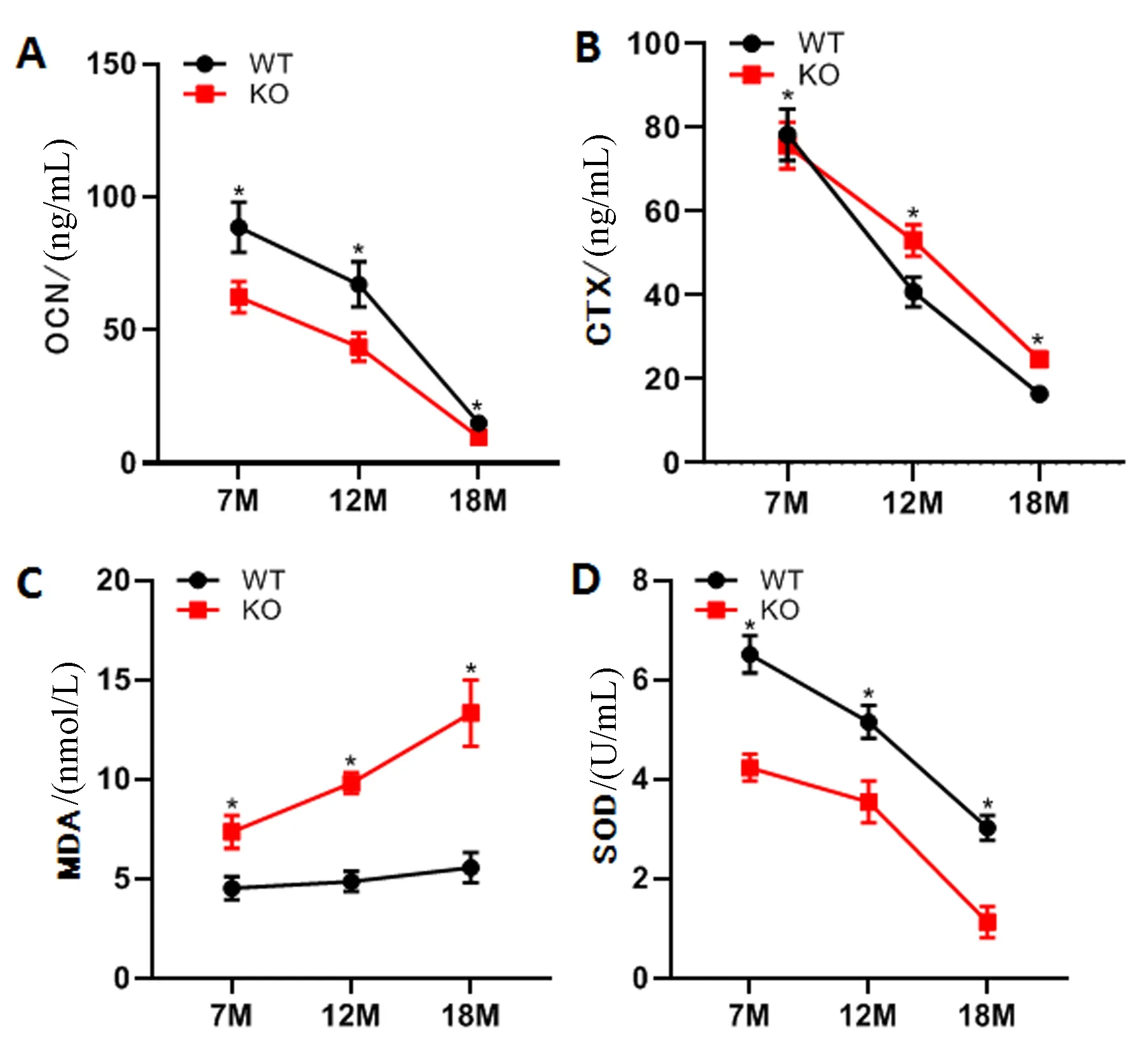
图4 小鼠骨转换指标和氧化应激指标结果Fig.4 Results of bone turnover index and oxidative stress index in mice注:A:血清骨钙素;B:血清I型胶原羧基末端肽;C:血清丙二醛;D:血清超氧化物歧化酶。与WT小鼠相比,*P<0. 05。
3 讨论
近年来的研究[3,13]表明骨代谢异常与机体铁蓄积有关。通过基因工程敲除铁代谢相关基因得到的内源性铁蓄积模型稳定可靠、结果更加准确[7]。在本研究中,大致模仿了人类的青年期、成年期、老年期,观察铁调素基因进行敲除后小鼠7、12、18月龄时铁代谢和骨代谢相关指标的变化。而且,由于雌激素和铁调素之间存在潜在直接调控关系[4],为排除雌激素影响,将雄性小鼠作为研究对象。本研究发现铁调素敲除组雄性小鼠铁调素明显下降,组织呈现明显的铁蓄积状态。随着小鼠月龄增大,组织铁呈渐进性累积,但两组小鼠在饮食、睡眠、活动或体重方面没有显著差异。这些表型证实这是研究机体慢性铁蓄积的成功模型。对股骨显微CT扫描发现KO组小鼠的骨密度较正常组小鼠显著下降,同时骨小梁分析参数发生了相应的变化,骨体积分数、骨小梁数目下降及骨小梁间隙增加。研究结果表明铁蓄积能显著降低小鼠的骨量和干扰正常骨微结构,与相关文献报道一致[12]。
骨重塑包括破骨细胞去除旧骨以及成骨细胞促进新骨的形成。本研究进一步检测了骨转换指标OCN和CTX。纵向比较发现WT组和KO组小鼠随着月龄增大,OCN和CTX均逐渐减少,说明随着增龄骨转换水平降低。而两组小鼠横向比较,KO组小鼠各时间点OCN均低于WT组小鼠;CTX水平除了在7月龄时无明显差异,在12、18月龄时KO组小鼠均高于WT组小鼠,说明铁蓄积抑制了成骨的同时且促进了破骨活性。对原代小鼠祖细胞和小鼠成骨细胞系的研究[14]表明,铁可抑制成骨细胞的生成、分化和功能。同时,铁蓄积还可通过刺激mTOR水平的升高抑制“骨形成和血管生成偶联”导致骨量下降[7]。成熟破骨细胞发挥骨吸收功能过程需要大量线粒体提供高能量来完成[15]。铁摄取可通过增加PGC-1 beta表达、ROS生成和线粒体数量刺激破骨细胞分化和骨吸收[16]。而铁稳态的关键调节因子铁调素通过降铁可逆转这种效应[10]。
本次研究同时观察了氧化应激指标。在本实验模型中,小鼠体内的ROS水平显著升高,在小鼠老龄时尤为明显,可能有两个主要原因。一方面,ROS主要产生于线粒体代谢,会随着年龄的增长而积累[17];另一方面,衰老细胞通常会积累大量的细胞内铁(高达30倍)[18],铁可介导Fenton反应产生氧化应激,因此衰老的因素及内源性铁蓄积综合导致了小鼠老龄时ROS水平升高[19]。活性氧的积累被认为是破坏骨内稳态的一个重要因素,包括抑制成骨细胞的活动、促进其凋亡[6],且可通过激活参与破骨细胞功能的关键途径加速破骨细胞的再吸收[16]。
综上所述,铁调素基因敲除后小鼠出现慢性累积性铁蓄积,铁蓄积可刺激氧化应激水平提高,并通过抑制成骨活性、促进破骨吸收而加重骨量丢失。
