骨质疏松症和动脉粥样硬化机制及“异病同治”分析
2023-02-26祁亮莫亮卫杨文祥庞智晖
祁亮 莫亮 卫杨文祥 庞智晖
广州中医药大学第一附属医院,广东 广州 510405
越来越多的证据[1-2]表明血管系统疾病和骨代谢相关,有学者提出“骨-血管轴”这一概念,认为骨组织和血管系统之间存在双向流动的细胞、内分泌和代谢因子等信号,可以双向调控骨和血管代谢。当骨-血管轴平衡被扰乱时,骨骼和血管系统疾病会同时发生。骨质疏松症(osteoporosis, OP)和动脉粥样硬化(atherosclerosis, AS)是临床上常见的骨骼和血管系统疾病,并常常同时出现[3]。大量研究[4]表明OP和AS之间存在直接联系,骨密度和动脉硬化程度呈负相关,然而对其具体的分子机制目前仍知之甚少。因此,本研究拟通过生物信息学整合OP及AS的基因数据,从分子层面阐述OP和AS间的相互影响机制,并基于中医学“异病同治”思想,在已知二者共同机制的前提下,尝试基于二者共同基因的关键靶点,筛选具有防治作用的中药,以期为后续临床应用及实验研究提供理论支持。
1 材料和方法
1.1 疾病靶点获取
分别以骨质疏松症(osteoporosis)和动脉粥样硬化(atherosclerosis)为关键词在疾病数据库GeneCards(https://genealacart.genecards.org)、DISEASES (https://diseases.jensenlab.org/) 和CTD (http://ctdbase.org/)中获得疾病相关靶点。通过韦恩图分别对三个数据库获得的疾病靶点取交集,再将两组疾病靶点映射获得OP和AS的共同疾病靶点。
1.2 PPI网络构建及关键靶点的筛选
将取得的共同疾病基因导入STRING数据库(https://string-db.org/)[5],限定物种为“Homo sapiens”,置信度(confidence score)≥0.4,得到相应数据,并使用Cytoscape软件[6]构建蛋白互作网络(protein-protein interaction network,PPI网络)。通过使用Cytoscape的cytoHubba插件来识别关键基因。分别使用八种常用算法(MCC、 MNC、 Degree、Closeness、Radiality、 Stress、 EPC、 Betweenness)获取排名前20的基因,再通过韦恩图获得关键基因。
1.3 功能富集分析
为了探讨OP和AS共同基因的潜在作用,应用Metascape在线网站[7](http://metascape.org/)对疾病基因进行GO(gene ontology)和KEGG(Kyoto Encyclopedia of Genes and Genomes)功能富集分析。P<0.01被认为差异具有统计学意义,并通过在线绘图网站(http://www.bioinformatics.com.cn/)绘制气泡图展示排名靠前通路。
1.4 中药筛选
将“1.2”项下获得的关键基因作为预测靶标,在医学本体信息检索数据库(Coremine Medical)中按照P<0.05且药物被《中华人民共和国药典》收录条件,筛选对关键基因具有生物学的中药。
2 结果
2.1 疾病共同靶点
利用GeneCards、DISEASES和CTD数据库收集OP和AS相关疾病靶点,通过韦恩图取交集,最终获得OP相关靶点315个(图1A)、AS相关靶点481个(图1B)、OP和AS共同靶点202个(图1C),表明二者之间存在大量共同基因,在发病机制上具有相通性。共同靶基因列表见表1。
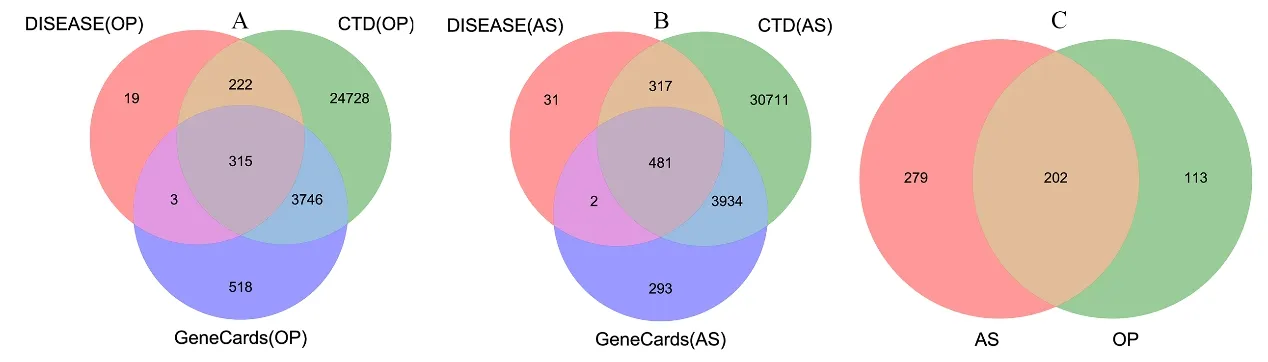
图1 OP及AS的疾病靶点韦恩图Fig.1 Venn diagram of OP and AS related gene targets注:A:OP相关靶点;B:AS相关靶点;C:OP和AS共同靶点。

表1 OP和AS的共同靶基因列表Table 1 The list of the common target genes of OP and AS
2.2 靶基因功能富集分析
通过Metascape在线网站对靶基因进行功能富集分析,以P<0.01为筛选条件并按P值从小到大排列。其中OP和AS 各自的KEGG通路富集分析结果见表2。通过气泡图展示OP和AS共同靶基因KEGG富集分析P值排名前15位的结果,主要涉及通路有细胞因子-细胞因子受体相关作用、PI3K-Akt信号通路、Th1和Th2细胞分化、Th17细胞分化、流体剪切应力与动脉粥样硬化和MAPK信号通路等(图2A)。将GO富集分析得到生物过程(biological process,BP)、分子功能(molecular function,MF)、细胞组分(Cellular Component,CC)富集结果P值排名前5位的通过气泡图展示(图2B)。发现共同靶基因的生物过程主要涉及对激素的反应、对细胞因子的反应、对肽的反应和细胞对脂质的反应;其影响的分子功能主要定位在受体-配体活性、信号受体激活剂活性、细胞因子活性和生长因子活性;参与了囊腔、细胞外基质、分泌颗粒腔和胞质囊腔等细胞组分。

表2 OP和AS各自靶点KEGG通路富集分析结果Table 2 The list of KEGG pathway analysis results of OP and AS, respectively
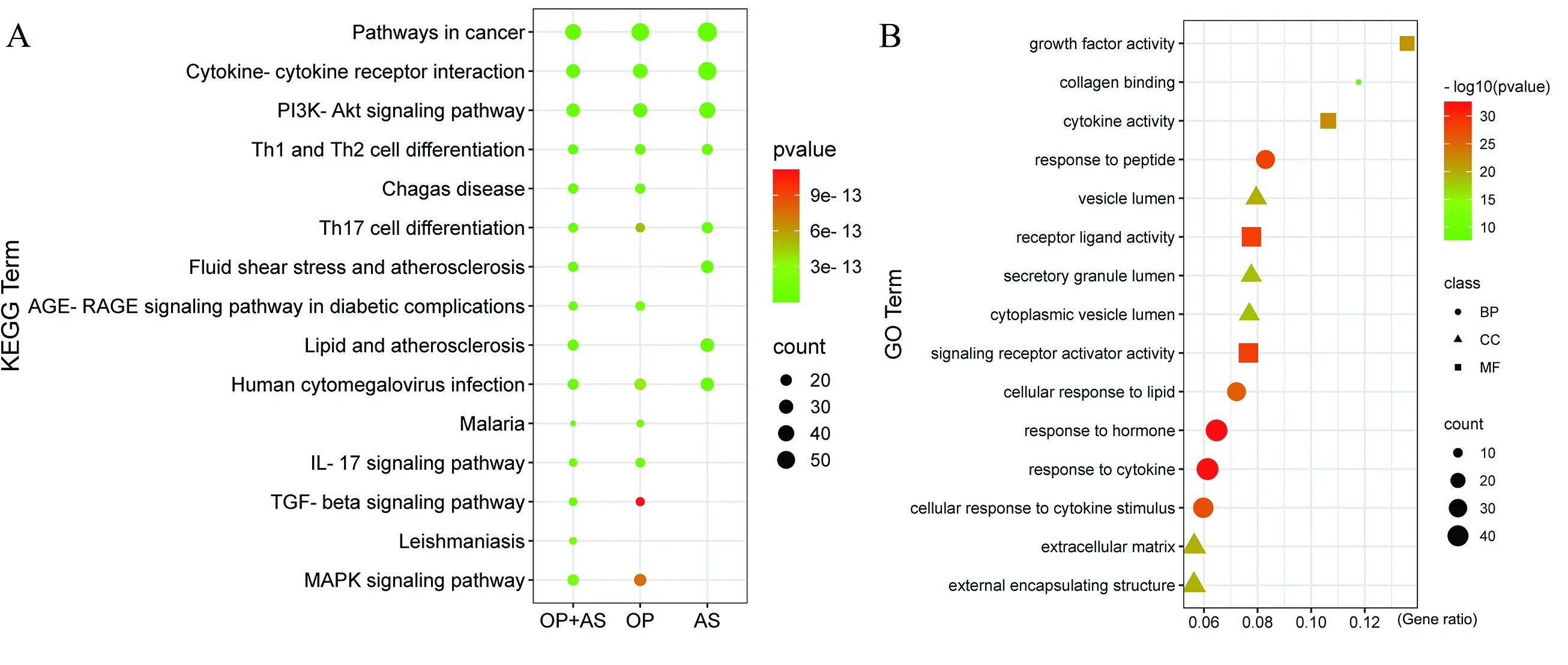
图2 OP和AS共同靶基因功能富集分析Fig.2 Enrichment analysis of common gene targets between OP and AS注:A:KEGG富集分析结果;B:GO富集分析结果。
2.3 PPI网络构建及关键基因筛选
将202个疾病共同靶基因导入STRING数据库,获得200个靶蛋白的互作网络,共1 697条边(图3A)。CytoHubba是cytoscape软件用于识别关键基因的插件,提供了12种分析算法来计算PPI网络图中的关键基因。利用其中八种算法(MCC、 MNC、 Degree、Closeness、Radiality、 Stress、 EPC、 Betweenness)筛选出10个重叠的关键基因,分别为CD4、 TLR2、 TIMP1、 CCL2、 APOE、 GAPDH、 NFKBIA、 IL4、CRP和TGFB1(图3B和图3C),关键基因信息及注释见表3。

图3 OP-AS共同靶基因PPI网络及关键基因筛选Fig.3 PPI network of common gene targets between OP and AS and the screening of hub gene targets注:A:共同靶基因PPI网络;B:八种算法的韦恩图;C:关键基因PPI网络。
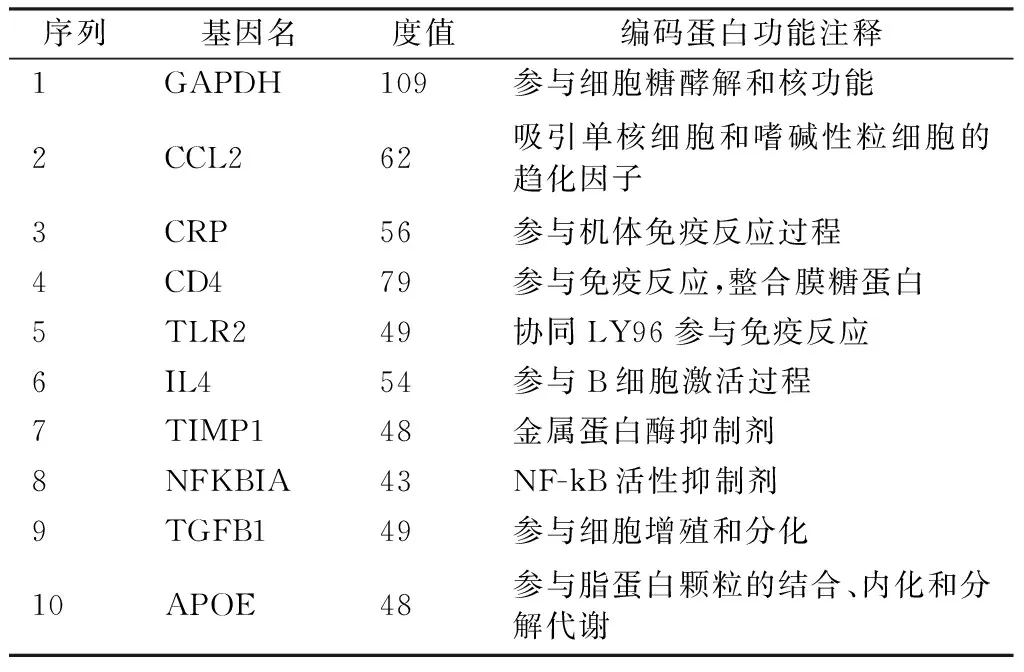
表3 关键基因信息表Table 3 The information sheet of hub genes
2.4 OP-AS异病同治的中药分析
将获得的10个关键基因导入Coremine Medical数据库,经筛选获得9味与关键基因相关的中药,包括黄芩(P=0.005 46)、人参花(P=0.006 78)、人参芦(P=0.006 79)、人参叶(P=0.006 79)、人参(P=0.006 83)、丹参(P=0.011 1)、三七(P=0.015 5)、三七叶(P=0.016 1)和三七花(P=0.016 1)。
筛选出的9味中药中,人参花、人参芦、人参叶和人参同属五加科人参不同药用部分,其根茎部分(人参)在临床上应用最广。三七叶、三七花和三七同属五加科三七不同药用部分,其根茎部分(三七)在临床上应用也最广范。因此,检索了黄芩、人参、丹参和三七四味中药在防治OP或AS上的相关研究(表4),结果表明它们在单病种上的防治作用已被证实,需进一步研究其在OP-AS共病中的干预作用。
3 讨论
有研究[27]指出全身免疫和炎症反应可能是加速动脉斑块形成和骨吸收的主要驱动因素。本研究发现共同靶基因大量富集在辅助性T细胞(Th1、Th2和Th17)分化及炎症因子TGF-β和白细胞介素(IL)-17通路上。T细胞是核因子κB受体活化因子配体(RANKL)和肿瘤坏死因子-α(TNF-α)的主要来源。当机体发生免疫反应时,活化的T细胞过表达RANKL和炎症因子诱导破骨细胞形成引起骨丢失[28]。AS是一种大中型动脉的慢性炎症性疾病,和免疫、炎症反应关系密切[29]。研究表明T细胞中CD4+T细胞(包括Th1、 Th2、Th17和调节T细胞)相较于CD8+T细胞与AS关系更为密切[30],其中Th1细胞通过分泌炎症因子(IL-2、IL-3和TNF-α)促进AS的形成并且是斑块中最主要的Th亚型[31]。靶向抑制T细胞增殖和Th1因子的产生可减少AS病变内的T细胞浸润,从而延缓病变发展[32],然而尚无研究表明控制炎症反应可同时干预OP和AS的进展。脂质代谢通路也被显著富集,与其相关的血脂异常已被大量研究证实是OP和AS共有的危险因素[33],血清胆固醇和低密度脂蛋白升高在导致动脉斑块形成的同时会抑制成骨细胞分化[34]。氧化低密度脂蛋白(Ox-LDL)可促进泡沫细胞生成,同时可激活Wnt /β-catenin等通路,促进钙化因子和血管平滑肌细胞成骨性转化,启动和促进骨组织血管钙化进程,加速OP和AS病程[35]。此外,PI3K-Akt和MAPK信号通路也被显著富集。PI3K-Akt通路与炎症反应关系密切,其通过抗骨细胞凋亡与OP相关联[36],同时与AS斑块中巨噬细胞自噬引起的炎症相关[37]。激活PI3K-Akt通路可以保护骨小梁结构,下调破骨细胞分化[38],同时降低ApoE-/-小鼠血脂水平并稳定易损斑块[41]。MAPK通路是调节破骨细胞代谢的主要通路,JUK和p38的磷酸化是破骨细胞分化和增殖的关键因素[40],其同时又参与了内皮细胞激活、诱导炎性因子分泌和黏附分子聚集,与AS的病理进展关系密切[41]。研究证实抑制MAPK信号通路可延缓OP[42]或AS[43]疾病的进展,但目前尚无研究表明二者可同时从MAPK抑制剂中获益。
获得的10个关键靶点中,如表3所示,大部分靶点与免疫炎症反应关系密切,值得一提的是TIMP1和APOE基因在共病机制中的作用。TIMP1属于基质金属蛋白酶(MMP)活性抑制剂,MMP与破骨细胞活性增加相关[44],同时其在粥样硬化斑块中的表达水平也明显升高[45]。最新研究发现MMP-9与血脂异常标志物及骨转换标志物显著相关,可作为OP-AS疾病偶联的关键因子[48]。而MMP的活性受TIMP1的调节,TIMP1基因缺陷小鼠AS病变进展加快[47],激活TIMP1的表达可抑制雌激素缺乏诱导的成骨细胞凋亡[48]。APOE基因主要编码载脂蛋白E,与人体血脂代谢关系密切,ApoE(-/-)小鼠常用于制备AS动物模型[49],同时APOE可通过调节骨钙素羧化和Wnt信号通路影响骨代谢[50]。因此调控TIMP1和APOE有望成为未来干预OP-AS共病的新靶点。综上所述,不难看出OP和AS之间存在密切联系,涉及免疫炎症反应、脂质代谢、PI3K-Akt和MAPK等相关通路及TIMP1和APOE等核心靶点,然而很少有学者研究相关通路或靶点对OP和AS的共同影响,本研究为OP和AS共同机制及靶点的挖掘提供了一定的线索。
OP属于祖国医学中“萎证”范畴,病变在骨,其本在肾;AS属于“脉痹”范畴,病变涉及心、脑、肾及全身脉管。中医认为二者共同病因病机主要涉及络脉病变、血液浊化和心肾不交三个方面[51]。心主血脉,五行属火,肾主骨,五行属水。《理虚元鉴》载记: “心肾不交….体倦骨痿”。心(血脉)与肾(骨)的功能互相影响,这一理念即符合中医整体观念,又与现代医学“骨-血管轴”这一概念不谋而和。“异病同治”是中医学整体观念的体现,鉴于OP和AS在基因层面及中医病机上具有广泛相通性,尝试通过二者之间的关键基因预测异病同治相关中药。
根据预测结果,共获得9味中药,都归属于活血化瘀药及补虚药两类,符合二者虚实夹杂的病机。其中人参花、人参芦、人参叶、三七花和三七叶在临床上较少使用,关于其活性成分及功效的研究亦较少,因此本研究重点探讨了另外四味中药及其活性成分对OP和AS的防治作用。目前临床上常用的他汀类药物在调节血脂、防止斑块形成同时,对增加骨密度、减少骨折也有积极影响,但一定程度上对骨髓干细胞产生不良影响[52]。最新研究发现丹参可通过调节骨代谢和血脂水平,同时干预OP和AS的进展,然而并未揭示其具体分子机制[53]。本研究通过检索文献发现大量研究证实了黄芩、人参、丹参和三七四味中药对OP和AS的干预作用,然而具体的药物活性成分有所差异。中药具有“多成分、多靶点”特点,药理作用广泛,探讨同一味中药或不同中药组成的复方对OP和AS的共同干预作用及同一活性成分对OP和AS的共同干预作用、明确药物的作用机制将是本团队未来研究的重点。
