破骨细胞分化信号传导及相关天然化合物的研究进展
2023-02-26屈泽超王栋冯铭哲高翔成张波弓伊宁孔令擘闫亮
屈泽超 王栋冯铭哲 高翔成 张波弓伊宁 孔令擘 闫亮
1.延安大学医学院,陕西 延安 716099 2.西安交通大学附属红会医院脊柱外科,陕西 西安 710054
骨稳态是通过破骨细胞(osteoclasts,OCs)介导的骨吸收与成骨细胞(osteoblasts,OBs)介导的骨形成来动态调节的,促使骨的各项指标及功能在生理范围内保持平衡[1]。骨质疏松症(osteoporosis,OP)是最常见的骨骼疾病,是一种以骨密度降低,骨组织微结构破坏,导致骨脆性增加,易发生骨折为特征的全身代谢性骨病[2]。OP发病原因主要包括内分泌因素、遗传及免疫因素、营养因素、性别及年龄因素、疾病及药物因素、失用及环境因素等[3-4],其中OCs分化异常是引起OP的关键病理基础[5-6]。OCs是起源于造血干细胞的单核/巨噬细胞系,受多种激素和局部细胞因子调节分化,其中核因子κB受体活化因子配体(receptor activator of nuclear factor-κB ligand,RANKL)与巨噬细胞集落刺激因子(macrophage colony stimulating factor,M-CSF)是OCs分化的主要关键分子[7]。M-CSF在早期OCs前体细胞的存活和增殖中起着关键作用[8]。核因子κB受体活化因子(receptor activator of nuclear factor-κB,RANK)属于肿瘤坏死因子受体家族蛋白,表达于OCs前体、成熟OCs以及树突状细胞等表面[9],其分化的关键步骤是OBs产生的RANKL与OCs前体细胞上受体RANK结合启动下游级联传导信号,RANK的胞浆区募集并活化衔接蛋白肿瘤坏死因子受体相关蛋白6(tumor necrosis factor receptor associated factor,TRAF6),激活的TRAF6触发下游NF-κB、MAPKs、PI3K/AKT、钙信号和活性氧等通路的活化[7,10-11]。这些信号通路最终导致OCs分化的主要转录因子NFATc1和c-Fos的表达并引起OCs分化相关基因,例如OCs相关受体(osteoclast-associated receptor,OSCAR)、抗酒石酸酸性磷酸酶(tartrated resistant acid phosphatse,TRAP)、基质金属肽酶-9(matrix metallopeptidase-9,MMP-9)、OCs刺激跨膜蛋白(osteoclast stimulatory transmembrane protein,OC-STAMP)、整合素β3(integrin β3)和组织蛋白酶K(cathepsin K,CTSK)等的表达[12]。综上所述,RANKL是诱导OCs分化的重要调控因子,其相关下游信号通路已成为调控OCs分化形成的潜在靶点,RANKL-RANK信号通路在OCs的形成和功能中起着关键作用。详见图1。

图1 RANKL诱导破骨细胞的分化Fig.1 RANKL induced osteoclastogenesis
在过去20年中,用于治疗OP的药物主要有双膦酸盐(bisphosphonates,BPs)、雌激素补充疗法(estrogen therapy,ET)、甲状旁腺素类似物(parathyroid hormone analogue,PTHa)和狄诺塞麦等[13]。然而,近年来文献报道长期使用这些药物会引起一些不良反应,可能不适合作为口服药物。BPs是目前临床上治疗OP的一线药物,虽然总体评价较高,但长期使用后会出现急性期反应、胃肠道不适和眼部不适等,并在2003年首次提出使用BPs会引起颌骨坏死,同时会增加食管癌的患病率[14-15]。ET已成为治疗OP的二线方案,总体上应用较安全,但长期使用也会出现雌激素依赖性肿瘤、血栓性疾病和致死性脑卒中等[16]。PTHa是治疗绝经后骨质疏松症的一种新方法,其不良反应主要为嗜睡和腰背四肢痛等,严重会引起骨肿瘤的产生[17]。狄诺塞麦是唯一获批靶向作用于RANKL的拮抗药,能抑制RANKL与其受体RANK的结合,减少OCs形成与活化,降低骨吸收,然而文献报道长期使用会引起高钙血症,增加原发性恶性肿瘤风险,同时会出现下颌骨坏死或非典型性股骨骨折[18]。因此,寻找高效低毒的抗骨质疏松药物具有重要的临床意义和医学价值。近年来,对于天然化合物的研究日益增加,天然化合物主要作用于RANKL诱导OCs分化下游相关通路,对于OCs的抑制作用还可能在于它们的抗炎和抗氧化特性能够优化骨骼健康。本文旨在总结RANKL及其下游信号通路在OCs分化中的最新研究进展,为以RANKL为药物靶点治疗OP提供进一步的认识。此外,笔者将简要介绍几种天然化合物通过调节RANKL相关信号通路而抑制OCs分化及其对骨质疏松的预防作用。
1 RANKL介导的相关经典信号通路
1.1 RANKL/NF-κB信号通路
在RANKL激活下游信号通路的早期阶段,NF-κB对OCs的分化起重要调控作用。Jimi等[19]研究表明NF-κB基因敲除的小鼠模型由于OCs形成受限而表现出严重的骨硬化病,证明NF-κB的活化是OCs形成所必需的细胞因子。NF-κB是一个二聚体转录因子家族,在静息状态下,NF-κB在细胞质中以p50/p65两个亚单位的异源二聚体形式存在,并与抑制剂IκB结合形成复合物。IκB的磷酸化是NF-κB级联激活的先决条件,它受IκB激酶(IKKs)复合物调控,IKKs复合物磷酸化IκB,使IκB蛋白酶体降解,从IκB中释放出的活性NF-κB二聚体易位到细胞核内,并引起OCs分化特异性基因的转录与表达[20]。
1.2 RANKL/MAPK信号通路
丝裂原活化蛋白激酶(mitogen-activated protein kinases,MAPKs)信号通路也参与了多种细胞活性,如基因表达、有丝分裂、分化、增殖和转化等。主要由3个激酶组成:细胞外信号调节激酶1/2(extracellular signal-regulated kinase,ERK1/2)、氨基末端激酶(Jun N-terminal kinase,JNK)和p38-MAPK,均可被RANKL刺激活化。RANKL与OCs前体上受体RANK结合,激活MAPKs相关信号分子,进一步诱导转录因子NFATc1和AP-1等的表达,促进OCs分化[21]。p38-MAPK信号通路在OCs分化的早期阶段尤为重要,它促进小眼球相关转录因子(micropthalmia-associated transcription factor,MITF)和TRAP的表达,驱动下游因子的激活[22-23]。
1.3 c-Src/PI3K/Akt信号通路
RANK-TRAF6复合物可以招募Src激酶家族进而诱导PI3K/Akt信号级联的激活。c-Src激酶作为Src家族的一个成员,对OCs的分化形成和成熟OCs的骨吸收功能至关重要。c-Src刺激磷脂酰肌醇-3激酶(phosphatidyl inositol 3-kinase,PI3K),活化的PI3K I型可磷酸化磷脂酰肌醇4,5-二磷酸(phosphatidylinositol 4,5-bisphosphate,PIP3)。PIP3是许多细胞表面受体用来控制细胞有丝分裂、生长、存活和分化的“第二信使”,进一步招募丝氨酸/苏氨酸激酶(serine/threonine kinase,Akt)表达到质膜上。PI3K/Akt信号可靶向使Smad1/5和CBP(CREB结合蛋白)关联,调节OBs中M-CSF的表达,刺激OCs分化[24-26]。Moon等[27]发现过表达Akt可以促进GSK3β的非活性形式形成和NFATc1的核定位,Akt可以通过激活 GSK3β/NFATc1信号轴诱导OCs的生成。Kawamura等[28]研究表明Akt1是OBs和OCs的关键调控因子,通过促进OBs和OCs的分化和存活来维持骨量和骨转化。
1.4 Ca2+信号通路
Ca2+信号在OCs生成中对细胞增殖、分化、基因转录和骨吸收等多种功能具有重要意义[29]。RANKL诱导的钙振荡与OCs分化、骨基质吸收和凋亡等密切相关。在OCs形成的早期阶段,RANKL会刺激磷脂酶Cγ(phospholipase Cγ,PLCγ),活化的PLCγ在细胞质中产生1,4,5-三磷酸肌醇(1,4,5-triphosphate,IP3)。IP3通过诱导内质网存储钙的释放,直接增加细胞内Ca2+水平,Ca2+通过store-operated Ca2+entry(SOCE)和瞬时受体电位通道流入,持续的钙信号进而诱导NFATc1转位到细胞核中,进一步上调靶基因和蛋白表达,促进OCs分化形成[30-31]。
1.5 ROS效应
正常机体代谢可以产生活性氧(reactive oxygen species,ROS),是由烟酰胺腺嘌呤二核苷酸磷酸氧化酶(nicotinamide adenine dinucleotide phosphate oxidase,NOX)内源性产生,或由线粒体电子传递链的副产物所产生[32]。ROS包含超氧阴离子自由基(O2·-)、过氧化氢(H2O2)、羟基自由基(-OH)和一氧化氮(NO)[33]。生理状况下,ROS能调控细胞内环境稳态、信号转导、促进免疫、细胞增殖等生理活动,与抗氧化剂处于动态平衡状态。然而,过量的ROS通过降低抗氧化酶水平,阻止OBs分化和OCs形成而破坏骨。在OCs分化过程中,NADPH氧化酶1将电子从NADPH转移到分子氧中而形成ROS[34]。ROS还可通过间接激活MAPK、PI3K和NF-κB的活化,驱动CTSK、MMP9、c-Fos和NFATc1等基因表达促进OCs的分化成熟。此外,Kelch样环氧氯丙烷相关蛋白1/核因子E2相关因子2(nuclear factor E2-related factor 2,Nrf2)/抗氧化反应元件信号通路与氧化应激密切相关,是细胞内抗氧化应激机制之一,可通过增加抗氧化酶血红素加氧酶1(heme oxygenase-1,HO-1)、过氧化氢酶(Catalase,CAT)和谷氨酰半胱氨酸合成酶(γ-glutamyl cysteine synthetase catalytic subunit,GCLC)的表达,增加细胞内ROS的清除,抑制OCs的分化与吸收[35]。大量研究表明抗氧化治疗可以有效挽救氧化应激诱导的骨丢失。
2 天然化合物
OP是一种系统性骨病,已成为我国面临的重要公共卫生问题。虽然目前已有很多药理产品用于治疗骨质疏松症,然而近年来发现很多药物长期使用伴随着不良反应。促使研究人员致力于对天然化合物的研究,以寻找有效抑制OCs的药物。如表1所示,天然化合物通过调节RANKL介导的相关通路来抑制OCs分化抗骨质疏松的作用。
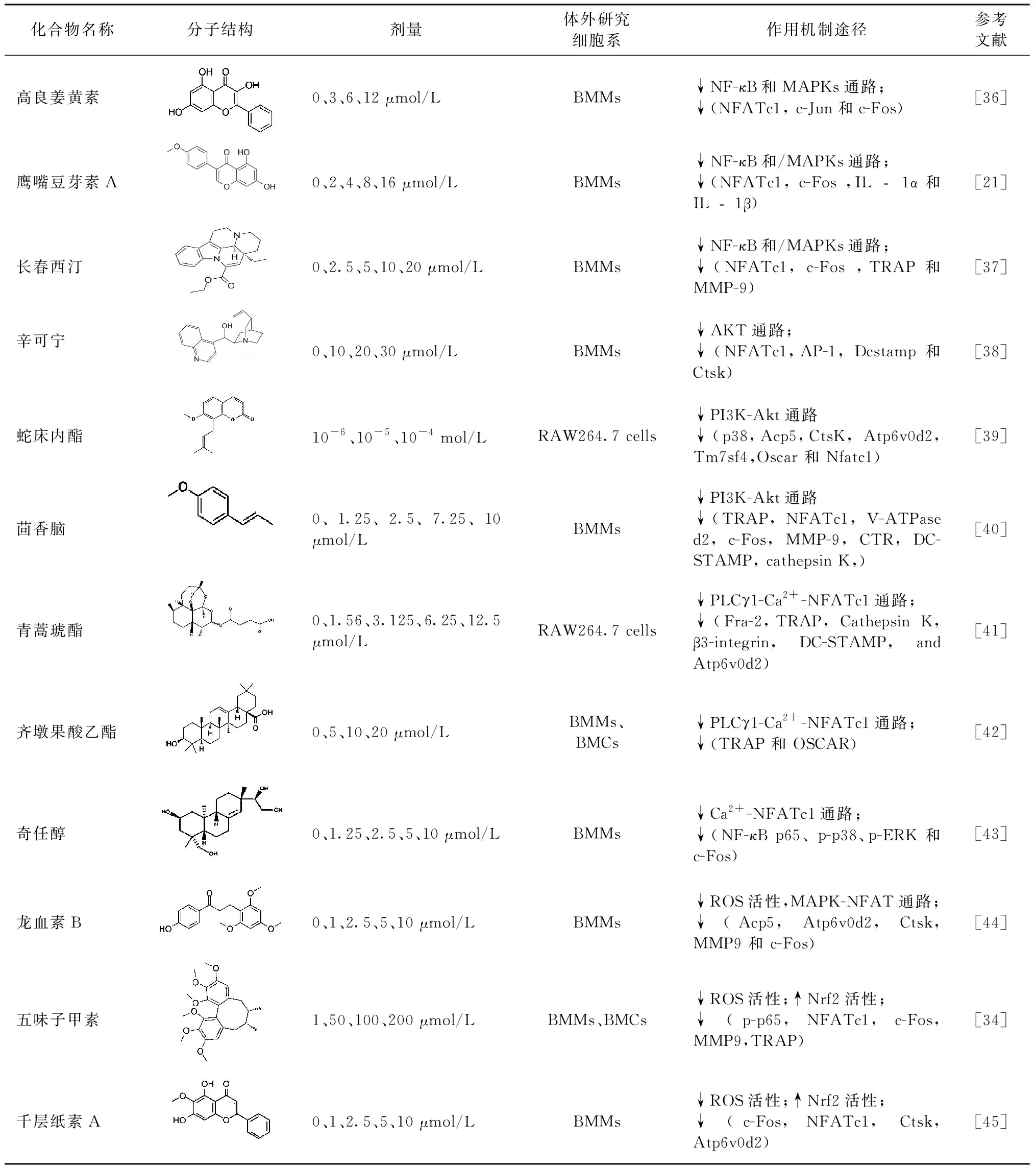
表1 12种天然化合物调节破骨细胞分化的分子结构、剂量、体外研究细胞系及其作用机制Table 1 The molecular structure, dose, cell lines and mechanism of 12 natural compounds on modulating osteoclast differentiation
2.1 天然化合物对NF-κB或MAPKs通路的调节作用
高良姜黄素(Galangin)是一种从传统中药中提取的生物黄酮,具有抗炎和抗氧化等生物活性。Li等[36]研究表明,在骨髓巨噬细胞(bone marrow macrophages,BMMs)向OCs分化过程中,高良姜黄素能抑制p38、ERK的磷酸化,降低NFATc1、c-Jun和c-Fos等下游因子的表达。鹰嘴豆芽素A(Biochanin A,BCA)是一种具有酚类结构的黄酮类化合物。Liao等[21]研究证明BCA通过抑制MAPK和NF-κB通路而下调NFATc1和c-Fos的表达,抑制OCs的分化及骨吸收功能。长春西汀(Vinpocetine,Vinp)是生物碱长春胺的衍生物,Vinp抑制RANKL诱导的OCs分化和F-actin的形成。此外,Vinp抑制OCs形成过程中NF-κB、MAPK和AKT信号通路的激活,降低下游特异性基因的表达。体内实验表明,Vinp显著降低OCs数量,减轻去卵巢诱导的骨丢失。Vinp可能成为一种潜在的预防和治疗骨质疏松症的药物[37]。
2.2 天然化合物对Akt信号通路的调节作用
辛可宁(Cinchonine,CN)作为一种生物碱具有抗疟疾、抗血小板和抗肥胖的作用。Jo等[38]研究表明CN抑制RANKL诱导的OCs分化和骨吸收,机制上CN抑制TRAF6介导的TAK1和AKT活性表达,引起NFATc1的下调。此外,CN能够减轻LPS和卵巢切除诱导的小鼠骨溶解模型。这表明CN对于炎性骨丢失和绝经后骨质疏松症具有治疗潜力。蛇床内酯(Cnidium lactone)是一种有效的中草药,能够预防去卵巢诱导的大鼠骨丢失模型[46]。Liang等[39]在RANKL诱导RAW264.7细胞分化中发现,蛇床内酯能够抑制TRAP阳性多核OCs的分化和骨吸收功能。机制上,蛇床内酯可降低p38和PI3K-Akt信号通路,进一步抑制c-Fos和NFATc1的表达。茴香脑(Anethole)作为20多种植物的主要活性成分,具有抗氧化、抗癌和麻醉等活性。Qu等[40]研究发现茴香脑通过阻断ERK和AKT信号通路抑制OCs的分化和骨吸收作用。在骨溶解动物模型中,茴香脑可以防止雌激素缺乏引起的骨量损失具有骨保护作用。
2.3 天然化合物对Ca2+信号通路的调节作用
青蒿琥酯是青蒿素的一种半合成衍生物,广泛用于疟疾的临床治疗。在RAW264.7细胞培养分化中,Zeng等[41]发现青蒿琥酯呈剂量依赖性抑制LPS诱导的OCs形成,同时抑制OCs分化关键基因的表达。此外,青蒿琥酯显著降低了LPS诱导的OCs分化过程中上游TLR4/TRAF6和下游PLCγ1-Ca2+-NFATc1信号通路的表达,对骨侵蚀具有潜在的作用。齐墩果酸乙酯(oleanolic acid acetate,OAA)作为一种从豇豆中分离出的三萜化合物,Kim等[42]研究发现OAA抑制LPS诱导的骨丢失。机制上OAA显著降低RANKL刺激的BMMs中PLCγ2磷酸化、Ca2+振荡和NFATc1的表达。结果表明OAA可通过PLCγ2-Ca2+-NFATc1信号通路抑制OCs生成,并在体内抑制炎症性骨丢失。奇任醇(Kirenol,Kir)是一种抗风湿中草药的二萜类化合物,Zou等[43]研究发现Kir通过抑制NFATc1的表达和核易位,降低了Ca2+振荡和小窝蛋白-1而抑制OCs的生成和骨吸收。同时,在体内实验中Kir通过减少OCs数量,降低Cav-1和NFATc1的表达,进一步减弱去卵巢诱导的骨质疏松症。
2.4 天然化合物对ROS介导效应的调节作用
龙血素B(Loureirin B,LrB)是从血竭中分离出来的活性成分,广泛用于治疗氧化应激和免疫紊乱等疾病,是一种包含12种以上活性化合物的中国传统草药。Liu等[44]研究表明LrB可通过影响NFATc1易位、ROS活性和钙振荡,降低OCs特异性基因的表达,抑制OCs的分化和骨吸收功能。体内研究中LrB可减轻去卵巢诱导的骨质疏松。五味子甲素(Schisandrin A,Sch)是一种从中药五味子中提取的联苯环辛烯型木脂素,Ni等[34]研究表明,Sch可通过下调TRAF6/Nox1信号通路,增强Nrf2的表达,减少ROS的产生,抑制OCs分化及骨吸收功能。体内实验表明,Sch通过作用于Nrf2抑制ROS的产生而减轻骨丢失,Nrf2信号通路可作为治疗OCs相关疾病的一种新研究靶点。千层纸素A(Oroxylin A,OA)是一种从黄芩根中提取的黄酮类化合物,Xian等[45]体外研究表明OA可通过上调转录因子Nrf2介导的CAT、HO-1、GCLC等多种抗氧化酶,降低ROS产生,抑制OCs的分化减弱对羟基磷灰石的骨吸收作用。体内实验结果显示,OA对LPS介导的骨溶解模型具有保护作用。OA可能具有抗骨质疏松和骨溶解的潜在作用。
3 总结
破骨细胞分化异常是引起骨质疏松症的主要病理原因,RANKL诱导的下游多个信号传导通路是OCs分化的关键步骤,这些下游信号分子的功能异常将导致OCs分化异常及功能障碍。本文综述了RANKL诱导OCs分化相关信号通路的最新研究进展,但目前对于破骨细胞分化的具体通路及分子机制还知之甚少,需要进一步研究。虽然目前临床上已有很多抗骨质疏松的药物,但长期使用会伴随一些不良反应。因此,探索抗骨质疏松的天然化合物仍是目前研究的重点。如图2示,天然化合物对OCs分化生物活性的影响及对于下游信号传导的作用机制。天然化合物是探索新的候选药物的良好来源,对于靶向破骨细胞分化的研究具有重要意义。然而,目前的研究主要依赖于体外与体内动物实验研究,尚未发现有效的人体内试验验证,还需要进一步探索,期望在未来能够有助于预防或治疗骨溶解相关疾病。

图2 天然化合物对于RANKL诱导破骨细胞分化信号通路的影响Fig.2 Effect of natural compounds on RANKL-mediated osteoclast differentiation signaling pathways
