金刚丸抗去卵巢大鼠骨质疏松症血清代谢组学研究
2023-02-26常裕绅朱亮亮匡浩铭院一蔚叶子丰钟秀远陈小明匡建军
常裕绅 朱亮亮 匡浩铭 院一蔚 叶子丰 钟秀远 陈小明 匡建军
1. 湖南中医药大学,湖南 长沙 410208 2. 湖南省中医药研究院,湖南 长沙 410006 3. 湖南中医药高等专科学校,湖南 株洲 412012
绝经后骨质疏松症(postmenopausal osteoporosis,PMOP)是绝经后女性好发的一种代谢性骨病。卵巢功能衰退引起体内雌激素分泌减少,对整体代谢系统产生影响,其发病特点是骨吸收大于骨生成、骨微结构破坏、骨量减少、骨脆性增加[1],使得绝经期女性发生骨折的概率大大增加,对生命健康带来了严重影响。祖国医学根据“肾主骨”理论辩证骨质疏松症主要为肾虚精亏,临床上常以补肾益精为治法。“金刚丸”最早记载于金·刘完素《素问病机气宜保命集》,由中药肉苁蓉、绵萆薢、菟丝子、杜仲和猪腰子炼制而成,是补肾强筋壮骨的经典名方。动物实验[2]表明金刚丸通过提高雌激素水平调节骨代谢提高骨密度,降低炎性因子对丝裂原活化蛋白激酶信号通路的影响抑制骨破坏[3],从而防治骨质疏松症。然而金刚丸治疗PMOP 的具体机制尚未明确,限制了其在临床的进一步推广与运用。
代谢组学通过分析微观代谢物的变化继而了解复杂疾病过程,广泛用于评价治疗效果和剖析天然产物的潜在机制[4],因其全面、系统的分析特点与中医的整体、辨证的观念相契合,能为从中医药层面探索PMOP的防治提供新的思维和实践。气相色谱-质谱(gas chromatography-mass spectrometry,GC-MS)是一种高适用性的代谢组学分析方法,稳定性好及分离率高,在复杂基质的分析方面具有明显优势[5]。本研究在前期金刚丸研究基础上尝试运用GC-MS技术探讨金刚丸治疗PMOP的代谢机制,以期将结果应用于后续的临床研究中。
1 材料与方法
1.1 材料
1.1.1实验药物:金刚丸(陕西天洋制药有限责任公司生产,国药准字:Z61020726,规格:6×9 g/袋/盒);戊酸雌二醇片(法国DELPHARM Lille S.A.S.生产,进口药品注册证号H20080108;规格:1 mg×21片/盒)。
1.1.2主要仪器与试剂:显微镜(Motic BA210 T);双能X线骨密度仪(MEDILINK公司 MEDIX-90);气相色谱-质谱联用分析仪(日本岛津 REX2000)、毛细管气象色谱柱(30 m×0.25 mm×0.25 μm,北京谱合 HP-5 MS);高速冷冻离心仪(湖南湘仪 H1650R);生物样品均质仪(中国杭州奥盛 Bioprep-24)。吡啶、甲氧胺盐酸盐(上海至吉生化科技有限公司);BSTFA+1%TMCS(99∶1)(ThermoFisher公司);甲醇、乙腈、丙酮、正庚烷(上海科醚化学科技有限公司),蒸馏水。
1.1.3实验动物:39只成年未经产6月龄SD雌性大鼠,体重(280±30)g [购于湖南省中医药研究院实验动物中心,许可证号:SCXK(湘)2019-0004]。饲养条件:(25±2)℃,相对湿度50 %~60 %,12 h光/12 h暗循环,标准营养颗粒饲料和饮水充足。本实验得到湖南省中医药研究院动物实验伦理委员会的批准,伦理号:2020-0065。
1.2 方法
1.2.1PMOP模型的建立:采用国内外公认的雌性大鼠 PMOP 模型[5]。将39只大鼠常规饲养一周适应环境,按随机数字表法随机分为3组,空白组(Blank,n=9)、假手术组(Sham,n= 9)、造模组(n=21);除Blank组以外的30只大鼠进行手术处理,Blank组不做处理。术前注射10 %水合氯醛溶液麻醉(0.2 mL/100 g体质量),无菌操作下摘除大鼠双侧卵巢,Sham 组则只切除卵巢附近等体积的脂肪,术后缝皮封口,连续3 d通过大腿部位肌注青霉素钠预防伤口感染,每只大鼠5万U/d。每组处死3只大鼠验证模型。
1.2.2动物分组及给药:造模成功后,将造模组剩下的18只大鼠再按随机数字表法分为模型组(OVX,n=6)、金刚丸组(JGW,n=6)、戊酸雌二醇组(E2,n=6)。造模后1周开始给药,参照标准的人与实验大鼠等效剂量换算[6],金刚丸水溶液含金刚丸生药3.6 g/kg,浓度为0.36 g/mL,戊酸雌二醇水溶液含戊酸雌二醇生药9 mg/kg,浓度为0.009 g/mL,灌胃给药每日1次,其他三组(空白组、假手术组、模型组)则分别根据大鼠体质量灌胃同体积蒸馏水1 mL/100 g,每日1次,每周称重。
1.2.3样本的收集与制备:各组实验大鼠给药12周后取材,每只大鼠以10 %水合氯醛溶液麻醉后取腹主动脉血5 mL、腰椎椎体及右侧股骨备用;代谢物提取[7]:取150 μL血清样品解冻,加入甲醇、乙腈和丙酮的等比例混合溶液800 μL 涡旋1 min,震荡混匀5 min,冰浴超声10 min,离心10 min(10 000 r/min),移液管吸取800 μL上清液于上样瓶中,常温下氮气蒸发至干燥;样品衍生化:加入75 μL 甲氧胺吡啶溶液混匀5 min,70 ℃条件下(300 r/min)震荡 1 h 后,冷却至室温,加入BSTFA+1%TMCS溶液75 μL,室温(300 r/min)震荡1 h,加入150 μL终止溶剂正庚烷(含0.1 g/L二十二烷),前处理完成后,取上清液于进样管,进行GC-MS分析。
1.2.4H&E染色法观察大鼠股骨组织结构:取大鼠右侧股骨中段1 cm,刮出多余肌肉组织,用4 %多聚甲醛固定,10 % EDTA溶液脱钙,切片置于二甲苯中,梯度乙醇脱水,骨组织块浸蜡、包埋,冷却后切片机切片,加热烫平,60 ℃恒温机烘干,二甲苯脱蜡,苏木素伊红染色10 min,每次蒸馏水冲洗,烘干后中性树胶封片,显微镜观察骨小梁结构。
1.2.5指标测定:通过双能X线骨密度仪测定大鼠腰椎椎体BMD值。骨代谢指标ALP、OCN、TRAP 5b均采用ELISE法按照试剂盒说明书测定。血脂指标TC、TG、LDL-C、HDL-C均采用全自动生化分析仪按照试剂盒说明书测定。
1.2.6色谱、质谱条件:色谱条件:毛细管柱HP-5 MS(30 m×0.25 mm×0.25 μm);进样口温度:270 ℃;升温程序:初始85 ℃(持续5 min),以 10 ℃/min 升至 300 ℃(持续 10 min);进样量2.0 μL(不分流);载气:99.99 %高纯氦气,流速为 1.0 mL/min;溶剂延迟 5 min。质谱条件:接口温度:280 ℃;离子源温度:230 ℃;四级杆温度 150 ℃;电离方式:EI;电离能量 70 eV;电子倍增器电压:1753 V;扫描方式:全扫描60~600 m/z。
1.3 数据处理与统计学分析

2 结果
2.1 H&E染色结果
与Blank组、Sham组相比,去卵巢后大鼠骨小梁出现明显断裂、形态模糊,骨髓腔间隙显著增加,大量部位被脂肪细胞所代替,而金刚丸治疗后的大鼠则观察骨小梁结构明显改善,且脂肪细胞重新被骨小梁所代替。见图1。
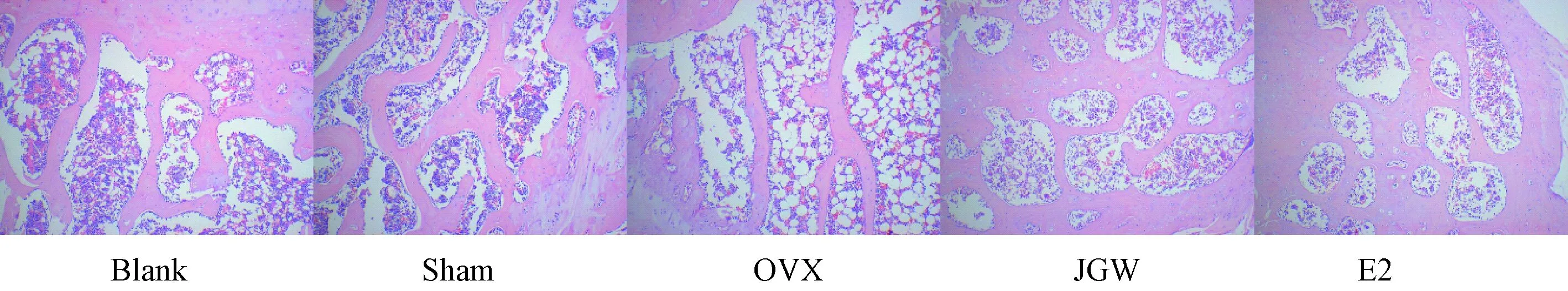
图1 各组大鼠骨组织形态结构(10×10)Fig.1 Morphological structure of bone tissue of rats in each group(10×10)
2.2 各组大鼠腰椎BMD、血清ALP、OCN、TRAP5b水平变化
Blank组、Sham组BMD水平比较差异无统计学意义(P>0.05);与Sham组比较,OVX组BMD明显降低(P<0.05);与OVX组比较,JGW组和E2组BMD水平明显升高(P<0.05)。与Sham组比较,OVX组ALP、OCN、TRAP5b水平升高(P<0.05或P<0.01);与OVX组比较,JGW组和E2组血清中ALP、OCN、TRAP5b水平均降低(P<0.05或P<0.01)。见图2。

图2 各组大鼠骨密度及骨代谢指标水平比较Fig.2 Comparison of BMD and bone metabolism index levels of rats in each group注: 与Sham组大鼠比较,#P>0. 05;与OVX组大鼠比较,*P<0. 05,**P<0. 01。
2.3 各组大鼠血脂水平变化
与Sham组比较,OVX组大鼠血清TC、TG、LDL-C水平明显升高,HDL-C水平明显降低(P<0. 05);与OVX组比较,JGW组和E2组血清中TC、TG、LDL-C水平均降低(P<0.05),HDL-C水平升高(P<0.05)。见图3。
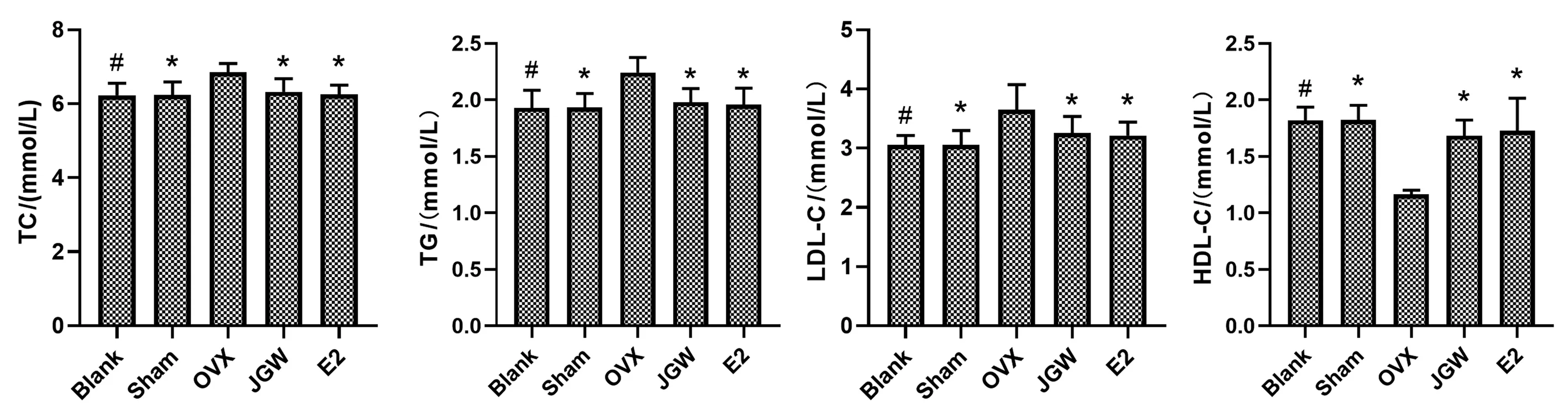
图3 各组大鼠血清中TC、TG、LDL-C、HDL-C含量比较Fig.3 Comparison of TC, TG, LDL-C, HDL-C contents in serum of rats in each group注: 与Sham组大鼠比较,#P>0. 05;与OVX组大鼠比较,*P<0. 05。
2.4 基于GC-MS的大鼠血清代谢组学检测
通过GC-MS分析后展示各组大鼠血清样本典型总离子流色谱图(图4),利用NIST标准物质库,鉴定出的大鼠内源性代谢产物主要分为氨基酸类、糖类、脂类及其他小分子代谢产物。综合结果来观察,各组大鼠代谢物轮廓基本类似,但代谢物水平之间差异较大。
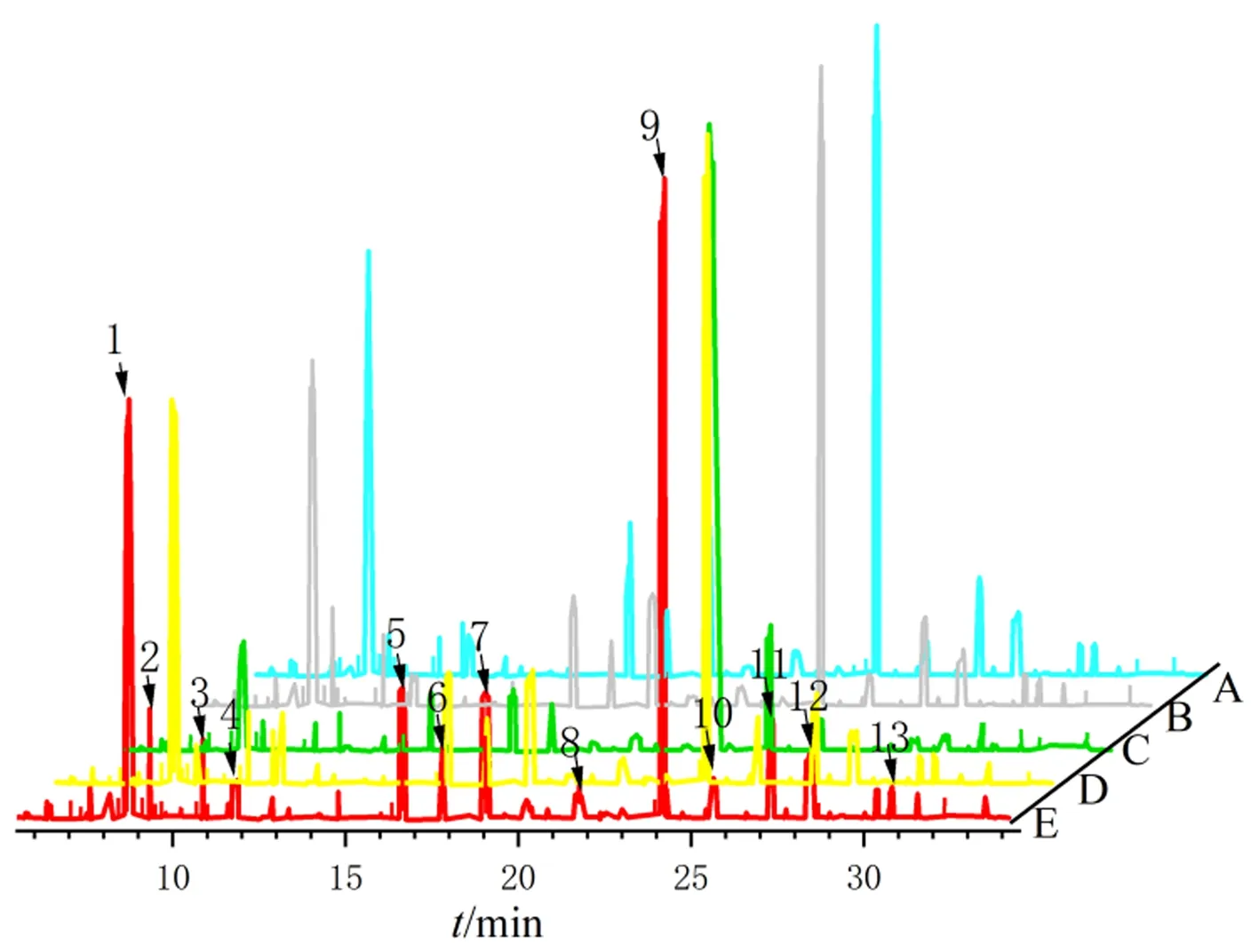
图4 各组大鼠血清总离子流色谱图Fig.4 Total ion chromatogram of rat serum in each group注:A:空白组;B:假手术组;C:模型组;D:金刚丸组;E:戊酸雌二醇组;1:草酸;2:乳酸;3:R-3-羟基丁酸;4:尿素;5:脯氨酸;6:甘露糖;7:葡萄糖;8:半乳糖;9:肌醇;10:油酸;11:十八碳二烯酸;12:花生四烯酸;13:胆固醇。
2.5 主要代谢物分析
PCA是一种采用数据降维算法可在二维或多维空间反应样本间总体分布。如图5所示,在PCA分数图中,基于样本之间的相似性对样本进行分组,可直观的看到各组大鼠的代谢表型均有一定的区分。

图5 各组大鼠血清PCA得分图Fig.5 Serum PCA scores plot of rats in each group注:A:空白组;B:假手术组;C:模型组;D:金刚丸组;E:戊酸雌二醇组。
2.6 差异代谢生物标志物筛选及分析
将Sham组与OVX组大鼠的归一化数据进行组间OPLS-DA,见图6,可见Sham组与OVX组分离明显,分别置于得分图两侧,组间差异远大于组内差异,说明该模型的区分程度较好,并以R2X=0.86,R2Y=0.999,Q2=0.996参数评判该模型质量较为可靠,见图7。根据VIP(VIP>1.0)、P(P<0.05)且经t检验,最终筛选得到具有统计学意义的13个差异生物标志物。进一步比较,其中OVX组大鼠较Sham组有5个代谢物表达水平明显上升,8个代谢物显著下降。对比OVX组与JGW组,经金刚丸治疗后的去卵巢大鼠体内5个代谢物表达上升,4个代谢物表达下降,4个变化不明显,见表1。并通过热图比较Sham、OVX、JGW、E2各组差异代谢标志物的表达情况,见图8。

图6 Sham组与OVX组大鼠血清OPLS-DA得分图Fig.6 OPLS-DA score plot of serum in Sham group and OVX group注:B:假手术组;C:模型组。

图7 OPLS-DA模型的验证图Fig.7 OPLS-DA validation plot of model

图8 各组大鼠的血清代谢物热图Fig.8 Heatmap representation of serum metabolites of rats in each group
2.7 代谢通路富集分析
将2.6中金刚丸干预后显著差异代谢物的HMDB号进行代谢通路分析,发现impact > 0.03的5条代谢通路,见图9及表2。

图9 特异性生物标志物的代谢路径影响值得分图Fig.9 The metabolic pathway influence value of specific biomarkers

表2 金刚丸干预去卵巢模型大鼠血清代谢通路Table 2 Jingangwan intervenes serum metabolic pathways in ovariectomized rats
3 讨论
PMOP是一种高转换代谢型骨病。在骨重建过程中,骨代谢指标可及时反映骨转换状态[8]。ALP、OCN是由成骨细胞合成和分泌,与骨基质矿化密切相关。本研究结果显示,模型组大鼠 ALP、OCN 较假手术组升高,可能是由于模型组大鼠骨代谢处于高转换状态,成骨细胞代谢活跃所致,而金刚丸大鼠血清 ALP 、OCN含量较模型组明显降低,提示金刚丸有改善骨代谢作用;据有关研究[9]显示,女性ALP、OCN在绝经期(50~59岁)显著升高,与BMD呈负相关,这与本研究结果相符。TRACP5b是在破骨细胞中特定表达的酸性磷酸酶同功酶亚型,是一个具有特异性和高敏感度的骨吸收指标,研究结果显示模型组较假手术组TRACP5b升高,提示骨吸收增强;金刚丸对TRACP5b有下调作用,说明金刚丸可通过影响TRACP5b抑制骨吸收。血清TC、TG、LDL-C、HDL-C均是评价心脑血管疾病的风险因素,同时也反应体内脂质代谢情况。模型组较假手术组TC、TG、LDL-C水平升高,HDL-C水平降低,这可能由于大鼠去卵巢后雌激素分泌减少导致脂代谢紊乱;经金刚丸治疗后,这些指标也得到明显回调,说明金刚丸可改善骨质疏松大鼠的脂代谢过程,同时也印证了骨-脂代谢异常失衡与绝经后骨质疏松症的发生关系密切[10]。
本次代谢组学研究发现了13个与PMOP有关的潜在代谢标志物。而在这些代谢物中,金刚丸组与模型组对比发现有9个代谢物发生了回调,可能通过花生四烯酸代谢、肌醇磷酸代谢、精氨酸和脯氨酸代谢和半乳糖代谢发挥作用。花生四烯酸(arachidonic acid,AA)在人体内由油酸转化而来,其参与合成物质具有多重生物活性[11],游离的AA先后在环加氧酶和前列腺素合成酶的酶促代谢作用下可形成前列腺素E2(prostaglandin E2,PGE2),大量的研究[12]表明PGE2对骨组织生长和骨折愈合以及预防骨质疏松有明显促进作用。但有研究[13]认为PGE2并不能直接促进成骨细胞分化,而是通过激活感觉神经来维持骨代谢平衡状态。本实验中模型组较假手术组AA水平下降,而金刚丸组较模型组AA表达水平上升,由此可推测金刚丸可能在通过调节脂代谢(尤其是不饱和脂肪酸代谢)来影响骨代谢方面发挥了重要作用。
肌醇是一种维生素类似物,其作用是与各种细胞内信号转导途径调节包括骨细胞、神经细胞代谢在内的生物过程有关。磷脂酰肌醇-3-激酶(phosphatidylinositol 3-kinase,PI3K)/丝氨酸/苏氨酸激酶(serine/threonine kinase,AKT)信号通路与骨质疏松的发生关系紧密[14],肌醇被脂质激酶磷酸化后的下游产物磷脂酰肌醇三磷酸是作为第二信使参与调控PI3K/Akt信号通路的。XI等[15]通过模拟骨质疏松症的体内和体外实验发现,PI3K/Akt细胞信号通路可以促成骨细胞增殖、分化和诱导骨形成。研究结果显示,与假手术组相比,模型组大鼠血清中肌醇水平下调,提示大鼠去卵巢后可引起肌醇水平降低,而金刚丸组与模型组相比肌醇水平升高,由此可推测金刚丸防治PMOP,可能与肌醇磷酸代谢和PI3K/Akt信号通路的激活有关。
甘露糖、半乳糖、葡萄糖三种单糖都是机体所需的能量物质。半乳糖(galactose,GA)代谢几乎发生在肝脏中,被机体吸收的GA经半乳糖激酶诱导后、在半乳糖-l-磷酸尿苷酰转移酶介导作用下生成二磷酸尿甘半乳糖,再经过半乳糖-4表异构酶的表异构化,最后形成l-磷酸葡萄糖进入葡萄糖代谢[16]。在调节葡萄糖能量代谢的过程中,雌激素可多角度参与相关蛋白的表达,直接或间接影响葡萄糖转运过程、糖酵解和氧化磷酸化反应[17]。有关研究[18]还发现雌激素对肝脏糖脂代谢具有保护作用。本研究中,当模型组雌激素水平下降时,半乳糖水平显著升高,葡萄糖水平下降,表明GA转变成l-磷酸葡萄糖的途径受阻,导致半乳糖堆积,核因子κB信号通路及核因子κ B受体活化因子配体系统被GA转换的晚期糖基化终末产物、活性氧和自由基等物质激活,直接导致炎症反应和破骨细胞的活化[19]。金刚丸干预后可使大鼠体内异常的半乳糖含量回调到正常水平,由此推测这些代谢产物的的改变可能是金刚丸对PMOP的一种积极的保护或治疗机制。从热图上还可发现模型组的(R)- 3-羟基丁酸和脯氨酸水平较假手术组下降,而金刚丸组较模型组均上升,差异具有统计学意义。氨基酸不仅是细胞信号分子,而且是基因表达和蛋白质磷酸化级联反应的调节剂。研究表明[20],在骨代谢方面氨基酸可以作为诱导骨形成和钙的直接调节剂。
综上所述,本研究采用GC-MS代谢组学技术进行分析,筛选出的13种代谢差异物可能作为诊断和治疗PMOP的潜在生物标志物,并且初步探讨了金刚丸改善PMOP可能与调节脂代谢、氨基酸代谢与糖代谢有关,为进一步指导临床诊治提供了一定的科学依据。
