BnABCI8影响甘蓝型油菜叶绿体发育
2023-02-25陈晓汉王丽琴汪华栋陶保龙涂金星傅廷栋沈金雄
陈晓汉 王丽琴 汪华栋 肖 清 陶保龙 赵 伦 文 静 易 斌 涂金星 傅廷栋 沈金雄
影响甘蓝型油菜叶绿体发育
陈晓汉 王丽琴 汪华栋 肖 清 陶保龙 赵 伦 文 静 易 斌 涂金星 傅廷栋 沈金雄*
华中农业大学作物遗传改良国家重点实验室 / 国家油菜工程技术研究中心, 湖北武汉 430070
成熟叶绿体是高等植物光合作用的重要场所, 是影响作物产量的重要器官。BnABCI8是ABC转运蛋白I亚族的成员, 在甘蓝型油菜中有2个功能拷贝, 分别是和, 其氨基酸序列在不同物种中是非常保守的。表达模式分析发现,在油菜植株各个组织中均有表达, 且在叶和花中表达量较高; 亚细胞定位证明, BnABCI8能够定位在叶绿体中; 表型鉴定发现,和的同时突变及的单突变均会导致黄色的子叶和褪绿的真叶, 且双突变体褪绿更为严重; 透射电镜结果显示, 双突变体中叶绿体不能够形成正常的类囊体膜;的敲除导致叶绿素合成途径相关基因的表达下调, 且叶片中积累了大量的Fe离子。这些结果表明,的突变造成叶绿体结构异常, 叶绿素合成受阻, 叶片中Fe离子大量积累, 而Fe离子的积累又可能会引发一系列的反应如活性氧积累, 细胞死亡和叶绿素降解等, 最终导致了叶色突变。
甘蓝型油菜;; ABC转运蛋白; 叶绿体发育; 叶绿素合成; 杂色突变体
叶绿体是高等植物最重要的质体之一, 是植物进行光合作用的场所, 它能将光能转化为化学能以维持植物体的正常生命活动。叶绿体由蓝藻通过内共生系统整合到宿主真核细胞中, 并不断进化发育而来, 因此叶绿体含有自己的基因组。经过漫长的内共生过程后, 许多基因转移到了细胞核基因组中, 这一过程使得叶绿体基因组严重减少, 而核基因组的复杂度大大增加[1]。叶绿体除了进行光合作用外, 还是叶绿素、血红素以及其他四吡咯生物合成的场所[2]。其中, 叶绿素的生物合成是由核基因与叶绿体基因共同调控的, 大约有20多种不同的酶参与这个过程[3], 从谷氨酰-tRNA开始到叶绿素、叶绿素合成结束, 该途径中任何基因的突变均会导致叶绿素合成受阻, 而导致叶色发生改变。例如玉米中尿卟啉原脱羧酶(uroporphyrinogen decarboxylase, UROD)的突变使得玉米叶片叶绿素含量减少且暴露在光下时会坏死病变[4]; 水稻中基因, 编码原叶绿素酸酯氧化还原酶(protochlorophyllide oxidoreductase, POR), 它的功能缺失导致叶片褪绿[5];编码叶绿素合成酶(chlorophyll synthase, CS), 该基因的突变会导致前期叶片黄色后期转绿[6]。除叶绿素合成途径受损会导致叶片颜色改变外, 叶绿体发育相关基因功能的丧失也会导致叶色的变化。编码叶绿体延长因子G, 拟南芥中突变体表现出白色的子叶[7]。水稻中基因的突变, 导致叶绿类囊体膜形成受阻, 最终导致水稻叶片白化[8]。
ATP结合盒(ABC)转运蛋白家族是一类古老而庞大的转运蛋白家族, 其功能主要是进行物质的跨膜转运。植物中ABC转运蛋白非常丰富, 拟南芥和水稻中分别有130个和128个ABC转运蛋白[9-10], 而油菜中ABC转运蛋白数量更多, 达到314个[11]。但在这众多转运蛋白中, 只有小部分被研究报道。这些ABC转运蛋白不仅参与激素、脂质、金属等运输, 还参与植物的抗病以及离子通道调节等[12-14], 多样的蛋白功能表明ABC转运蛋白在植物内的分子机制具有一定的复杂性, 有待更进一步探究。根据序列的相似性及进化分析, 将ABC转运蛋白家族分成8个主要的亚族并以A~H来表示[15]。此外, 在植物内存在一类特殊的细菌类型ABC转运蛋白, 被命名为ABCI亚族, 与典型的ABC转运蛋白结构相比, ABCI亚族成员不同时具有NBD和TMD结构域[16]。拟南芥中AtABCI8是一种参与光敏色素a信号通路的远红光特异信号因子[17], 此外, AtABCI8能够与AtABCI6和AtABCI7形成复合物, 参与叶绿体中铁硫簇的组装[18]。参与调节质体内金属稳态[19]。这些研究表明, 拟南芥中的ABCI成员具有多种功能, 包括光信号转导、铁硫簇组装和金属稳态等。
甘蓝型油菜是世界上主要的油料作物之一, 在世界范围内种植面积很广[20]。由于甘蓝型油菜是异源四倍体, 在甘蓝型油菜中一个基因可能存在2个到6个功能冗余的拷贝, 因此较难研究油菜基因的功能。最近, CRISPR/Cas9介导的基因编辑技术与泛基因组序列的不断完善为研究多倍体作物基因功能提供了极大便利。更重要的是, 目前尚未有任何油菜ABCI亚族成员的功能报道。是ABC转运蛋白I亚族的成员, 在油菜中的功能未知。本研究利用CRISPR/Cas9系统创建了的敲除突变体, 并对突变体进行了表型、细胞学的观察和叶绿体发育相关基因的表达分析, 为进一步研究油菜的功能奠定了基础。
1 材料与方法
1.1 试验材料和生长条件
本研究以甘蓝型油菜6-102B作为转基因受体材料, 按照本室之前报道的方法进行遗传转化[21]。用特异性引物扩增甘蓝型油菜6-102B中和的gDNA和cDNA序列用于后续的研究。亚细胞定位所用的材料为本氏烟草。试验所涉及的材料在华中农业大学试验田或温室中进行种植。温室温度为21~23℃、湿度为30%~60%、16 h光照/8 h黑暗。
1.2 结构域和系统进化分析
从甘蓝型油菜基因组数据库(http://cbi.hzau.edu. cn/bnapus/index.php)获得BnABCI8的全长氨基酸序列, 并在NCBI (https://blast.ncbi.nlm.nih.gov/Blast. cgi)中进行BLAST检索, 批量下载拟南芥、水稻、小麦、大豆、黄瓜、甘蓝、白菜、葡萄、烟草、棉花、柑橘中同源蛋白序列。使用MEGA7软件进行蛋白序列的比对以及系统进化树的构建并用GeneDoc软件进行美化。用NCBI保守结构域数据库(https://www.ncbi.nlm.nih.gov/Structure/cdd/wrpsb. cgi)对BnABCI8的蛋白质结构域进行预测。
1.3 qRT-PCR分析
取甘蓝型油菜6-102B的根、茎、子叶、真叶、蕾、花、角皮、种子进行表达模式的研究。取野生型、单突变体和双突变体30 d相同叶位的叶片进行以及叶绿素合成途径相关基因表达水平的检测。采集的样品迅速在液氮中冷冻, 并存放于-80℃冰箱。使用Eastep Super总RNA提取试剂盒(LS1040, 上海普洛麦格)提取总RNA。使用第一链cDNA合成试剂盒(AE311, 北京全式金生物技术有限公司)进行反转录。使用SYBR Green I (AQ601, 北京全式金生物技术有限公司)和CFX384荧光定量PCR仪检测基因的相对表达量。反应体系为10 μL, 包含50×稀释的cDNA产物4.2 μL、正向和反向引物各0.4 μL (10 μmol L–1)、2× Green qPCR SuperMix 5 μL, 按相应的程序进行PCR。以作为甘蓝型油菜内参基因, 按照2–ΔΔCt方法计算基因的相对表达量。所用引物见附表1。
1.4 Bn.ABCI8的亚细胞定位
用特异性引物扩增不含终止密码子的的CDS序列, 并重组到瞬时表达载体pMDC83-35S- GFP中, 得到C端融合GFP的融合产物。将重组的载体转化到农杆菌GV3101中, 利用农杆菌将外源基因导入到烟草叶片中进行表达。以叶绿体自发荧光作为标记。使用FluoView FV1000激光共聚焦显微镜观察荧光信号。
1.5 CRISPR/Cas9载体构建及转基因植株编辑情况检测
本研究所用的基因编辑载体为陈其军实验室的双靶点载体, 按照所报道的方法进行载体构建[22]。利用CRISPR-P 2.0 (http://crispr.hzau.edu.cn/cgi- bin/CRISPR2/CRISPR)网站进行靶点的设计, Cas9引物用于转基因阳性植株的鉴定, 利用Hi-TOM高通量测序技术对转基因阳性植株进行编辑情况检测[23]。
1.6 叶绿素含量测定
分别取3株野生型和T1代双突变体30 d和56 d的叶片, 除去叶脉并剪成小碎片, 称重约0.3 g放入到50 mL离心管中, 并倒入20 mL (丙酮∶乙醇=8∶1, v/v), 在黑暗中放置48 h, 期间多次摇晃。然后将样品3000´离心10 min, 用比色皿收集上清在分光光度计(UV-1800, Mapada, 上海)中进行测量。测量波长为470 nm、646 nm和663 nm下的吸光度值, 按Arnon公式计算: 叶绿素浓度Ca = 12.21A663-2.81A646; 叶绿素浓度Cb=20.13A646-5.03A663; 类胡萝卜素和叶黄素浓度C = (1000A470–3.27Ca– 104Cb)/229。叶绿素含量(mg g–1) = C´V/ 1000A; 其中C为叶绿素浓度(mg L–1), V为提取液总体积(mL), A为叶片鲜重(g)。
1.7 叶片Fe离子含量测定
分别取3株野生型和T1代突变体30 d的叶片, 150℃杀青30 min, 然后在80℃条件下干燥48 h, 用研钵磨样, 避免接触金属, 精确称量粉末0.10 g放入10 mL试管中并记录, 添加2 mL硝酸过夜, 将过夜后的离心管放入100℃水浴锅水浴2 h, 待冷却后加入蒸馏水至总体积为10 mL, 利用铁离子标准液配置0、2、4、6、8、10和12 μg mL–1的铁离子溶液, 使用火焰原子吸收光谱仪测量铁离子含量。
1.8 叶绿体超微结构观察
取野生型和T1代突变体56 d的叶片, 用剪刀剪成1 mm´2 mm的矩形小块, 并放入2.5%戊二醛中固定, 抽真空使得叶片下沉为止, 固定2 h以上后送华中农业大学电镜平台进行处理和叶绿体超微结构的观察。
2 结果与分析
2.1 结构域和系统进化分析
在甘蓝型油菜中主要有2个功能拷贝, 分别是和。其中与白菜中的高度相似,与甘蓝中的高度相似。因此,可能是来自于二倍体祖先白菜的,可能来自于二倍体祖先甘蓝的(图1-A)。与拟南芥、水稻、小麦、大豆、黄瓜的氨基酸序列相比, BnABCI8的N端是不保守的。另外根据预测BnABCI8还含有一个SUFBD结构域, 这个结构域在这些物种中是非常保守的(图1-B)。
2.2 BnABCI8以组成型模式表达且BnABCI8蛋白定位在叶绿体上
为探索的时空表达模式, 设计特异引物检测了和在不同组织中的表达水平。定量结果分析显示,和的表达模式相似, 在各个组织中均有表达, 且在根和茎中表达量较低, 在花和叶中表达量较高(图2)。
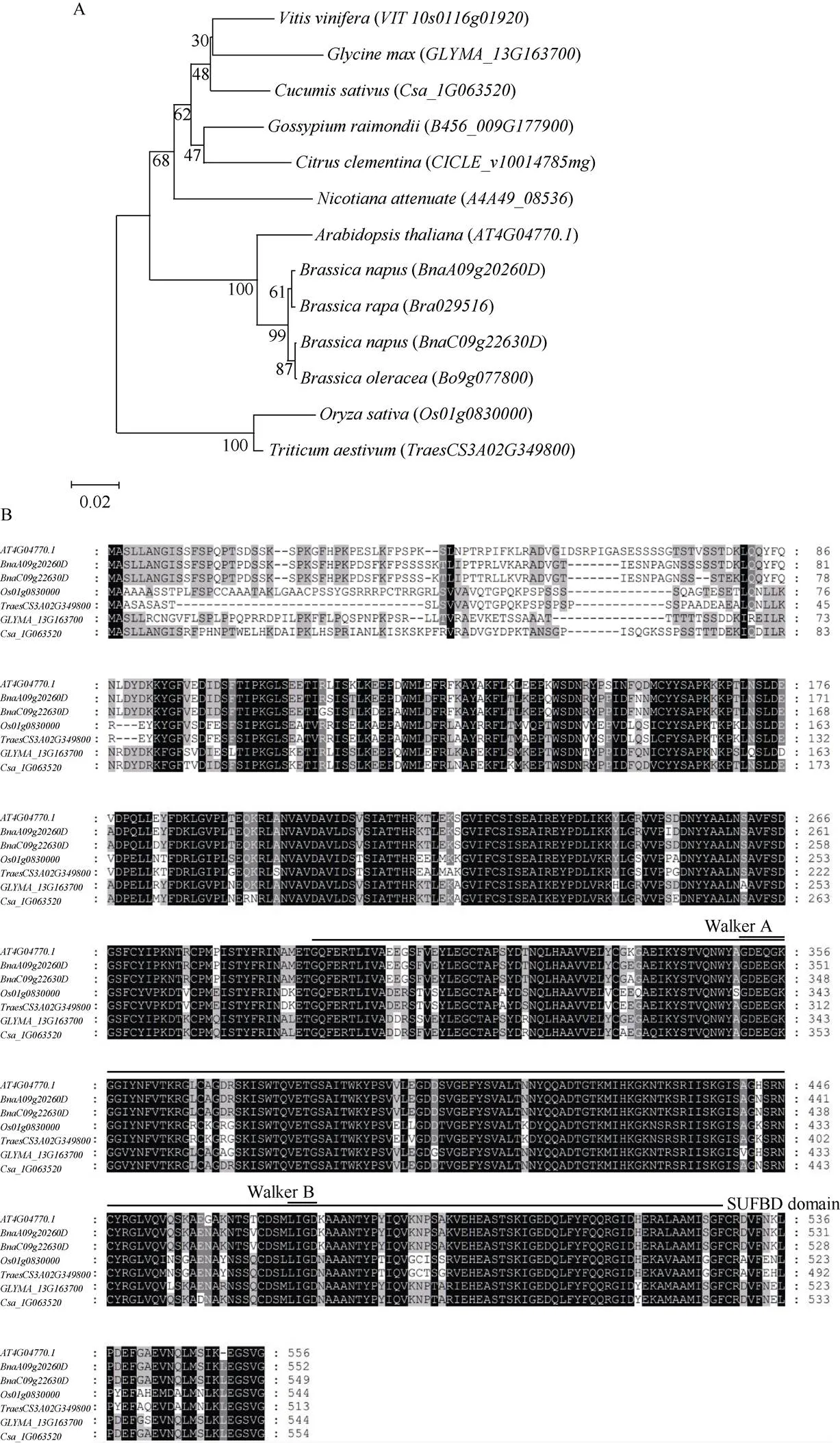
图1 植物中ABCI8同源蛋白之间的进化关系
A: BnABCI8及其同源蛋白的系统发育树。分支上的数字是1000次重复的引导值(%)。B: BnABCI8及其5种同源蛋白的氨基酸序列。
A: the phylogenetic tree of the sequence of BnABCI8 and its putative orthologs in different species. Numbers on branches are bootstrap values for 1000 replications. B: the amino acid sequences of BnABCI8 and putative orthologs in five species.

图2 BnABCI8的表达模式
数值表示为±SD (= 3)。Values are means ± SDs (= 3).
为研究BnABCI8蛋白的亚细胞定位情况, 本研究将、的全长CDS去终止密码子后重组在pMD-C83载体GFP的N端, 在本氏烟草中进行蛋白的瞬时表达, 通过激光共聚焦显微镜观察, 发现融合蛋白的绿色荧光能够与叶绿体自发荧光重叠, 表明BnA09.ABCI8和BnC09. ABCI8定位于叶绿体(图3)。进一步说明该蛋白主要行使功能的部位在叶绿体, 可能参与维持叶绿体的正常功能。
2.3 BnABCI8功能分析
为进一步研究在甘蓝型油菜的功能, 本研究利用CRISPR/Cas9技术对的两个功能拷贝进行了敲除。的全长CDS为1659 bp, 编码552个氨基酸。的全长CDS为1650 bp, 编码549个氨基酸。两者都包含2个外显子和1个内含子(图4-A), 且它们的CDS序列高度相似。经过T0代阳性植株检测, 共计得到10株阳性植株(图4-B), 然后进行二代测序检测编辑情况。
经高通量测序结果显示T0代得到的突变体均是杂合突变类型。为获得稳定遗传的纯合突变体材料, 挑选T0代杂合突变体进行了自交加代, 分离得到了、均被编辑的纯合双突变体及被编辑的纯合单突变体(图5-A)。随后选取了部分双突变体、单突变体以及野生型植株进行了相对表达量的鉴定。qRT-PCR结果显示, 与野生型叶片相比,和在双突变体中表达显著降低。在的单突变体中,的表达量明显下降, 而的表达似乎也受到了影响, 部分单株表达显著降低(图5-B), 可能这2个拷贝在甘蓝型油菜中以二聚体的形式发挥作用。表明经CRISPR/ Cas9系统编辑不仅影响了的翻译产物而且影响该突变基因的转录水平。
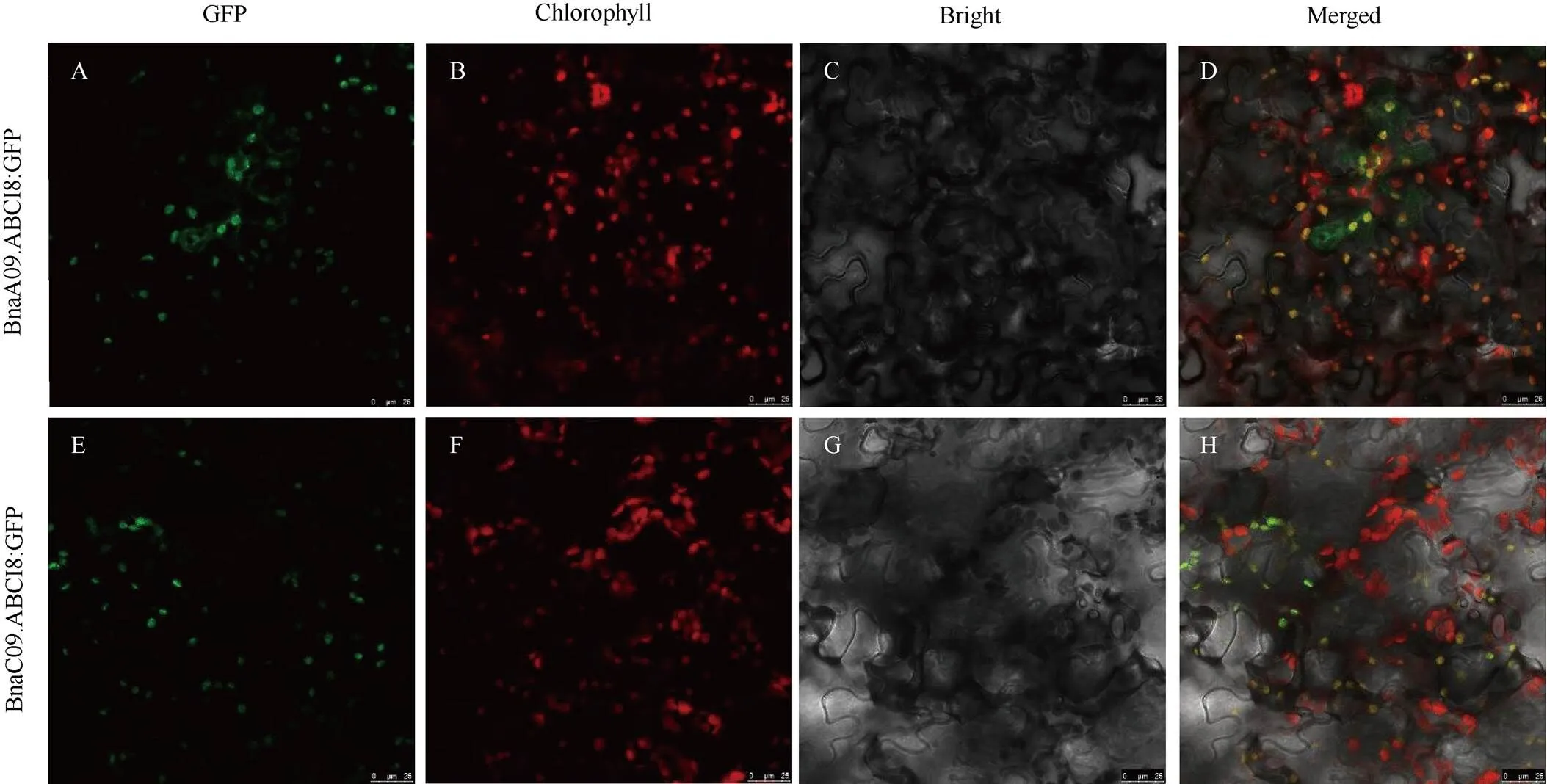
图3 BnABCI8的亚细胞定位
A, E: P35S::BnaA09.ABCI8:GFP和P35S::BnaC09.ABCI8:GFP转化烟草后的绿色荧光图像; B, F: 叶绿体在烟草中的红色荧光图像; C, G: 明场下的图像; D, H: 分别由A~C和E~G的合并图像。
A, E: green fluorescence signals of transformed tobacco with the P35S::BnaA09.ABCI8:GFP and P35S::BnaC09.ABCI8:GFP constructs, respectively. B, F: red fluorescence of chloroplasts in tobacco. C, G: the image under bright field. D, H: the merged images from (A–C) and (E–G), respectively.
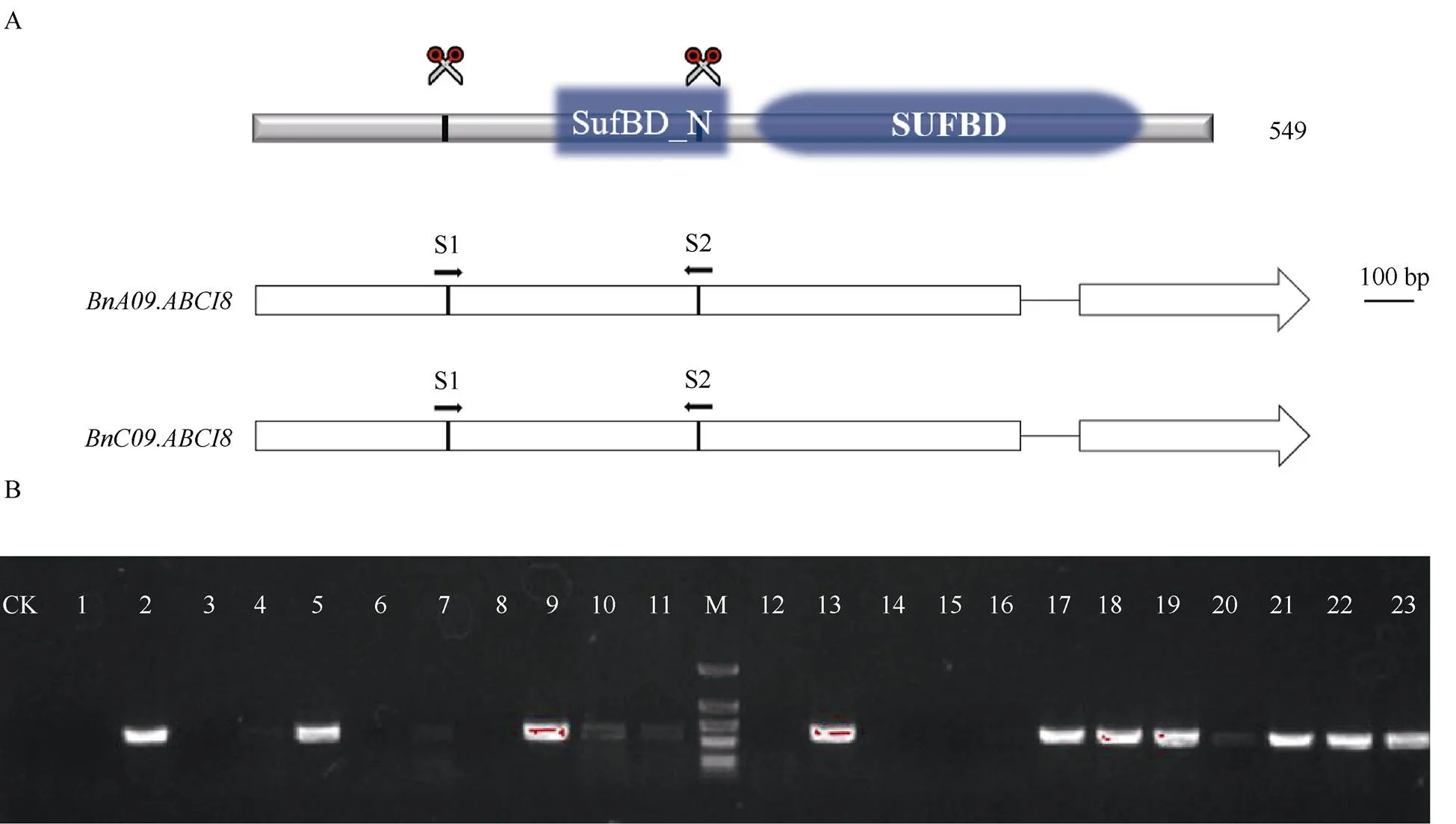
图4 BnABCI8的基因结构和CRISRP阳性植株鉴定
A:和的基因结构; B: 转基因阳性植株电泳鉴定。Marker大小分别为2 kb、1 kb、750 bp、500 bp、200 bp, 目的条带大小为686 bp。
A: gene structure ofand;B: the electrophoretic identification of CRISPR-edited positive plants. The marker bands are 2 kb, 1 kb, 750 bp, 500 bp, and 200 bp, respectively, and the target band is 686 bp.

图5 T1代突变体的鉴定
A: 部分植株的编辑情况。黄色标记表示PAM位点以及插入的碱基, 红色破折号表示缺失。B: 突变体中的相对表达量。*、**分别表示在0.05和0.01概率水平差异显著。
A: the editing of some plants. The yellow mark indicates the PAM site and the inserted base, and the red dash indicates the deletion. B: the relative expression levels ofin mutants. * and ** mean significant differences at< 0.05 and< 0.01, respectively.
选取单突变体、、和双突变体、、进行了表型的考察。经过观察发现, 单突变体与双突变体均表现出黄色的子叶, 子叶边缘较白, 新生的真叶为绿色, 后期真叶慢慢褪绿为杂色(图6)。双突变体褪绿较快且严重, 杂色更明显, 且发白, 绿色部分非常少, 生长非常缓慢、长势弱。单突变体真叶褪绿较缓慢, 存在较多绿色部分, 生长速度和长势与野生型相比较弱(图7)。
接着分别取了双突变体30 d和56 d的叶片进行了观察并测定叶绿素含量。结果显示, 与野生型相比, 在幼苗生长前期, 双突变体出现轻微杂色, 叶绿素和叶绿素含量下降, 而叶绿素和叶绿素的比值上升。在生长后期, 叶色褪绿更为明显, 叶绿素和叶绿素含量下降更为明显, 叶绿素和叶绿素的比值上升更加显著(图8)。
2.4 叶绿素合成途径相关基因表达分析
突变体叶片叶绿素含量的降低可能与叶绿素的合成受阻或者叶绿素降解加快等原因有关, 为探究叶色的改变是否由叶绿素的合成受阻导致的, 本研究对双突变体当中叶绿素合成途径的相关基因的表达水平进行了检测。结果表明, 叶绿素合成途径中的关键基因如、、等都明显的下调表达(图9)。说明的突变影响了甘蓝型油菜叶绿素的生物合成, 对于是否会影响叶绿素的降解过程有待进一步研究。

图6 突变体子叶的表型观察
A~C: 野生型幼苗10 d龄; D~F: 单突变体10 d龄; G~I: 双突变体10 d龄; J~L: 双突变体17 d龄。
A–C: 10-day-old wild type; D–F: 10-day-old single mutants; G–I: 10-day-old double mutants; J–L: 17-day-old double mutants.

图7 突变体的表型观察
A: 野生型56 d龄; B: 单突变体56 d龄; C: 双突变体56 d龄。
A: 56-day-old wild type; B: 56-day-old single mutants; C: 56-day-old double mutants.

图8 双突变体真叶表型观察及叶绿素含量测定
A, C: 30 d双突变体和野生型的真叶和叶绿素含量比较图; B, D: 56 d的双突变体和野生型的真叶和叶绿素含量比较图。数值表示为±SD (= 3)。*、**分别表示在0.05和0.01概率水平差异显著。
A, C: the comparison of true leaves and chlorophyll contents between double mutant and WT at 30 days old; B, D: the comparison of true leaves and chlorophyll contents between double mutant and WT at 56 days old. Values are presented as mean ± SD (= 3). * and ** mean significant differences at< 0.05 and< 0.01, respectively.
2.5 突变体叶片Fe离子含量测定
在拟南芥中的同源基因为,作为叶绿体中SUF系统的支架参与到叶绿体铁硫簇的组装[18], 甘蓝型油菜的与拟南芥的高度同源, 并且都具有参与SUF系统的SUFBD结构域, 预示着也可能参与到叶绿体铁硫簇的组装, 可能对维持甘蓝型油菜叶绿体中铁稳态具有重要作用。为此, 测定了双突变体以及单突变体叶片中Fe离子含量。根据结果显示, 单突变体Fe离子的含量是野生型的1.5倍左右, 而双突变体中Fe离子的含量是野生型的3倍左右(图10)。说明的突变会导致叶片中Fe含量的积累,可能参与到维持甘蓝型油菜叶片中Fe的稳态。
2.6 双突变体真叶的叶绿体超微结构观察
叶绿体是叶绿素、血红素以及其他四吡咯生物合成的场所。叶绿体发育异常也会影响到叶绿素的代谢从而导致叶色的改变。为了解的突变是否会对叶绿体的发育造成影响, 本研究取野生型和双突变体56 d的真叶进行了透射电镜观察。结果显示, 在双突变体真叶中, 细胞中叶绿体数目较少且发育不良, 不饱满, 且叶绿体内部缺乏类囊体膜。相比之下, 野生型真叶中叶绿体数目多发育正常且饱满, 能够明显的观察到类囊体膜结构(图11)。说明的突变使得叶绿体不能够正常形成类囊体膜, 叶绿体的发育受到了影响。
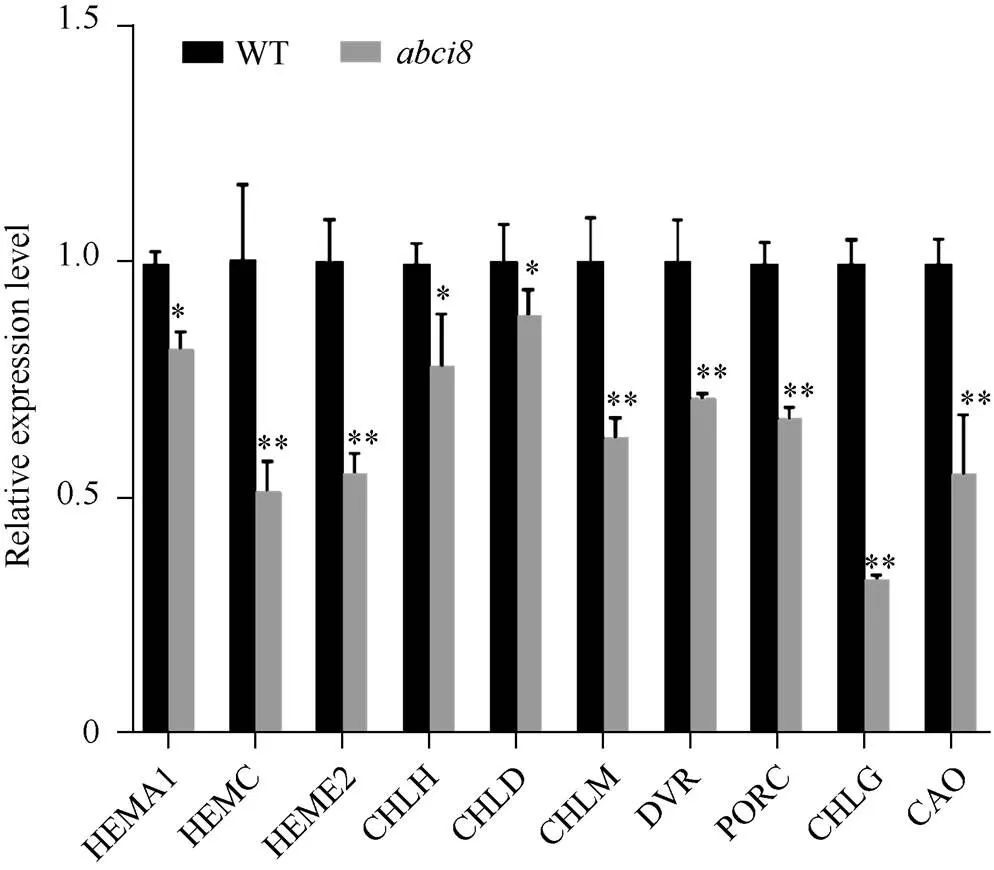
图9 叶绿素合成途径相关基因的相对表达量
数值表示为±SD (= 3)。*、**分别表示在0.05和0.01概率水平差异显著。
Value is mean ± SD (= 3). * and ** mean significant differences at< 0.05 and< 0.01, respectively.
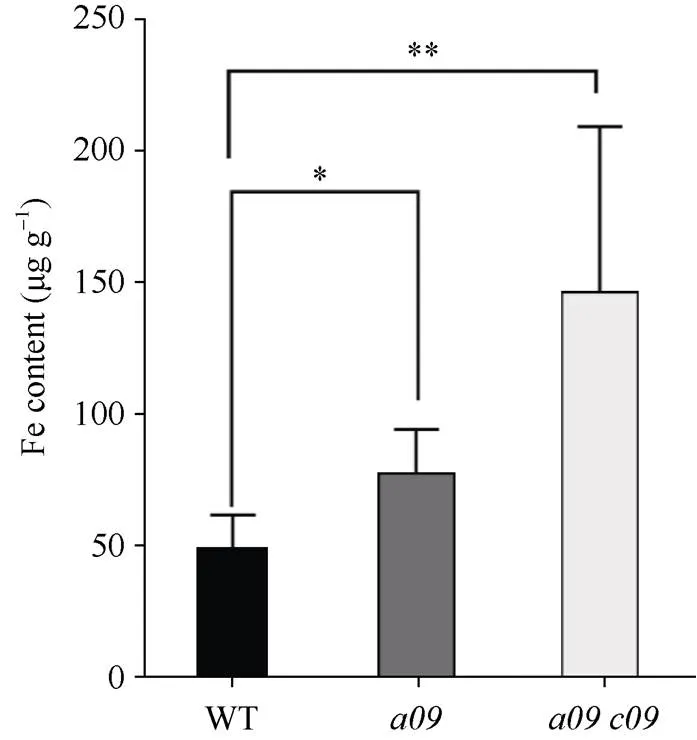
图10 叶片中Fe的含量
表示突变的单突变体;表示和突变的双突变体。数值表示为±SD (= 3)。*、**分别表示在0.05和0.01概率水平差异显著。
represents single mutants of the;represents double mutants of theand. Value is mean ± SD (= 3). * and ** mean significant differences at< 0.05 and< 0.01, respectively.
3 讨论
3.1 BnABCI8在叶绿体发育过程中起重要作用
植物中许多叶色突变与叶绿体发育之间存在某种因果关联, 叶色突变体的叶绿体结构往往表现出异常。拟南芥中编码PD1蛋白基因的突变使得突变体PEP依赖性转录显著受损, 造成叶绿体没有类囊体结构, 幼苗无法积累色素[24]; 甘蓝型油菜黄色子叶突变体中,的突变影响了质体基因转录 , 造成类囊体膜形成受阻, 叶绿素和叶绿素含量显著下降[25]; 甘蓝型油菜黄化突变体中, 编码TPR蛋白基因的突变, 导致叶绿体发育不良, 类囊体减少, 叶绿素和叶绿素含量下降[26]。在本研究中,编码叶绿体定位的ABC转运蛋白, 该基因的突变造成甘蓝型油菜子叶变黄, 真叶褪绿, 叶绿素和叶绿素含量显著下降, 同时伴随着叶绿体结构异常, 尤其是类囊体膜结构受损严重。

图11 野生型和双突变体的叶绿体超微结构
A~C: 野生型叶绿体结构; D~F: 双突变体叶绿体结构; Cp: 叶绿体; Tm: 类囊体膜。
A–C: the chloroplast structure of wild type; D–F: the chloroplast structure of double mutant; Cp: chloroplast; Tm: thylakoid membrane.
叶绿素的含量与叶色有着直接的联系, 叶色突变体在生长过程中往往表现出光合效率低, 长势与野生型相比较弱, 严重可能致死的情况。如黄绿白菜型油菜突变体, 其叶绿体基粒类囊体数目较少,总叶绿素含量显著降低, 植株矮小[27]; 玉米黄绿叶突变体不能产生雄穗, 长势明显弱于野生型[28]; 拟南芥中PD1基因的突变使得突变体白化和幼苗致死[24]。本研究中的突变体表现出植株长势弱于野生型的现象, 该现象可能由叶片叶绿素含量下降, 光合效率低不能够提供充足的能量供生长发育所致。
综上所述,在叶绿体发育过程中起着重要的作用, 该基因的突变会导致叶绿体发育异常, 叶绿素含量减少, 株高降低等现象。
3.2 BnABCI8维持甘蓝型油菜叶片Fe稳态
在进化过程中, 真核宿主细胞与蓝藻共生而产生叶绿体作为光合作用的细胞器, 因此叶绿体内有过渡金属, 包括铁、铜和锰, 它们具有氧化还原能力,对于光合电子传递是必需的, 一些过渡金属稳态受到破坏会影响叶绿体的正常功能。已有研究表明, 在拟南芥中定位于叶绿体的铁转运蛋白基因被敲除后, 植株表现出严重的褪绿现象[29-31]; 水稻中的缺陷型突变体表现出较高的Mn含量和较低的Cu含量, 叶绿体类囊体结构被破坏, 叶片黄化[10];缺陷型突变体表现出较高的Fe含量和Ni含量, 叶绿体发育异常, 叶片白化[32]。在本研究中, 通过火焰原子吸收光谱仪检测发现, 突变体叶片中Fe离子含量显著增加, 因此我们认为参与调节甘蓝型油菜叶片中Fe稳态,被敲除后, Fe离子稳态受到破坏, 叶绿体正常功能受到了影响, 叶色发生了改变。
在拟南芥的同源基因为,作为叶绿体中SUF系统的支架参与叶绿体铁硫簇的组装[18], 基于甘蓝型油菜和拟南芥ABCI8蛋白序列的保守性, 我们同样也可以推测, 在甘蓝型油菜中可能参与叶绿体铁硫簇的组装。由于叶绿体中许多蛋白质需要铁硫簇作为辅因子, 其次叶绿素的生物合成也需要铁硫簇。叶绿素很不稳定, 容易受到各种因素影响而导致降解。因此该基因突变之后, 造成叶绿体结构异常和铁水平的增加, 引起叶绿素的生物合成和降解紊乱, 导致甘蓝型油菜叶色突变。
4 结论
本研究通过CRISPR/Cas9系统靶向敲除基因构建了甘蓝型油菜叶色突变体。在叶中高量表达, 其编码的蛋白定位在叶绿体中。该基因的突变造成叶绿体结构异常, 叶绿素合成受阻, 植株叶绿素含量下降, 长势弱, 并且叶片中铁离子的稳态遭到破坏。研究结果表明,对于甘蓝型油菜叶绿体的正常发育是至关重要的。
[1] Timmis J N, Ayliffe M A, Huang C Y, Martin W. Endosymbiotic gene transfer: organelle genomes forge eukaryotic chromosomes., 2004, 5: 123–135.
[2] Neuhaus H E, Emes M J. Nonphotosynthetic metabolism in plastids., 2000, 51: 111–140.
[3] Beale S I. Green genes gleaned., 2005, 10: 309–312.
[4] Hu G, Yalpani N, Briggs S P, Johal G S. A porphyrin pathway impairment is responsible for the phenotype of a dominant disease lesion mimic mutant of maize., 1998, 10: 1095–1105.
[5] Sakuraba Y, Rahman M L, Cho S H, Kim Y S, Koh H J, Yoo S C, Paek N C. The rice faded green leaf locus encodes protochlorophyllide oxidoreductase B and is essential for chlorophyll synthesis under high light conditions., 2013, 74: 122–133.
[6] Wu Z, Zhang X, He B, Diao L, Sheng S, Wang J, Guo X, Su N, Wang L, Jiang L, Wang C, Zhai H, Wan J. A chlorophyll-deficient rice mutant with impaired chlorophyllide esterification in chlorophyll biosynthesis., 2007, 145: 29–40.
[7] Albrecht V, Ingenfeld A, Apel K. Characterization of the snowy cotyledon 1 mutant of: the impact of chloroplast elongation factor G on chloroplast development and plant vitality., 2006, 60: 507–518.
[8] Hayashi-Tsugane M, Takahara H, Ahmed N, Himi E, Takagi K, Iida S, Tsugane K, Maekawa M. A mutable albino allele in rice reveals that formation of thylakoid membranes requires thegene., 2014, 55: 3–15.
[9] 王晓珠, 孙万梅, 马义峰, 韩二琴, 韩丽, 孙丽萍, 彭再慧, 王邦俊. 拟南芥ABC转运蛋白研究进展. 植物生理学报, 2017, 53: 133–144.
Wang X Z, Sun W M, Ma Y F, Han E Q, Han L, Sun L P, Peng Z H, Wang B J.Research progress of ABC transporters in., 2017, 53: 133–144 (in Chinese with English abstract).
[10] 贺彦. 水稻ATP结合盒式转运基因的克隆与功能分析. 中国农业科学院博士学位论文, 北京, 2020.
He Y. Map-based Cloning and Functional Analysis of the ATP-binding Cassette Transporterin Rice. PhD Dissertation of Chinese Academy of Agricultural Sciences, Beijing, China, 2020 (in Chinese with English abstract).
[11] Zhang X D, Zhao K X, Yang Z M. Identification of genomic ATP binding cassette (ABC) transporter genes and Cd-responsive ABCs in., 2018, 664: 139–151.
[12] Zuo J, Wu Z, Li Y, Shen Z, Feng X, Zhang M, Ye H. Mitochondrial ABC transporter ATM3 is essential for cytosolic iron-sulfur cluster assembly., 2017, 173: 2096–2109.
[13] Xu Y, Zhang S, Guo H, Wang S, Xu L, Li C, Qian Q, Chen F, Geisler M, Qi Y, Jiang D A.functions in auxin transport and iron homeostasis in rice (L.)., 2014, 79: 106–117.
[14] Rea P A. Plant ATP-binding cassette transporters., 2007, 58: 347–375.
[15] Dean M, Annilo T. Evolution of the ATP-binding cassette (ABC) transporter superfamily in vertebrates., 2005, 6: 123–142.
[16] Kang J, Park J, Choi H, Burla B, Kretzschmar T, Lee Y, Martinoia E. Plant ABC transporters., 2011, 9: e0153.
[17] Møller S G, Kunkel T, Chua N H. A plastidic ABC protein involved in intercompartmental communication of light signaling., 2001, 15: 90–103.
[18] Xu X M, Adams S, Chua N H, Møller S G.represents an atypical SufB protein inplastids., 2005, 280: 6648–6654.
[19] von Voithenberg L V, Park J, Stübe R, Lux C, Lee Y, Philippar K. A novel prokaryote-type ECF/ABC transporter module in chloroplast metal homeostasis., 2019, 10: 1264.
[20] Sun M, Hua W, Liu J, Huang S, Wang X, Liu G, Wang H. Design of new genome- and gene-sourced primers and identification of QTL for seed oil content in a specially high-oilcultivar., 2012, 7: e47037.
[21] Dai C, Li Y, Li L, Du Z, Lin S, Tian X, Li S, Yang B, Yao W, Wang J. An efficient Agrobacterium-mediated transformation method using hypocotyl as explants for., 2020, 40: 96.
[22] Xing H L, Dong L, Wang Z P, Zhang H Y, Han C Y, Liu B, Wang X C, Chen Q J. A CRISPR/Cas9 toolkit for multiplex genome editing in plants., 2014, 14: 327.
[23] Liu Q, Wang C, Jiao X, Zhang H, Song L, Li Y, Gao C, Wang K. Hi-TOM: a platform for high-throughput tracking of mutations induced by CRISPR/Cas systems., 2019, 62: 1–7.
[24] Yang Z, Liu M, Ding S, Zhang Y, Yang H, Wen X, Chi W, Lu C, Lu Q. Plastid deficient 1 is essential for the accumulation of plastid-encoded RNA polymerase core subunit β and chloroplast development in., 2021, 22: 13648.
[25] Liu T T, Tao B L, Wu H F, Wen J, Yi B, Ma C Z, Tu J X, Fu T D, Zhu L X, Shen J X.affects chloroplast development inL., 2021, 9: 992–1002.
[26] Zhang H Y, Li X T, Yang Y B T, Hu K N, Zhou X M, Wen J, Yi B, Shen J X, Ma C Z, Fu T D, Tu J X., encoding a tetratricopeptide repeat protein, is required for early chloroplast biogenesis in., 2022, 10: 597–610.
[27] 孙璇. 一种叶色黄绿白菜型油菜突变体性状研究. 山西农业大学硕士学位论文, 山西太谷, 2018.
Sun X. Study on the Character of a Yellow-green Leaf Mutant in. MS Thesis of Shanxi Agricultural University, Taigu, Shanxi, China, 2018 (in Chinese with English abstract).
[28] 李玉荣. BSR-Seq方法定位玉米黄化突变基因. 华中农业大学硕士学位论文, 湖北武汉, 2014.
Li Y R. Etiolation Mutant Gene Mapping via Bulked Segregant RNA-Seq (BSR-Seq) Method in Maize. MS Thesis of Huazhong Agricultural University, Wuhan, Hubei, China, 2014 (in Chinese with English abstract).
[29] Duy D, Wanner G, Meda A R, von Wirén N, Soll J, Philippar K. PIC1, an ancient permease inchloroplasts, mediates iron transport., 2007, 19: 986–1006.
[30] Jeong J, Cohu C, Kerkeb L, Pilon M, Connolly E L, Guerinot M L. Chloroplast Fe (III) chelate reductase activity is essential for seedling viability under iron limiting conditions., 2008, 105: 10619–10624.
[31] Shimoni-Shor E, Hassidim M, Yuval-Naeh N, Keren N. Disruption of Nap14, a plastid-localized non-intrinsic ABC protein inresults in the over-accumulation of transition metals and in aberrant chloroplast structures., 2010, 33: 1029–1038.
[32] Zeng X, Tang R, Guo H, Ke S, Teng B, Hung Y H, Xu Z, Xie X M, Hsieh T F, Zhang X Q. A naturally occurring conditional albino mutant in rice caused by defects in the plastid-localized OsABCI8 transporter., 2017, 94: 137–148.
附表1 本研究中用到的引物
Table S1 Primers used in this study

引物名称Primer name引物序列Primer sequence (5'-3')作用Function C83-A09FcttgcatgcctgcaggtcgacATGGCGTCTCTCCTCGCG亚细胞定位Subcellular localization assay C83-A09RtctaccggtacccggggatccGAACCCACTGATCCTTCAAGCTT C83-C09FFcttgcatgcctgcaggtcgacATGGCGTCTCTCCTCGCG C83-C09RRtctaccggtacccggggatccGAACCCACTGATCCTTCAAGCTT C83FATTTCATTTGGAGAGGACCTCG C83RTGTGCCCATTAACATCACCATC QA09FATCCAGGTTAAGAATCCATCAGCGqPCR分析qPCR analysis QA09RTCTGCAGAACCCTGAGATCATCG QC09FATCCAGGTTAAGAACCCATCAGCC QC09RTCTGCAGAACCCAGAGATCATTG QHEMA1FTCCGAGGAACAACAACAGAACCAG QHEMA1RTGTATATCTGTCGGGTGCAGAGT QHEMCFCGGTTCCGTCTCCGTCAT QHEMCRGGCATTAGGTGCGGATTCAG QHEME2FCGAAATCTTCCCGGTCAATTCGTTG QHEME2RAGAGGCTCAGTGGTTGCAGAG QCHLHFGCACGCTTGGTTTGCATCCTATT QCHLHRCATGTGACTTCCCTGTTCTAGGGTCA QCHLDFGATTGCTATTTCAGGTCGTAGAGG
(续附表1)

引物名称Primer name引物序列Primer sequence (5'-3')作用Function QCHLDRGTTCGTCTTCCCACTCATCAG QCHLMFGCGACGATCGTTTCCTTGAC QCHLMRAAATACTCCCTCACCACCTCCTT QDVRFTCCAGTGGATACATACAACCAATGGCT QDVRRATTGGTTTGGAAGGTGGAAGCGAGA QPORCFCCGACAAGATCTCCATCAAGGAG QPORCRCGGCGATGCTTCGTTCGAT QCHLGFCGAGTTGGAGCACTCTCTCTCCA QCHLGRCTCTTCCCAGAAGAGTTGGAGTCC QCAOFGTCTATTGTCTTCCTTCTTCCTC QCAORTCCTTTCACTCCCTTCTTTCTG actionQ3FCTATCCTCCGTCTCGATCTCGC actionQ3RCTTAGCCGTCTCCAGCTCTTGC HA09-1-FggagtgagtacggtgtgcACAGTACTTCCAAAACCTAGACTACGACHi-tom分析Hi-tom analysis HA09-1-RgagttggatgctggatggGCCGAGCTTGTCGAAATACTCGA HA09-2-FggagtgagtacggtgtgcCCGCTTTGAACTCAGCTGTGT HA09-2-RgagttggatgctggatggCTTCGTGACGAAATTATAAATCCCTCCT HC09-1-FggagtgagtacggtgtgcGCAATACTTCCAAAACCTAGACTACGAC HC09-1-RgagttggatgctggatggGCCGAGCTTGTCGAAGTAGTCAA HC09-2-FggagtgagtacggtgtgcCTGCTCTGAACTCCGCCG HC09-2-RgagttggatgctggatggGTGACGAAATTGTAGATCCCTCCCTTC F-1ACTCTTTCCCTACACGACGCTCTTCCGATCTgcttGCGTtggagtgagtacggtgtgc F-2ACTCTTTCCCTACACGACGCTCTTCCGATCTgcttGTAGtggagtgagtacggtgtgc F-3ACTCTTTCCCTACACGACGCTCTTCCGATCTgcttACGCtggagtgagtacggtgtgc F-4ACTCTTTCCCTACACGACGCTCTTCCGATCTgcttCTCGtggagtgagtacggtgtgc F-5ACTCTTTCCCTACACGACGCTCTTCCGATCTgcttGCTCtggagtgagtacggtgtgc F-6ACTCTTTCCCTACACGACGCTCTTCCGATCTgcttAGTCtggagtgagtacggtgtgc F-7ACTCTTTCCCTACACGACGCTCTTCCGATCTgcttCGACtggagtgagtacggtgtgc F-8ACTCTTTCCCTACACGACGCTCTTCCGATCTgcttGATGtggagtgagtacggtgtgc F-9ACTCTTTCCCTACACGACGCTCTTCCGATCTgcttATACtggagtgagtacggtgtgc F-10ACTCTTTCCCTACACGACGCTCTTCCGATCTgcttCACAtggagtgagtacggtgtgc F-11ACTCTTTCCCTACACGACGCTCTTCCGATCTgcttGTGCtggagtgagtacggtgtgc F-12ACTCTTTCCCTACACGACGCTCTTCCGATCTgcttACTAtggagtgagtacggtgtgc R-AGACTGGAGTTCAGACGTGTGCTCTTCCGATCTctgtGCGTtgagttggatgctggatgg R-BGACTGGAGTTCAGACGTGTGCTCTTCCGATCTctgtGTAGtgagttggatgctggatgg R-CGACTGGAGTTCAGACGTGTGCTCTTCCGATCTctgtACGCtgagttggatgctggatgg R-DGACTGGAGTTCAGACGTGTGCTCTTCCGATCTctgtCTCGtgagttggatgctggatgg R-EGACTGGAGTTCAGACGTGTGCTCTTCCGATCTctgtGCTCtgagttggatgctggatgg R-FGACTGGAGTTCAGACGTGTGCTCTTCCGATCTctgtAGTCtgagttggatgctggatgg R-GGACTGGAGTTCAGACGTGTGCTCTTCCGATCTctgtCGACtgagttggatgctggatgg R-HGACTGGAGTTCAGACGTGTGCTCTTCCGATCTctgtGATGtgagttggatgctggatgg 5UDI427AATGATACGGCGACCACCGAGATCTACACGCCTTCAAACACTCTTTCCCTACACGACGC 5UDI428AATGATACGGCGACCACCGAGATCTACACAGGAACCTACACTCTTTCCCTACACGACGC 7UDI427CAAGCAGAAGACGGCATACGAGATTCACGAAGGTGACTGGAGTTCAGACGTGTGCTCTT
(续附表1)

引物名称Primer name引物序列Primer sequence (5'-3')作用Function 7UDI428CAAGCAGAAGACGGCATACGAGATCTTAGCCAGTGACTGGAGTTCAGACGTGTGCTCTT Cas9FCGAGAAGAAGAACGGCCTGTTCG基因编辑Gene editing Cas9RAGTTGCCCCTAGCGAGTGGG U626-IDFTGTCCCAGGATTAGAATGATTAGGC U629-IDRAGCCCTCTTCTTTCGATCCATCAAC crp1-BsF-ABCI8ATATATGGTCTCGATTGACTCCTTCACAATCCCCAAGTT crp1-F0-ABCI8TGACTCCTTCACAATCCCCAAGTTTTAGAGCTAGAAATAGC crp2-R0-ABCI8AACCGTGTTCTTGGGGATATAGCAATCTCTTAGTCGACTCTAC crp2-BsR-ABCI8ATTATTGGTCTCGAAACCGTGTTCTTGGGGATATAGCAA
affects chloroplast development of
CHEN Xiao-Han, WANG Li-Qin, WANG Hua-Dong, XIAO Qing, TAO Bao-Long, ZHAO Lun, WEN Jing, YI Bin, TU Jin-Xing, FU Ting-Dong, and SHEN Jin-Xiong*
National Key Laboratory of Crop Genetic Improvement / National Engineering Research Center of Rapeseed, Huazhong Agricultural University, Wuhan 430070, Hubei, China
Mature chloroplast is an important place for photosynthesis of higher plants and important organs that affects crop yield. BnABCI8 is a member of the ABC transporter I subfamily, and there are two functional copies ofandin. Their amino acid sequences are very conserved in different species. The relative expression patterns showed thatwas expressed in all tissues of, and the relative expression level in leaves and flowers was higher. Subcellular localization indicated that BnABCI8 was located in chloroplast. Phenotypic identification showed that the double mutation ofandand the single mutation ofboth resulted in yellow cotyledons and chlorotic true leaves, among which double mutant was more severe chlorosis. Transmission electron microscope demonstrated that the chloroplasts in the double mutants could not form normal thylakoid membranes. The knock-out ofresulted in the decrease of the relative expression level of related genes in the chlorophyll synthesis pathway, and significantly increased the iron content in mutant leaves. These results indicated that the mutation ofresulted in abnormal chloroplast structure, hindered the synthesis of chlorophyll, and significantly increased the iron content in the leaves. In addition, the accumulation of iron ion might lead to a series of reactions such as accumulation of reactive oxygen species, cell death and chlorophyll degradation, and eventually led to mutation of leaf color.
;gene; ABC transporter; chloroplast development; chlorophyll synthesis; variegated mutant
10.3724/SP.J.1006.2023.24065
本研究由国家自然科学基金项目(31930032)资助。
This study was supported by the National Natural Science Foundation of China (31930032).
沈金雄, E-mail: jxshen@mail.hzau.edu.cn
E-mail: 809365931@qq.com
2022-03-23;
2022-07-21;
2022-08-15.
URL: https://kns.cnki.net/kcms/detail/11.1809.S.20220811.1912.004.html
This is an open access article under the CC BY-NC-ND license (http://creativecommons.org/licenses/by-nc-nd/4.0/).
