赤水乌骨鸡PTGDS基因克隆、序列特征及组织表达分析
2023-02-24吴芸欧正淼殴小嫚陈粉粉闫吉美李盼盼
吴芸 欧正淼 殴小嫚 陈粉粉 闫吉美 李盼盼

摘要:为研究赤水乌骨鸡PTGDS基因的结构和功能,检测其在赤水乌骨鸡不同组织、胸肌和腿肌中的表达情况,探究PTGDS基因对赤水乌骨鸡肉质性能的影响。运用RT-PCR获得PTGDS基因CDS序列,对其氨基酸序列进行生物信息学分析,揭示其结构特征和亲缘關系,同时通过qPCR检测赤水乌骨鸡PTGDS基因在同一时期不同组织中的表达特性。结果显示,赤水乌骨鸡PTGDS基因编码区长558 bp,编码186个氨基酸,保守性分析发现赤水乌骨鸡PTGDS基因与原鸡的同源性最高,核酸和氨基酸序列比对同源性分别为100%;系统进化分析发现,赤水乌骨鸡与原鸡的亲缘关系最近,与黑天鹅和鸿雁的亲缘关系最远。PTGDS基因在各组织中均有表达,在肾中的表达量最高,显著高于其他组织(P<0.05);肌肉中腿肌的表达量高于胸肌,但差异不显著(P>0.05)。研究结果可为进一步揭示PTGDS基因的功能和调控机制提供参考。
关键词:赤水乌骨鸡;PTGDS基因;生物信息学分析;组织mRNA表达
中图分类号:S831.2 文献标志码:A
文章编号:1002-1302(2023)23-0022-06
前列腺素D合成酶(prostaglandin D synthase,PTGDS)是一种最早发现在人的脑脊液中大量表达的低分子量糖蛋白[1],后来又相继在大脑、肝脏、心脏、骨骼肌、肺、胰腺和脂肪等多种组织中检测到PTGDS的存在。PTGDS是脂质运载蛋白超家族成员之一,是该家族中唯一具有酶功能的成员,具有前列腺素代谢和脂质转运双重功能,既可以合成前列腺素,又可以作为亲脂性小分子的载体参与诸如视黄醇、视黄酸、胆红素、胆绿素和类维生素A等一些小亲脂性分子的运输,还可以作为一种高度糖基化的蛋白质参与花生四稀酸的代谢,PTGDS在脂质代谢中起调节作用[2-4]。
赤水乌骨鸡是贵州优良的地方鸡品种,属于肉蛋兼用型鸡,羽毛、皮肤和肌肉均呈现黑色,具有耐粗饲、肉质好、适应性强等特性,是优良的育种素材。目前,对赤水乌骨鸡肉质和风味方面的研究较少。本试验以赤水乌骨鸡为研究对象,通过RT-qPCR方法克隆得到PTGDS基因序列,进行生物信息学分析,同时采用qPCR检测了PTGDS基因在不同组织和肌肉中的表达差异,为进一步探究PTGDS基因对赤水乌骨鸡肉质风味相关的调控机制和鸡机体上的生物学功能提供理论依据。
1 材料与方法
1.1 试验样品采集及总RNA提取
试验选用的同批次孵化、体质量相近的35日龄赤水乌骨鸡,由贵州竹香鸡养殖合作社提供。所有试验用鸡均在相同饲养管理和营养水平条件下饲养。随机选取10羽公鸡,屠宰后采集各羽公鸡的心脏、肝脏、脾脏、肺、肾脏、腿肌和胸肌7个组织样品,将采集的组织样品迅速置于组织RNA保存液中 4 ℃ 过夜,随后置于-80 ℃超低温冰箱中保存待用。采用TRIzol法提取各组织总RNA,超微量紫外分光光度计测定提取RNA的浓度和纯度,1%琼脂糖凝胶电泳检测RNA的完整性。使用PrimeScriptTM RT试剂盒对检测合格的RNA进行反转录,合成cDNA第1链。
1.2 主要仪器和试剂
全自动快速研磨仪(JXFSTPRP-64,上海净信实业发展有限公司),高速冷冻离心机(TGL-16G,上海安亭科学仪器厂),多功能成像系统[ChemiDOC MP,伯乐生命医学产品(上海)有限公司],荧光定量PCR仪[CFXconnect,伯乐生命医学产品(上海)有限公司],微量核酸蛋白检测仪(UVS-99,艾文思生物技术公司);RNAiso Plus、TB Green Premix Ex TaqTM Ⅱ和PrimeScriptTM RT试剂盒,均购自宝日医生物技术(北京)有限公司;质粒小提试剂盒、胶回收试剂盒,购自Omega Bio-Tek公司;DH5α感受态细胞、T 载体 PCR 产物克隆试剂盒,购自生工生物工程(上海)股份有限公司;RNAwait购自北京索莱宝科技有限公司。
1.3 赤水乌骨鸡PTGDS基因克隆
参照GenBank原鸡PTGDS基因序列(NM_204259.2),采用Primer Premier 6.0软件设计扩增赤水乌骨鸡 PTGDS基因CDS序列的特异性引物(表1),引物由生工生物工程(上海)有限公司合成。以赤水乌骨鸡胸肌组织的cDNA为模板进行PCR扩增。扩增体系为:cDNA 3 μL,上、下游引物各2 μL,2×TransStar FastPfu PCR Super Mix 20 μL,ddH2O 13 μL。反应条件为:94 ℃预变性 5 min;94 ℃变性30 s,52 ℃退火30 s,72 ℃延伸 1 min,共35个循环;72 ℃延伸10 min,10 ℃保存。扩增产物用1%琼脂糖凝胶电泳检测,将检测正确的条带切胶回收产物连接到T载体,转化感受态细胞,挑阳性克隆提质粒送生工生物工程(上海)股份有限公司测序。
1.4 生物信息学分析
通过使用DNAMAN 9.0软件对测序得到的赤水乌骨鸡PTGDS基因CDS区序列与原鸡序列进行序列比对,采用NCBI的 BLAST在线软件对其进行同源性搜索,将搜索得到的原鸡、日本鹌鹑、雉鸡、盔珠鸡、艾草松鸡等的PTGDS基因用MegAlign软件进行同源和变异分析。采用MEGA 11.0软件构建PTGDS基因的遗传进化树。采用STRING在线软件(https://string-db.org/)预测可能与PTGDS蛋白发生相互作用的蛋白。采用ProtParam 在线软件(http://web. expasy. org/protparam/)分析PTGDS蛋白质的理化性质。采用ProtScale(https://web.expasy.org/protscale/)在线软件计算PTGDS蛋白的疏水性。TMHMM在线软件(http://www. cbs. dtu. dk/services/TMHMM/)预测PTGDS蛋白质的跨膜结构域。采用Signal P 5.0(https://services.healthtech.dtu.dk/service.php?SignalP-5.0)预测PTGDS蛋白的信号肽。用Phyre2(http://www.sbg.bio.ic.ac.uk/phyre2/html/page.cgi?id=index)和SWISS-MODEL在线软件(https://www.expasy.org/resources/swiss-model)分别预测分析PTGDS蛋白的二级结构和三级结构。运用Net-Phos 3.1(https://services.healthtech.dtu.dk/service.php)预测PTGDS蛋白的磷酸化位点。用在线软件PSORT(https://www.genscript.com/tools/psort)进行蛋白的亚细胞定位。
1.5 赤水乌骨鸡PTGDS基因在不同组织的表达分析
以赤水乌骨鸡的心脏、肝脏、脾脏、肺、肾、腿肌和胸肌7种组织的cDNA为模板,GAPDH为内参,进行RT qPCR检测目的基因表达量,并分析 PTGDS基因在各组织的表达量。RT-qPCR反應体系:TB Green Premix Ex TaqTM Ⅱ(2×)12.5 μL,模板 2.0 μL,上下游引物各1.0 μL,ddH2O 8.5 μL。RT-qPCR 的扩增条件为:95 ℃预变性30 s;95 ℃变性5 s,60 ℃退火30 s并采集荧光信号,72 ℃延伸30 s,40个循环。每个样品3次重复,扩增反应完成后分析熔解曲线。
1.6 生物统计学分析
利用Excel对试验数据进行整理,采用2-ΔΔCT 法计算 PTGDS基因相对内参基因GAPDH的表达差异量,ΔCT=CT PTGDS-CtGAPDH,ΔΔCT=Δ组织-ΔCT心脏。采用SPSS 26.0软件对计算数据进行单因素方差分析及显著性检验。用GraphPad Prism 6.0绘制图表。结果以“平均值±标准误”表示,P<0.05表示差异显著。
2 结果与分析
2.1 PTGDS基因CDS特征及序列比对
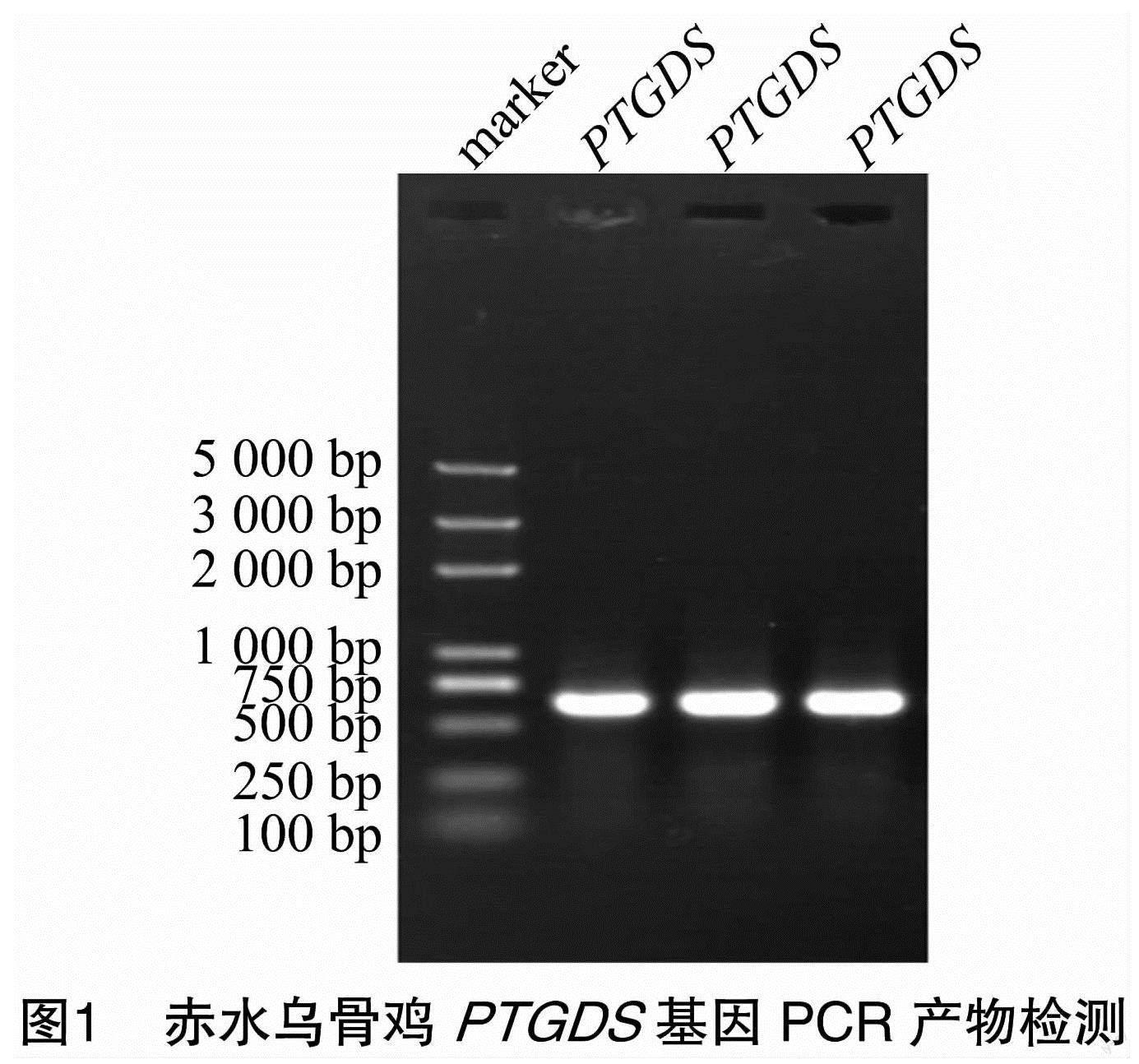
以cDNA为模板进行PCR扩增PTGDS基因,用1%琼脂糖凝胶进行电泳检测,结果见图1。由图1可知,扩增产物条带单一,与目的片段618 bp大小一致。胶回收产物克隆转化,菌液PCR检测得到的片段大小与预期相符,结果见图2。
2.2 PTGDS基因的生物信息学分析
测序获得的赤水乌骨鸡的PTGDS基因的编码区长558 bp,编码185个氨基酸。测序序列与原鸡序列比对显示,CDS的第105位发生A>G突变,不过编码的氨基酸未发生改变。测序结果与NCBI发表的基因序列的氨基酸同源性比对分析结果见图3。由图3可知,赤水乌骨鸡的PTGDS基因与原鸡氨基酸序列同源性是100%,与火的同源性为973%,与鸡日本鹌鹑的同源性为96.8%,雉鸡、艾草松鸡和盔珠鸡同源性均为96.2%,与岩雷鸟、白尾雷鸟和穴小鸮的同源性分别为95.7%、95.1%和876%,与黑天鹅和鸿雁的同源性为86.5%。用邻接(neighbor joining,NJ)法构建PTGDS蛋白的系统进化树,由图4可知,赤水乌骨鸡与原鸡聚为一类,与雉鸡、火鸡、艾草松鸡、雷鸟同在一个分支。赤水乌骨鸡与原鸡的亲缘关系最近,与黑天鹅和鸿雁的亲缘关系最远。
采用Protparam在线软件对赤水乌骨鸡PTGDS基因编码区的氨基酸序列进行分析,预测蛋白分子式是C914H1 448N254O285S9,分子量为20 843.62 u,理论等电点为6.3,脂溶性指数为79.68,不稳定指数为35.86,提示此蛋白为稳定蛋白。用ExPASy的ProtScale在线软件计算PTGDS的编码氨基酸序列的疏水性,结果见图5。由图5可知,其计算结果推测该蛋白是亲水性蛋白。运用TMHMM-2.0对PTGDS蛋白的跨膜区进行预测分析,结果见图6。结果(图6)显示,该蛋白不属于跨膜蛋白,无跨膜结构。使用在线软件SignalP 5.0预测,结果见图7,PTGDS蛋白潜在信号肽及切割位点,经分析,其存在Sec/SPI类型信号肽的概率为99.738%,说明PTGDS蛋白存在Sec信号肽,切割位点为19~20之间的LHA-QN,切割概率为 75.400%,其信号肽序列为MQATLLSILGLALLGALHA。
Phyre2在线软件对赤水乌骨鸡PTGDS蛋白的二级结构分析结果显示,PTGDS蛋白中无规则卷曲、α-螺旋和β-折叠结构分别占20%、12%和49%。采用在线软件SWISS-MODEL的自动建模功能预测赤水乌骨鸡PTGDS蛋白的三级结构,由图8可知,用于建立三维模型的氨基酸残基范围为 24~181位,模型以4orw.1.A蛋白为模板,序列同源性为43.17%。
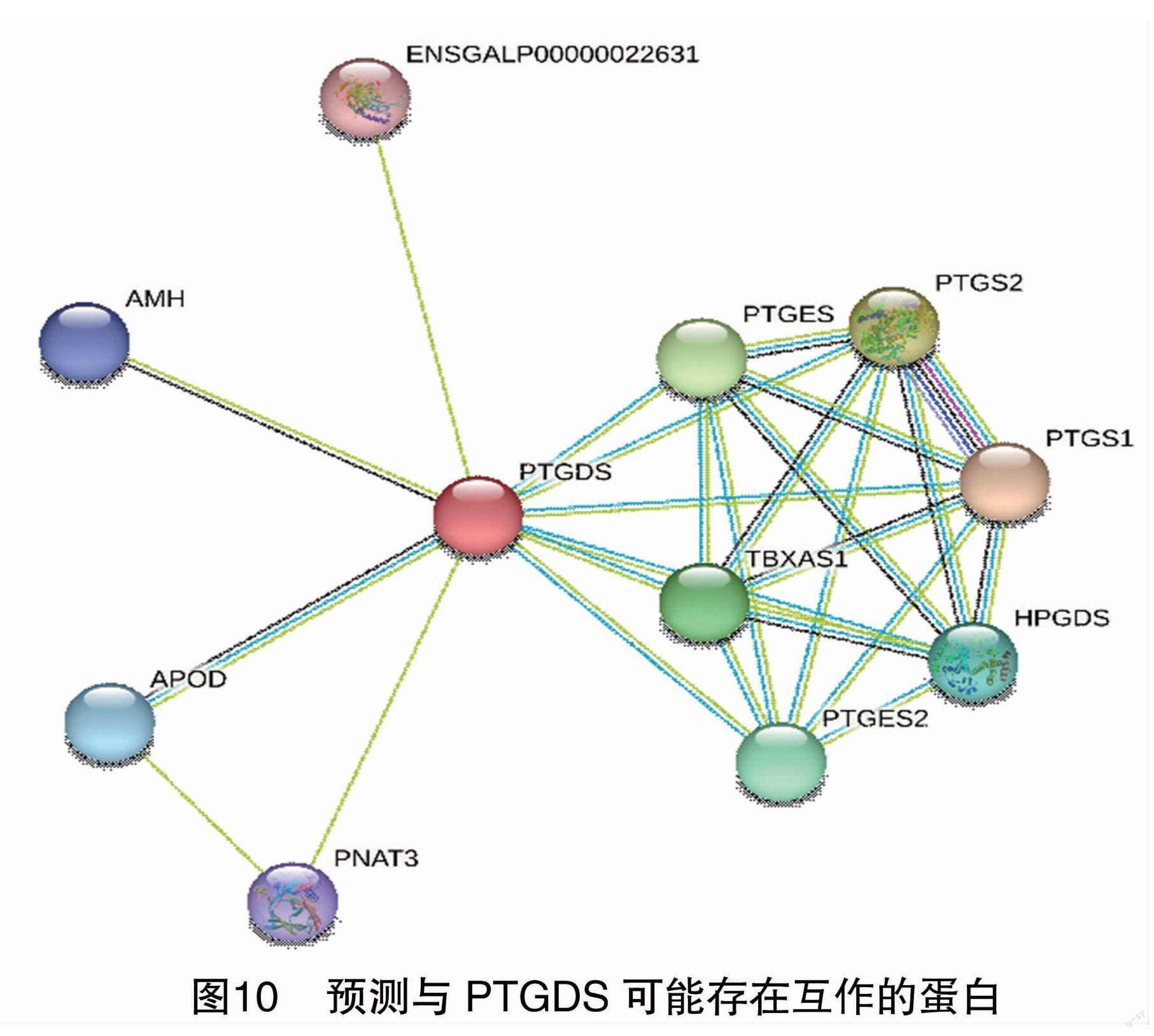
经NetPhos 3.1 在线软件预测PTGDS蛋白可能的磷酸化位点,结果见图9。由图9可知,PTGDS蛋白含有丝氨酸(ser)磷酸化位点16个,苏氨酸(thr)磷酸化位点8个,酪氨酸(tyr)磷酸化位点7个,无N-糖基化位点。在线软件PSORT亚细胞定位分析显示,PTGDS蛋白主要定位于包括细胞壁的细胞外(77.8%),其他定位于细胞核(11.1%)和线粒体(11.1%)上。由图10可知,根据STING在线软件预测到PTGDS蛋白与APOD、PNAT3、TBXAS1、PTGES、AMH及HPGDS等共10个蛋白质之间可能存在相互作用,推测这些蛋白可能会影响PTGDS的表达水平。
2.3 赤水乌骨鸡PTGDS基因在不同组织中的表达
PTGDS基因在赤水乌骨鸡不同组织中的表达情况,由图11可知,PTGDS基因在各赤水乌骨鸡的心脏、肝脏、脾脏、肺、肾脏、腿肌及胸肌中均有表达。PTGDS在肾脏中的相对表达量最高,显著高于其他各组织中的表达量(P<0.05),其次是肺,接下来分别是肝脏、心脏、脾脏和腿肌,胸肌中PTGDS的表达量最低。PTGDS在各组织中的表达量均达显著差异(P<0.05),但在肝脏和肺中这2个组织中的表达量无显著差异(P>0.05),胸肌和腿肌中两者间PTGDS的表达量也无显著差异(P>0.05)。
3 讨论与结论
克隆得到的赤水乌骨鸡PTGDS基因的CDS区序列经生物信息学分析,得到PTGDS基因CDS区片段长度为558 bp,编码186个氨基酸,结果与Fujimori等从鸡脑组织中提取的总RNA反转后克隆得到的PTGDS基因部分序列[5]高度相似。与火鸡的同源性为97.3%,与日本鹌鹑的同源性为968%,说明该基因在鸟类中应该是高度保守的,可能具有相似的生物学功能。穆松银等对PTGDS基因在犏牛各组织和睾丸不同发育阶段的表达检测发现,PTGDS基因在犏牛睾丸、胃、肝和肺中均有表达[6],而PTGDS基因在鼠的胰腺、心脏、骨骼、肌肉、肾脏和肺中均有检测到[7-12],本试验在赤水乌骨鸡的心脏、肝、脾、肺、肾和肌肉中PTGDS基因mRNA均有表达。推测可能是由于物种不同导致PTGDS基因在不同组织中的表达情况存在差异。李欣对肉鸡胫骨软骨发育不良模型中前列腺素合成相关基因的表达进行研究,提出前列腺素E2和或其他类型的前列腺素可能参与了生长板细胞增殖、分化过程[13]。肌肉收缩是一个能量的消耗过程,骨骼肌中的代谢无疑需要大量的能量,除了由提供能量速度较慢的长链脂肪酸的β氧化外,还有速度快速的葡萄糖氧化来供能[14]。有研究表明,采用L-PGDS处理对胰岛素敏感的大鼠大腿骨骼肌细胞,可使葡萄糖转运增加约2倍[15]。L-PGDS在机体内调节葡萄糖利用中起重要作用[15]。本试验腿肌中的PTGDS基因表达量比胸肌中的高,可能在鸡运动中腿肌需要大量的能量,PTGDS的多表达可能会增加葡萄糖的利用,为肌肉收缩提供更多的能量。Virtue等对PTGDS在棕色脂肪组织中的研究显示,L-PGDS可以调控脂质和碳水化合物利用之间的平衡[2]。
脂肪形成是一個复杂的过程,已经证实 C/EBPs、PPARγ、SREBP-1c等许多的转录因子通过调节多种脂肪形成蛋白基因的表达参与调控[16-17]。前列腺素作为脂质介质参与脂肪生成的一些调节[18]。PGD2促进脂肪及其代谢产物的生成,PGD2是由L-PGDS催化PGH2转化的,PGD2再进一步代谢得到Δ12-PGJ2,而Δ12-PGJ2是PPARγ的激动剂[19-21]。脂肪细胞的基本功能之一是以甘油三酯形式合成和储存游离脂肪酸,脂肪细胞中PPARγ可诱导分泌脂联素,脂联素通过增加胰岛素敏感性和脂肪酸氧化来影响脂质的摄取、脂肪组织的分化[21]。敲除L-PGDS导致脂联素表达降低,AMPK磷酸化降低,导致脂肪生成增加,L-PGDS可能是脂肪细胞中脂联素分泌的上游调节因子[8]。同时,将PPARγ2和L-PGDS等2个基因都敲除小鼠(DKO小鼠)皮下及腹腔内白色脂肪组织产热基因、脂酶和蛋白标记物等的研究发现,皮下白色脂肪功能的维持需要L-PGDS,DKO小鼠可能更加依赖腹腔内白色脂肪组织供应脂肪进行氧化[2],提示L-PGDS和PPARγ2可能协同调节脂质代谢。因此,结合PTGDS基因在赤水乌骨鸡腿肌、胸肌上的表达,推测PTGDS基因可能参与鸡肌肉和脂肪的发育及能量代谢。
参考文献:
[1]Shiki Y,Shimoya K,Tokugawa Y,et al. Changes of lipocalin-type prostaglandin D synthase level during pregnancy[J]. Journal of Obstetrics and Gynaecology Research,2004,30(1):65-70.
[2]Virtue S,Feldmann H,Christian M,et al. A new role for lipocalin prostaglandin d synthase in the regulation of brown adipose tissue substrate utilization[J]. Diabetes,2012,61(12):3139-3147.
[3]Eguchi Y,Eguchi N,Oda H,et al. Expression of lipocalin-type prostaglandin D synthase (β-trace) in human heart and its accumulation in the coronary circulation of angina patients[J]. Proceedings of the National Academy of Sciences of the United States of America,1997,94(26):14689-14694.
[4]Kumar S,Srivastava A,Palaia T,et al. Lipocalin-type prostaglandin D2 synthase deletion induces dyslipidemia and non-alcoholic fatty liver disease[J]. Prostaglandins & Other Lipid Mediators,2020,149:106429.
[5][JP3]Fujimori K,Inui T,Uodome N,et al. Zebrafish and chicken lipocalin-type prostaglandin D synthase homologues:conservation of mammalian gene structure and binding ability for lipophilic molecules,and difference in expression profile and enzyme activity[J]. Gene,2006,375:14-25.
[6]穆松银,熊显荣,马鸿程,等. 犏牛L-PGDS基因克隆及其在各组织和睾丸不同发育阶段的表达研究[J]. 中国畜牧兽医,2020,47(12):3985-3992.
[7]Kumar S,Palaia T,Hall C E,et al. Role of lipocalin-type prostaglandin D2 synthase (L-PGDS) and its metabolite,prostaglandin D2,in preterm birth[J]. Prostaglandins & Other Lipid Mediators,2015,118/119:28-33.
[8]Ankita S,Thomas P,Christopher H,et al. Lipocalin-type prostaglandin D2 synthase appears to function as a novel adipokine preventing adipose dysfunction in response to a high fat diet[J]. Prostaglandins and Other Lipid Mediators,2021,157:106585.
[9]Zayed N,Li X F,Chabane N,et al. Increased expression of lipocalin-type prostaglandin D2 synthase in osteoarthritic cartilage[J]. Arthritis Research & Therapy,2008,10(6):R146.
[10]Korotkova M,Lundberg I E.The skeletal muscle arachidonic acid cascade in health and inflammatory disease[J]. Nature Reviews Rheumatology,2014,10(5):295-303.
[11]Ito H,Yan X X,Nagata N,et al. PGD2-CRTH2 pathway promotes tubulointerstitial fibrosis[J]. Journal of the American Society of Nephrology,2012,23(11):1797-1809.
[12]Daiki H,Wataru F,Kosuke A,et al. L-PGDS attenuates acute lung injury by prostaglandin D2 in both dependent and independent ways[J]. Journal of Immunology,2021,207(10):2545-2550.
[13]李 欣. 重組鸡GSTA3蛋白对福美双诱导肉鸡TD中前列腺素相关基因的影响[D]. 太谷:山西农业大学,2017.
[14]Rose A J,Richter E A. Skeletal muscle glucose uptake during exercise:how is it regulated ?[J]. Physiology,2005,20(4):260-270.
[15]Ragolia L,Hall C E,Palaia T.Lipocalin-type prostaglandin D2 synthase stimulates glucose transport via enhanced GLUT4 translocation[J]. Prostaglandins & Other Lipid Mediators,2008,87(1/2/3/4):34-41.
[16]Fujimori K,Aritake K,Oishi Y,et al. L-PGDS-produced PGD2 in premature,but not in mature,adipocytes increases obesity and insulin resistance[J]. Scientific Reports,2019,9:1931.[HJ1.9mm]
[17]White U A,Stephens J M.Transcriptional factors that promote formation of white adipose tissue[J]. Molecular and Cellular Endocrinology,2010,318(1/2):10-14.
[18]Masoodi M,Kuda O,Rossmeisl M,et al. Lipid signaling in adipose tissue:connecting inflammation & metabolism[J]. Biochimica et Biophysica Acta(Molecular and Cell Biology of Lipids),2015,1851(4):503-518.
[19]Yanai H,Yoshida H.Beneficial effects of adiponectin on glucose and lipid metabolism and atherosclerotic progression:mechanisms and perspectives[J]. International Journal of Molecular Sciences,2019,20(5):1190.
[20]Fujimori K,Maruyama T,Kamauchi S,et al. Activation of adipogenesis by lipocalin-type prostaglandin D synthase-generated Δ12-PGJ2 acting through PPAR γ-dependent and independent pathways[J]. Gene,2012,505(1):46-52.
[21]lvarez-Almazán S,Bello M,Tamay-Cach F,et al. Study of new interactions of glitazone's stereoisomers and the endogenous ligand 15d-PGJ2 on six different PPAR γ proteins[J]. Biochemical Pharmacology,2017,142:168-193.
