从阵发性睡眠性血红蛋白尿药物靶点出发的补体C5抑制剂在疾病治疗中的应用
2023-02-22孙庆阳李文蕾徐寒梅
孙庆阳 ,李文蕾,李 剑,徐寒梅
(1.中国药科大学生命科学与技术学院, 江苏 南京211198; 2.天士力生物医药股份有限公司, 天津 300410)
罕见病作为一种发病率极低、诊断难、误诊率高、症状危急的疾病,已日益成为医疗卫生体系中需要着重提升的方向。虽然此类疾病患者比例极低,但在我国极大的人口基数下,患者群体的数目仍较多。因此,近年来我国越发着眼于罕见病的治疗,相关政策法规也在逐步出台与完善。
阵发性睡眠性血红蛋白尿(paroxysmal nocturnal hemoglobinuria,PNH)是一种以慢性血管内溶血与骨髓衰竭为主要表现的罕见病,其发病率约为百万分之1.3,患病率约为百万分之15.9[1]。目前,PNH的发生被认为与造血干细胞基因突变密切相关。患者红细胞、骨髓和淋巴细胞在内的所有血液谱系中,X染色体上的磷脂酰基糖苷-A基因发生突变,使其子代细胞表面缺乏所有的糖基化磷脂酰肌醇锚定蛋白 (glycosylphosphatidy-linositol-anchored protein,GPI-AP)[2-3],其中包含的两种补体调节蛋白缺失会造成末端补体抑制功能丧失,使患者多种血细胞无法调节自身末端补体的装配,其受到补体系统的作用进而发生胶体渗透性溶解[4]。
基于此发病机制,当前治疗PNH有多种手段[5]:对于轻症患者采用免疫抑制剂,难治患者则主要借助于输血、抗体药物、造血干细胞移植等。其中能够治愈此病的医疗手段仅造血干细胞移植一项,但由于施治难度大,目前患者多使用药物治疗[6-7]。而专门用于治疗PNH的上市药物仅有2个,均为靶向补体成分5(the fifth component of complement,C5)的单克隆抗体[8-9]。
在补体系统中C5是一个共有分子,为3种激活途径的“交集”,其已日益成为补体系统调控的研究热点,且多种疾病的发病机制均被证实与该靶点异常激活密切相关。本文从PNH治疗靶点入手,对C5的分子结构、功能、调控机制及其药物研发进展进行综述,为该靶点的进一步开发与相关药物研发等提供参考。
1 阵发性睡眠性血红蛋白尿的诊断与治疗
近年来,PNH的检测与诊断方法不断更新:早期主要采用Ham试验,其存在检测敏感性偏低的问题[10],为改善此现象研发出蛇毒因子试验,但以上方法只适用患者突变红细胞达到一定比例的情况;伴随着科学家对于PNH发病机制的深入研究,针对于患者血细胞存在白细胞分化抗原55(cluster of differentiation 55,CD55)和CD59两种补体调节蛋白的缺失,开发出流式细胞术用于诊断,大大提高了以上方法的特异性[11],而后荧光标记的嗜水气单胞菌溶素变异体(fluorescently labeled aerolysin,FLAER)分析法的出现则从根源上与膜上GPI蛋白结合,进一步提高了检测的特异性与敏感性[12]。正因为诊断方法的不断提高,目前国内外均对于该疾病的诊治出具了相关指南用于临床[13-14],使检测方法趋向标准化。
回顾性分析表明,PNH患者的中位生存期为22年,10年死亡率约为30%[6,15-16]。相较于恶性肿瘤、心脑血管疾病等,PNH对于患者生活质量的影响高于其对于患者生命的威胁。这正是PNH患者如今面对的最大问题,虽然诊断方法不断更新换代,PNH发病率低、病程隐匿的特点仍旧对诊断造成影响:在疾病初期仅有约25%的典型PNH患者出现血红蛋白尿[15],约半数患者则主要表现为贫血[10],一定比例患者被诊断为再生障碍性贫血(aplastic anaemia,AA),加之医疗条件较差地区无法进行高特异性的检测等均对患者确诊产生极大的影响。
PNH患者往往具有贫血的症状,具体表现为乏力、头晕等,若患者未能在疾病早期合理施治则将更易产生多种并发症,其中包含肺动脉高压、慢性肾病等[17]。患者多会出现由肺血管平滑肌失调导致的呼吸困难,同时溶血产生的血红蛋白被重吸收分解后的产物沉积在肾小管上皮细胞中,造成肾小管损伤进而引发肾脏缺血,肾脏功能受损严重则最终导致肾衰竭[18]。目前PNH的主要致死原因为血栓的发生,据统计在发生血栓的患者中约有6成最终死亡,且血栓的产生会使死亡率增加5 ~ 10倍[12]。除此之外,年龄、诊断期等也与患者预后相关,对于55岁以上的血液病患者PNH筛查是极为必要的。
总而言之,此疾病易复发,且并发症会对患者的日常生活造成极大的影响,生活质量显著降低,因此及早进行临床治疗在患者病程中显得尤为重要。
1.1 传统治疗
PNH患者的典型症状即为血管内溶血,临床上常采用定期输血予以治疗[15],补充患者由于溶血损失的红细胞、血小板等,但长期输血也有加重溶血的风险,且由于该病症状难以预测,极大地影响了患者的日常生活。
除输血外,治疗PNH的药物主要着眼于以下3点:1)控制溶血症状的产生,常用免疫抑制剂如肾上腺糖皮质激素、环孢素等,降低免疫系统对于血细胞的攻击;2)调节红细胞的生成,达那唑与雄激素均为常用药物;3)抗凝治疗,由于血栓为PNH患者中致死率极高的并发症,对已发生血栓患者使用抗凝血药物进行预防,减少病情反复对于患者的影响[19]。遗憾的是,长期使用激素类药物对于患者的代谢、免疫力、生殖系统等均有影响,需按周期使用。
因此,以上传统治疗手段无法保证患者的日常生活质量,同时达不到根治PNH的目的。
1.2 C5抑制剂用于阵发性睡眠性血红蛋白尿治疗
PNH的发病正是由于补体系统对于患者体内发生基因突变的血细胞发生攻击造成的,其中补体调节蛋白(CD55、CD59)的突变是PNH产生的直接因素,阻断补体系统激活是控制疾病进展的有效手段。
而补体系统借助于三种协调有序的酶级联反应而被激活[20],即经典途径、选择性途径和凝集素途径,从而形成膜攻击复合物(membrane attack complex,MAC)。补体系统在人体内发挥免疫保护作用,是先天免疫系统发挥效应的机制之一:能够通过病原体识别、调理和裂解作用清除外来细胞[21];并且结合免疫复合物和凋亡细胞,将其从循环和受损组织中清除[22]。此外补体系统对适应性免疫反应进行调节[23-24],借助所释放的过敏毒素达到招募吞噬细胞并激活白细胞、血小板等作用。
如图1所示,3种激活途径均生成C5这一中间组分,且有研究发现吞噬细胞(特别是肺巨噬细胞)可以利用结合丝氨酸蛋白酶,在不依赖于血浆补体系统的情况下裂解C5[25];凝血因子FXa、FXIa和纤溶酶蛋白也有该作用[26]。因此在多种激活物存在的情况下,C5分子是末端补体通路激活所必需的关键节点,阻断其发挥生物学作用即可有效调控末端补体系统生成MAC进而清除细胞。更为重要的是,C5位点的阻断使C3b介导的调理和免疫复合物清除不受影响,对上游激活途径的免疫保护和调节功能进行了最大程度的保留。
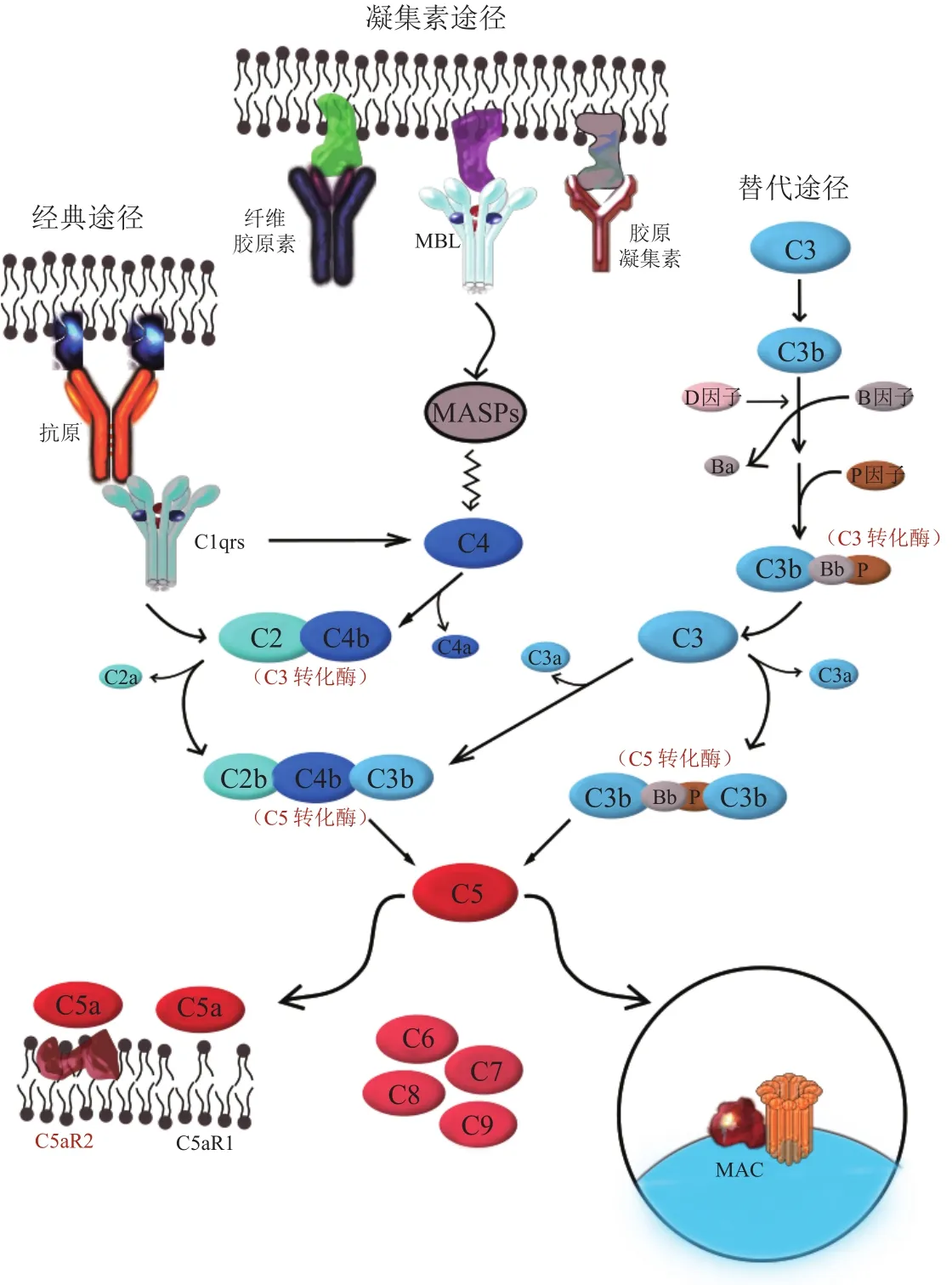
图1 补体系统激活途径Figure 1 Complement system activation pathway
正因如此,阻断C5治疗PNH成为科学家研究的方向之一。Hillmen等[27]使用一种重组人源化单克隆抗体,其通过阻断C5分裂用于治疗PNH患者临床症状,统计数据表明:该抗体能够安全有效地减少患者血管内溶血,使输血率大大下降并显著减少了96%血红蛋白尿的发生,改善PNH患者生活质量。在此基础上,更多的临床试验数据验证了C5这一靶点的有效性。PNH的并发症是影响患者生活的最大因素,而C5抑制剂可显著降低并发症的出现,用药患者两项肺动脉高压指标明显改观,并在后续治疗中得到保持[28];同时,对195例患者的治疗结果表明,抑制剂的使用将血栓发生率降低约85%[29]。由此可见,选择C5为PNH治疗的靶点是可取的,具有极大的前景。
2 C5的结构与功能
C5是活化后具有酶活性的一种糖蛋白,作为补体系统的组分之一,分布于人体的血清和组织液中。该基因在人类中处于9号染色体,全长79kb,包含40个内含子与41个外显子[30]。翻译后得到无活性的单链C5前体蛋白,进一步加工形成相对分子量为190 000,通过二硫键链接含α、β链的双链蛋白。在C5转化酶的作用下,蛋白在α链N端的作用位点裂解形成两个活性片段:1)释放进入组织液中的α链N末端为C5a,是一种具有强致痉挛和趋化活性的过敏毒素[31],与C5a受体1(C5a receptor 1,C5aR1)结合可引起多种反应,且能够刺激多形核白细胞的运动并引导其向炎症部位迁移。更为重要的是,C5a能够增强机体免疫应答,诱导淋巴细胞产生抗体,单核细胞分泌细胞因子[24];2)其余部分则构成C5b结合在细胞膜表面,可作为亚基进一步与C6结合最终形成MAC,其对细胞膜发挥作用形成穿膜孔洞致孔,使胞内渗透压低于细胞外液,细胞溶胀破裂。
3 补体系统与疾病发展
目前,多种疾病的发生发展被研究证实均与补体系统异常激活密切相关。对大部分疾病而言补体系统仅会使患者的疾病发展进程加快(放大、加重炎症与损伤);而小部分病症的发病则与补体功能失调直接相关,这其中就包含原发性调节障碍、自身免疫病、退行性疾病[32]、缺血再灌注损伤[33]等。
非典型溶血性尿毒症综合征(atypical hemolytic uremic syndrome,aHUS)是由补体系统失衡所引起的一类原发性失调疾病。此类患者往往出现1个或多个补体抑制因子基因突变,使患者出现微血管病变性溶血性贫血、血小板减少和肾功能衰竭等临床症状[34]。在aHUS患者中,补体因子H(complement factor H,CFH)的C端表面识别域内的错义突变最为常见[35],突变的CFH无法调节肾内皮上补体替代途径的激活。而研究表明在CFH突变的转基因小鼠模型中,补体C5的缺乏可防止血栓形成的微血管病变[36],提示C5在aHUS中起关键作用。
系统性红斑狼疮(systemic lupus erythematosus,SLE)是一种自身性免疫疾病。目前未有确切病因发现,但家族遗传史、免疫系统与环境因素均为影响因素。SLE患者最具病理学特征的器官是肾脏,而末端补体通路与狼疮性肾炎这一并发症的发生有极大的相关性:C5b-9主要对于SLE患者的肾小球产生损伤[37],在肾小球内沉积的免疫复合物被补体系统识别,通过激活补体级联引起细胞增殖、坏死和纤维化[38]。此外,C5酶切产生的强有力促炎副产物C5a和C5b-9已被证明是肾小管中中性粒细胞积累的直接原因[39]。更有研究发现,在给予功能性阻断抗C5单克隆抗体6个月后,自身免疫综合征模型小鼠表现出了蛋白尿的延迟发作和生存率显著增加[40],表明在SLE动物模型中,抗C5抗体对终末补体成分的抑制可防止肾脏疾病的进展及其导致的死亡。
此外在炎症损伤方面,如黄斑变性[41]、动脉粥样硬化[42]、慢性阻塞性肺病[43]等疾病中,补体系统同样发挥重要作用。因此开发C5抑制剂可减缓或阻断多种疾病的进展,发挥调节补体系统的作用。
4 C5靶点药物
4.1 已上市药物
4.1.1 EculizumabEculizumab(Soliris®)为重组人源化IgG2/4κ单克隆抗体,是第一种以C5为靶点的补体抑制剂,通过与C5的高亲和力结合来抑制补体末端通路的激活。该药于2007年3月16日通过美国FDA上市审批[44],成为首个获批专门用于治疗PNH的药物。在此基础上eculizumab在aHUS、抗乙酰胆碱受体抗体阳性的全身性重症肌无力(generalized myasthenia gravis,gMG)、视神经脊髓炎谱系障碍(neuromyelitis optica spectrum disorder,NMOSD)的临床研究中均取得进展,通过上市审批,适应证范围扩展至4种罕见病。该药物在儿童患者人群中的安全性与有效性也得到证明[45],在药动学与药效学数据的基础上根据儿童体重划分用药剂量,最终在临床试验中得到成功验证。
但目前eculizumab的应用上仍存在一些风险,该药增加了脑膜炎奈瑟菌的感染概率,患者必须在治疗前接种疫苗并全程监测[46]。尽管对C5进行阻断,但eculizumab仍然无法对疾病达到根治:补体上游未被阻断处于持续激活状态,使用该药的患者产生了C3在PNH红细胞上沉积的现象[47],仍有轻中度的血管外溶血症状。此外,eculizumab的使用频率高、两周一次静脉注射对患者从经济到用药依从性上都是极大的负担。而该药物在不同人群中出现的耐受现象也不容忽视,对耐受患者的C5基因序列进行分析,这些患者中均有1个C5杂合子突变即C5蛋白的885位氨基酸由精氨酸(Arg)突变为组氨酸(His)(Arg885His)[48],因此寻找不同结合位点的C5拮抗剂也成为亟待解决的问题。
4.1.2 RavulizumabRavulizumab(Ultomiris®)则是以eculizumab为结构基础改造得到的长效抗体药物,与eculizumab具有相同的表位。在该药物可变区引入组氨酸残基,并通过改造其可结晶段(crystalline fragment,Fc)部分以增强与新生儿Fc受体(neonatal Fc receptor,FcRn)的结合,获得了变体ALXN1210(ravulizumab)[49]。这种结构改造极大地延长了药物半衰期,其末端半衰期提升约4倍,从而达到降低药物清除率与输液频率的作用,使用药间隔延长至每8周一次。而其皮下制剂正处于临床研发阶段,Ⅲ期临床数据显示皮下制剂可以提供与静脉制剂相同的补体抑制效果[50]。
但与eculizumab相似,ravulizumab同样存在使被注射患者脑膜炎奈瑟菌感染概率增加的风险,且对于少数具有C5(Arg885His)的多态性突变患者仍起不到治疗作用。
4.2 在研药物
鉴于目前已上市药物的使用存在局限性,目前抗C5药物的开发主要着眼于以下几点:1)提高药物安全性、有效性;2)提高药物的给药间隔,增加半衰期;3)改善现有静脉注射方式,提高患者依从性;4)开发新的结合位点以对应上市药物无效现象;5)采用联合用药方式提升疗效,减少现存不良反应;6)拓展新的适应证范围。目前在研药物以单克隆抗体、核酸、多肽、小分子类药物为主,同时,对上市药物进行重开发以满足上述要求。
4.2.1 单克隆抗体类药物目前以C5为靶点的抑制剂开发多以单克隆抗体为主,各制药公司采用多种筛选方法得到全人源化单克隆抗体及其单链抗体或抗原结合片段(fragment of antigen binding,Fab)抗体等,已有多种药物进入临床研发阶段(见表1)。
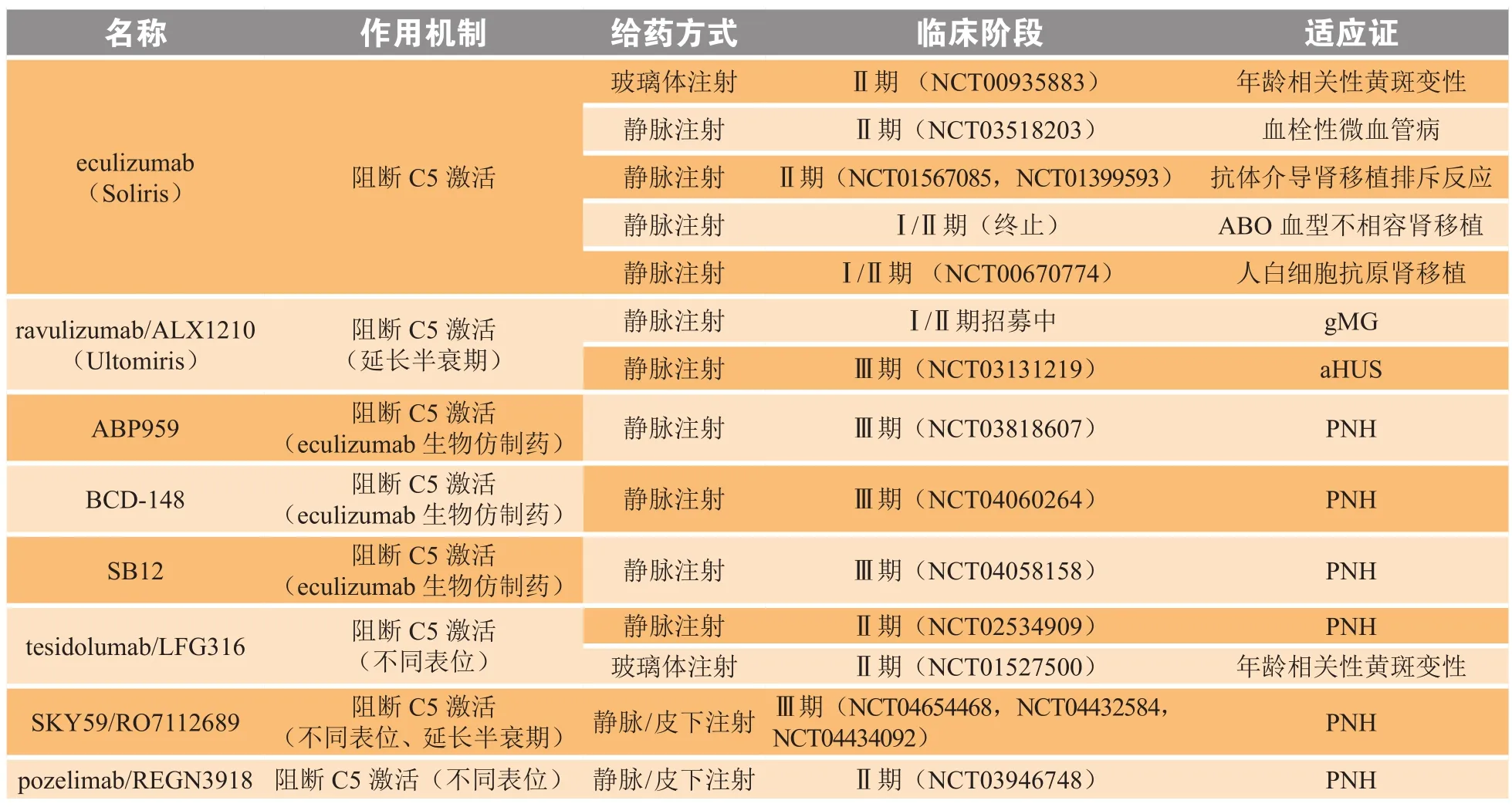
表1 处于临床研发阶段的抗C5单克隆抗体Table 1 Anti-C5 monoclonal antibodies under clinical trials
由于血浆中C5浓度高,当C5与抗体发生相互作用构成免疫复合物时,传统的抗C5抗体会减少C5的清除,从而导致C5在血浆中积累。SKY59/RO711268是一种长效循环人源化抗C5单抗,通过pH依赖结合达到靶向C5的作用[51],即在核内体酸性条件下免疫复合物分解,C5被运输到溶酶体中降解,而无C5结合的抗体循环进入血浆再次发挥作用。此外SKY59溶解度高、注射体积小;且其可特异性抑制C5b6在细胞膜上的沉积[52],进一步限制细胞膜攻击介导的复杂组织损伤。
而LFG316则是通过噬菌体库筛选得到的重组人源化IG1/λ单克隆抗体,正开发多个适应证,其对于eculizumab耐受的日本患者有明显疗效[53],而针对年龄相关性黄斑变性开发的eculizumab玻璃体内注射制剂,在所有治疗组中安全、耐受性好,未发现与药物有关的全身或眼部不良事件[54],且血清中LFG316浓度低,对补体替代途径无抑制作用。
4.2.2 核 酸 类 药 物Zimura(avacincaptad pegol,ARC1905)是一种全合成聚乙二醇化RNA适配体,能够选择性抑制C5裂解[55]。药物最初被设计用于与抗血管内皮生长因子药物联合给药,为抗血管内皮生长因子单一疗法提供协同优势。研究认为zimura有潜力减缓视网膜细胞退行性病变的进程,并且在治疗年龄相关性黄斑变性继发地理萎缩方面取得进展。Jaffe等[56]在两组患者玻璃体腔内连续12个月分别给药zimura 2和4 mg,发现给药可显著减缓患者眼内萎缩的进展。第2个验证性关键临床试验正在进行中,以确认zimura治疗作用的有效性和安全性。
小干扰核糖核酸(small interfering RNA,siRNA)是一种新的药物类型,其利用天然的RNA干扰(RNA interference,RNAi)机制来控制目标基因的表达[57]:沉默复合物上的siRNA被存在于细胞质中的RNA诱导,能够特异性地靶向切割互补的mRNA,从而减少致病蛋白质的合成。因此,这一机制为完全阻断C5激活提供了新的途径。ALNCC5是一种化学修饰的双链siRNA,由21个核苷酸组成正义链,25个核苷酸构成反义链。正义链的3”末端结合到三配体的N-乙酰半乳糖胺上通过与肝细胞上的一种高表达跨膜糖蛋白——去唾液酸糖蛋白受体(asialoglycoprotein receptors,ASGPR)结合,靶向输送到肝脏[58]。一旦进入肝细胞胞浆,ALNCC5利用内源性RNAi途径特异性靶向并切割C5 mRNA,导致肝脏内蛋白合成减少,C5蛋白循环水平降低[59]。但该药物也存在一些缺陷,在给药与药物发挥疗效之间存在显著的滞后现象,导致其用药频率增加。
4.2.3 多肽类药物相较于抗体药物,多肽的作用机制则更为多元化,加之皮下注射方便了患者自我给药,已成为补体失调疾病与C5多态性患者的又一选择。
Zilucoplan是一个相对分子质量为3 500,包含15个氨基酸残基的大环肽,与C5具有高亲和力和特异性。该药一方面抑制C5裂解为补体成分C5a和C5b;另一方面也可结合到C5对应于C5b的区域,从而阻断C5b与C6的结合[60]。这种双重作用机制阻止了末端补体通路的激活与MAC的装配。Zilucoplan在Ⅱ期临床研究中的安全性和耐受性良好[61],在12周内对中度至重度gMG患者产生了快速、持续的改善效果,而后将以0.3 mg · kg-1剂量进行进一步Ⅲ期临床研究(NCT04115293)。
Nomacopan(Coversin)是一个相对分子质量为17 000,最初来源于蜱唾液的多肽分子,具有隔离白三烯B4和抑制C5活化的双重功能[62]。临床试验表明,对于PNH皮下注射Coversin具有生物有效性,并且患者依从性强,但出现血管内溶血的比例过高仍需改进治疗方案[63]。而Coversin对自身免疫性葡萄膜炎同样有治疗作用。在小鼠模型中可防止视网膜结构损伤,使效应Th17细胞和炎性巨噬细胞显著减少,可作为潜在抑制眼内炎症的新型药物[64]。
4.2.4 小分子药物为了避免已上市药物存在的增加脑膜炎奈瑟菌感染风险的问题,目前研究人员开发了一种优先输送C5补体抑制剂到涉及病理过程器官的小分子重组蛋白ergidina。该蛋白是通过融合C5中和抗体[65](Mubodina)与环化的精氨酸-甘氨酸-天冬氨酸(RGD)多肽得到的。融合蛋白与表达RGD结合位点的整合素相互作用,使中和C5抗体优先归巢肾缺血内皮细胞[66],并能有效控制大鼠肾缺血再灌注损伤模型中的组织损伤程度。由于其独有的归巢特性,该分子完全抑制组织水平的补体激活,并在不影响C5循环的情况下保护补体介导的局部组织损伤,弥补了增加药物感染风险的临床现状。
此外,研究发现ergidina的体外结合不仅局限于肾脏,也可以在缺血的心脏上看到,这表明这种药物可能是移植前治疗器官的有用工具[67]。
综合目前在研药物的研发进程,除已有上市药物单克隆抗体之外,核酸、多肽、小分子药物的研发中同样取得了多样的进展,从不同层面抑制补体C5的激活,并在一定程度上解决现有耐受患者的治疗问题,市场前景广阔。
5 结语与展望
近年来,受PNH靶向治疗药物eculizumab的研发与治疗成果启发,并且被证实与C5激活相关的疾病也与日俱增,越来越多的药物以C5为靶点进行开发。作为首个靶向C5的上市药物eculizumab不断扩展其适应证范围,在多个疾病治疗领域验证了其安全性与有效性,并针对自身不足开发出长效化抗体满足患者用药需求。基于eculizumab的成功,多家医药公司相继开展研发工作,在单克隆抗体类药物中以开发新的结合位点与拓展适应证为主,有多个单抗进入临床试验阶段。同时多元化的核酸、多肽、小分子类药物研发,将C5抑制剂的作用机制大幅度延伸,以期满足不同患者对于疾病治疗的需求。相信未来C5的靶向药物应用将更加广泛。
Li等[68]在对青蒿素治疗补体相关自身免疫病的研究中发现,其水解衍生物青蒿琥酯(artesunate,ART)剂量依赖性地通过效应通路抑制C4、C3激活和终末补体复合物组装。利用ART结合的介孔二氧化硅颗粒进行的流式细胞仪(fluorescence activated cell sorter,FACS)分析显示,ART特异性地将C1q、C3和C5的关键治疗靶点结合在微粒上,揭示了ART的治疗作用机制。而在近期新型冠状病毒感染(Coronavirus Disease 2019,COVID-19)治疗中,补体抑制剂(如C3和C5抑制剂)也被认为是一种很有前景的治疗严重COVID-19的药物[69],可以减少新型冠状病毒导致的相关肺损伤和全身血栓形成,加之C5a/C5aR1轴与COVID-19肺病理间的作用机制已被阐明[70],显示出C5抑制剂在此领域的开发潜力。
基于目前药物治疗中的局限性,双靶点阻断已成为克服抑制剂开发瓶颈的新手段。Barratt-Due等[71]提出将阻断补体系统和toll样受体家族的关键上游分子作为一种治疗方案,治疗先天免疫识别导致的不受控制的激活。而已开发药物中针对C5补体的RNAi药物ALN-CC5也将与抗C5单克隆抗体REGN3918开发联用治疗方案,评估其在C5介导疾病中的效果。
对于靶向C5抑制剂市场而言,虽然已上市与临床研发药物在罕见病的应用中表现出优异的疗效,但其在常见疾病中的应用仍存在大片空白且进展缓慢,这可能成为此类药物今后的开发方向。
