CELMoDs类IKZF1/3降解剂的研究进展
2023-02-22吴雄焦宇吕仕铭陈亚东梅德盛
吴雄 ,焦宇,吕仕铭,陈亚东*,梅德盛
(1.苏州国匡医药科技有限公司,江苏 苏州 215000;2.中国药科大学理学院,江苏 南京 211198)

1 IKZF1/3概述
1.1 IKZF1/3生理功能
IKZF1(Ikaros)和 IKZF3(Aiolos)属于 Ikaros家族蛋白,是一类具有高度保守锌指结构的转录因子,通过选择性剪切可以产生不同的蛋白质亚型,不同亚型以及同族蛋白之间可以形成同源二聚体,如Ikaros-Ikaros和异源二聚体,如Ikaros-Aiolos,发挥多种生理学功能[1]。
IKZF1/3通过与各种被称为表观遗传调节和染色质重塑的核因子结合,既可以作为基因转录抑制因子又能够作为基因激活因子[2]。如果通过直接结合Mi-2来招募组蛋白重塑复合物,如染色质重塑和脱乙酰基酶复合物NuRD(Ikaros与乙酰转移酶、甲基转移酶、脱乙酰基酶和染色质重塑复合物共同构成NuRD复合物),它将介导基因抑制;如果整合到依赖三磷酸腺苷(adenosinetriphosphate,ATP)的染色质重塑复合物SW1/SNF(switch/sucrose nonfermentable)中,将介导基因激活。
IKZF1/3在各种造血和免疫细胞中发挥多效性作用,淋巴细胞的分化、增殖尤其依赖于IKZF1/3。IKZF1是造血干细胞(hematopoietic stem cell,HSC)和淋巴-髓系启动的多能祖细胞(lymphoid-primed multipotent progenitor,LMPP)中促进淋巴系启动的关键转录因子[3]。在T细胞中,IKZF1和IKZF3都参与了白细胞介素2(interleukin 2,IL-2)表达的直接调节,由于IL-2是许多辅助性T细胞基因程序的关键、差异性调节因子,这种机制有可能广泛影响辅助性T细胞亚群的分化和功能[4]。在B细胞前体中,IKZF1通过与超级增强子(super enhancer,SE)结合,诱导pre-B细胞分化所需的基因表达(如Syk、Blnk、Il2r、Cd79b和Foxo1),从而促进pre-B细胞的分化[5];IKZF3在B细胞分化成熟的中后期占主导地位,介导激活B细胞对刺激的反应和B细胞增殖[6]。在固有淋巴细胞(innate lymphoid cells,ILCs)中,IKZF1/3则作为ILC3-ILC1/自然杀伤细胞(nature killer cell,NK)细胞转分化的重要调节因子[7]。
1.2 IKZF1/3与相关疾病
IKZF1/3的功能紊乱已在恶性肿瘤、自身免疫病和免疫缺陷等多种疾病的病理过程中被发现。IKZF1的缺失或功能失调与急性淋巴细胞白血病(acute lymphoblastic leukemia,ALL)和急性髓系白血病(acute myelogenous leukemia,AML)的耐药性、高复发率和不良预后密切相关[8]。IKZF3上的一个复发性突变是慢性淋巴细胞白血病(chronic lymphocytic leukemia,CLL)的潜在癌症驱动因素,在非霍奇金淋巴瘤(non Hodgkin” s lymphoma,NHL)、系统性红斑狼疮(systemic lupus erythematosus,SLE)和类风湿关节炎(rheumatoid arthritis,RA)患者的外周血单个核细胞亚群中,也发现IKZF3表达上调[9]。IKZF1/3还被发现在多发性骨髓瘤(multiple myeloma,MM)中过度表达,导致恶性浆细胞的大量增殖[10]。IKZF1/3调控着干扰素调节因子4(interferon regulatory factor 4,IRF4)和c-Myc的表达,IRF4和c-Myc在一个正反馈回路中相互调节,IRF4与促进其表达的c-Myc基因启动子区域结合,c-Myc则反式激活IRF4基因,这种特殊的调节回路维持着MM细胞的异常增殖。
2 CELMoDs概述
2.1 CELMoDs的前身—免疫调节药物
沙利度胺(thalidomide,1)及其衍生物可以通过诱导细胞因子的产生来调节T细胞和NK细胞等免疫细胞的功能,如IL-2、干扰素-γ(interferon-γ,IFN-γ)等[11]。因此,沙利度胺及其类似物,包括来那度胺(lenalidomide,2)和泊马度胺(pomalidomide,3),被称为免疫调节药物(immunomodulatory drugs,IMiDs)。IMiDs影响着肿瘤微环境中T细胞、B细胞等免疫细胞的增殖分化和功能表达,因此其具有强大的免疫刺激特性和直接的抗肿瘤活性。
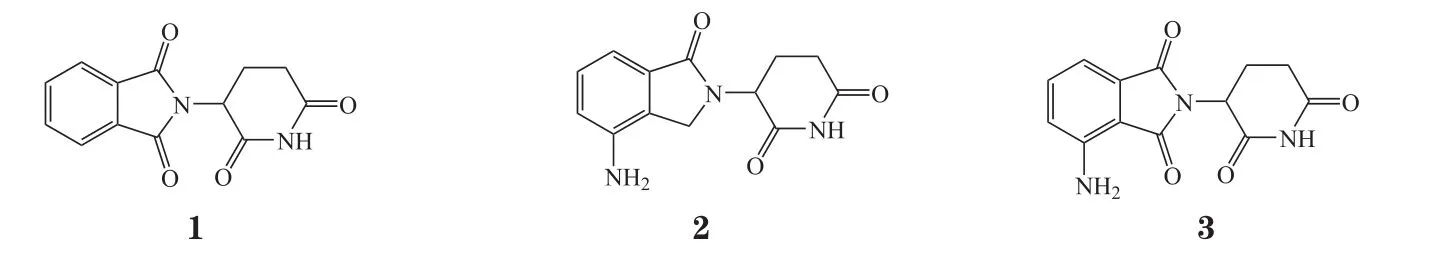
在MM患者的治疗中发现,IKZF1/3是IMiDs诱导的泛素化及随后降解的主要靶点[12]。Cereblon(CRBN) 是 一 种 CRL4(CUL4-RBX1-DDB1)泛素连接酶复合物的底物受体,IMiDs靶向结合CRBN后,并不抑制CRBN,而是赋予CRBN新的功能:通过改变泛素连接酶的底物特异性,促进目标蛋白的募集[13]。IMiDs与CRBN结合后使底物被CRBN-CRL4复合物泛素化,最终导致底物被26S蛋白酶体降解。IKZF1/3是首批被鉴定出的CRBN底物,添加CRBN调节配体会触发它们的募集和降解[14]。来那度胺和泊马度胺在不同细胞类型中均可诱导IKZF1和IKZF3降解,继而引发如抗肿瘤和免疫调节特性相关的多种下游效应。
2.2 CELMoDs结构及其应用
Cereblon E3泛素连接酶调节剂(CELMoDs)是一类新型的沙利度胺类似物,同样可以用于降解IKZF1/3[15]。就化学结构而言,CELMoDs是IMiDs的深度结构改造物(见图1):二者均含有戊二酰亚胺和异吲哚啉酮环结构,但CELMoDs中具有额外结构如RA片段(一般为芳环如苯环)和RB片段(一般为取代或未取代的环杂烷基)。与IMiDs相比,这些额外结构片段可进一步与CRBN相互作用,更深程度地改变CRBN的蛋白构象,从而提高对底物的结合力和特异性。两者具有共同但又差异性的作用机制,从而产生类似但不同的细胞效应。
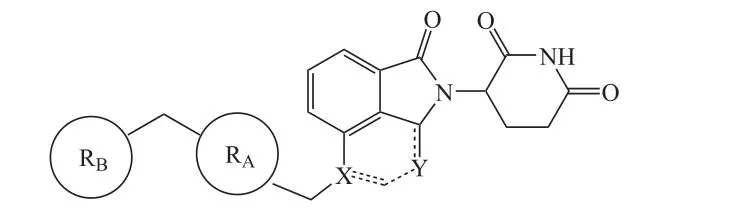
图1 CELMoDs的一般结构Figure 1 General structure of CELMoDs
CELMoDs作为一类典型的分子胶,与蛋白降解靶向联合体(proteolysis-targeting chimeras,PROTAC)同为蛋白靶向降解类药物,均是利用生物体内固有的泛素-蛋白酶体系统(ubiquitinproteasome system,UPS)降解蛋白质,但两者结构和具体作用机制并不相同(见图2)[16]。PROTAC由3部分组成,分别为用于结合目标蛋白的配体、用于结合E3泛素连接酶的配体以及两配体之间的连接子[17]。PROTAC的结构与作用机制明确,但相对分子质量较大,往往成药性不足且合成工艺复杂。CELMoDs主要诱导或稳定泛素连接酶和底物蛋白之间的相互作用,进而导致蛋白降解,不需要在靶蛋白上有结合位点。CELMoDs的相对分子质量较小,成药性较高,但当前仍缺乏合理有效的发现和设计策略。
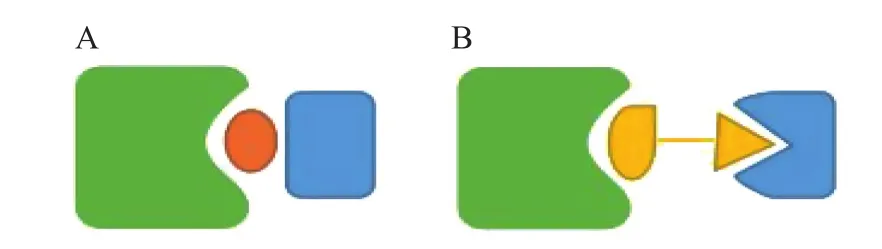
图2 CELMoDs与PROTAC的不同连接模式Figure 2 Different connection modes between CELMoDs and PROTAC
大多数MM患者最初对包括IMiDs(如来那度胺和泊马度胺等)和蛋白酶体抑制剂在内的联合疗法均有应答反应,然而,仍有一些患者对上述治疗缺乏初始反应(即难治性)[18]。同时,尽管近年来MM患者平均生存率增加了一倍多,但绝大多数患者出现药物治疗后依然会复发的情况。MM治疗存在未被满足的巨大临床需求。基于此,CELMoDs用于治疗复发或难治性多发性骨髓瘤(relapse/refractory multiple myeloma,RRMM)患者的临床研究正在积极进行中[19]。现有CELMoDs主要用于降解IKZF1/3,治疗MM在内的多种血液系统恶性肿瘤,大多数尚处于早期研发阶段,已进入临床开发的CELMoDs包括CC-92480(4)、CC-220(5)、CC-99282(6)和CFT-7455(7)等。
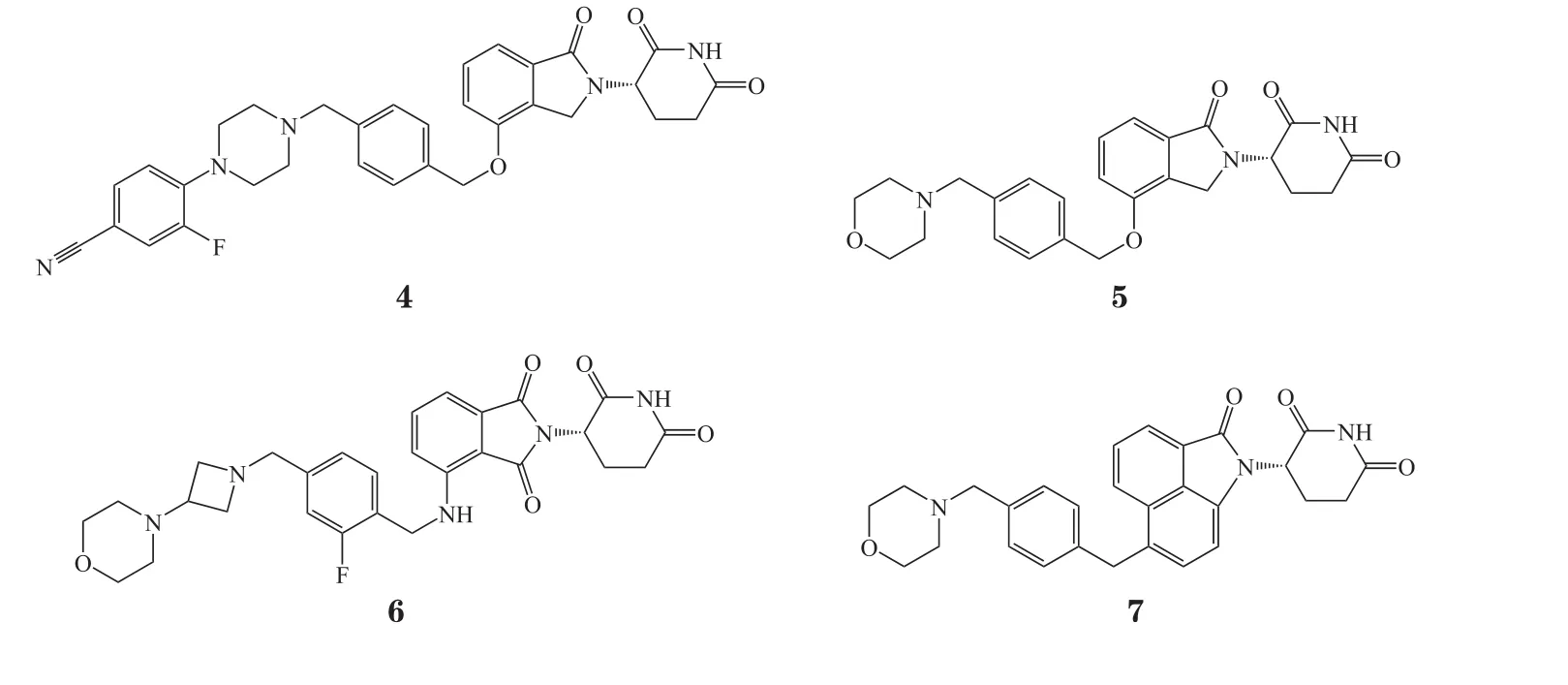
3 CELMoDs临床研究进展
截至2022年5月,CELMoDs类IKZF1/3降解剂的研发公司、适应证、研发阶段和临床试验编号见表1。

表1 CELMoDs类IKZF1/3降解剂临床研究进展Table 1 Clinical research advances in IKZF1/3 degraders of CELMoDs
3.1 CC-92480
3.1.1 临床前研究体外活性研究发现,与泊马度胺相比,CC-92480能够以更低浓度、更快速度降解IKZF1/3。在来那度胺耐药细胞中,CC-92480能近乎完全降解IKZF1/3,降解能力为泊马度胺1 000倍以上;且CC-92480可稳定p27蛋白并诱导凋亡标记物(如cleaved caspase),而泊马度胺则几乎没有作用[20]。小鼠移植瘤模型体内药效研究表明,在来那度胺耐药H929 R10-1模型中,CC-92480在1、3和10 mg · kg-1剂量下均显示出良好抑瘤效果,其中1 mg · kg-1时抑瘤率即可达75%[21]。大鼠的药代动力学研究表明,CC-92480以1 mg · kg-1经口给药后可迅速达到最大血浆浓度(0.5 ~ 1 h),半衰期约为4 h,口服生物利用度为63%[22]。CC-92480的动物体内药代动力学参数显示出良好的应用前景,符合血液系统肿瘤的治疗特点。对CC-92480的代谢产物进一步分析将有助于研究和改变药物的药代动力学性质。
3.1.2 临床研究CC-92480是首个进入临床的CELMoDs。在一项多中心、剂量递增的临床试验(NCT03989414)中,研究者评估了CC-92480与地 塞 米松(dexamethasone,DEX)、硼替佐米(bortezomib,BORT)联合治疗RRMM的临床数据。在此研究中,RRMM患者入组前均接受过2 ~ 4种治疗方案(包括来那度胺),并且在最后一次骨髓瘤治疗期间或之后均发生了疾病进展。CC-92480+DEX联用给药组共66例患者入组,口服给药,周期为28 d[23]:治疗中出现的常见3/4级治疗紧急不良事件(treatment emergent adverse events,TEAE)包括淋巴细胞减少症、贫血和感染;最常见的剂量限制性毒性是中性粒细胞减少,CC-92480的最大耐受剂量(maximum tolerated dose,MTD)为1mg;所有可评估患者的总有效率(overall response rate,ORR)为21%,其中9例患者有非常好的部分缓解(very good partial response,VGPR),疗效取决于用药剂量和用药周期,但与IMiDs的难治性无关。CC-92480+DEX+BORT联用给药组共19例患者入组[24]:没有患者出现剂量限制毒性,也没有达到MTD;最常见的3/4级TEAE是中性粒细胞减少症和血小板减少症;所有剂量的总有效率为73.7%,较CC-92480+DEX给药组有明显提高;基于安全性、有效性和药代动力学数据,选择1 mg剂量的CC-92480作为Ⅱ期临床研究推荐剂量(recommended phase Ⅱ dose,RP2D)。
综上所述,CC-92480对于IMiDs的难治性患者临床疗效有限,可能仅针对复发性MM有效,而无法治疗难治性MM。CC-92480联合BORT后能进一步提高总体有效率,CC-92480与DEX、BORT 3种药物之间应存在协同作用;CC-92480+DEX联用的最大耐受剂量作为三药联用的RP2D,这可能是由于它们的作用机制并不相同所致。
3.2 CC-220(Iberdomide)
3.2.1 临床前研究CC-220主要用于治疗RRMM和SLE。体外活性研究发现,CC-220结合CRBN的IC50约为 150 nmol · L-1,用 CC-220(0.1 µmol · L-1)比用泊马度胺(1 µmol · L-1)处理能够更快降低IKZF1/3的浓度[25]。与来那度胺和泊马度胺相比,CC-220含有额外的苯基和吗啉基部分,能够提高其与CRBN的相互作用力;底物更快降解可能是由于CC-220与CRBN的结合亲和力增加和/或Iberdomide结合E3连接酶后的底物特异性得到改善。
在来那度胺敏感(H929)细胞系、来那度胺获得性耐药(H929/LR)细胞系和MM细胞系的抗增殖研究中,用泊马度胺或CC-220处理H929细胞会导致G0/G1和亚G1细胞周期的时间依赖性增加,且CC-220的活性始终高于泊马度胺和来那度胺;而在KMS-12-BM/PR细胞中,只有CC-220能有效诱导IKZF1/3的快速消耗;在MM1.S细胞中进行与硼替佐米的联合用药试验后发现,波马度胺和CC-220的诱导凋亡率均得到提高,继续添加DEX能够增加它们的抗肿瘤效应[26]。3种药物在整个浓度范围内具有协同抗增殖作用,这与CC-92480的临床结果一致。
3.2.2 临床研究在首次健康志愿者中进行的一项双盲、单剂量递增(single ascending dose,SAD)的Ⅰ期临床研究(NCT01733875)中,CC-220口服给药的中位达峰时间(tmax)为2.5 ~ 4 h,半衰期为9 ~ 13 h;另一项多剂量递增(multiple ascending dose,MAD)试验(NCT02034773)中,每天1次,多次口服给药后,第7天左右达到稳态,此时CC-220在血浆中的浓度约为第1天的2倍,半衰期为10 ~ 20 h[27]。两次临床试验显示CC-220的降解半衰期较长,存在一定的药物累积。
目前,一项适应证为RRMM的多中心、非盲和剂量探索Ⅰ/Ⅱ期研究(NCT02773030)正在进行中,目的是评估CC-220作为单一疗法、与DEX联合使用、加或不加达鲁单抗或硼替佐米时的安全性、药代动力学和初步疗效[28]:截至2021年6月2日,107例患者入组,给药组为CC-220+DEX,周期为28 d,ORR为26.2%,完全缓解(complete response,CR)为0.9%,中位总生存期(overall survival,OS)为11.2个月,Ⅱ期推荐剂量为1.6 mg;82.2%的患者出现3/4级TEAE,最常见的是中性粒细胞减少症、贫血症和血小板减少症。CC-220的临床受益率与CC-92480并无明显差异,但耐受性有所提高;同时两者的副作用相似,均出现在血液系统中,属于药物过量带来的副作用。
在一项42例SLE患者参加的Ⅱa期临床试验(NCT02185040)中,患者接受CC-220治疗12周后,在主要评估皮肤症状的皮肤红斑狼疮区域和严重性指数(CLASI)评分上,不同剂量给药组患者平均下降了4.3 ~ 7.8分,而对照组(安慰剂对照)上升了0.4分[29]。CLASI评分下降4分以上意味着明显的临床症状改善。CC-220在Ⅱ期临床(NCT03161483)继续显示出潜在临床有效性与良好的耐受性[30]。目前SLE尚缺乏有效治疗药物,CC-220在SLE领域临床研究的良好前景,为SLE治疗开启了新方向,但CELMoDs在SLE领域的应用更需高度关注中性粒细胞减少症的发生。因为SLE属于慢性病,其安全性要求显著高于恶性肿瘤,一定程度的中性粒细胞减少症的发生,在恶性肿瘤领域可以接受,但在慢性病领域可能不符合临床要求。CELMoDs临床开发的趋势表明,CELMoDs既可以用于治疗MM,也可以用于治疗SLE等自身免疫疾病,从而实现CELMoDs药物的差异化开发。
3.3 CC-99282
3.3.1 临床前研究体外活性研究表明,与来那度胺和其他免疫调节剂相比,CC-99282在一系列弥漫性大B细胞淋巴瘤(diffuse large B-cell lymphoma,DLBCL)及获得性化疗耐药DLBCL细胞中显示出较强的抗增殖、凋亡和免疫刺激活性;在测试的23个肿瘤细胞系中,有20个细胞系对CC-99282表现出 敏 感 性,IC50为 1 ~ 500 nmol · L-1; 且 CC-99282浓度小于10 µmol · L-1时,非肿瘤细胞中未观察到一般的细胞毒性[31]。小鼠异种移植瘤模型体内药效研究表明,在不同给药方案下使用CC-99282(1 ~30 mg · kg-1)治疗的几种DLBCL异种移植模型均显示出显著的肿瘤消退和无瘤状态[32]。这种强大的抗肿瘤活性伴随着CC-99282的分布可在多个组织器官中显现,如在中枢神经系统淋巴瘤的颅内异种移植模型中,CC-99282能够有效地穿过血脑屏障,显示出抗肿瘤活性。
3.3.2 临床研究一项非盲、剂量探索的Ⅰ期临床试验(NCT03930953)评估了CC-99282在R/R NHL患者中的疗效、安全性和药物代谢动力学数据[33]。截至2021年4月9日,30例DLBCL患者和5例滤泡性淋巴瘤(follicular lymphoma,FL)患者已入组:21例患者出现与CC-99282相关的3/4级TEAE,最常见的是中性粒细胞减少症、血小板减少症;剂量限制性毒性是血液学TEAE,给药剂量尚未达到MTD;在可耐受的剂量水平下,CC-99282治疗的总缓解率为40%,包括3例CR和7例PR;药物代谢动力学分析表明,CC-99282口服给药后可被迅速吸收,并很好地分布到周围组织中,但半衰期长达50 h。
综上所述,不同于其他CELMoDs,CC-99282被开发用于R/R NHL,从Ⅰ期临床试验来看,单药治疗即有较高获益,具有可预见的临床疗效,这或成为此类药物开发的新方向;同时CELMoDs须高度关注药物的半衰期,以避免由于药物蓄积而导致副作用特别是中性粒细胞减少症的发生。MM、NHL等血液肿瘤自有其特殊性:其靶点在血液系统中,故而药物无需较长半衰期,较长半衰期反而易导致脱靶效应等不良事件。血液肿瘤对药物半衰期的要求迥异于实体瘤,此点需特别关注。
3.4 CFT-7455
3.4.1 临床前研究体外活性研究表明,CFT-7455结合CRBN的亲和力是泊马度胺的近800倍(0.9vs.712 nmol · L-1),且能在细胞中取代已与CRBN结合的泊马度胺;在NCIH929骨髓瘤细胞中,CFT-7455 降解 IKZF1 的 IC50约为 10 pmol · L-1,具有极高的活性;在DLBCL、套细胞淋巴瘤(mantle cell lymphoma,MCL)和外周T细胞淋巴瘤(peripheral T-cell lymphoma,PTCL)的体外细胞模型中,CFT7455 的 IC50小 于 100 nmol · L-1; 在 各 种 MM细 胞 模 型 中,IC50均 小 于 1 nmol · L-1[34]。CFT-7455的细胞水平活性远远优于传统IMiDs和其他CELMoDs,这可能得益于其引入的独特三环结构,进一步提高了与CRBN的结合力。
小鼠移植瘤模型体内药效研究表明,在小鼠间变性大细胞淋巴瘤(anaplastic large cell lymphoma,ALCL)DL-40模型中,与同类药物相比,CFT-7455展现出优异的抑瘤活性[35]:CFT-7455给药剂量在 10 µg · kg-1时,抑瘤效果显著优于 300 µg · kg-1的 CC-92480,更远优于 3 000 µg · kg-1的泊马度胺;CFT-7455 给药剂量在 30 和 100 µg · kg-1时,可见肿瘤体积显著缩小,部分小鼠肿瘤完全消失。CFT-7455是目前动物移植瘤水平活性最高的IKZF1/3降解剂。
3.4.2 临床研究CFT-7455是新一代CELMoDs,用于治疗MM、NHL等多种血液系统恶性肿瘤,其中用于治疗MM已处于Ⅰ期临床。
2022年4月,C4 Therapeutics公 司公 开 了CFT-7455的一项非盲、多中心、Ⅰ/Ⅱ期临床试验(NCT04756726)数据,适应证为RRMM,共5例患者入组,口服给药,给药周期为28 d[36]。在首次接受 50和 25 μg · d-1CFT-7455治疗的患者中,3例患者达到疾病稳定(stable disease,SD),2例患者发生疾病进展(progressive disease,PD);CFT-7455的tmax为4 h,半衰期为48 h,较长的半衰期导致了明显药物蓄积:从第1天到第15天,AUC0-24h增加了3 ~ 4倍;CFT-7455的3 ~ 4级中性粒细胞减少症发生率高达80%,停药7天后症状逐渐出现好转。目前,C4 Therapeutics公司正考虑通过改变用药频率,期望降低中性粒细胞减少的不良反应。CFT-7455 在 50 或 25 μg · d-1时出现较为严重的副作用,同时50 μg · d-1作为基于临床前数据预估的起始有效剂量,这意味着并不能通过降低用药剂量来减少药物带来的不良反应。相比之下,CC-220半衰期为10 ~ 20 h,3级中性粒细胞减少症发生率为44.9%[27];CC-99282半衰期为50 h,中性粒细胞减少症发生率为54%[33]。CFT-7455和CC-99282半衰期相近,而中性粒细胞减少症的发生率有明显差异,主要原因可能是CFT-7455生物学活性显著优于CC-99282,导致相同时间内脱靶效应更明显,因而副作用更强。
在治疗RRMM患者的临床试验中,CC-92480、CC-220与DEX联用后ORR均达到20%以上;而CFT-7455虽在临床前动物模型中显示出比CC-92480高30倍左右的体内活性,但其在单独给药的临床研究中,临床有效率甚至未达到ORR标准,而只能用疾病稳定描述。从CELMoDs临床开发经验来看,CELMoDs的药物开发需与DEX、BORT等联用以此提高临床有效率。联合用药可通过协同机制等多种机制有效增强临床药物的抗肿瘤活性,是抗RRMM药物开发的实践总结,也是抗RRMM药物开发过程中的趋势和内在要求。在临床方案设计中,临床研究者尤其需注意加入CELMoDs与DEX、BORT或抗体药物的联合给药对照组。
CFT-7455用于治疗R/R NHL正在进行临床试验注册中(NCT04756726),约有164例患者已在美国登记,即将开展Ⅰ期临床试验[37]。
4 结语与展望
通过靶向降解蛋白质影响目标蛋白水平对于药物发现具有重大意义。IMiDs诱导靶蛋白降解,尤其是转录因子降解(如IKZF1/3),为治疗恶性肿瘤提供了一种新策略,在开发新型治疗血液肿瘤药物方面具有巨大潜力。目前,IMiDs在临床上广泛用于治疗MM、NHL和其他血液系统癌症[38]。相较于IMiDs,CELMoDs具有延伸的结构片段,可在CRBN表面形成额外相互作用位点,从而增强E3泛素连接酶与靶蛋白的相互作用。在多种移植瘤模型研究中,如DL-40等,CELMoDs在动物体内的抑瘤效果明显优于IMiDs。基于CC-92480、CC-220、CC-99282和CFT-7455等药物的CELMoDs已成为一种极具吸引力的癌症治疗技术。
综上所述,用于降解IKZF1/3的CELMoDs开发已获得一定成效,但也存在一些不足。在CELMoDs药物应用中,药物完成生物学功能后应尽快从血液系统中清除。具体而言,新型CELMoDs在保持高生物学活性的同时,需将药物半衰期显著降低,如从现有药物半衰期的20~50 h,调整至几小时。具备上述特征的新型CELMoDs,在临床中与DEX、BORT或抗体联用,对于MM、RRMM或SLE的治疗可获得更理想的收益。
